Vejledning for Paroxystisk sympatisk hyperaktivitet
Dansk Neurotraume Udvalg
Version 1.1 2024
Overlæge Pernille Haure, Aalborg Universitetshospital
Overlæge Christina Rosenlund, Odense Universitetshospital
Speciallæge Astrid Wille-Jørgensen, Bodil Eskesens Center Overlæge Ann Kathrine Sindby, Aarhus Universitetshospital
PAROXYSTISK SYMPATISK HYPERAKTIVITET (PSH)
Baggrund
Efter et traume aktiveres det sympatiske nervesystem for at sikre ilttilførsel og bevare vitale fysiologiske processer. Det parasympatiske nervesystem forsøger at genskabe homeostase ved at reducere den sympatiske overaktivitet, men når denne feedback mekanisme svigter, fører det uhindrede sympatiske out flow til hyperaktivitet og ultimativt til PSH (1-3).
PSH-episoderne kommer i anfald og med vekslende varighed og intensitet. Et af problemerne med at erkende PSH er, at mange af symptomerne findes i andre kliniske syndromer. Det er en udelukkelsesdiagnose, der kræver, at andre vigtige årsager til symptomerne er vurderet og udelukket; herunder for tidlig vækning, abstinenser, infektion (specielt neuro-), nytilkommet CNS-læsion, anfaldsfænomener/status epileptikus og hydrocephalus. se Figur 1.
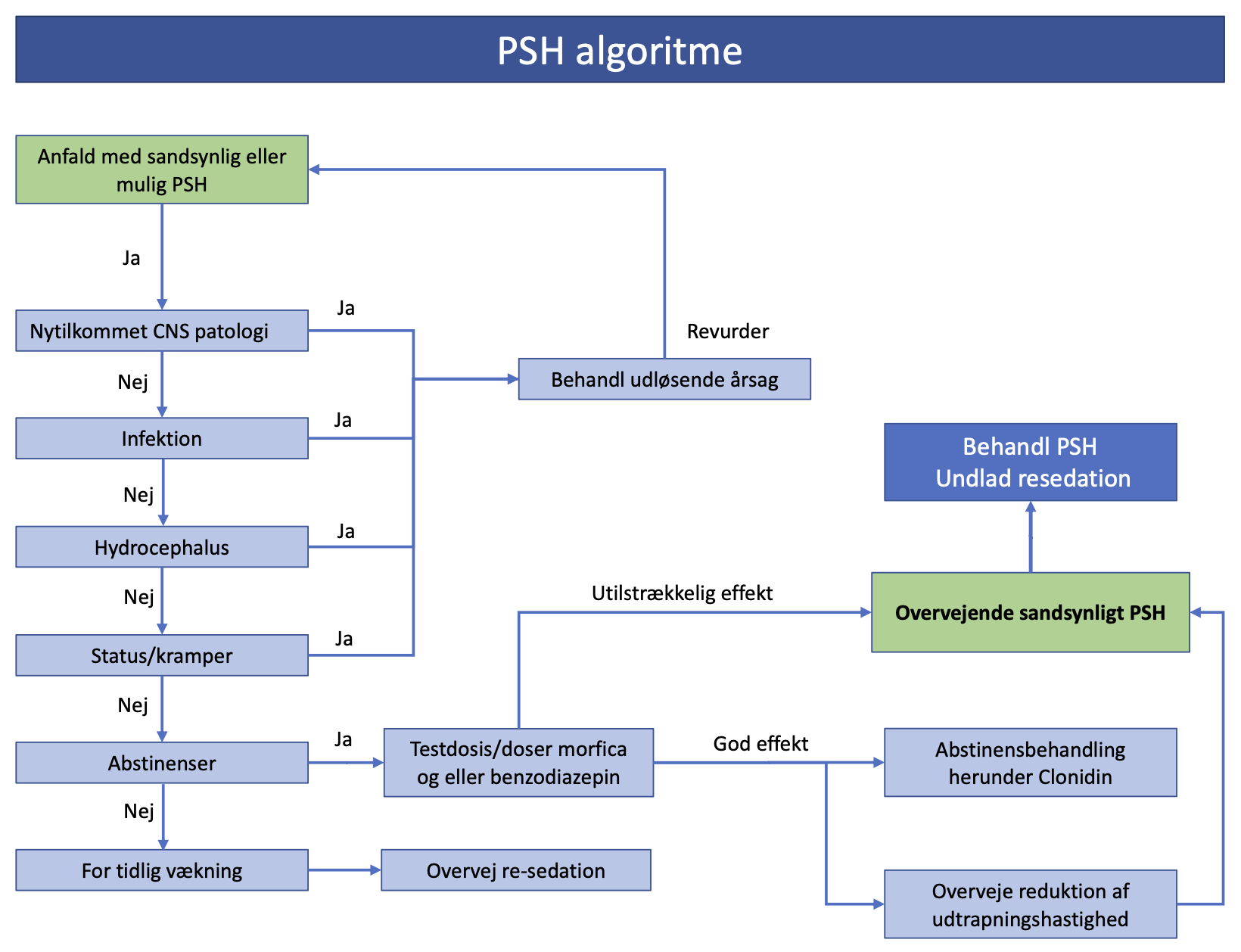
Figur 1. Diagnostisk algoritme for paroxystisk sympatisk hyperaktivitet (PSH)
PSH kan ses hos patienter med alle former for diffus og/eller central/dybtliggende hjerneskade (3-9). Langt hyppigste årsag er svær traumatisk hjerneskade (TBI), oftest med diffus axonal skade, svarende til ca. 80% af patienterne med PSH. Omvendt ses PSH hos 10-33% af komatøse med TBI.
De hyppigst forekommende symptomer er takykardi, takypnoe, hypertension, hypertermi og sveden samt rigiditet og dystoni (unormale, ufrivillige og ofte smertefulde muskelsammentrækninger) (1, 2). I nogle tidligere definitioner har motoriske symptomer været obligatorisk for at stille diagnosen, men dette indgår ikke længere som et nødvendigt element. I Hughes’ retrospektive undersøgelse fra 2014 (10) sås det således hos < 50%.
Graden og mængden af symptomerne afgør alvorligheden og en yderligere beskrivelse af omstændighederne medvirker til vurdering af sandsynligheden for, at det drejer sig om PSH.
Symptomerne trigges af plejeprocedurer som manipulation, fysisk undersøgelse og berøring, vending, sugning og badning, men kan også udløses af fysiologiske triggere som blæredistension, obstipation og smerte.
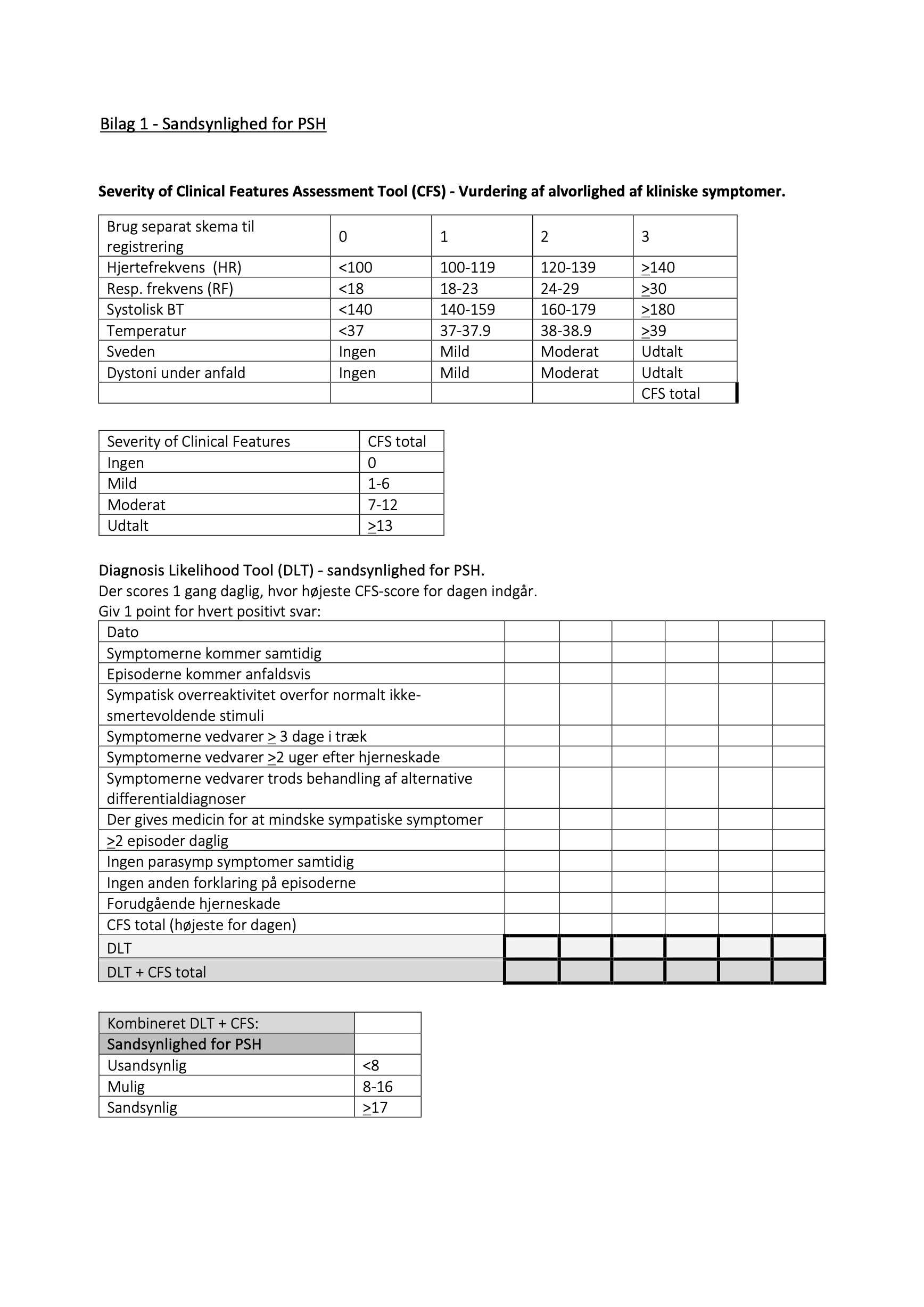
Til sandsynliggørelse anvendes skema udarbejdet på baggrund af Baguleys diagnostiske værktøj (1) – Se bilag 1 (Sandsynlighed for PSH).
PSH kan ses indenfor de første 24 timer til op til uger og måneder efter TBI (6), men opdages oftest indenfor den første uge, omkring dag 5, i forbindelse med forsøg på vækning. PSH beskrives også i rehabiliteringsfasen.
Symptomerne består ubehandlet i uger til flere år, hvor de efterhånden bliver mindre hyppige, hos nogle med mindre intensitet og kortere varighed (10), men hos andre længere varighed.
Behandling
Behandling involverer både farmakologisk og non-farmakologiske tiltag.
Den non-farmakologiske behandling inkluderer minimering af eksterne stimuli som undersøgelser eller ubehagelige/smertevoldende procedurer, men også normale plejeprocedurer som vending og badning.
Mange forskellige former for konventionel medicinsk behandling har været forsøgt, med det formål at forsøge at stoppe, forhindre eller mindske symptomer, men uden effekt på den grundliggende problematik (1).
Nedenstående skema er en opsummering og forslag til symptomatisk behandling jf. Meyfroidt og Baguley (11). Videregivelse tilladt efter CC BY-NC-ND 4.0.
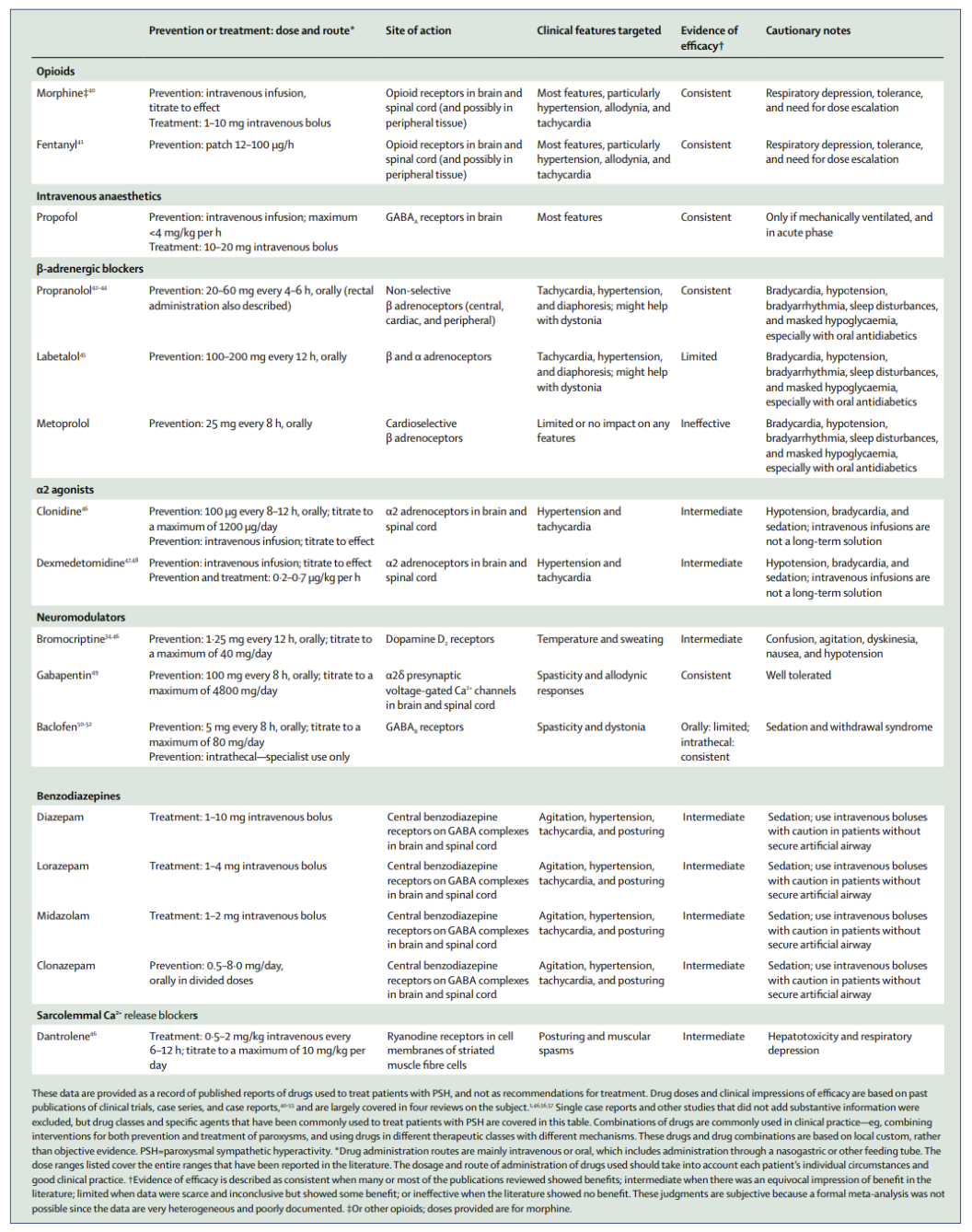
De fleste medikamenter involverer CNS depression og forårsager øget sedation. Oftest anvendt til symptomkontrol har været morfin, benzodiazepiner samt non-selektive beta-blokkere (12-14). Alfa- agonisterne Clonidin og dexmedetomidin har været anvendt og ser ud til at have effekt på de sympatiske symptomer, men uden at beskytte mod recidiv efter seponering (15). En lille case-serie peger på mulig varig effekt af Gabapentin, givet efter at andre behandlingsmuligheder var udtømt (1). Ud over behandling af selve PSH-symptomerne skal patienten naturligvis have generel understøttende behandling inklusive fokus på proteinrig ernæring og normotermi.
Haloperidol (og chlorpromazin) skal undgås på grund af dets antidopaminerge effekt, der kan udløse eller forværre PSH (30,31).
Baklofen, der er en GABA-B receptor agonist, som hæmmer de polysynaptiske reflekser og GABA- metabolismen, kan virke ved at reducere og modulere den cerebrale hyperaktivitet (16,17). Peroral behandling er ikke attraktivt, idet der skal store doser til at give effekt, med deraf følgende stor risiko for bivirkninger og komplikationer.
Intratekal Baklofeninfusion (ITB)
Ved hjælp af pumpe og intraspinalt kateter administreres intratekal Baklofen. ITB er effektivt i meget lave doser og derfor også med meget mindre risiko for systemiske bivirkninger (18).
ITB-behandling er veletableret til behandling af spasticitet, men anvendes også til behandling af dystoni, også hvor denne er en del af PSH. Det er vist at eliminere de autonome symptomer og dystonien i flere studier (19-24). Der er betydelige individuelle forskelle i respons på ITB og dermed også på effektfuld dosis.
ITB benyttes på Danske neurointensive afdelinger og på højt specialiseret rehabilitering. Erfaring viser, at det i nogle tilfælde er tilstrækkeligt at behandle i nogle få dage i den akutte fase, hvorefter der ikke er behov for yderligere. I andre tilfælde kan det være nødvendigt med længerevarende behandling, der ultimativt kan nødvendiggøre implantation af baklofenpumpe. Risiko for komplikationer og bivirkninger vil i så tilfælde være højere.
Formål med intratekal baklofen
At få hurtig kontrol over den sympatiske hyperaktivitet med henblik på at forhindre sekundære komplikationer af forlænget stress og facilitere rehabilitering (25). Derudover bedre at kunne vurdere patientens neurologiske status og få patienten hurtigere ud af sedation, respiratorbehandling og intensiv.
- Nedsætte katabolismen (nedsætte muskelspænding) og deraf følgende muskel- og vægttab
- Reducere sympatiske symptomer
- Forebygge kontrakturer og fejlstilling
- Nedsætte smerter som følge af forhøjet tonus – og dermed reducere behovet for smertestillendebehandling
- Reducere behovet for sedativa og afkorte respirator- og intensiv forløbet
- Undgå/reducere hypertermi, der kan resultere i sekundære hjerneskader
- Bedre mulighed for neurologisk vurdering pga. mindre sedation, smertestillende og evt. andenmedicinsk behandling
- I nogle tilfælde er der endvidere set bedring i bevidsthedsniveauet hos patienter med svære skaderefter ITB (26-28).
Anvendelse
Testdosis
Effekten af ITB testes ved Baklofen givet via lumbalpunktur. Bolus/testdosis som anført i nedenstående skema.
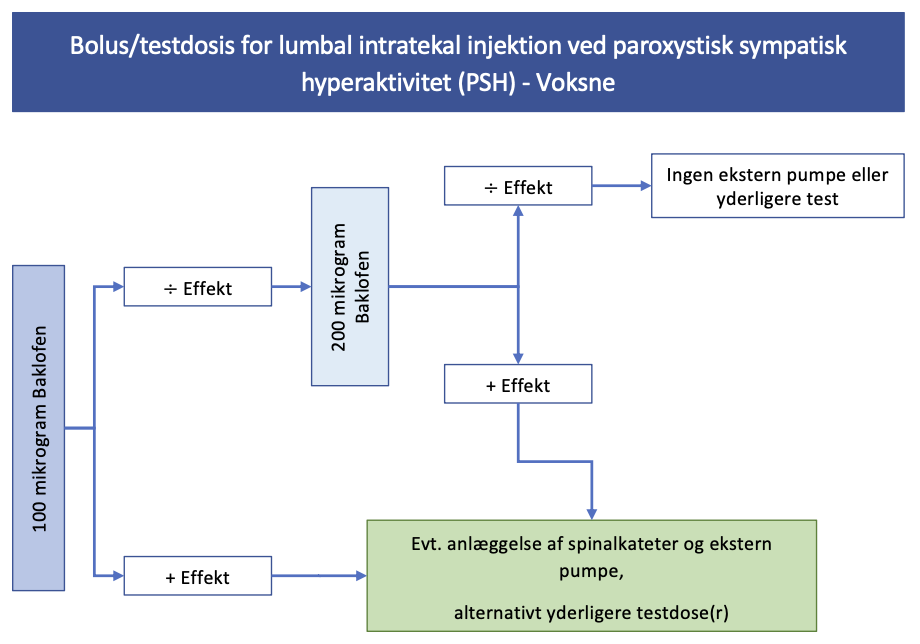
Figur 2. Bolus/testdosis for lumbal intratekal injektion ved paroxystisk sympatisk hyperaktivitet (PSH)
Effekten indtræder efter 1-2 timer og varer i 12-24 timer med halveringstid på 1-5 timer. Der ventes mindst 12 timer mellem hver dosis.
Alternativt kan kontinuerlig testinfusion i spinalkateter anvendes. Ved kontinuerlig testdosis startes med 5 mikrogram/time og højst hver 8 time kan der titreres op til effekt.
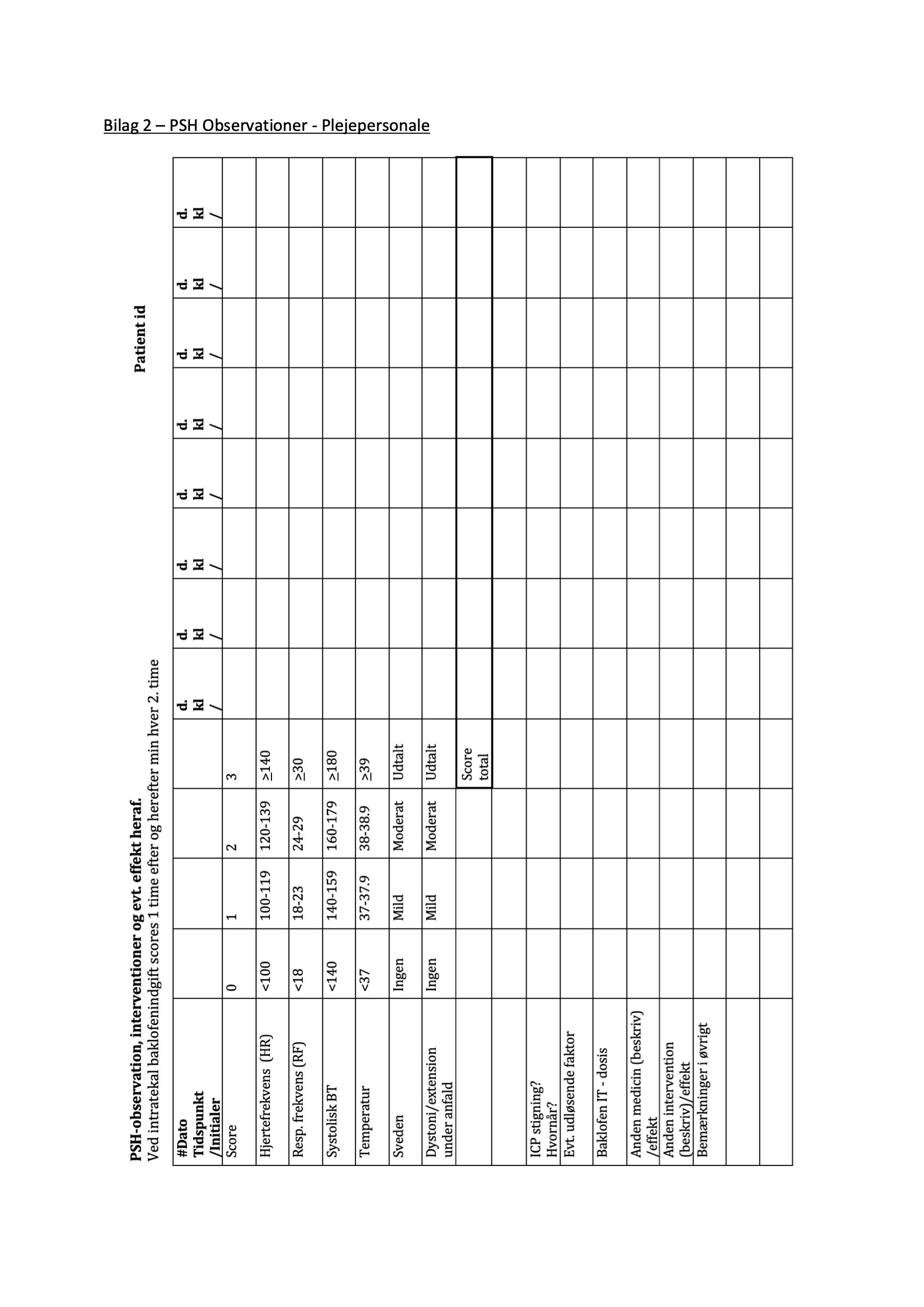
Effekten – eller manglende effekt – dokumenteres af sygeplejerske på PSH-observationsskema (Bilag 2) samt i elektronisk patientjournal med angivelse af evt. reduktion af de symptomer, der førte til diagnosen PSH.
Spinalkateter
Startdosis på 5 – 10 mikrogram/time, der giver en døgnmængde på 120 – 240 mikrogram. Behandlingsdosis pr. døgn på op til 800 mikrogram og i enkelte tilfælde kan være nødvendig for at få tilstrækkelig effekt. Med en koncentration i sprøjtepumpe på 10 mikrogram/ml giver det en infusionshastighed på 0,5 – 1 ml/time.
Blandingsforhold:
1. Ampuller på 50 mikrogram/ml suppleres med 4 ml isotonisk NaCl pr. ml baklofenopløsning
(f.eks. 4 ml i 16 ml isotonisk NaCl til 20 ml i alt)
2. Ampuller på 500 mikrogram/ml suppleres med 49 ml isotonisk NaCl pr. ml baklofenopløsning (f.eks. 1 ml i 49 ml isotonisk NaCl til 50 ml i alt)
| Dosis: mikrogram/time |
5 |
10 |
15 |
20 |
25 |
30 |
| Dosis: ml/time (10 mikrogram/ml) |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
| Dosis: mikrogram/døgn |
120 |
240 |
360 |
480 |
600 |
720 |
Dosisøgning sker under observation af patienten og under hensyntagen til, hvorvidt denne er i respirator eller ej. Patienter i respirator og under observation kan øges med 50 – 100 % højst hver 8 time. I andre tilfælde øges med omkring 15 %.
Spinalkatetret kan benyttes i 3-6 dage, hvor der observeres for infektionstegn.
Hvis symptomerne på PSH ikke er forsvundet indenfor denne tid og behandlingen ikke kan afsluttes, anlægges permanent subkutan pumpe.
Eksternt ventrikel dræn
Alternativt kan Baklofen overvejes givet via eksternt dræn i ventrikelsystemet, men dosis er ikke veletableret. 10-15% af intratekal dosis kan overvejes som startdosis, fx 12,5 μg (som givet af Becker et al. (29)). I så fald skal drænet være afklemt i en periode efterfølgende, f.eks. 30 min.
Referencer:
1 Baguley IJ, Perkes IE, Fernandez-Ortega JF, Rabinstein AA, Dolce G, Hendricks HT. Paroxysmal sympathetic hyperactivity after acquired brain injury: consensus on conceptual definition, nomenclature, and diagnostic criteria. J Neurotrauma. 2014;31(17):1515-20.
2 Perkes I, Baguley IJ, Nott MT, Menon DK. A review of paroxysmal sympathetic hyperactivity after acquired brain injury. Ann Neurol. 2010;68(2):126-35.
3 Perkes IE, Menon DK, Nott MT, Baguley IJ. Paroxysmal sympathetic hyperactivity after acquired brain injury: a review of diagnostic criteria. Brain Inj. 2011;25(10):925-32.
4 Farias-Moeller R, Carpenter JL, Dean N, Wells EM. Paroxysmal Sympathetic Hyperactivity in Critically Ill Children with Encephalitis and Meningoencephalitis. Neurocrit Care. 2015;23(3):380-5.
5 Fernandez-Ortega JF, Prieto-Palomino MA, Garcia-Caballero M, Galeas-Lopez JL, Quesada- Garcia G, Baguley IJ. Paroxysmal sympathetic hyperactivity after traumatic brain injury: clinical and prognostic implications. J Neurotrauma. 2012;29(7):1364-70.
6 Hinson HE, Sheth KN. Manifestations of the hyperadrenergic state after acute brain injury. Curr Opin Crit Care. 2012;18(2):139-45.
7 Hinson HE, Takahashi C, Altowaijri G, Baguley IJ, Bourdette D. Anti-NMDA receptor encephalitis with paroxysmal sympathetic hyperactivity: an under-recognized association? Clin Auton Res. 2013;23(2):109-11.
8 Letzkus L, Keim-Malpass J, Kennedy C. Paroxysmal sympathetic hyperactivity: Autonomic instability and muscle over-activity following severe brain injury. Brain Inj. 2016;30(10):1181-5.
9 Rabinstein AA. Paroxysmal sympathetic hyperactivity in the neurological intensive care unit. Neurol Res. 2007;29(7):680-2.
10 Hughes JD, Rabinstein AA. Early diagnosis of paroxysmal sympathetic hyperactivity in the ICU. Neurocrit Care. 2014;20(3):454-9.
11 Meyfroidt G, Baguley IJ, Menon DK. Paroxysmal sympathetic hyperactivity: the storm after acute brain injury. Lancet Neurol. 2017;16(9):721-9. CC BY-NC-ND 4.0.
12 Lump D, Moyer M. Paroxysmal sympathetic hyperactivity after severe brain injury. Curr Neurol Neurosci Rep. 2014;14(11):494.
13 Rabinstein AA, Benarroch EE. Treatment of paroxysmal sympathetic hyperactivity. Curr Treat Options Neurol. 2008;10(2):151-7.
14 Schroeppel TJ, Sharpe JP, Magnotti LJ, Weinberg JA, Clement LP, Croce MA, Fabian TC. Traumatic brain injury and β-blockers: not all drugs are created equal. J Trauma Acute Care Surg. 2014;76(2):504-9; discussion 9.
15 Peng Y, Zhu H, Chen H, Zhu Z, Zhou H, Zhang S, et al. Dexmedetomidine attenuates acute paroxysmal sympathetic hyperactivity. Oncotarget. 2017;8(40):69012-9.
16 Hoarau X, Richer E, Dehail P, Cuny E. Comparison of long-term outcomes of patients with severe traumatic or hypoxic brain injuries treated with intrathecal baclofen therapy for dysautonomia. Brain Inj. 2012;26(12):1451-63.
17 Kofler M, Poustka K, Saltuari L. Intrathecal baclofen for autonomic instability due to spinal cord injury. Auton Neurosci. 2009;146(1-2):106-10.
18 Meythaler JM, Guin-Renfroe S, Grabb P, Hadley MN. Long-term continuously infused intrathecal baclofen for spastic-dystonic hypertonia in traumatic brain injury: 1-year experience. Arch Phys Med Rehabil. 1999;80(1):13-9.
19 Mathew MJ, Deepika A, Shukla D, Devi BI, Ramesh VJ. Paroxysmal sympathetic hyperactivity in severe traumatic brain injury. Acta Neurochir (Wien). 2016;158(11):2047-52.
20 Becker R, Alberti O, Bauer BL. Continuous intrathecal baclofen infusion in severe spasticity after traumatic or hypoxic brain injury. J Neurol. 1997;244(3):160-6.
21 Hilz MJ, Liu M, Roy S, Wang R. Autonomic dysfunction in the neurological intensive care unit. Clin Auton Res. 2019;29(3):301-11.
22 Marehbian J, Muehlschlegel S, Edlow BL, Hinson HE, Hwang DY. Medical Management of the Severe Traumatic Brain Injury Patient. Neurocrit Care. 2017;27(3):430-46.
23 Pucks-Faes E, Hitzenberger G, Matzak H, Verrienti G, Schauer R, Saltuari L. Intrathecal baclofen in paroxysmal sympathetic hyperactivity: Impact on oral treatment. Brain Behav. 2018;8(11):e01124.
24 Samuel S, Allison TA, Lee K, Choi HA. Pharmacologic Management of Paroxysmal Sympathetic Hyperactivity After Brain Injury. J Neurosci Nurs. 2016;48(2):82-9.
25 Lemke DM. Sympathetic storming after severe traumatic brain injury. Crit Care Nurse. 2007;27(1):30-7; quiz 8.
26 Al-Khodairy AT, Wicky G, Nicolo D, Vuadens P. Influence of intrathecal baclofen on the level of consciousness and mental functions after extremely severe traumatic brain injury: brief report. Brain Inj. 2015;29(4):527-32.
27 Hoarau X, Richer E, Dehail P, Cuny E. A 10-year follow-up study of patients with severe traumatic brain injury and dysautonomia treated with intrathecal baclofen therapy. Brain Inj. 2012;26(7- 8):927-40.
28 Pistoia F, Sacco S, Sarà M, Franceschini M, Carolei A. Intrathecal baclofen: effects on spasticity, pain, and consciousness in disorders of consciousness and locked-in syndrome. Curr Pain Headache Rep. 2015;19(1):466.
29 Becker R, Benes L, Sure U, Hellwig D, Bertalanffy H. Intrathecal baclofen alleviates autonomic dysfunction in severe brain injury. J Clin Neurosci. 2000;7(4):316-9. 30 Sandel, M. E., Olive, D. A., & Rader, M. A. (1993). Chlorpromazine-induced psychosis after brain injury. Brain Injury.1993;7(1), 77Y83.
31 Wilkinson, R., Meythaler, J. M., & Guin-Renfroe, S. (1999). Neuroleptic malignant syndrome induced by haloperidol following traumatic brain injury. Brain Injury, 1999;13(12), 1025Y1031
Bilag
Bilag 1 – Sandsynlighed for PSH
Bilag 2 – PSH Observationer – Plejepersonale