Fødeepidural
En klinisk vejledning Obstetrisk udvalg, DASAIM.
Forår 2021
2024: Opdateret iht ny DASAIM vejledning omkring anæstesiologisk håndtering af Præeklampsi/Eklampsi
INTRODUKTION
FORMÅL
PRIMÆR
- Formålet med denne vejledning er at sikre kvaliteten af epidural analgesi til fødende
SEKUNDÆRE
- Danne basis for udarbejdelsen af lokale instrukser for anlæggelse af fødeepidural og monitorering før, under og efter anlæggelse
- Danne basis for undervisningen i obstetrisk anæstesi ved speciallægeuddannelsen i anæstesiologi
- Tjene som vejledning for daglig klinisk praksis ved administrering af fødeepidural
MÅLGRUPPE
Læger under uddannelse til anæstesiologer, speciallæger i anæstesiologi med ansættelse på danske anæstesiologiske afdelinger og jordemødre ansat på danske fødeafdelinger.
METODE
Vejledningen er udarbejdet af en arbejdsgruppe nedsat af Dansk Selskab for Anæstesiologi og Intensiv Medicin (DASAIM)’s Obstetriske udvalg, obstetrikere udpeget af Dansk Selskab for Obstetrik og Gynækologi (DSOG) og en jordemoder udpeget af Dansk Jordemoder Fagligt Selskab (DJS). Vejledningen er en opdatering af ”Fødeepidural. En klinisk vejledning” fra 2011.
ÆNDRINGER SIDEN SIDST
Vejledningen er opdateret og de enkelte afsnit er skilt mere ud. Der er tilføjet afsnit om kredsløbsstabilisering, alternativer når epidural er kontraindiceret – opioider og neurologiske klager efter fødslen.
DEFINITIONER
- En fødeepidural er en epiduralblokade til smertelindring under vaginal fødsel
- En fødespinal er en single-shot spinalblokade som gives under vaginal fødsel
- En kombineret spinal-epidural blokade (CSE) er en kombination af en fødespinal og et epiduralkateter til smertelindring under fødslen
- Patient-kontrolleret epidural analgesi (PCEA) betyder, at patienten selv kan aktivere en pumpe til at administrere smertestillende medicin som bolus gennem epiduralkateteret
ARBEJDSGRUPPENS MEDLEMMER
Afdelingslæge Lotte Marie Vestergaard (LV), Anæstesiologisk Afdeling, Hvidovre Hospital (tovholder)
Afdelingslæge Mette Legaard Andersson (MLA), Anæstesiologisk Afdeling, Odense Universitetshospital
Overlæge Eva Weitling (EW), Anæstesiologisk Afdeling, Kolding Sygehus
Afdelingslæge, Greta Skou (GS), Anæstesiologisk Afdeling, Aalborg Universitetshospital Nord
Overlæge Kim Ekelund (KE), Anæstesiologisk Afdeling, JMC, Rigshospitalet
Afdelingslæge Kim Lindelof (KL), Anæstesiologisk Afdeling, JMC, Rigshospitalet
Afdelingslæge Kim Wildgaard (KW), Anæstesiologisk Afdeling, Herlev Hospital
Overlæge Lars Møller Pedersen (LMP), Anæstesiologisk Afdeling, Hvidovre Hospital
Overlæge Lone Fuhrmann (LF), Anæstesiologisk Afdeling, Herlev Hospital
Overlæge Omar Rian (OR), Anæstesiologisk Afdeling, Hospitalsenheden Horsens
Afdelingslæge Christina Frøslev-Friis (CFF), Anæstesiologisk afdeling, Sygehus Sønderjylland, Aabenraa
Afdelingslæge Jan Herzog (JAH), Anæstesiologisk afdeling, Odense Universitetshospital
Overlæge Neel Walløe (NW), Anæstesiologisk afdeling, Sydvestjysk Sygehus, Esbjerg
Afdelingslæge Patricia Duch (PD), Anæstesiologisk afdeling, Nordsjællands Hospital, Hillerød
Afdelingslæge Julie Wiis (JW), Anæstesiologisk afdeling, Herlev Hospital
Afdelingslæge Renee Anita Bøgeskov (RB), Anæstesiologisk afdeling, Herlev Hospital
Afdelingslæge Maria Egede Kromann (MEK), Anæstesiologisk Afdeling, Hvidovre Hospital
Overlæge Nini Møller (NM), Obstetrisk og gynækologisk afdeling, Nordsjællands Hospital, Hillerød
Afdelingslæge Mona Aarestrup Karlsen (MAK), Obstetrisk afdeling, Rigshospitalet
Jordemoder Stinne Høgh (SH), Obstetrisk afdeling, Rigshospitalet
OPDATERING AF DE ENKELTE AFSNIT
Opdatering af de enkelte afsnit blev uddelegeret til to medlemmer af arbejdsgruppen:
| Afsnit | Arbejdsgruppe |
| 3. Information | KE, NKM |
| 4. Monitorering og udstyr | EW, SH |
| 5. Indikationer og kontraindikationer | KL, JW, (MEK) |
| 6. Teknik ved anlæggelse | LMP, GS |
| 7. Test | OR, RB |
| 8. Bolus | LMP, PD |
| 9. Vedligehold | OR, KW |
| 10. Kredsløbsstabilisering | LV, NW |
| 11. Administrationsformer | JAH, RB |
| 12. Bivirkninger og komplikationer | PD, JW |
| 13. Top-up til sectio og PPH | MLA, CFF |
| 14. Insufficient epidural | KL, MLA |
| 15. Alternativer til epidural | NW, LV |
| 16. Alternativer når epidural er kontraindiceret | MAK, LV |
| 17. ADP og PDPH | KW, GS |
| 18. Neurologiske klager efter fødslen | EW, LF |
INTERESSEKONFLIKTER
Forfatterne har ingen interessekonflikter
FORKORTELSER
| ACOG | American College of Obstetricians and Gynecologists |
| ADP | Accidentiel Dura Punktur |
| ASA | American Society of Anesthesiologists |
| BMI | Body Mass Index |
| BT | Blodtryk |
| CEI | Continued Epidural Infusion |
| CPICEA | Computerintegreret PCEA pumpe |
| CSF | Cerebrospinal væske |
| CTG | Cardiotocografi |
| CSE | Combined Spinal Epidural (kombineret spinal-epidural) |
| DASAIM | Dansk Selskab for Anæstesiologi og Intensiv Medicin |
| DIC | Dissemineret Intravaskulær Koagulation |
| DPE | Dura Puncture Epidural (dura punktur epidural) |
| DSOG | Dansk Selskab for Obstetrik og Gynækologi |
| DSTH | Dansk selskab for trombose og hæmostase |
| EBP | Epidural Blood Patch |
| EVE | Epidural-Volume-Expansion |
| GA | Generel Anæstesi |
| GONB | Greater n. occipitalis blok |
| HELLP | Haemolysis, Elevated Liver Enzymes and Low Platelet count |
| LOR | Loss Of Resistance |
| MR | Magnetisk Resonans |
| NSAID | Non Steroidal Anti-Inflammatory Drug |
| OAA | Obstetric Anaesthetists’ Association |
| RCT | Randomized Controlled Trial |
| RR | Relativ Risiko |
| PDPH | Post Dural Puncture Headache |
| PIEB | ProgrammedIntermittent Epidural Bolus |
| PCEA | Patient Controlled Epidural Analgesia |
| PCA | Patient Controlled Analgesia |
| PUR | Postpartum Urinretention |
| SPGB | Sphenopalatine Ganglion Block |
| SSI | Statens Serum Institut |
| UL | Ultralyd |
| VAS | Visuel Analog Score |
INFORMATION
KE og NKM
- Af etiske og juridiske grunde skal enhver patient, der ønsker eller tilbydes en fødeepidural orienteres om virkninger, bivirkninger og komplikationer ved at vælge denne smertebehandling
- Patienten har ret til at frabede sig information. Men samtykke skal foreligge
- Informationen skal gives løbende såvel skriftlig som mundtlig og kan hensigtsmæssigt gives under graviditeten af jordemoder samt under fødslen før epiduralkateteret lægges
- Jordemoderen informerer indledende under fødslen, men anæstesilægen skal selv informere og indhente informeret samtykke af patienten
- Anæstesilægen skal notere i journalen, at der er indhentet informeret samtykke. Også om patienten evt. har takke nej til at modtage informationen
- Information om meget sjældne komplikationer bør indgå i den skriftlige information
BAGGRUND FOR INFORMATION
Ifølge Sundhedsloven af 02.11.2018 kapitel 5 ”Patienters medinddragelse i beslutninger” skal der indhentes informeret samtykke til enhver undersøgelse og behandling, der foretages på en habil patient. Dette gælder også fødende kvinder (1).
For at kunne indhente et informeret samtykke til en behandling, skal patienten orienteres om virkning og bivirkning/komplikationer, have forstået informationen og taget beslutning.
Det har været diskuteret, om kvinder under en fødsel præget af stærke smerter, udmattelse og eventuelt af smertestillende medicin, er fuldt i stand til at tage stilling til den givne information (2,3). Undersøgelser har vist, at fødende kvinder bedst kan huske informationen, hvis informationen er givet både mundtligt og skriftligt, og hvis den er givet både under graviditeten op til fødslen og umiddelbart inden anlæggelsen af fødeepiduralen (2,4–8).
Kvinder i fødsel kan skifte mening og har derfor krav på igen at blive orienteret om muligheden for epidural smertelindring under fødslen (9).
Anæstesilægen, som anlægger epiduralkateteret, er ansvarlig for, at patienten har forstået informationen og at samtykket indføres i patientjournalen (1).
I tilfælde med en sprogbarriere, der hindrer umiddelbar forståelse af informationen, kan der muligvis hentes hjælp fra LabourPains.com https://www.labourpains.com/International_Translations, udarbejdet af Obstetric Anaesthesia Association (OAA).
HVAD SKAL DER INFORMERES OM
Informationen skal indeholde tilstrækkelig oplysning om behandlingsmuligheder, fordele og risici og bivirkninger mv.,
så patienten har det nødvendige grundlag til at kunne tage stilling til behandlingsspørgsmålet.
Når der skal informeres om mulige komplikationer i forbindelse med undersøgelse og behandling, skal der tages udgangspunkt i, om der er tale om:
- Alvorlige og almindelige komplikationer
- Alvorlige og sjældne forekommende komplikationer
- Ikke alvorlige og almindelige komplikationer
- Ikke alvorlige og sjældne forekommende komplikationer
Patienten har også ret til at afstå fra at blive orienteret om bivirkninger og komplikationer.
Patientklager i forbindelse med obstetrisk anæstesi forekommer (særligt internationalt) ikke sjældent.
Appendix 1
Se side 50.
MONITORERING
EW og SH
REKOMMANDATIONER
MONITORERING
Den fødende og fostret skal monitoreres på samme måde uanset hvornår i fødslen (latens- og aktive fase) fødeepiduralen anlægges.
- Blodtryks (BT)-kontrol før og hvert 5. min i de første 15 minutter efter anlæggelse. BT-kontrol før og hvert 5. min i de første 15 min gentages, hvis der gives bolus med dosis ≥ testbolus.
- Kvinden bør være smertelindret 20-30 min. efter bolus og gennem hele fødselsforløbet, i modsat fald kontaktes anæstesilægen igen.
- Kvinden skal opfordres til at tømme blæren hver 4. time. Alternativt kan blæren tømmes med blærekateter med samme interval eller vejledt af ultralyd. Blæren kan vurderes med ultralyd oftere, hvis det vurderes klinisk relevant.
- Cardiotocografi (CTG)-monitorering skal foretages i de første 30 min. efter anlæggelsen og efter hver bolus med dosis ≥ testbolus.
- Ved indikation for kontinuerlig CTG skal denne fortsættes ud over 30 min.
BAGGRUND FOR REKOMMANDATIONER
MONITORERING
Den fødende kan tilbydes fødeepidural både i latensfasen og i den aktive fase af fødslen (10,11). Monitorering skal ske på samme måde uanset hvornår i fødslen fødeepiduralen anlægges. Føtale pulsændringer ses især efter bolusindgift, og hyppigst efter intrathekal opioid(12). Maternel hypotension kan forekomme efter fødeepidural og kombineret epidural-spinal (CSE) og især, hvis der anvendes høje koncentrationer af lokalanalgetika (13). På grund af risiko for nedsat blæresensibilitet og overdistension bør kvinden opfordres til at tømme blæren hver 4. time (14). Alternativt kan blæren undersøges med ultralyd (UL) oftere, og ved behov tømmes med kateter.
Uterusruptur er en velkendt risiko (ca. 2 %) hos fødende, der tidligere har fået foretaget kejsersnit, og disse bør derfor have kontinuerlig CTG-overvågning under fødsel med fødeepidural (15,16). Kontinuerlig CTG-monitorering bør desuden foretages på indikation (16).
INDIKATIONER OG KONTRAINDIKATIONER TIL FØDEEPIDURAL
KL og JW
REKOMMANDATIONER
Neuroaksial analgesi bør tilbydes som intrapartum smertelindring uanset paritet og cervikal dilatation, dog ikke hvis der er kontraindikationer.
INDIKATIONER OG KONTRAINDIKATIONER TIL FØDEEPIDURAL INDIKATIONER
-
- Ønsket af den gravide kvinde som smertelindring
- Kan være indiceret ved gemelli, præeklampsi og foetus mortuus
- Medicinske sygdomme hos mater:
- Hjertesygdom
- Lungesygdom
- Neurologiske sygdomme
- Anæstesirelaterede (anbefalet som ”tidlig fødeepidural” for at undgå/minimere risikoen for generel anæstesi)
- Øget risiko ved luftvejshåndtering (f.eks. lille mundåbning, nedsat nakkebevægelighed)
- Ved allergi overfor medicin der anvendes ved generel anæstesi (f.eks. porfyri (thiopental), malign hypertermi (sevofluran/suxamethonium), muskeldystrofi (suxamethonium))
- Højt Body Mass Index (BMI), da anlæggelse af neuroaksial anæstesi og luftvejshåndtering vanskeliggøres af højt BMI
KONTRAINDIKATIONER
Absolutte
- Manglende samtykke
- Betydende koagulopati
- Absces/infektion, tumor eller AV-malformation/hæmangiom/karanomali i området for indstik
Relative
- Stivgørende rygoperation, tethered cord, chiliplaster
- Diskusprolaps og dissemineret sklerose er normalt ingen kontraindikation ved stabil neurologi
- Alle gravide med betydende co-morbiditet bør tilses af anæstesiolog i starten af tredje trimester
BAGGRUND FOR REKOMMANDATIONER
INDIKATIONER
Smertelindring og maternel request: American Society of Anesthesiologists (ASA) og American College of Obstetricians and Gynecologists (ACOG) anbefaler, at hvis der ikke er medicinske kontraindikationer, er maternal request tilstrækkelig indikation for anlæggelse af epidural mhp. Smertelindring (17,18) I to forskellige cochrane reviews har man vist: 1) at overordnet tilfredshed med fødselsoplevelsen og den bedste smertestillende effekt fandtes ved epidural analgesi, når man sammenlignede med transkutan elektrisk nervestimulation, i.m. pethidin, inhalation af N2O, forskellige ikke-farmakologiske metoder samt kombinationer af disse (19). 2) at kvinderne var mere tilfredse med smertelindringen i epiduralgrupperne, når man sammenlignede med systemisk opioid, placebo/ingen behandling eller N2O-inhalation (20).
Gemelli/flerfoldsgraviditet: Da der ofte er brug for fleksibel anæstesi ved flerfoldsfødsel (risiko for konvertering til sectio/behov for vending af tvilling B efter fødsel af tvilling A), er epidural den optimale anæstesiform til flerfoldsfødsler, da det giver mulighed for bolusadministration i epidural (21).
Præeklampsi: Fordelene ved fødeepidural til kvinder med præeklampsi er, at man undgår luftvejshåndtering (øget ødem i luftveje og risiko for blodtryksstigning ved laryngoskopi) ved konvertering til sectio. Desuden undgås blodtryks-top under veer, hvorved der opnås bedre blodtrykskontrol (22). Epiduralen kan hæmme yderligere hypertension som respons på smerte samt sænke niveauerne af katekolaminer og stressrelaterede hormoner hos kvinden (23).
Foetus mortuus: Dette for den fødendes komfort. Et ikke så velundersøgt et område, men da risici for den fødende er minimale, synes det oplagt at tilbyde denne mulighed.
Medicinske sygdomme hos mater: Hjertesygdom (f.eks. mitralstenose) (24), lungesygdom (f.eks. astma) (25) neurologiske sygdomme (f.eks. myastenia gravis (uden svær lungeinvolvering) og rygmarvsskader (risiko for autonom dysreflexi minimeres)) (26,27). Det primære mål med epidural analgesi er, hæmning af de fysiologiske effekter af veerne (pludselig preloadstigning), takykardi, øget systemisk vaskulær modstand, hypertension og hyperventilation (28).
Anæstesi-relaterede (anbefales som “tidlig epidural” for at undgå/minimere risikoen for generel anæstesi): Luftvejshåndtering bør undgås, hvis muligt, idet det udgør en øget mortalitet/morbiditetsrisiko hos gravide. Der kan ses generaliseret ødem hen imod slutningen af graviditeten – også i øvre luftveje, hvorfor intubation kan være vanskelig. Derudover falder den funktionelle respiratoriske residualkapacitet med ca. 20% hos den raske gravide. Den fødende har tillige øget aspirationsrisiko grundet forsinket ventrikeltømning og afslapning af den nedre lukkemuskel i spiserøret.
Hos fødende med yderligere øget risiko ved luftvejshåndtering, f.eks. i form af malformation af øvre luftveje/cervikale columna, vil tidlig epidural give mulighed for relevant anæstesi ved konvertering fra vaginal fødsel til akut sectio. Hos patienten med højt BMI vil luftvejshåndtering være særligt risikofyldt og anlæggelse af neuroaksial anæstesi kan være vanskelig, hvorfor tidlig epidural anbefales. Desuden vil allergi for medicin, der anvendes ved generel anæstesi også indicere tidlig epidural (fx. porfyri, malign hyperthermi, muskeldystrofi), for at undgå eventuel general anæstesi.
KONTRAINDIKATIONER
Manglende samtykke: Proceduren kræver informeret samtykke.
Manglende compliance: Bevægelse hos kvinden under anlæggelse anses for at være forbundet med en øget risiko for iatrogen skade og er derfor en absolut kontraindikation.
Koagulopati:
- Overordnet set anbefales at anvende retningslinjerne i PRAB-rapporten af 2023 fra Dansk Selskab for Trombose og Hæmostase på https://dsth.dk/pdf/prab_final_2023.pdf /
- Bemærk at PRAB-rapporten af 2023 ikke længere indeholder anbefalinger for grænseværdier for trombocytter og INR ved anlæggelse af neuroaksial blokade.
- DASAIMs obstetriske udvalg anbefaler brug af nedenstående grænser ved anlæggelse af neuroaksial blokade
- Ved præeklampsi anbefales det at trombocyt-blodprøver maksimalt er 6 timer gamle ved en stabil tilstand og maksimalt 2 timer gamle ved en ustabil tilstand.
Hos stabile ukomplicerede præeklampsi patienter, uden mistanke om leversvigt eller abruptio placenta og med et trombocyttallet > 100×109/l anbefales INR ikke målt rutinemæssigt. Supplerende vurdering af koagulation anbefales ved medfødt eller erhvervet koagulationsdefekt, sivblødning, HELLP, mistanke om DIC, abruptio placenta, leversvigt (ALAT > 70 IU/l eller LDH > 600 U/l) eller trombocyttal < 100 x109/l .
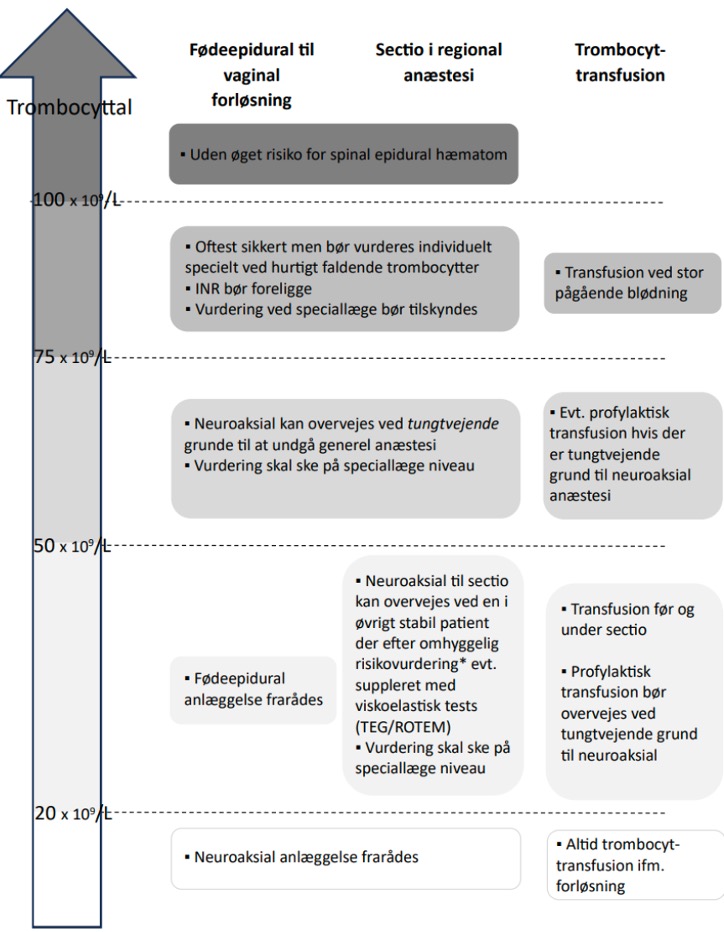
Der kan forekomme tilstande hos gravide, fx DIC ved foetus mortuus eller sepsis, eller svær preeklampsi/HELLP, acute fatty liver of pregnancy, hvor koagulopati kan optræde, og neuroaksial blokade derfor er kontraindiceret.
Absces/infektion/tumor/AV-malformation/hæmangiom/karanomali i området for indstik: Ved risiko for spredning af infektion, tumorceller eller høj risiko for spinal/epidural blødning er epiduralanlæggelse absolut kontraindiceret.
RELATIVE KONTRAINDIKATIONER
Stivgørende rygoperation er ingen absolut kontraindikation men kan besværliggøre anlæggelsen af epidural pga. besvær med fleksion af ryg. Desuden kan arvæv påvirke udbredelsen af analgesien. Gravide kvinder med stivgørende rygoperation, bør have anæstesiologisk tilsyn forud for forløsning mhp. fremskaffelse af operations- og scanningsbeskrivelser samt plan for analgesi/anæstesi. Hvis der kan anlægges neuroaksial blokade ét niveau over eller under dese-materialet, kan anlæggelse tilbydes, men med særlig fokus på sterilitet (29).
Anatomiske ryg-anomalier, fx tethered cord er sjælden, men ved begrundet mistanke om lavtliggende conus bør kvinden scannes forud for anlæggelse af spinal anæstesi. Tethered cord kan optræde sammen med spinal dysraphisme. Spinal dysraphisme (fx spina bifida/neuralrørsdefekter) kan være forbundet med øget risiko for besværlig anlæggelse, durapunktur, høj blokade og/eller insufficient anslag, men epidural er ikke absolut kontraindiceret. Det anbefales at undgå indstik på niveauet for anomalien, og kvinden bør informeres om potentielt let øget risiko for durapunktur, vanskelig anlæggelse, insufficient blok og/eller høj blokade. Anlæggelsen besværliggøres af, at spinal dysraphism/spina bifida ofte er kombineret med scoliose/kyfoscoliose (30).
Kvinder med syringomyeli kan tilbydes fødeepidural, hvis der ikke har været progression i symptomer under graviditeten. Det anbefales, at epiduralen opsprøjtes i refrakte doser idet anslag kan være uforudsigeligt (31).
Rygsmerter, tatovering, diskusprolaps, dissemineret sclerose og tidligere sectio er ikke kontraindikationer.
TEKNIK VED ANLÆGGELSEN
LMP og GS
REKOMMANDATIONER
- Både siddende stilling og sideleje kan anvendes
- Lumbal eller lav thorakal anlæggelse mediant eller paramediant
- Steril procedure med desinfektion med klorhexidin 0,5 % med ethanolsprit 70-85%
- Saltvand er førstevalg til identifikation af Loss Of Resistance (LOR)
BAGGRUND FOR REKOMMANDATIONER
FORBEREDELSE TIL EPIDURAL ANLÆGGELSE
LEJRING VED ANLÆGGELSE
Fødeepiduralen kan lægges med patienten siddende eller i sideleje. Der findes dokumenterede fordele og ulemper for begge metoder:
Patient i sideleje: Fordele: Der er mindre risiko for at penetrere et kar og få blod i kateteret (32,33). Mindre risiko for displacering af kateter grundet længere afstand til epiduralrummet (34). Ulemper: Længere afstand til epiduralrum kan vanskeliggøre proceduren.
Siddende patient: Fordel: Ved BMI > 30 muligvis lettere at identificere midtlinjen (35).
Hos raske gravide fandtes ingen klinisk relevant forskel i cardiac index ved sammenligning af sideleje og siddende stilling (34).
INDSTIKSNIVEAU
Ud fra en teoretisk betragtning om de, på et givent tidspunkt i fødslen, involverede medullære segmenter, kan det undertiden (tidligt i fødslen) forsvares at anlægge fødeepidural lavt thorakalt/ højt lumbalt for at opnå størst analgetisk effekt. En sådan praksis indebærer imidlertid øget risiko for medullær skade, hvorfor indstik under L3 anbefales af nogle (35). Ved anlæggelse af CSE bør naturligvis altid stikkes under conus medullaris.
Indstik og indføring af kateter: Median eller paramedian adgang kan begge anvendes. Der er ikke fundet signifikant forskel på de to metoder med hensyn til komplikationer og paræstesier (36,37).
STERILITET
I overensstemmelse med SSI´s retningslinie anbefales: to gange desinfektion med klorhexidin 0,5% med ethanolsprit 70-85% og tid til at tørre for hver gang (38).
ULTRALYD
I trænede hænder kan præ-procedure ultralydsundersøgelse af columna facilitere neuraksiale procedurer. Hos overvægtige gravide findes god korrelation mellem estimeret og faktisk LOR (39) og hos både overvægtige og normalvægtige gravide øges succesraten i forbindelse med spinalanlæggelse til sectio (40). Imidlertid fandt man ingen gevinst af UL i forbindelse med epidural anlæggelse hos fødende med nemt palpable rygge (41).
ANLÆGGELSEN AF EPIDURAL
SALTVAND VERSUS LUFT VED LOSS OF RESISTANCE
En Cochrane analyse fra 2014 og en Meta-analyse fra 2010 fandt ikke statistisk signifikant forskel på de to teknikker ifht. reduktion af komplikationer, såsom ”patchy” blokade, accidentiel durapunktur (ADP), post dura punktur hovedpine (PDPH) mv. (42,43).
Anbefalinger i litteraturen af NaCl til brug for LOR-teknik er alene baseret på en teoretisk risiko for pneumocephalus ved ADP og brug af luft.
Det er ofte tilfældet, at man ved brug af saltvand hurtigere opdager en ændring i modstand ved LOR-teknik (32).
TEST AF EPIDURALKATETERET
OR og RAB
REKOMMANDATIONER
TEST AF EPIDURALKATETERET
- Testdosis skal være mindre end, eller tilsvarende intrathekal dosis lokalanalgetika til kejsersnit
- Testdosis med lidokain-adrenalin indebærer risiko for alvorlige bivirkninger ved intrathekal beliggenhed af kateteret. Opsprøjtning med refrakte doser af lavkoncentrerede lokalanalgetika i kombination med opioid kan med fordel anvendes som test
- Anvendes fraktioneret bolus om test, skal den totale dosis lokalanalgetika ikke overstige 10 mg bupivacain. Patienten skal observeres i 10 minutter, før intrathekal lokalisering med sikkerhed kan udelukkes
- Enhver administration i epiduralkateteret skal betragtes som en testdosis, og bør forudgås af aspiration, da displacering, herunder sekundær intrathekal og intravasal migration, forekommer
- Testdosis med adrenalin skal administreres i vepausen. Administration under ve øger risikoen for falsk positivt resultat
- Udstyr til håndtering af luftvej og hæmodynamisk instabilitet skal være tilgængelig ved administration af enhver epidural bolus, i tilfælde af højt spinalt blok
BAGGRUND FOR REKOMMANDATIONER
TEST AF EPIDURALKATETERET
Epidural fødselsanalgesi er en veletableret og sikker behandling. Uerkendt intrathekal eller intravasal beliggenhed af kateteret er en sjælden og potentielt alvorlig komplikation (44). Intrathekal administration af lokalanalgetika i epidural dosering kan medføre livstruende komplikationer hos den gravide og fødende patient (45). Risikoen for intravaskulær og intrathekal lokalisering omfatter også tidligere anlagte og velfungerende epiduralkatetre, da der i sjældne tilfælde kan forekomme sekundær migrering (45).
Incidensen af displacerede epiduralkatetre hos fødende er den samme som hos ikke-obstetriske patienter. ADP forekommer ved 1-1,5% og vaskulær punktur i 5% af epiduralanlæggelser (44,45), dette vil i langt de fleste tilfælde erkendes ved aspiration på katetret. Intrathekal beliggenhed efter negativ aspiration er meget sjældent og forekommer hos 0.035-0,25% (44–47).
Evidensen omkring test af epiduralkateteret er typisk ekstrapoleret fra ikke-gravide populationer eller bygger på kliniske studier som sammenligner respons på epidurale vs. spinale doser af lokalanalgetika administreret til gravide i forbindelse med kejsersnit (44). Risikoen ved administration af testdosis skal derfor opvejes mod risikoen for at administrere en epidural bolus intrathekalt eller intravasalt.
LIDOKAIN-ADRENALIN
For at identificere displacerede katetre er der traditionelt anvendt en testdosis bestående af 20-45 mg lidokain med adrenalin. Lidokain medfører motorisk blokade indenfor 5 minutter ved intrathekal administration, mens adrenalin ved intravaskulær administration medfører stigning i hjertefrekvens, hvor en frekvensøgning > 10/min i 30-60 sek indenfor 30 sek betragtes som et positiv resultat (44,45,47).
Gravide og fødende har dels en nedsat sensitivitet for β-adrenerg stimulation, og dels en øget sensitivitet overfor lokalanalgetika, hvorfor administration af den traditionelle testdosis i sig selv kan medføre risiko for hypotension, motorisk og sensorisk blokade, samt højt spinal blok med behov for intubation og ventilation. Anvendelsen af adrenalin som intravasal test er associeret med nedsat uterint bloodflow, som i sjældne tilfælde kan medføre føtal distress resulterende i akut kejsersnit (45,47). Incidensen af falsk positive test er højere hos fødende kvinder, hvor der naturligt forekommer en stor fluktuation i hjertefrekvens, især under veaktivitet.
Anvendelse af den traditionelle testdosis til gravide og fødende er således kontroversielt, og der foreligger divergerende og mangelfulde guidelines på området, ligesom flere studier afdækker stor heterogenicitet i klinisk praksis (45,47,48).
TEST MED LAVKONCENTREREDE LOKALANÆSTETIKA/OPIOID-BLANDINGER
De seneste årtier er der sket en udvikling i retning af lavdosisregimer for epidural fødselsanalgesi, resulterende i færre alvorlige komplikationer. Comparative Obstetric Mobile Epidural Trial (COMET) konkluderede, at de nuværende lavdoserede epiduralblandinger med opiod med fordel kan anvendes som test fremfor den traditionelle testdosis med lidokain-adrenalin. Således anvendes nu i højere grad en fraktioneret bolusdosis af lavkoncentrerede epduralblandinger som test – typisk ropivacain eller bupivacain tilsat et opiod som fentanyl eller sufentanil (44,47). Anvendes fraktioneret bolus som test, skal den totale dosis lokalanalgetika ikke overstige den man ville anvende intrathekalt til et kejsersnit, og ikke over 10 mg bupivacain da højt blok er observeret ved større dosis (44,47). Anslag af motorisk blokade ved intratekal test med lavdosis ropivacain eller bupivacain er forlænget, og patienten skal observeres i op til henholdsvis 8 og 10 minutter før intratekal lokalisering sikkert kan udelukkes (44). Intravasalt beliggende kateter vil afdækkes indirekte som følge af manglende analgetisk effekt, da lavdosis regimer medfører ringe risiko for maternel systemisk toxisitet (45,47).
TEST FØR TOP-UP TIL AKUT KEJSERSNIT
Særlig opmærksomhed omkring test af kateteret er påkrævet ved top-up af en eksisterende epidural til akut kejsersnit (45). Dog skal risikoen ved den forsinkelse, som administration af en fuld testdosis medfører, opvejes mod risikoen for sekundær migration af kateteret. Et studie fra 209 fødesteder i England rapporterede således at kun 34% administrerede en fuld testdosis før top-up af fødeepidural til akut kejsersnit (47). For at balancere behovet for hurtigt anslag med risiko for intrathekal beliggenhed, foreslås aspiration på kateteret kombineret med fraktioneret administration af bolus som en mulig løsning (47).
TEST AF EPIDURALKATETERET UNDER SPECIELLE FORHOLD
Ved kombineret spinal-epidural teknik kan epiduralkateteret først testes efter at den initiale intrathekale dosis er aftaget.
Ved anvendelse af regimer med patient controlled analgesia (PCA) eller programmed intermittent epidural bolus (PIEB), administreres boli uden forudgående testdosis (44). Dette kan til dels løses ved programmerede boli som ikke overstiger den lokalanalgetiske dosis som anvendes intrathekalt ved kejsersnit.
BOLUS VED OPSTART AF EPIDURAL ANALGESI
LMP og PD
REKOMMANDATIONER
Som bolus til epidural analgesi anbefales én af følgende:
- Bupivacain 0,625-1,25 mg/ml, 10-15 ml tilsat fentanyl 1- 2 mikrogram/ml eller sufentanil 0.25- 0.5 mikrogram/ml
- Ropivacain 0,1 % tilsat fentanyl 1-2 mikrogram/ml eller sufentanil 0.25- 0.5 mikrogram/ml
BAGGRUND FOR REKOMMANDATIONER
VOLUMEN OG KONCENTRATION
En bolus med et større volumen af en fortyndet opløsning af lokalanalgetika giver en hurtigere og mere effektiv analgesi sammenlignet med et mindre volumen af en højere koncentration (49,50). Tilsætning af et opioid forstærker den analgetiske effekt og bevirker at dosis af lokalanalgetika kan reduceres (51). Det anbefales at anvende den lavest effektive koncentration af et lipofilt opioid for at minimere opioidbivirkninger. I et studium fra 1999 af 60 kvinder sammenlignede man effekten af tre forskellige doser og voluminae af Bupivacain til opstart af fødselsanalgesi. De tre grupper fik henholdsvis: bupivacain 0,5 % 4 ml, bupivacain 0,2 % 10 ml og bupivacain 0,1 % 20 ml. Kvinder der fik 10 eller 20 ml, havde bedre analgetisk effekt end dem der fik 4 ml, og de kvinder der fik 20 ml 0,1 % bupivacain havde desuden den hurtigst indsættende analgesi. Der var ingen forskel i maternelle bivirkninger (52). I en undersøgelse af ropivacain med anvendelse af samme volumen på 15 ml, men med tre forskellige koncentrationer på henholdsvis 0,2 %, 0,15 % og 0,1 % fandt man flere kvinder med tilfredsstillende analgesi efter 0,2 %, men ingen forskel i maternelle bivirkninger (53).
VEDLIGEHOLD AF EPIDURALANALGESI
KW og OR
REKOMMANDATIONER
VEDLIGEHOLD AF EPIDURALANALGESI
Som vedligehold af epidural analgesi anbefales én af følgende:
- Bupivacain 0,625 – 1 mg/ml ved tilsat opioid
- Ropivacain 0,8 – 1,5 mg/ml ved tilsat opioid
- Tilsætning af opioider f.eks. fentanyl 2 mikrog/ml eller sufentanil 0,2-0,5 mikrog/ml anbefales for at kunne reducere koncentrationen af lokalanalgetika
- Infusionshastigheden bør øges ved lav koncentration af lokalanalgetika
BAGGRUND FOR REKOMMANDATIONER
VEDLIGEHOLD AF EPIDURALANALGESI
Bupivacain og ropivacain virker med ækvianalgetisk effekt i fødeepiduraler (ved koncentration på 0,625mg/ml og infusionshastighed på 10 ml/t) uden betydning på forløsningsmetode, længde af fødsel, og neonatalt outcome (54).
Lokalanalgetika dosis kan reduceres ved at give lavere koncentration i større volumen (50 % volumen øgning leder til 25% dosis reduktion) (55).
LOKALANALGETIKA +/- OPIOID
Reduktion af dosis lokalanalgetika kan også ske ved substitution med opioid. Tilsætning af opioid (bupivacain 1mg/ml + fentanyl 2µg/ml) kan levere samme analgesi som en stærkere opløsning (bupivacain 2,5mg/ml) (56). Desuden ses reduceret motorisk blokade.
Flere ældre studier viser ensartet ligeværdig analgetisk effekt af ’lav-dosis’ lokalanalgetika med opioid overfor en højere dosis lokalanalgetika (uden opioid). Typisk ses øget motorisk blokade i gruppen, der fik lokalanalgetika uden opioid (57–59). En meta-analyse fra 2013 af ’low-dose’ versus ”high-dose” bupivacain eller ropivacain viste en reduktion af instrumentel vaginal fødsel, kortere anden fase af fødslen og reduktion i maternelle bivirkninger (motor blokade, ambulering og urinretention). I studier med ’low-dose’ + opioid var der en lille effekt på det nyfødte barn i form af dårligere apgar score ved 1 min ift. blandinger uden opioid (60). Den kliniske konsekvens af lavere APGAR 1, men ikke APGAR 5 eller 10, er uklar.
Samlet set anbefales lav koncentration af lokalanalgetika i epidural blandinger til smertelindring i fødslen. Litteraturen beskriver koncentrationer ned til 0,625 mg/ml for bupivacain + opioid (60). I Danmark ses koncentrationer af bupivacain med opioid fra 0,625mg/ml til 1,25 mg/ml, og ropivacain med opioid på 1 eller 2 mg/ml (61). Den analgetisk effekt øges ved tilsætning af opioid til blandingen. Ved manifeste bivirkninger (kløe, kognitiv eller respiratorisk påvirkning), som ikke forsvinder ved engangsadministration af lavdosis naloxon, kan en epidural blanding med ren lokalanalgetika benyttes. I blandinger uden opioid rekommanderes det at øge infusionshastigheden.
| Lokalanalgetika | Opioid | Infusionshastighed | |
| Bupivacain-sufenta | Bupivacain 0.625 mg/ml | Sufentanil 0.50 µg/ml | 8ml/t |
| Bupivacain-sufenta | Bupivacain 0,8mg/ml | Sufentanil 1µg/ml | 5ml/t |
| Ropivacain | Ropivacain 1,25mg/ml | Fentanyl 2µg/ml | 8ml/t |
BUPIVACAIN VERSUS ROPIVACAIN
Der har igennem de sidste årtier været en tendens til at bruge lavdosis lokalanalgetika i fødeepiduraler sv.t. koncentrationer < bupivacain 1,25 mg/ml eller < ropivacain 2,0 mg/ml. Begge lokalanalgetika er vist at være ækvianalgetiske, om end potens er forskellige. Flere har beskrevet nedsat potens af ropivacain med op til 40 % i forhold til bupivacain (62–64).
Et forslag til fødeepidural: Bupivacain 0,625 -1mg/ml eller ropivacain 0,8-1,5 mg/ml. sammen med opioid, fx sufentanil eller fentanyl, hvilket reducerer lokalanalgetika behov, giver mindre motorisk blokade, færre instrumentelle forløsninger, færre kejsersnit og god maternel tilfredshed (65).
Bupivacain og ropivacain i ækvianalgetiske doser er vist at have ligeværdig effekt på sensorisk udbredning, fødselsvarighed, fødselsmåde, maternelle bivirkninger og tilfredshed (65).
Ropivacain menes at have færre toksiske bivirkninger ved i.v. administration end bupivacain (62). Der er beskrevet dødsfald ved 90 mg i.v. administration, hvilket er langt over aktuelle anvendte doser (64).
I et review fra 2014 fandt man længere analgetisk effekt af ropivacain med sufentanil end bupivacain med sufentanil og en ikke signifikant tendens til mere motorisk blokade ved ropivacain. Derimod fandt man hurtigere analgetisk anslag af bupivacain med sufentanil (66).
KREDSLØBSSTABILISERING
LV og NW
REKOMMANDATIONER
HYPOTENSION
VÆSKE
- Det anbefales ikke at anvende preload for at forebygge hypotension efter anlæggelse af fødeepidural
- Ved vedvarende hypotension anbefales det at give en væskebolus på 500-1000 ml isotonisk krystalloid
- Der skal udvises forsigtighed med væskebolus til fødende med præeklampsi
MEDICIN
- Det anbefales at behandle hypotension med enten efedrin 5-10 mg iv eller phenylephrin 0,1-0,2 mg iv pn
- Der anbefales ikke profylaktisk efedrin i.m. til forebyggelse af hypotension
LEJRING
- Det anbefales at lejre den gravide i fuldt venstre sideleje ved vedvarende hypotension
BAGGRUND FOR REKOMMANDATIONER
HYPOTENSION
Der findes kun sparsom litteratur omkring hypotension efter fødeepidural, både hvad angår definition og behandling. Langt de fleste rekommandationer omkring behandling kommer fra studier omhandlende hypotensionsprofylakse til kejsersnit.
DEFINITION AF HYPOTENSION
Der er ikke enighed i litteraturen om, hvordan hypotension defineres (67). De fleste bruger 20% eller 30% fald fra udgangsblodtryk eller systolisk blodtryk under 100 mmHg (67,68). Kinsella et al. anbefaler at regulere blodtrykket indenfor 90% af udgangstrykket (69). Ud fra de forskellige definitioner rapporteres incidensen af hypotension hos fødende med en fødeepidural fra 0-50% (67,68,70). Et Cochrane review fandt en relativ risiko (RR) for hypotension ved fødeepidural på 11,34 i forhold til ingen epidural, men kun få studier med høj heterogenitet og høj risiko for bias var inkluderet (13).
VÆSKE
Flere studier beskriver effekten af preload til at forebygge hypotension efter anlæggelse af fødeepidural (71–73). Studierne er små, og der er ikke enslydende resultater. Generelt forebygger preload ikke hypotension, men der er en tendens til færre føtale epioder med påvirket CTG (f.eks. bradykardi eller decellerationer) efter preload (73), men omvendt reduceret veaktivitet efter preload med 1000 ml krystalloid væske (72). I ét studie anbefales derfor preload ved høj-risiko fødsler (73). Wong anbefaler i Chestnut’s Obstetric Anesthesia, at der udføres såkaldt co-load med 500 ml krystalloid væske, men denne anbefaling kommer fra studier omkring anæstesi til kejsersnit (67).
MEDICIN
Anbefalingen om at bruge efedrin eller phenylephrin til behandling af hypotension kommer fra studier om anæstesi til kejsersnit og ikke fra studier om fødeepiduraler. Et studie undersøgte profylaktisk efedrin intramuskulært (i.m.) inden anlæggelse af epidural til at forebygge hypotension (74). De fandt signifikant lavere incidens af hypotension i efedrin gruppen, tendens til takykardi hos fostret i efedrin gruppen og flere tilfælde med påvirket CTG (sene decelerationer) hos fostre i gruppen der ikke fik efedrin (74).
LEJRING
Preston et al. har lavet det ene studie, der undersøger betydningen af lejring af den fødende efter epidural anlæggelse og incidensen af hypotension, hvor fald i føtal hjertefrekvens bruges som surrogatmål for hypotension (75). Den fødende lejres enten i rygleje med tilt eller fuldt sideleje. De fandt signifikant flere tilfælde med påvirket CTG i gruppen af fødende i rygleje med tilt sammenlignet med fuldt sideleje, 15% versus 0% (75), dette kan dog også ses hos fødende uden epidural, så den kliniske relevans er ukendt. Beilin et al. undersøgte kvaliteten af den smertelindrende effekt af fødeepiduraler og om position af den fødende havde indflydelse på kvaliteten (76). De havde som sekundære mål hypotension, sene decelerationer hos fostret og brug af efedrin. Den fødende var enten lejret i rygleje med 30 graders tilt eller i fuldt sideleje. De fandt bedre smertelindrende effekt af epidural analgesien ved fuldt sideleje. De fandt ingen forskel i incidensen af hypotension eller sene decelerationer mellem de to positioner, men et højere forbrug af efedrin i 30 grades tilt gruppen, 10% versus 4% (76), hvilket er i modstrid med førstnævnte studie fra Preston et al. Dog havde Beilin et al smertelindrende kvalitet som primære outcome og ikke hypotension eller ændringer af CTG.
EPIDURALE ADMINISTRATIONSFORMER
JAH og RAB
REKOMMANDATIONER
Efter etablering af fødeepidural kan behandlingen vedligeholdes ved:
- Kontinuerlig epidural infusion (CEI)
- Programmeret intermitterende epidural bolus (PIEB)
- Medikamentelle boli administreret af sundhedspersonale
Hertil kan tillægges og/eller suppleres med
- Patientkontrolleret epidural administration (PCEA)
- Medikamentelle ”rescue-boli” administreret af sundhedspersonale
Anvendelse af PIEB med eller uden PCEA, bør anbefales frem for CEI, på de hospitaler hvor der forefindes pumper som er egnet til formålet.
BAGGRUND FOR REKOMMANDATIONER
CEI VS. PCEA
Et systematisk review fra 2009 konkluderede at PCEA+CEI (< 5 ml/t) giver bedre analgesi end PCEA uden CEI, samt nedsætter behovet for uplanlagte boli fra personalet (77).
En metaanalyse fra 2015 identificerede 7 randomiserede dobbeltblindede studier indeholdende 891 patienter, der sammenlignede PCEA med CEI+PCEA (78). Man fandt øget risiko for instrumentel forløsning og forlænget 2.stadie af fødselen i CEI+PCEA-gruppen, men mindre behov for supplerende boli via PCEA eller personale. Der var ingen forskel i maternelle (kvalme, kløe, hypotension) eller neonatale outcomes (APGAR, navlesnors-pH).
CEI VS. PIEB
Et cochrane review fra 2018 baseret på 12 studier med totalt 1121 patienter viste at PIEB, sammenlignet med CEI, medførte mindre gennembrudssmerte og lavere totalforbrug af lokalanalgetika uden forringelse af den analgetiske effekt og patienttilfredshed (79). 5/7 studier rapporterede en øget maternel tilfredshed med intermitterende epidurale boli vs. kontinuerlig infusion Der fandtes ingen eller meget lille forskel i risiko for kejsersnit, instrumentel forløsning, varighed af fødsel og APGAR-scores (79).
Et systematic review fra 2013 inkluderede 8 randomiserede kliniske studier med 344 patienter i CEI-gruppen og 350 patienter i PIEB-gruppen (80). Forfatterene konkluderede at PIEB, med eller uden PCEA, reducerede forbruget af lokalanalgetika og øgede den maternelle tilfredshed sammenlignet med CEI.
Nunes et al. fandt, at PIEB er associeret med en lavere risiko for kejersnit, sammenlignet med CEI (81). Studiet er dog behæftet med flere metodologiske mangler, og resultaterne bør derfor vurderes med forsigtighed.
Et review fra 2017 har undersøgt data på PIEB vs CEI, eventuelt med supplerende PCEA i begge grupper (82). PIEB+PCEA var associeret med mindre motorisk blokade og nedsat risiko for instrumentel forløsning. Resultaterne kan ikke umiddelbart generaliseres som følge af stor heterogenicitet i grupperne.
PCEA SOM SUPPLEMENT TIL CEI ELLER PIEB
Et systematisk review og metaanalyse fra 2019 undersøgte forskellen i PEIB og CEI som baggrundsdosering ved PCEA(83). 11 studier blev inkluderet hvoraf 717 patienter var allokeret til PEIB + PCEA og 650 patienter til CEI + PCEA. PIEB+PCEA reducerede signifikant risikoen for instrumentel forløsning, resulterede i bedre analgesi med mindre forbrug af lokalanalgetika, samt højere maternel tilfredshed og statistisk signifikant (dog ikke klinisk betydende) afkortning af fødselsforløbet. Der var ingen forskel i motorisk blokade eller øvrige bivirkninger. Forfatterne påpeger risiko for bias med hensyn til den store heterogenicitet i metode (kombineret spinal epidural teknik vs. epidural teknik), samt koncentration og volumen af lokalanalgetika og tilsætning af opioid.
PIEB, med eller uden PCEA, kan anvendes på de hospitaler hvor der forefindes pumper som er egnet til formålet. Der er ringe evidens for valg af dosis, volumen og intervaller ved sådan et regime. Der foreligger dog klinisk erfaring fra en dansk fødeafdeling med følgende fremgangsmåde:
Efter epiduralanlæggelse og testdosis, administreres første PIEB bolus og herefter f.eks 10 ml x 1/60 min.., med mulighed for PCEA f.eks 8 ml bolus med 20 min. lockout mellem administrerede boli. Der anvendes standard fødeepiduralblandinger med lavkoncentreret lokalanalgetika tilsat opioid.
COMPUTERINTEGREREDE OG INTERAKTIVE ADMINISTRATIONSFORMER
Et review fra 2017 har gennemgået fremtidige muligheder for optimering af epidural vedligeholdelsesbehandling (84). Eftersom fødselsmerten er dynamisk og typisk intensiveres som fødselen skrider frem, kan computerintegrerede PCEA-pumper med interaktive programmer (CIPCEA) muligvis anvendes til at optimere den epidural analgesi. Programmet registrerer løbende analgesibehovet, og opjustere basalinfusionsraten afhængig af antal patientadministrerede boli. CIPCEA-algoritmen er associeret med reduceret gennembrudssmerte uden øget totalforbrug af lokalanalgetika eller bivirkninger, når sammenlignet med traditionel CEI+PCEA. Forekomsten af personaleadministrerede boli var 15% i CIPCEA-gruppen vs. 35% i PCEA-gruppen. Maternel tilfredshed var større i CIPCEA-gruppen.
ADMINISTRATIONSFORMER RESUMÈ
Efter etablering af fødeepidural kan behandlingen vedligeholdes som CEI med eller uden intermitterende boli. Epidurale boli kan administreres som PCEA, PIEB eller boli administreret af sundhedspersonale. Sidstnævnte typisk som ”rescue-boli” ved smertegennembrud.
Vedligeholdelsesbehandling med intermitterende epidural boli medfører et højere injektionstryk sammenlignet med kontinuerlig infusion, dette er asocieret med større spredning/distribution af lokalanalgetika. Flere studier påpeger at vedligeholdelesbehandling med intermitterende epidurale boli medfører lavere forbrug af lokalanalgetika, bedre analgetisk effekt, mindre motorisk blokade og højere maternel tilfredshed end CEI.
CEI kan administreres via en simpel kondompumpe, mens anvendelsen af PIEB kombineret med PCEA og/eller CEI kræver mere avancerede pumper. Udover økonomiske hensyn, må man formode at avancerede pumper med flere indstillingsmuligheder indebærer en større risiko for fejl under anvendelsen, men også bedre mulighed for individualiseret smertebehandling.
BIVIRKNINGER OG KOMPLIKATIONER
PD og JW
REKOMMANDATIONER
Dette afsnit er en systematisk gennemgang af potentielle bivirkninger og komplikationer ved fødeepidural.
Nedenstående tabel er en oversigt over dette. Det afsluttende afsnit gennemgår litteraturen bag tabellens punkter.
Det anbefales at sundhedspersonale involveret i anlæggelse og brug af fødeepidural er bekendt med både de potentielle bivirkninger og komplikationer, hvor der er øget forekomst og dem, hvor der ikke er.
POTENTIELLE BIVIRKNINGER OG KOMPLIKATIONER VED FØDEEPIDURAL
Ved lav koncentration af lokalanalgetika (bupivacain ≤ 1mg/ml – ropivacain ≤ 1,7 mg/ml)
| Meget almindelige (> 10%) | Blodtryksfald
Feber Motorisk blokade Urinretention |
| Almindelige (1-10%) | Durapunktur (heraf risiko for postspinal hovedpine 62-88%)
Omlægning af epidural |
| Sjældne (0,1-1%) | – |
| Meget sjældne (0,1-0,01%) | Respirationsdepression
Systemisk toksisitet fra lokalanalgetika |
| Ekstrem sjælden (<0,01%) | Anafylaksi som reaktion på lokalanalgetika
Epidural absces Epiduralt hæmatom Høj neuroaksial blokade Meningitis Nerveskade |
| Ingen øget forekomst af bivirkninger og komplikationer ift
|
Anlæggelsestidspunktet for epidural
Amning Instrumentel forløsning Kejsersnit Kvalme og opkast Neonatale bivirkninger/komplikationer Oxytocininfusion, opstart Rygsmerter Varighed af fødslens 1. stadie Varighed af fødslens 2. stadie Varighed af fødslens 3. stadie |
| Ikke tilstrækkeligt undersøgt | Kløe
Shivering |
BAGGRUND FOR REKOMMANDATIONER
MATERNELLE BIVIRKNINGER
BLODTRYKSFALD
Neuroaksial blokade inducerer sympatikusblokade og vasodilatation. Hypotension opstået efter neuroaksial blokade skyldes hovedsageligt nedsat systemisk vaskulær modstand og forekomsten øges med intensiteten af blokaden (85). Et Cochrane studie fra 2018 med 10 RCT n=4212 sammenlignede smertelindring med fødepidural versus opioid (im/po/iv)/ingen opioid og fandt en gennemsnitlig RR på 11,34 (95% CI 1.89 to 67.95, I2 = 87%; P < 0.00001 (13). Den meget store heterogenicitet kan tilskrives studiernes forskellige metode med en tradition for højere doser lokalanalgetika i de ældre studier. Ligesom hypotension ikke var primær outcome for flere af studierne og definitionen af hypotension varierede. Alle 10 studier rapporterede dog en signifikant grad af hypotension efter anlagt epidural blokade. Ud fra ovenstående skønnes incidensen af hypotension som værende meget almindelig svt > 10%. Afsnittene: Kredsløbsstabilisering og monitorering i vejledningen dækker den kliniske håndtering.
FEBER
Omkring 20% af fødende kvinder med neuroaksial analgesi vil opleve en stigning i kropstemperatur til over 38°C (86). Ætiologien bag temperaturstigning i forbindelse med epidural analgesi er ikke til fulde forstået (87), muligvis er det et respons på non-infektiøs inflammation (86). Et Cochrane review fra 2011 fandt at fødende med epidural har en signifikant større risiko for feber (> 38°C) end fødende uden epidural (13). Et systematisk review fra 2010 fandt at incidensen for feber hos kvinder med epidural analgesi var 20-30% versus 5-7% hos kvinder i kontrolgrupperne (88). Samlet set vurderes forekomsten af feber ved anlagt fødeepidural som meget almindelig svt > 10%.
KLØE
Ætiologien bag opioidinduceret kløe er uklar, men skyldes ikke histaminfrigivelse (hvorfor behandling med antihistamin er uden effekt) (87). Risiko for kløe er markant højere ved intrathekal administration end ved epidural administreret opioid (87). Incidensen er dosisafhængig og mindskes ved samtidig indgift af lokalanalgetika (55,67). Kløen er typisk er selvlimiterende og svinder markant efter den første time (67).
Et Cochrane studie fra 2018 undersøgte smertelindring i fødslen med opioid intramuskulær (i.m.)/intravenøs (i.v.)/peroral (p.o.)/ingen opioid versus fødeepidural med opioid og kunne inkludere 8 randomised controlled trial (RCT) med i alt 2900 kvinder. Der var ingen forskel mellem grupperne ift kløe RR 1,19 (0,81-1,77). På baggrund af ovenstående vurderes der ikke at være øget foreskomst af kløe ved opiod i fødeepidural sammenlignet med opioid i.m./i.v./p.o. (13). Kløe ved fødeepidural versus kløe ved non-opioid smertebehandling i fødselsforløbet er ikke tilstrækkeligt belyst i litteraturen, men antages at være øget.
KVALME OG OPKASTNING
Kvalme og opkastning er almindeligt forekommende under fødsel. Det kan derfor være svært at opgøre den incidens, der direkte kan relateres til epiduralen (fx pga. epiduralt administreret opioid eller hypotension induceret ved epiduralanalgesi) (67,87). Et Cochrane review fra 2018 (13) fandt en signifikant lavere risiko for kvalme og opkast hos fødende kvinder med epidural sammenlignet med de kvinder, der fik i.v. opioid som smertebehandling. To studier har sammenlignet fødeepidural med ingen intervention/placebo og fandt ingen forskel i grupperne, omend resultaterne var ikke signifikante (13). Det vurderes på baggrund af ovenstående, at der ikke er øget forekomst at kvalme og opkastning ved epidural.
URINRETENTION
Urinretention er en mulig bivirkning til både neuroaksial lokalanalgesi og opioid. Begge dele sænker evnen til at mærke en fuld blære og at have vandladning (87). Urinretentionen synes at sætte ind samtidig med, at analgesien slår an ved epidural (67). Et Cochrane review fra 2018 fandt signifikant flere kvinder med urinretention i epidural gruppen vs. i.m./i.v. opioidgruppen (13). Graden af urinretention har sammenhæng med lokalanalgetika koncentrationen (87). Wilson et al. sammenlignede kvinder, der fik epidural infusion, med henholdsvis 1 mg/ml bupivacain (med fentanyl) og 2,5 mg/ml bupivacain og fandt at 32% af kvinderne med den lave koncentration havde spontan vandladning versus 11% af kvinderne med den stærkere koncentration (89).
Post partum urinretention (PUR) er en velkendt tilstand efter fødsel. PUR forekommer hos 1,5%-45% af fødende kvinder og risikoen øges ved epidural (90). På baggrund af ovenstående gennemgang vurderes det, at forekomsten af urinretention er en meget almindelig bivirkning, som forekommer hos over 10% efter epiduralanlæggelse.
PÅVIRKNING AF FØDSELSFORLØBET
Litteraturen bærer præg af et skift i gældende praksis. Aktuelt bruges lav koncentration af lokalanalgetika som epidural analgesi på de danske fødegange. Tidligere blev højere koncentrationer brugt. Når studier med høj vs. lav koncentration af lokalanalgetika sammenlignes, ses der tydelig forskel i påvirkning af fødselsforløbet (13). Lav koncentration af lokalanalgetika defineres i studierne som ≤ 1mg/ml bupivacain eller en ækvipotent koncentration af ropivacain (≤ 1,7 mg/ml) eller levobupivacain (≤ 1mg/ml).
ANLÆGGELSESTIDSPUNKT AF EPIDURAL
Ved epidural analgesi med lav koncentration af lokalanalgetika er det vist, at opstartstidspunktet ikke har betydning for fødselsforløbet, hvad enten opstart er tidlig eller sent (91,92).
INSTRUMENTEL FORLØSNING
En Cochrane metaanalyse af Wang et al. 2017 med 10 RCTs (n=1809) sammenligner epiduralanalgesi med lav koncentration af lokalanalgetika med opioider og finder ingen forskel i risiko for instrumentel forløsning (92). Et Cochrane studie fra 2018 bestående af 40 RCTs med både høj- og lavkoncentration af bupivacain finder en øget risiko for instrumentel forløsning i epiduralgruppen sammenlignet med opioidanalgesi (p.o./i.m./i.v.), men en post hoc analyse af 10 studier efter 2005 med lavdosis lokalanalgetika viste ingen forskel i instrumentel forløsning sammenlignede med opioidanalgesi (13). På baggrund af ovenstående vurderes risiko for instrumentel forløsning ikke at være forhøjet.
KEJSERSNIT
Det er velundersøgt at fødeepiduralanalgesi sammenlignet med opioidanalgesi givet i.m./i.v./p.o. i fødselsforløbet ikke øger risiko for kejsersnit. Dette fremgår bl.a. af en Cochrane metaanalyse fra 2018 med 33 RCTs, n=10.350 (92).
MOTORISK BLOKADE
Høj koncentration af lokalanalgetika forårsager motorisk blokade. Motorisk blokade er forbundet med nedsat evne til at presse ved veer og til at gå. Motorisk blokade har i flere studier vist sig at påvirke fødslens 2. stadie (91,92) samt øge risiko for instrumentel forløsning(93). Derfor er gængs praksis at bruge lav koncentration af lokalanalgetika i fødeepiduraler og tilsætte opioid for at kunne reducere begge stoffer mest muligt (92).
En fra 2013 metaanalyse af fødeepidural med høj- versus lav koncentration af lokalanalgetika fandt signifikant lavere forekomst af motorisk blokade i lavdosis gruppen (91). Et systematisk review fra 2018 med 30 blandede studier af høj og lav koncentration lokalanalgetika (n=2851) finder incidensen af motorisk blokade til 14,7% (94). På baggrund af eksisterende litteratur vurderes forekomsten af motorisk blokade til > 10%.
OXYTOCIN INFUSION
Der er ikke øget risiko for opstart af oxytocin infusion på grund af en anlagt fødeepidural (13).
VARIGHED AF FØDSLENS 1. STADIE
Litteraturen på området er divergerende og rapporterer både kortere (13,95) og længere varighed af fødslens 1. stadie når kvinden har en fødeepidural(13). Uanset, har det minimal klinisk betydning (96). De fleste metaanalyser rapporterer på baggrund af ældre RCTs med høj koncentration af bupivacain og finder forlænget 1. stadie med 32,28 min. (21), mens et studie af epidural analgesi med lav koncentration af bupivacain (<1mg/ml) fandt en ikke signifikant forlænget varighed på 17.34 min. (92). Samlet set vurderes varigheden af fødslens 1. stadie ikke at forlænges signifikant.
VARIGHED AF FØDSLENS 2. STADIE
Det har tidligere været en bivirkning til epiduralanalgesi at fødslens 2. stadie forlænges ved brug af fødeepidural, men denne påvirkning af fødselsforløbet er ændret sammen med skiftet i brugen fra høj til lav koncentration af lokalanalgetika i fødeepiduralen.
I en metaanalyse fra 2016 med 8 RCTs (n=1445) så Wang et al. på studier med lav koncentration af bupivacain (<1mg/ml) svarende til vanlig brug på de danske fødegange og fandt en ikke signifikant forlænget varighed af fødslens 2. stadie på 5,7 min. (92). På baggrund af dette vurderes det at påvirkningen af fødslens 2. stadie ikke er af klinisk betydning.
VARIGHED AF FØDSLENS 3. STADIE
Rosaeg et al. fandt i 2002 i et retrospektivt studie af 7468 fødende ikke forlænget tid fra fødslen af barnet til placenta fødes. Derimod fandtes tiden til eventuel intervention kortere hos fødende med fødeepidural i tilfælde af behov for manuel placenta fjernelse (97).
SHIVERING
Shivering opstår hos over 15% af fødende (98) og skyldes flere faktorer, der påvirker det termoregulatoriske respons (99). Shivering opstår muligvis hyppigere under epiduralanalgesi (13,88,100), men området er ikke velbeskrevet. Et Cochrane review fra 2014 konkluderer på baggrund af ét studie, at der ikke er signifikant forskel mellem grupperne med og uden fødeepidural (101). Forekomsten af shivering ved fødeepidural er ikke tilstrækkeligt belyst i litteraturen, hvorfor der for nuværende ikke kan konkluderes på området.
MATERNELLE KOMPLIKATIONER
ANAFYLAKSI
Allergisk type 1 reaktion/IgE medieret straks reaktion for lokalanalgetika er ekstrem sjælden (102). Henover en 20-årig periode i en stor tysk allergiklinik blev 402 patienter henvist til udredning for dette. Heraf havde 2 patienter en IgE medieret allergi for lokalanalgetika, mens 27 havde en reaktion med urticaria (103). Det danske allergicenter har hen over 10 år ikke fundet nogle tilfælde med hypersensitivitet for lokalanalgetika (102). På baggrund af ovenstående vurderes risiko for anafylaksi som værende ekstrem sjælden (< 0,01%).
DURAPUNKTUR
En metaanalyse fra 2013 med 41 RCT n=12479 viser en forekomst af ADP ved anlæggelse af fødeepidural hos 1,21% (104). En metaanalyse fra 2003 med 16 RCT fandt incidensen af ADP til 2,9%, postspinal hovedpine forekom hos 62% (105). I en større engelsk audit fra 2008 med n=18337 fik 0,91 ADP og 88% PDPH (106). Forekomsten af PDPH rapporteres også høj i et større retrospektivt studie af 35000 fødende hvor forekomsten af hovedpine var 86%. Mens ADP beskrives til 1,3% (107). Samlet set vurderes incidensen af ADP til 0,9-2,9% og risiko for postspinal hovedpine mellem 62%-88%. Behandling og risikofaktorer beskrives i afsnittet om ADP og PDPH.
EPIDURAL ABSCES
I et natio
I et nationalt audit projekt i Storbritannien i 2008, fandtes ét tilfælde af epidural absces ud af 161.550 epidurale procedurer (108). Lignende tal findes fra D’Angelo i 2014, der i et amerikansk prospektivt multicenter survey (2004-2009) fandt 4 epidurale abscesser (og meningitis) ud af 216.094 epidural- og epispinal procedurer (109). På baggrund af ovenstående vurderes forekomsten ekstrem sjælden (< 0,01%).
EPIDURALT HÆMATOM
Risiko for epiduralt hæmatom er ekstremt sjældent (<0,91%). Et studie rapporterer om ét tilfælde ud af 168000 anlagte fødeepiduraler (110). Hæmatom i det subdurale eller epidurale rum er en potentielt alvorlig komplikation til fødeepidural, der kan medføre kompressions- eller iskæmiske skader på rygmarven (111). Den største risikofaktor for epiduralt hæmatom hos den fødende er koagulopati. Øvrige risikofaktorer er atypisk anatomi af spinalkanalen og multiple forsøg på epiduralanlæggelse (111) Ved epiduralt hæmatom er tidlig intervention vigtig. De typiske tegn er længerevarende nedsat kraft og sensibilitet i underekstremiteterne efter ophør af infusion i fødeepidural kateteret, men også svære rygsmerter ses i disse tilfælde bør speciallæge i anæstesi kontaktes. For yderligere udredning anbefales MR scanning og neurokirurgisk tilsyn (99).
HØJ NEUROAKSIAL BLOKADE
Høj neuraksial blokade opstår i 1:1400-16.200 (112–114) og kan skyldes et for højt volumen lokalanalgetika givet i epiduralkatetret, typisk ved opsprøjtning til sectio (112) eller uintenderet injektion af lokalanalgetika spinalt, subduralt eller subaraknoidalt gennem et epiduralkateter, der enten er migreret fra epiduralrummet eller hvor placeringen uden for epiduralrummet ikke er erkendt (115). Et engelsk retrospektivt studie af 145.550 fødeepiduraler fandt en incidens af høj neuroaksial blokade på 1:16.200 (0,006%) (113). Et prospektivt studie af 10.995 fødeepiduraler viste en lavere incidens på 1:1400 (114). Høj spinal eller høj epidural anæstesi var en del af årsagen hos 16% af de maternelle dødsfald i USA 1997-2002 svarende til 0,19:1000.000 (116). På baggrund af ovenstående vurderes forekomsten ekstrem sjælden (<0,01%).
MENINGITIS
Et review fra 2008 med 161.550 epidurale procedurer fandt en incidens hos obstetriske patienter på 1:39.000 (0,00256%) (117). Lignende tal findes fra D’angelo i 2014, der i et amerikansk prospektivt multicenter survey (2004-2009) fandt 4 tilfælde af meningitis ud af 251.463 obstetriske procedurer (spinal/CSE/epidural), alle de 4 tilfælde af havde fået et epiduralkateter og epidural absces forud for meningitis (109). Meningitis opstår ekstremt sjældent (<0,01%).
RESPIRATIONSDEPRESSION
Administration af opioid, uafhængig af administrationsvej, kan medføre risiko for respirationsdepression. Hvis der tidligere i fødselsforløbet er givet i.v. opioid vil risikoen for respirationsdepression øges (67). Ved brug af vanlige doser neuroaksialt administreret opioid er klinisk relevant respirations depression sjælden (87). Et Cochrane review fra 2018 fandt at færre fødende kvinder med epidural oplevede respirationsdepression versus fødende der fik opioid i.v./i.m. (13). Det er praksis at bruge lavdosis opioid i fødeepiduralinfusionen og på baggrund af ovenstående vurderes forekomsten af klinisk relevant respirationspåvirkning som meget sjælden (0,1%-0,01%).
RYGSMERTER
I et Cochrane review fra 2018 var der ingen klar forskel på grupperne (fødeepidural versus i.v. opioid) ved langvarige rygsmerter (13). Flere prospektive studier rapporterer at der ikke er sammenhæng mellem rygsmerter og neuroaksial anæstesi (87).
SKADER PÅ RYGMARV ELLER NERVERØDDER
Skader på rygmarv eller nerverødder kan ske ved direkte traume, hæmatom, iskæmi, neurotoksisitet eller infektion. Derudover kan ses skade ved accidentiel indgift af medicin i rygmarv eller nerverødder. Nerverne i epiduralrummet er omgivet af 3 meninges lag og i tilfælde af skade ses ofte heling på dage til måneder i modsætning til de mere sårbare nerverødder i subarachnoidalrummet (87).
Postpartum neurologiske symptomer har en prævalens på ca. 1% og er typisk en komplikation til veerne og selve fødslen og skyldes det tryk og stræk der påføres det lumbosakrale plexus af fostret eller evt. instrumentering (111). Nulliparitet og forlænget 2. stadie af fødslen er blevet positivt korreleret til parese. Neuroaksial anæstesi kan måske indirekte påvirke denne risiko pga den medførende immobilitet og maskerede nociception.(118).
Den engelske nationale audit, NAP3, viste at risikoen for direkte nerveskade efter neuroaksial blokade var 2-4,2:100.000 (119). Resultatet beror på tal fra både spinal/epidural/CSE hos både obstetriske og ikke-obstetriske patienter. Incidensen i den obstetriske gruppe var ekstremt lav, og desuden fandt man, at 2/3 af alle alvorlige skader remitterede fuldstændigt (108). På baggrund af ovenstående konkluderes det at risiko for nerveskade ved fødeepidural analgesi er ekstrem sjælden (<0,01%). Emnet uddybes i afsnittet om neurologiske klager efter fødslen.
SYSTEMISK TOKSICITET FRA LOKALANALGETIKA
Systemisk toksisitet fra lokalanalgetika sker oftest efter utilsigtet injektion af lokalanalgetika i en epidural vene. Obstetriske patienter til termin har øget risiko for toxicitet pga. øget kardiel- og neuronal følsomhed for lokalanalgetika (112). Derudover kan det øgede kardielle output og dilaterede epiduralvener hos gravide formentlig øge absorptionen af lokalanalgetika ved epidural analgesi. Et prospektiv audit fra UK 1987-2003 med 145.000 obstetriske procedurer fandt incidensen af intravasculær injektion til 1:5000 (113). Den lave koncentration af lokalanalgetika, der bruges til fødeepidural indebærer en lav risiko for systemisk toksisitet. Derimod øges risikoen, når en epidural sprøjtes op til sectio med højdosis højkoncentreret lokalanalgetika (112). Samlet set vurderes forekomesten af systemisk toksisitet fra lokalanalgetika som meget sjælden (0,1-0,01%).
UTILSTRÆKKELIG EFFEKT AF FØDEEPIDURAL
Utilstrækkelig effekt af fødeepidural viser sig enten ved manglende smertelindring, unilateral effekt eller plettet udbredelse. I et retrospektivt studie fra 2004 (n=14.444) fik 6,8% omlagt deres kateter (120). Mens et prospektivt studie (n=10.995), viste en omlægnings frekvens på 5%(114). Et prospektivt studie (n=800) fra et privathospital med speciallæger, fandt en frekvens på 2% (121). I flere studier findes lavere tal når fødeepiduralen anlægges som kombineret epi-spinal (121,122). Samlet set varierer den rapporterede incidens mellem studier fra 2-6,8% (120,121) og utilstrækkelig effekt af fødeepidural må vurderes som en almindelig komplikation (1-10%). Punktet uddybes i guidelinens afsnit om insufficient epidural.
NEONATALE BIVIRKNINGER
Epidural analgesi med lokalanalgetika og opioider kan påvirke barnet både direkte systemisk og indirekte ved analgesiens påvirkning af mater (67). Ved normalt blodtryk hos mater vil epidural anæstesi ikke påvirke den nyfødte negativt (87).
I et Cochrane review fra 2018 fandt man ikke forskel i grupperne med APGAR score < 7 efter 5 min, mellem epiduralgruppen versus gruppen med placebo/ingen behandling versus opioidgruppen. Når man sammenlignede epiduralgruppen med opioidgruppen var risikoen for navlesnors pH < 7,2 og behov for naloxon administration lavere i epiduralgruppern (20).
Bradykardi hos fostret opstår oftest indenfor de første 15 minutter efter epiduralanlæggelse og kan skyldes uterus’ hyperaktivitet/tonus eller hypotension hos mater, men fører ikke til øget forekomst af føtal acidose, lav APGAR score eller behov for sectio (87).
Respirationsdepression hos nyfødte sker sjældent ved kontinuerlig epidural opioidinfusion (67). Færre nyfødte fik brug for naloxone postnatalt når man sammenlignede fødende der fik opioid i.m./i.v./p.o. som smertelindring med fødeepidural. Der var ingen forskel i antallet af indlæggelser på neonatalafdelingen (20).
Multiple faktorer påvirker sandsynligheden for om amning etableres. Litteratur på området er sparsom. Opioid i fødeepiduralen bidrager med langt mindre systemisk koncentration af opioid end opioid givet p.o., i.v. eller i.m. Man kan derfor forestille sig, at opioid i fødeepiduralen frem for systemisk opioid vil interferere mindre med den neonatales ammeadfærd. Et enkelt randomiseret studie undersøgte om mængden af fentanyl i fødeepiduralen påvirkede initieringen af amning og fandt ingen forskel (123).
Samlet set vurderes der ikke at være øget forekomst af neonatale bivirkninger når fødeepidural anvendes.
TOP-UP AF FØDEEPIDURAL TIL KEJSERSNIT OG POSTPARTUM INDGREB
CFF og MLA
REKOMMANDATIONER
TOP-UP AF FØDEEPIDURAL TIL KEJSERSNIT
● Det anbefales at følge eksisterende DASAIM-vejledning ”Anæstesi til kejsersnit” på www.dasaim.dk
TOP-UP AF FØDEEPIDURAL TIL POSTPARTUM INDGREB
POSTPARTUM INDGREB
Postpartum indgreb inkluderer f.eks.:
- Intrauterin palpation inkl. fjernelse af fastsiddende placenta, placentadele eller andre vævsrester
- Kirurgisk behandling af læsioner i fødselskanalen inkl. suturering af sphincterruptur og bristninger i perineum
- Laparotomi
TOP-UP AF FØDEEPIDURAL
- Det anbefales at anvende top-up af velfungerende fødeepidural til anæstesi til postpartum indgreb, såfremt patienten er hæmodynamisk stabil
- Hæmodynamisk ustabile patienter bør væskeresusciteres inden eller sideløbende med top-up af fødeepidural
- Ved top-up af fødeepidural bør anæstesien dække til T4 for at kunne forventes at være sufficient til intrauterint indgreb og laparotomi foretaget sv.t. kejsersnit cikatrice
- Ved top-up af fødeepidural bør anæstesien dække til T10 for at kunne forventes at være sufficient til kirurgisk behandling af læsioner i fødselskanalen som f.eks. cervicale og vaginale læsioner
- Ved suturering af sphincterrupturer og bristninger i perineum kræves sufficient sakral blokade
- I litteraturen beskrives fænomenet sakral sparring i relation til epidural. Derfor kan spinal være at foretrække til denne type indgreb
- Det anbefales at anvende samme top-up medicin som ved top-up af fødeepidural til kejsersnit, dvs. blandingen 15-20 ml lidokain 20 mg/ml med adrenalin tilsat opioid (fentanyl 100 mikrog eller sufentanil 10 mikrog) og ved ønske om kortere anslagstid tilsættes natriumbikarbonat 84 mg/ml (1 ml pr. 10 ml lidokain 20 mg/ml med adrenalin)
- Dosis af top-up medicin for at opnå sufficient anæstesi vil afhænge af type af indgreb og er derfor typisk 10-20 ml af ovenstående blanding
- Top-up medicin bør gives i refrakte doser afhængig af patientens hæmodynamiske tilstand og anæstesiniveauet vurderes løbende
BAGGRUND FOR REKOMMANDATIONER
TOP-UP AF FØDEEPIDURAL TIL KEJSERSNIT
Der henvises til DASAIM-vejledning ”Anæstesi til kejsersnit” på www.dasaim.dk (124)
TOP-UP AF FØDEEPIDURAL TIL POSTPARTUM INDGREB
Der er generelt ikke meget evidens om top-up af fødeepidural til post partum indgreb. Anbefalinger bygger derfor primært på rekommandationer fra internationale anæstesiologiske selskaber og UpToDate (18,125). Anbefalinger om neuroaksial anæstesi fremfor generel anæstesi bygger på de samme overvejelser, som gør sig gældende for anæstesi til kejsersnit (124), specielt risikoen for vanskelig luftvej. Som udgangspunkt betragtes man som værende i risiko op til 24 timer postpartum (126).
ASA anbefaler anvendelse af fødeepidural til anæstesi til postpartum fjernelse af fastsiddende placenta, hvis fødeepiduralen er velfungerende, og patienten er hæmodynamisk stabil (18). Velfungerende top-up epidural har vist at mindske risikoen for postpartum blødning sammenlignet med patienter uden epidural, formentlig fordi tiden til kirurgi nedsættes (127).
Ved neuroaksial anæstesi med f.eks. top-up af fødeepidural ses sympatikushæmning, som kan lede til markant hypotension, især hvis patienten er hypovolæm og blokket etableres hurtigt. På den anden side kan generel anæstesi hos hæmodynamisk ustabile patienter også føre til markant hypotension, hvorfor nedblødte patienter altid bør væskeresusciteres inden eller sideløbende med etablering af anæstesien, hvad enten der vælges neuroaksial eller generel anæstesi (125).
Tidligere audits angav neuroaksial anæstesi til T10 som værende sufficient til intrauterine indgreb postpartum (128). Dette har dog vist sig at være forbundet med betydeligt ubehag for patienterne, hvorfor nyere anbefalinger er neuroaksial anæstesi til minimum T6 og gerne T4 ved behov for intrauterine indgreb og laparotomier sv.t. kejsersnit cikatrice (125,128). Ved læsioner i fødselskanalen bør neuroaksial anæstesi til T10 være sufficient til kirurgisk behandling af cervicale og vaginale læsioner (125). Sphincterrupturer og bristninger i perineum kræver sufficient sakral anæstesi. I litteraturen beskrives fænomenet sakral sparring i relation til epidural anæstesi. Evidensen er sparsom, men det er en overvejelse om spinal anæstesi er at foretrække til denne type indgreb (129).
Ved top-up af fødeepidural til postpartum indgreb anbefales samme blanding af lokalanalgetika, opioid og evt. natriumbikarbonat som ved top-up af fødeepidural til kejsersnit (125). Dvs. det anbefales at anvende refrakte doser af følgende blanding: 15-20 ml lidokain 20 mg/ml med adrenalin, opioid (fentanyl 100 mikrog eller sufentanil 10 mikrog) og natriumbikarbonat 84 mg/ml (1 ml pr. 10 ml lidokain 20 mg/ml med adrenalin). Opioid anvendes for at opnå̊ bedre intraoperativ analgesi og lavere dosis lokalanalgetika. Natriumbikarbonat anvendes, når kortere anslagstid ønskes (124). Hvilken volumen, som er påkrævet til sufficient anæstesi, afhænger af flere faktorer bl.a.: Hvornår der sidste er giver bolus i fødeepiduralen, om infusionen i fødeepiduralen har været afbrudt og hvilken type kirurgi, der skal udføres og dermed, hvilket niveau anæstesien skal dække. Derfor anbefales refrakte doser indtil sufficient anæstesi opnås (130).
INSUFFICIENT FØDEEPIDURAL
KL og MLA
REKOMMANDATIONER
INSUFFICIENT ANALGESI VIA FØDEEPIDURAL
GENERELT
- Sufficient analgesi via fødeepidural dækker svarende til T10-S4
- Det anbefales, at anæstesilægen orienteres ved insufficient analgesi via fødeepidural
- Det anbefales at vurdere smerternes lokalisation og intensitet samt progressionen af fødslen og andre årsager til smerter
- Det anbefales at teste dermatomudbredelsen af analgesien med kulde
- Det anbefales at undersøge om epiduralkateret er in situ, og om alle connections er intakte
- Det anbefales at reevaluere analgesien 20-30 min. efter der udført forbedrende tiltag
- Det anbefales at omlægge epidural, hvis epiduralkateret ikke er eller kan bringes til at være velfungerende
INSUFFICIENT UDBREDELSE AF ANALGESI
- Det anbefales at give en bolus af en blanding af lokalanalgetika med opioid, f.eks. 5-10 ml bupivacain 0,625 – 1,25 mg/ml eller ropivacain 1 mg/ml tilsat fentanyl 2 mikrog/ml eller sufentanil 0,5 mikrog/ml
- Hvis sufficient analgesi opnås ved bolus, kan der efterfølgende blive behov for at skifte vedligeholdelsesinfusion til lokalanalgetika med lavere koncentration og større volumen over tid
- Det anbefales at omlægge epidural, hvis der ikke opnås sufficient analgesi af bolus
- Det kan overvejes, om jordemoderen kan supplere med pudendus blokade, hvis der er sakrale/vaginale smerter
ASYMMETRISK UDBREDELSE AF ANALGESI
- Det anbefales at give en bolus, f.eks. 5-10 ml bupivacain 0,625 – 1,25 mg/ml eller ropivacain 1 mg/ml tilsat fentanyl 2 mikrog/ml eller sufentanil 0,5 mikrog/ml
- Den fødende kan forsøgsvis lejres på den side, hvor der er smerter, inden bolus injiceres, og forblive i denne position 10-20 min.
- Såfremt der er placeret tilstrækkeligt af epiduralkateteret i epiduralrummet (> 5cm), kan kateteret forsøgsvis trækkes 1-2 cm tilbage, inden bolus gives
- Hvis sufficient analgesi opnås ved bolus, kan der efterfølgende blive behov for at skifte vedligeholdelses-infusion til lokalanalgetika med lavere koncentration og større volumen over tid
- Det anbefales at omlægge epidural, hvis der ikke opnås sufficient analgesi af bolus og øvrige tiltag
GENNEMBRUDSSMERTER
- Det anbefales at give en bolus, f.eks. 10 ml bupivacain 1,25 mg/ml eller 5 ml bupivacain 2,5 mg/ml tilsat opioid, f.eks. fentanyl 50 mikrog eller sufentanil 10 mikrog
- Såfremt der er placeret rigeligt af epiduralkateteret i epiduralrummet (> 5cm), kan kateteret forsøgsvis trækkes 1-2 cm tilbage, inden bolus gives
- Jordemoder eller obstetriker kan supplere med yderligere smertelindrende, jf. DSOG-vejledningen ”Medicinsk smertelindring under fødslen” på dsog.dk
INSUFFICIENT ANÆSTESI VIA TOP-UP FØDEEPIDURAL
- Det anbefales at følge eksisterende DASAIM-vejledning ”Anæstesi til kejsersnit” på dasaim.dk (124).
BAGGRUND FOR REKOMMANDATIONER
INSUFFICIENT ANALGESI VIA FØDEEPIDURAL
GENERELT
Der er generelt ikke meget evidens vedrørende håndtering af insufficient fødeepidural. Anbefalinger bygger derfor primært på rekommandationer fra internationale anæstesiologiske selskaber, UpToDate og lærebøger (65,67,131–133).
Opgørelser i litteraturen over frekvensen af insufficiente fødeepidural varierer mellem 5-13% afhængig af definitionen af insufficient analgesi (67,134). Insufficient analgesi efter anlæggelse af fødeepidural er bl.a. ingen blokade, unilateral blokade, manglede segmentspredning og utilfredsstillende intensitet af blokaden (67).
Ved henvendelse om insufficient fødeepidural bør flere tiltag udføres tværfagligt: Vurdering af fødslens progression og evt. andre årsager til smerter (fyldt blære, uterus ruptur o.l.). Anæstesilægen bør sikre at epiduralkateteret stadig er in situ og bør vurdere analgesiens udbredelse. Vurdering af den sensoriske udbredelse skal gøres med kulde eller skarp genstand, start gerne lateralt på låret og undersøg bilateralt i både caudal og craniel retning, idet en fødeepidural ideelt set skal dække dermatomerne T10-S4 Hvis epiduralkateteret ikke er in situ, eller der er totalt fravær af sensorisk blokade, bør fødeepiduralen tilbydes genanlagt (65,67).
Der er ikke helt overensstemmelse i litteraturen omkring den fødendes stilling og analgesiens udbredelse, men formentlig har placeringen af epiduralkateteret i relation til øvrige epidurale strukturer (f.eks. bindevæv, fedtvæv og blodkar) større betydning for spredningen af lokalanalgetika end den fødendes stilling. Anatomiske barriere (f.eks. længdegående bindevævsstrøg mellem dura og ligamentum flavum) eller placering af kateterspidsen i det anteriore epiduralrum eller paravertebrale rum kan i nogle tilfælde forklare unilateral eller asymmetrisk blokade (67).
Ved insufficient eller asymmetrisk udbredelse af analgesien, anbefaler nogle anæstesiologer at trække epiduralkateteret 1-2 cm, inden der gives bolus af lokalanalgetika. Der er umiddelbart ikke fundet evidens herfor (67).
INSUFFICIENT UDBREDELSE AF ANALGESI
Ved utilfredsstillende sensorisk blokade enten caudalt eller cranielt kan det gavne at injicere en større volumen af lokalanalgetika med lav koncentration som bolus (f.eks. 5-15 ml bupivacain 0,625 mg/ml, bupivacain 1,25 mg/ml eller ropivacain 1 mg/ml) tilsat opioid (fentanyl 2 mikrog/ml eller sufentanil 0,5 mikrog/ml). Skift af vedligeholdelsesinfusion til lokalanalgetika med lavere koncentration, så større volumen kan gives, kan have effekt efterfølgende (65,67,135).
I sjældne tilfælde ses sufficient sensorisk blokade ved undersøgelse, men den fødende klager stadig over smerter. I sådanne tilfælde kan en bolus af mere koncentreret lokalanalgetika (f.eks. 5-10 ml bupivacain 2,5 mg/ml) eller lipidopløselig opioid (f.eks. fentanyl 50 mikrog eller sufentanil 10 mikrog) i epiduralen give smertelindring (67).
Sakral sparing mistænkes, hvis den fødende beskriver smerter sv.t. vagina, perineum og rectum (65,67). Vurdering af analgesiens udbredelse kan udføres med kulde sv.t. lateralt på fødderne (S1). Her kan det gavne at injicere bolus af mere koncentreret lokalanalgetika (f.eks. 5-10 ml bupivacain 1,25 mg/ml eller 3-5 ml bupivacain 2,5 mg/ml) med eller uden opioid (f.eks. fentanyl 50 mikrog eller sufentanil 10 mikrog) med patienten i siddende stilling (65).
Alternativer til at give analgesi sakralt er pudendus blokade, fødespinal og CSE (136).
ASYMMETRISK UDBREDELSE AF ANALGESI
Asymmetrisk udbredelse af analgesien kan være enten unilateral blokade eller manglende spredning til enkelte dermatomer. Her kan det gavne at injicere en større volumen af lokalanalgetika med lav koncentration som bolus (f.eks. 5-15 ml bupivacain 0,625 mg/ml, bupivacain 1,25 mg/ml eller ropivacain 1 mg/ml) tilsat opioid (fentanyl 2 mikrog/ml eller sufentanil 0,5 mikrog/ml) (65,67,135). Den fødende kan forsøgsvis lejres, så den side, hvor blokade er insufficient placeres nederst (65,67). Skift af vedligeholdelsesinfusion til lokalanalgetika med lavere koncentration, så større volumen kan gives, kan have effekt efterfølgende (67).
GENNEMBRUDSSMERTER
Hvis den fødende oplevet gennembrudssmerter trods en velplaceret fødeepidural med sufficient udbredelse af blokaden, kan der være behov for mere intens blokade. Dette kan opnås med en bolus af lokalanalgetika med højere koncentration tilsat opioid. Det er anbefalet at give 6-10 ml bupivacain 1,25 mg/ml eller 3-5 ml bupivacain 2,5 mg/ml nogen steder (65) og 10-15 ml bupivacain 1,25 mg/ml eller 5-10 ml bupivacain 2,5 mg/ml andre steder (129). Epidural administration af clonidin 75 mikrog anvendes også nogle steder (67).
Epiduralkateteret kan evt. trækkes tilbage, men det anbefales, at der minimum er 3 cm i epiduralrummet hos normalvægtige og 4 cm hos adipøse (67).
INSUFFICIENT ANÆSTESI VIA TOP-UP FØDEEPIDURAL
Insufficient neuroaksial anæstesi til kejsersnit er adresseret i DASAIM-vejledningen ”Anæstesi til kejsersnit” på www.dasaim.dk (124).
ALTERNATIVER TIL FØDEEPIDURAL
LV og NW
REKOMMANDATIONER
ALTERNATIVER TIL EPIDURAL
Som udgangspunkt anbefales anlæggelse af almindelig fødeepidural. Der kan dog være omstændigheder hvor der ønskes fødespinal eller epidural-spinal. Disse fødende skal udvælges nøje, da evidensen for disse alternativer ikke er overvældende. I samarbejde med obstetriker/jordemoder afdækkes behovet for smertelindring, men det er altid en anæstesiologisk vurdering om der skal anlægges andet end en almindelig fødeepidural.
FØDESPINAL
- Det anbefales at bruge bupivacain tung 2,5 mg.
- Det anbefales at tilsætte sufentanil 5-10 mikrog eller fentanyl 12,5-25 mikrog for at forlænge virkningen af fødespinalen. Virkningen af fødespinalen er længere med sufentanil end fentanyl
- Føtal bradykardi er en bivirkning til intrathekale opioider, så der anbefales CTG overvågning af fostret ved anlæggelsen af en fødespinal
- Det anbefales at udvælge de kvinder der får anlagt en fødespinal nøje, da evidensen for anlæggelsen er sparsom og kun støtter anlæggelsen til flergangsfødende i hurtig progredierende fødsel
- Hvis der meldes akut kejsersnit på en kvinde, der har fået anlagt en fødespinal, så er det op til den enkelte anæstesiolog at vurdere, om der skal anlægges spinal eller epidural til kejsersnittet, eller om kvinden skal i generel anæstesi, men risikoen for høj spinal ved anlæggelse af en ny spinal til kejsersnit vurderes som værende lille
- Genanlæggelse af en fødespinal anbefales ikke
- Hvis der er tale om en fødende med en kompliceret fødsel, så skal det overvejes at anlægge fødespinalen som en del af en CSE
EPIDURAL-SPINAL
- CSE er et alternativ til fødeepidural ved hurtigt fremadskridende fødsler.
- Det anbefales at bruge bupivacain tung 1,5-2,5 mg tilsat opioid i form af sufentanil 5-10 mikrog eller fentanyl 10-15 mikrog til spinalen
- Epidural bolus dosis anbefales at være én af følgende:
- bupivacain 0,625-1,25 mg/ml 10-15 ml uden opioider
- bupivacain 0,625-1,25 mg/ml 10 ml tilsat opioid i form af enten fentanyl 2 µg/ml sufentanil 0,25-0,5 mikrog/ml
- ropivacain 1 mg/ml 10-15 ml med eller uden opioid
DURAPUNKTUR EPIDURAL
- Der er i litteraturen ikke evidens nok til at anbefale DPE som standard neuroaksial analgesi til fødende Fordelene ved anvendelse af DPE er færre ensidige epidural blokader, hurtigere anslag, bedre sakral analgesi og større sandsynlighed for vellykket top-up til kejsersnit
- Det anbefales af bruge en 25 eller 26 G til durapunktur
- Ved DPE findes færre maternelle og føtale bivirkninger end ved fødespinal og CSE
BAGGRUND FOR REKOMMANDATIONER
ALTERNATIVER TIL EPIDURAL
FØDESPINAL
En fødespinal som enkeltstående intervention er kun undersøgt i få studier; hvorimod flere udenlandske studier og større internationale guidelines har undersøgt fødespinal som en del af anlæggelsen af en kombineret epidural-spinal, hvilket man har tradition for at bruge flere steder udenfor Danmark (18).
Varigheden af en fødespinal med bupivacain 2,5 mg tilsat sufentanil 10 mikrog er gennemsnitlig 113 ± 50 min til 148 ± 27 min(137–141), med den længste varighed i tidlig fødsel (orificium 3-5 cm ved anlæggelsen) (142).
Da evidensen er sparsom, er det svært at udtale sig om, hvilke kvinder der vil profitere af en fødespinal. Eriksson et al. fandt god analgetisk effekt og obstetrisk outcome ved brug af en fødespinal på en meget selekteret gruppe bestående af 40 flergangsfødende i hurtig progredierende fødsel (141). Sharpe et al. undersøgte behovet for yderligere analgesi efter anlæggelsen af en fødespinal og fandt, at behovet var signifikant højere ved nullipara, anlæggelse tidligt I fødslen og stigende maternel alder (143). De konkluderer også, at kvinderne skal udvælges nøje og fødespinal ikke bør anlægges på førstegangsfødende, kvinder med høj alder, kvinder i tidlig fødsel, kvinder med højt BMI eller risiko for vanskelig luftvej. Som Eriksson et al. mener de, at en fødespinal skal anlægges på flergangsfødende i hurtigt progredierende fødsel (141,143).
De fleste studier undersøgte enten bupivacain tung eller bupivacain plain (137,138,140,141,144–149). Konklusionen var, at bupivacain plain giver kortere varighed af analgesien og et højere blok end bupivacain tung (149). Sammenlignet med ropivacain giver bupivacain tung ligeledes en længere varighed af analgesien (150–152). Cheng et al. fandt at fentanyl giver et hurtigere anslag, men en kortere varighed sammenlignet med sufentanil (140). Af rapporterede bivirkninger er kløe langt den hyppigste med en incidens på 21-85% (137–139,141). Motorisk blokade er sjælden, og tunghed af benene ses med en hyppighed på 0-5 % (137–141,153). Hypotension har en incidens på 0-15% (137,138,140,141,153), men da de nævnte studier definerer/registrerer hypotension forskelligt, skal disse tal tolkes med forsigtighed.
Intrathekale opioider kan give føtal bradykardi (12). De studier der rapporterer føtal bradykardi, beskriver en forekomst på 3-10%, men ingen af disse tilfælde førte til akut kejsersnit (139–141,146,147).
KOMBINERET EPIDURAL-SPINAL
Kombineret epidural-spinal (CSE) er en anerkendt teknik (154,155). De umiddelbare fordele ved CSE fremfor epidural analgesi, er det hurtigere anslag af blokaden ved anlæggelse af spinal analgesi samt en reduceret risiko for dyb motorisk blokade (137). Ulemperne er den manglende erkendelse af fejlplaceret epidural kateter, og bivirkninger i form af pruritus, forbigående føtal bradykardi uden øget risiko for akut forløsning og hypotension (156).
Ved konventionel CSE anvendes hyppigst needle-through-needle teknik, og der injiceres lokalanæstesi med eller uden opioid. Herefter indføres epidural kateteret og analgesien kan opretholdes med epidural administration. Der er beskrevet mange forskellige regimer for spinaldoser, epidural blandinger og tidsinterval til opstart af epidural. To nyere tekniske modifikationer af CSE er beskrevet: Sekventiel CSE-teknik og Epidural Volume Expansion (EVE). Ved Sekventiel CSE-teknik injiceres en mindre dosis intrathekalt, hvorefter en kontinuerlig epidural administration umiddelbart opstartes. Denne teknik kræver længere tid inden fuldt sensorisk blok nås, men vælges fremfor konventionel CSE for at undgå en hurtig sympatisk blokade. Ved EVE teknikken injiceres ligeledes en reduceret dosis spinalt for at opnå sensorisk blokade, herefter gives der i det anlagte epidural kateter en bolus af typisk 5-10 ml NaCl for at opnå cephal spredning EVE anvendes ikke så ofte, da der er rapporteringer om insufficiente blok, men yderligere undersøgelser kræves(157). Der er i litteraturen ikke evidens for at anbefale konventionel CSE fremfor sekventiel CSE, men EVE bør ikke anvendes på baggrund af nuværende litteratur.
Den største fordel ved CSE sammenlignet med epidural analgesi er den hurtigere smertestillende effekt. Effektiv fødeanalgesi er etableret efter ca. 4-6 min (121,137,158,159), som er væsentlig hurtigere end epidural analgesi mellem 15-25 min. Nickells et al. fandt ikke samme statistisk evidens for det hurtigere anslag ved CSE, der kunne retfærdiggære ulemperne ved CSE, se senere (160). Flere studier har vist lavere VAS-score ved CSE i sammenligning med epidural anæstesi på grund af det hurtigere anslag og den bedre efterfølgende analgesi. Årsagen til dette er færre unilaterale blok, færre supplerende epidural boli og færre epidurale replaceringer (121,158,161–164). Klinisk angiver de fødende færre sakrale smerter ved CSE (159). Andre studier har ikke kunnet påvise forskel i visuel analog score (VAS-score) (160,165). Hess et al. fandt, at man med konventionel epidural analgesi havde tre gange så stor risiko for at få gennembrudssmerter sammenlignet med CSE gruppen (164). Der er desuden significant nedsat behov for lokalanæstesi med CSE sammenlignet med konventionel epidural (158,166). Det er uklart, hvad årsagen til dette er, om det er udeladelse af initiale epidural bolus, om der er en dosissparende effekt af spinalen eller om durahullet faciliterer passagen under analgesien.
En bekymring ved anlæggelse af CSE er om fejlplacering epidural kateteret erkendes i tilfælde af akut sectio. Booth et al. analyserede 2395 fødendes neuroaksiale procedurer og fandt fejlplaceringer ved 6,6% ved CSE mod 11,6% ved konventionel epidural (122). Desuden fandt de, at CSE ikke forsinkede erkendelsen af fejlplacering af epiduralkateter. Flere studier har påvist samme pålidelighed af epidural kateterets placering ved CSE (159,167,168). Ved anlæggelsen af CSE er manglende CSV relateret til øget risiko for fejlplacering af katetret. CSV konfirmerer dels midtlinien, som også konfirmeres ved LOR. Thomas et al. fandt i en subgruppe af 18 fødende ved DPE uden CSV retur, at det havde større risiko for replacering af kateteret (38), og Grondin et al. fandt at epidural katetre placeret ved CSE teknik uden initial CSV retur havde 28,6% risiko for replacering i forhold til 4,1%, hvor der var CSV i spinalnålen (169). I en metaanalyse er unilaterale blok ligeledes fundet significant sjældnere efter CSE vs konventionel epidural (162), omvendt kunne man ikke genskabe tidligere studiers signifikant lavere forekomst af replaceringer af epidural katetre ved CSE vs epidural.
Der findes en del ulemper og komplikationer til CSE (170). Nogle kan relateres til intrathecal medicin og er dosisafhængig: Pruritus er den hyppigste ulempe ved intrathecal opioid administration (158,171,172), men også respirationsdepression, ændring af bevidsthedsniveau, dysfagi og højt sensorisk blok er beskrevet (173–177). Komplikationer i henhold til neuroaksiale blokader med medulære skader er teoretisk øget for CSE vs epidural (35,178). Selvom infektioner i CNS er sjældent forekommende under aseptisk teknik, og nogle hævder at dura punktur øger risikoen for infektion i CNS, er ingen evidens, der tyder på, at CSE er associeret med hyppigere infektion. Ej heller risikoen for PHPH ved dura punktur er der fundet evidens for (168,179).
Føtal bradykardi uden øget risiko for akut forløsning og hypotension er beskrevet under fødespinal.
DURAPUNKTUR EPIDURAL
Durapunktur epidural (DPE) er den seneste udvikling indenfor neuroaksial blokade til fødende. Ved anlæggelse af DPE anvendes samme teknik som ved CSE med needle-though-needle. Efter epiduralrummet er identificeret, indføres spinalkanylen, og når der observeres cerebrospinalvæske, får man indirekte bekræftet at epiduralnålens placering er nær midten af epiduralrummlet. Herefter fjernes spinalkanylen uden at der injiceres medicin i spinalrummet, og epiduralkateteret indsættes og epidural analgesi påbegyndes med bolus efterfulgt af kontinuerlig indgift.
Tilbage i 1996 fandt Suzuki et al. (180), at DPE med 26G durapunktur efterfulgt af kontinuerlig epidural forbedrede den caudale spredning af epidural anæstesi hos abdominalkirurgiske patienter. Forbedringen i anæstesien blev tilskrevet den mængde medicin der kom intrathecalt under epidural analgesien. De teoretiske fordele ved DPE i forhold til epidural er et hurtigere anslag af blokaden, færre unilaterale blok og bedre sakral blokade. Litteraturen er ikke entydig i dette, og da der mangler entydig evidens over fordele i forhold til risici, kan DPE ikke anbefales (181,182).
I et randomiseret studie med 120 kvinder fandt man overordnet en bedre bivirkningsprofil ved DPE sammenlignet med CSE og epidural analgesi (183). Her fandt man et hurtigere anslag ved CSE (2 min), og ingen signifikant forskel mellem DPE (11 min) og epidural (18 min). Ved DPE fandt man færre interventioner i fødslen samt færre maternelle (pruritus, hypotension) og føtale (bradykardi) bivirkninger end ved CSE. Ved sammenligning mellem DPE og epidural fandtes bedre blokade af S2, færre unilaterale blokader og færre interventioner under fødslen.
I et abestudie fandt en positiv korrelation mellem størrelsen på durahullet og strømmen over dura og anbefaler, at anvende en spinalnålen større end 27G (184).
OPIOIDER
- Remifentanil anbefales ikke som fødselsanalgesi på danske fødegange
- Dog kan remifentanil overvejes ved behov for smertelindring og samtidig kontraindikation for neuroaksial blokade. Konstant tilstedeværelse på stuen kræves af en anæstesisygeplejerske
- Det anbefales, at den fødende overvåges med kontinuerlig saturationsmåling og respirationsfrekvens og får taget blodtryk hvert hvert 5. min. i 30 min efter opstart af remifentanil og derefter hvert 15. min, så længe der gives remifentanil
- kapnografi skal kraftigt overvejes, da hypoventilation og apnø opdages hurtigere med kapnografi end saturationsmåling
- kontinuerlig CTG-overvågning af barnet og tilstedeværelse af pædiater ved fødslen ved brug af remifentanil
- Dog kan remifentanil overvejes ved behov for smertelindring og samtidig kontraindikation for neuroaksial blokade. Konstant tilstedeværelse på stuen kræves af en anæstesisygeplejerske
- Fentanyl anbefales ikke som fødselsanalgesi på danske fødegange
- Sufentanil anbefales ikke som fødselsanalgesi på danske fødegange
- Petidin anbefales ikke som fødselsanalgesi på danske fødegange
- Morfin anbefales ikke til kvinder i aktiv fødsel af et levende barn
BAGGRUND FOR REKOMMANDATIONER
OPIOIDER
Opioider var vidt brugt mod vesmerter før indførelsen af neuroaksial analgesi.
Petidin (halveringstid 24 timer, den aktive metabolit norpetidin har en halveringstid på ca. 60 timer) danner i litteraturen ofte sammenligningsgrundlag for anden smertelindring intrapartum, men må frarådes grundet lang halveringstid og en uhensigtsmæssig bivirkningsprofil, herunder respirationsdepression og nedsat krampetærskel hos den nyfødte. En rundspørge i oktober 2019 viste, at petidin er taget helt ud af brug på danske fødegange.
Morfin (halveringstid 4 timer) var ligeledes brugt flittigt tidligere, men grundet risiko for respirationsdepression hos den nyfødte anvendes morfin ikke længere i den aktive del af fødslen af et levende barn.
I særlige tilfælde, hvor epidural er absolut kontraindiceret, kan visse opioider (remifentanil) dog have en plads som smertelindring under fødslen (185).
REMIFENTANIL
Remifentanil er et yderst potent, hurtigvirkende opioid med kort halveringstid (få minutter). Stoffet nedbrydes i blod og væv, hvorfor renal og hepatisk dysfunktion ikke har betydning for nedbrydningen. Remifentanil passerer placenta, men nedbrydes hurtigt af barnet, hvorfor respiratorisk påvirkning af den nyfødte forventes at være kortvarig.
Patientadministreret remifentanil er undersøgt i et Cochrane review fra 2017, hvor man evaluerede den smertelindrende effekt samt mulige bivirkninger for mor og barn (186). Den smertelindrende effekt samt patienttilfredsheden tenderede at være bedre i remifentanilgruppen sammenlignet med andre opioider, men signifikant bedst i epiduralgruppen. Dette understøttes af et nyere RCT (187). Behov for yderligere smertestillende var mindre i remifentanilgruppen sammenlignet med grupper, der modtog andre opioider, men markant større sammenlignet med epidural/CSE-gruppen. Det skal dog nævnes, at Cochrane-gruppen lægger vægt på, at de studier med data om maternel og føtal/neonatal sikkerhed er meget begrænsede og af dårlig kvalitet.
Der er stor variation i, hvor hyppigt desaturation og dermed respirationsdepression rapporteres i forskellige studier. Dette grundet forskellige definitioner af desaturation og grad af monitorering (187–193). Ud fra disse forskellige definitioner og tæthed af monitorering ses desaturation som udtryk for respirationsdepression i 13-97% af alle fødende med remifentanil PCA (185,187,198,188–190,193–197). Der er kun ét studie, der har adresseret blodtryksændringer ved brugen af remifentanil PCA (190). I studiet måles blodtryk hvert 5. min den første halve time efter opstart at remifentanil og derefter hvert 15. min. De fandt ingen tilfælde af hypotension.
Pga risikoen for respirationsdepression anbefales konstant tilstedeværelse på stuen af en anæstesisygeplejerske. Maternel overvågning kræver som et minimum kontinuerlig overvågning med saturation og respirationsfrekvens, samt blodtryk hvert 5. min. i 30 min efter opstart af remifentanil og derefter hvert 15. min så længe der gives remifentanil. Kapnografi skal kraftigt overvejes, da hypoventilation og apnø opdages hurtigere med kapnografi end saturationsmåling (196).
Der er i litteraturen flere cases med respirationsstop og hjertestop som følge af PCA remifentanil (198,199). Det er oftest grundet samtidig administration af andet opioid eller fejldosering af remifentanil. Ligeledes omhandler en stor del af kasuistikkerne kvinder med foetus mortuus, hvor neonatal sikkerhed ikke er en bekymring, og man kan mistænke, at disse kvinder ikke har været observeret i samme grad som kvinder med levende fostre (198).
Den neonatale sikkerhed er undersøgt i flere studier, og der er ikke fundet øget behov for naloxon eller neonatal resuscitering ved brug af PCA remifentanil uden baggrundsinfusion (185,190,195,197,198) under fødslen. Dog kan remifentanil, som alle andre opioider, give nedsat variabilitet af fostrets hjertefrekvens, som kan tolkes som føtal stress (198). Risikoen for akut forløsning eller anden intervention i fødslen grundet overvågningsudfald er ikke beskrevet i litteraturen.
FENTANYL
Fentanyl kan bruges som både PCA og som bolus administration. Der er ikke meget litteratur, der støtter brugen af fentanyl som fødselsanalgesi. Et studie undersøgte PCA remifentanil overfor PCA fentanyl og fandt, at begge stoffer giver moderat smertelindring(195). Der ses oftere desaturation med PCA remifentanil (13%) end med fentanyl (2%), mens behovet for neonatal resuscitering er hyppigere i fentanylgruppen (59%) end i remifentanilgruppen (25%). Et andet studie undersøgte remifentanil, fentanyl og petidin PCA som fødselsanalgesi(197). Det skal bemærkes, at ingen grupper opnåede VAS under 4,5 cm. Smertescoren med fentanyl (og de andre opioider) returnerede mod baseline efter den første time (197). Et studie fandt i et review om opioider som fødselsanalgesi, at fentanyl havde et hurtigt anslag på ca. 2 min og en virkningsvarighed på ca. 30 min (198). Administration i doser á 50-100 mikrog/t giver analgesi i ca. 45 min. Disse doser kan give kortvarig (ca. 30 min) nedsat variabilitet i hjerterytmen hos fostret. Studiet fandt ikke forskel i apgar score eller neurologisk vurdering af den nyfødte sammenlignet med ingen analgesi (198). Et retrospektivt studie undersøgte apgar score og behov for naloxon hos nyfødte, hvis mødre havde fået fentanyl som fødselsanalgesi (200). De fandt, at 43% af alle nyfødte havde en apgar ≤ 6 ved 1 min. og 1% havde behov for naloxon. Ved 5 min. havde alle nyfødte en apgar ≥ 7, undtagen den 1% der havde behov for naloxon administration ved fødslen. Det skal dog bemærkes, at det er en retrospektiv opgørelse uden kontrolgruppe, så det er ikke sikkert, at det kun er administration af fentanyl, der er årsagen til fundene. Det mest bekymrende ved den publicerede litteratur er, at ingen nævner fentanyls kontekstsensitive halveringstid. Betydende at, jo hyppigere administration, desto større akkumulation af stoffet i den fødende og fostret.
SUFENTANIL
Intravenøs sufentanil som fødselsanalgesi er kun undersøgt i ét studie, der sammenligner 10 mikrog sufentanil administreret hhv. intravenøst, epiduralt og intrathekalt. De finder, at sufentanil 10 mikrog intrathekalt har en smertestillende effekt i ca. 2 timer, og at hverken epidural eller intravenøs sufentanil er smertestillende (201).
PETIDIN
Petidin krydser hurtigt placenta og metaboliseres til den aktive metabolit norpetidin, der giver respirationsdepression. Halveringstiden for norpetidin er for den fødende ca. 21 timer og for fostret ca. 63 timer. Norpetidin akkumuleres hos både den fødende og i fostret. Petidin gives hyppigst i.m. i doser af 50-100 mg og giver signifikant sedation, der måske tolkes som smertestillende effekt. Intravenøs petidin 50 mg giver samme smertestillende effekt som 1 g paracetmol, med en rate af bivirkninger på 64% for petidin og 0% for paracetamol (198). Derfor anbefales petidin ikke som fødselsanalgesi.
ACCIDENTIEL DURAPUNKTUR OG POST SPINAL HOVEDPINE
GS og KW
REKOMMANDATIONER
ACCIDENTIEL DURAPUNKTUR OG POST SPINAL HOVEDPINE
- For epidural teknik bør ikke anvendes tykkere end G18 touhy nåle
- Det frarådes at anlægge profylaktisk epidural blood patch (EBP) efter accidentiel durapunktur (ADP)
BEHANDLING
- Det anbefales at behandle let PDPH konservativt, med normohydrering og perorale analgetika
- Det anbefales at behandle moderat til svær PDPH varende > 48 timer med EBP. Tidligere intervention kan være indiceret efter individuel vurdering. EBP er mest effektiv når det sker > 48 timer efter durapunktur
- Ved EBP anbefales langsom injektion af 20 ml af autolog blod. Injektion skal afbrydes ved betydelig smerte eller tryk
- Det anbefales, at EBP foretages i samme niveau som ADP eller caudalt herfor
- Det anbefales, at patienten lejres horisontalt de første 2 timer efter EBP
- Det anbefales at gentage behandling med EBP ved recidiv af PDPH, forudsat at der har været klar effekt af den første EBP
- Det anbefales at foretage neurologisk vurdering ved mistanke om intrakraniel patologi, hvis hovedpinens karakter ændres, ved recidiv efter 2. EBP eller hvis der ikke har været klar effekt af EBP
BAGGRUND FOR REKOMMANDATIONER
POST DURA PUNKTUR HOVEDPINE
PDPH er en velkendt bivirkning til neuroaksiale procedurer (202–204). Mekanismen ved PDPH er ikke fuldt afdækket, og der findes to dominerende teorier: 1) Udsivning af CSF leder til mindre intrakraniel CSF. Dette betyder mindre opdrift af cerebrum resulterende i træk på strukturer i hjernen, som leder til smerter (202,203). 2) Mindre CSF leder til intrakraniel kompensatorisk arterio- og venodilatation som giver PDPH (202,203).
RISIKOFAKTORER
ALDER
20-30-årige har ved durapunktur, en 3-5 gange øget risiko for at udvikle PDPH i forhold til > 60-årige (205).
KØN
Kvinders risiko for at udvikle PDPH er dobbelt så stor som mænds (206).
ANAMNESE
Tidligere PDPH og kronisk hovedpine disponerer til udvikling af PDPH (206).
BMI
Højt BMI beskytter mod PDPH via en ikke kendt mekanisme (206).
DIAGNOSTICERING
Se kriterier nedenfor.
DEFINITION
PDPH er lavtrykshovedpine forårsaget af læk af CSF efter neuroaksial instrumentering (spinal eller epidural anæstesi)) (207).
KRITERIER
De diagnostiske kriterier for lavtrykshovedpine forårsaget af durapunktur er (206,207).
| Kriterie | |
| A | Ortostatisk hovedpine, som klassisk består af nedenstående:
● Nakkesmerter ● Tinnitus ● Ændret hørelse ● Lysskyhed ● Kvalme Symptomlindring ved skift fra stående til liggende stilling. Forværring ved hoste, nys eller brug af bugpressen |
| B | Nylig udført neuroaksial procedure |
| C | Der er gået ≤ 5 dage fra neuroaksial instrumentering til symptomdebut |
| D | Ingen anden bedre forklaring |
Det Internationale Hovedpine Selskab beskriver ikke antal af kriterier, der er nødvendige for diagnosen, eller skelner mellem sværhedsgrader af PDPH (207).
Ved svære symptomer (nedsat eller manglende evne til at varetage den nyfødte herunder mobilisering) bør man tidligere tilbyde invasiv behandling end ved lette symptomer.
BILLEDDIAGNOSTISKE TESTS
Der er muligt at vise diskrete forandringer med MR ved PDPH. Men MR kan være normal trods symptomatisk PDPH (205). MR anbefales ikke som til diagnosticering af PDPH induceret lavtryks hovedpine.
DIFFERENTIALDIAGNOSER
| Differentialdiagnoser til hovedpine efter durapunktur(206) |
| 1. Uspecifik (muskulær/spændings) hovedpine
2. Migræne 3. Koffein-abstinens hovedpine 4. Meningitis 5. Sinuitis hovedpine 6. Hypertensiv hovedpine (præeklampsi) 7. Misbrug (kokain, amfetamin) 8. Pneumocephalus relateret hovedpine (luft efter LOR-teknik?) 9. Cerebral venøs trombe 10. Subduralt hæmatom 11. Subarakhnoidalt hæmatom 12. Tumor cerebri 13. Lakterings hovedpine (søvnmangel, stress, dehydrering) 14. Apopeksi (hæmoragisk) 15. Posterior reversible encephalopathy syndrome (PRES) |
PROFYLAKSE FØR INDSTIK
Se afsnit: Teknik ved anlæggelsen s. 13
VAND VS. LUFT VED LOSS-OF-RESISTANCE VED EPIDURAL ANALGESI
En Cochrane analyse fra 2014 fandt ikke forskel i ADP uanset brug af luft eller vand (42).
Anbefalinger i litteraturen af NaCl til brug for LOR-teknik er alene baseret på en teoretisk risiko for pneumocephalus ved ADP og brug af luft.
ULTRALYDSVEJLEDT SPINAL- OG EPIDURAL TEKNIK
Standardiseret ultralydsteknik til neuroaksiale procedurer vinder frem (208). Med standardiseret teknik kan afvigelse mellem ultralydsmåling og nåleafstand til LOR reduceres til ca. 3 mm (209). En metaanalyse af ultralydsvejledt spinal og epidural anlæggelse viste at neuroaksial ultralyd øgede effektiviteten ved anlæggelse af lumbal epidural og spinal anæstesi ved korrekt at identificere indstiksniveau, reducere antallet af opgivne epidurale anlæggelser og antal indstik i patienter med både normale og vanskelige anatomiske kendetegn (209).
Reduktion i ADP/PDPH virker sandsynlig ved brug af ultralyd som tillader afstandsbedømmelse til det posteriore kompleks. Viden om hud-epiduralrum afstand kan så hindre unødig lang nåleindføring. Der foreligger endnu ikke studier, der viser reduktion af ADP og PDPH ved brug af neuroaksial ultralyd.
PROFYLAKSE EFTER DURAPUNKTUR
PROFYLAKTISK BLOODPATCH
Profylaktisk EBP anbefales ikke rutinemæssigt, da effekten er uklar. Litteraturgennemgang relateret til profylaktisk EBP inden for obstetrisk anæstesi viser, at det ikke reducerer forekomsten af PDPH, men kan reducere intensitet eller/og varighed af symptomer (210).
SPINALKATETER VED ADP
Effekt af spinalkateterplacering efter ADP er ikke blevet vist i randomiserede kontrollerede studier, og de fleste undersøgelser har ikke rapporteret nogen fordel af anlæggelse af spinalkateter. Metaanalyse af ikke-randomiserede studier fra 2013 har vist, at anlæggelse af spinalkateter efter ADP, som fjernes igen efter 24 timer, reducerer behovet for EBP, men ikke forekomsten af PDPH (211). Spinalkatetre efter ADP kan have en højere grad af mislykket fødselsanalgesi sammenlignet med gentagne epiduralkatetre (212). Af disse årsager anbefales rutinemæssig anlæggelse af intrathekalt kateter efter ADP ikke. Dog kan det anlægges selektivt (f.eks. efter en vanskelig epidural procedure). Tilstedeværelse af et spinalkateter indebærer dog i sig selv en risiko for infektion og fejladministration. Derfor skal spinalkateter markeres tydeligt og medicin administreres af anæstesilæge. Erfaringer med spinalkatetre til fødsels analgesi er få og anbefales derfor ikke.
MEDICINSK PROFYLAKSE
Pga. begrænsede tilgængelige data anbefaler vi ikke administration af profylaktiske lægemidler efter ADP for at forhindre PDPH. Studier med få deltagere har vist, at epidural morfin (213) og cosyntropin (214) kan reducere risikoen for PDPH efter ADP. Epiduralt morfin er forbundet med høj risiko for PONV (44%) og usikkerhed med hensyn til, hvor meget morfin, der transporteres spinalt gennem perforationen i dura (215).
Peroral koffein forhindrer ikke PDPH efter ADP (216).
SENGELEJE OG VÆSKE
Sengeleje eller ekstra væsketilførsel, ud over normohydrering, reducerer ikke risikoen for PDPH efter ADP (203).
BEHANDLING AF PDPH
Behandlingsstrategien ved PDPH afhænger af sværhedsgraden af hovedpinen og dets indvirkning på patientens evne til at fungere.
MEDICINSK BEHANDLING
Flere typer medicin er blevet undersøgt til behandling af PDPH i små undersøgelser, men ingen har vist sig at være gavnlige.
Koffein: Der er begrænset evidens til at understøtte brugen af koffein i behandlingen af obstetrisk PDPH. Hvis det anvendes, bør behandlingen med koffein ikke vare længere end 24 timer. Oral behandling er foretrukket, og doserne må ikke overstige 300 mg, med maksimalt 900 mg pr. 24 timer. En lavere maksimal dosis på 200 mg pr. 24 timer bør overvejes hos kvinder, der ammer. Dette især for mødre til børn med lav fødselsvægt eller for tidligt fødte spædbørn. Kvinder, der får koffeinbehandling, skal have deres koffein indtag monitoreret, og den anbefalede daglige dosis bør ikke overskrides.(204)
Analgetika: Nogle eksperter foretrækker oral analgetika til symptomatisk behandling af PDPH, typisk med paracetamol eller NSAID. Der er manglende evidens for dette, specielt til PDPH(204).
Opioider: Opioider kan tilbydes kvinder med PDPH, indtil EBP kan tilbydes, hvis paracetamol/NSAID oral analgesi er ineffektiv, men langtidsbehandling anbefales ikke(204).
Neostigmin/atropin: Et mindre RCT viste at brug af neostigmin 20 mikrog/kg og Atropin 10 mikrog/kg i.v. var effektive til behandling af PDPH. Ingen af patienterne i neostigmin/atropin-gruppen havde efterfølgende brug for EPB. Neostigmin kan passere choroid plexus, men ikke blod-hjerne barrieren. De centrale virkninger af begge lægemidler påvirker både cerebrospinalvæskeudskillelse og cerebral vaskulær tone, som er de primære patofysiologiske ændringer i PDPH (217). Vi anbefaler ikke rutinemæssig brug af disse to lægemidler pga. utilstrækkelig evidens.
Andre lægemidler: Effekten af gabapentin, hydrocortison og theophyllin er minimal til PDPH. Ved behandling ved Sumatriptan og adrenokortikotrof hormon er der ikke evidens for positiv effekt på PDPH (204).
Væske: Effekten af i.v. væsker er uklar (203)(203) og anbefales kun til patienter, som ikke kan indtage tilstrækkelig væske peroralt (204)
Tromboseprofylakse: Hvis kvinder er sengeligende mere end 24 timer på grund af PDPH, bør tromboseprofylakse overvejes og diskuteres med obstetriker. Hvis der anvendes farmakologisk tromboseprofylakse, og en EBP skal udføres, skal EBP times ift. sidste dosis af antikoagulant og EBP være udløbet for at reducere risikoen for vaskulære komplikationer (204).
EPIDURAL BLOOD PATCH
Succesrate: EBP er en effektiv behandling af PDPH (218–220). Den initiale succesrate er ca. 90% uafhængig af om PDPH er opstået efter epidural, CSE eller spinal anæstesi. Risikoen for tilbagefald er 31% efter epidural, 7% efter CSE og 5% efter spinal anæstesi (221).
Volumen: Det optimale volumen er ukendt. De fleste anbefalinger er 10-20 ml. Det seneste studie sammenlignede 15, 20 og 30 ml autologt blod og fandt ingen signifikant forskel. Anbefalingen blev injektion af 20 ml autologt blod og afbrydelse af proceduren, hvis patienten oplevede smerter i ryg eller ben under injektionen (114).
Niveau: EBP skal foretages på niveau med durapunkturen eller caudalt herfor, idet MR efter EBP viser, at blodet hovedsagelig spreder sig kranielt for indstiksstedet (222,223).
Timing: Retrospektive studier viser højere succesrate, når EBP foretages mere end 48 timer efter PDPH-debut. Dette kan dog skyldes, at svær PDPH foranlediger tidligere EBP. En international konsensusgruppe anbefaler, at kvinder med PDPH informeres om reduceret effekt og øget risiko for endnu en blood patch ved anlæggelse af blood patch < 48 timer efter durapunktur (224). Immobilisering > 24 timer resulterer i anbefaling af tromboseprofylakse, som kan påvirke anlæggelsestidspunktet.
Lejring: Et studie fandt bedre effekt ved horisontal lejring i 2 timer sammenlignet med horisontal lejring i 30 min. efter EBP (225).
Komplikationer til EBP: Rygsmerter er den hyppigst forekommende komplikation ved EBP. Rygsmerter forekommer hos 25-35% af patienterne. Rygsmerter forsvinder som regel spontant inden for 48 timer(226). Sjældne komplikationer omfatter: Hæmatom (epiduralt, subduralt og subarachnoidalt), infektion, subdural absces, lammelse af n. facialis, rodaffektion og spastisk paraparese (227).
ALTERNATIVE BEHANDLINGER AF PDPH
Bilateralt transnasalt sphenopalatint ganglion blok (SPGB): SPGB menes at virke ved at blokere flow til cerebral vaskulatur, hvilket reducerer cerebral vasodilatation (204,228). Der er i øjeblikket utilstrækkelig evidens til at anbefale brugen af SPGB’er til behandling af obstetrisk PDPH. SPGB kan måske tilbydes patienter, som ikke ønsker en EBP, eller til dem hvor EBP er relativt eller absolut kontraindiceret.
Greater n. occipitalis blok (GONB): En randomiseret undersøgelse, der sammenlignede GONB med sengeleje, hydrering og svage analgesi (både fødselsrelateret og ikke-obstetrisk) ved PDPH efter spinalanæstesi med en 27G skærende spinalnål, viste en statistisk signifikant reduktion i VAS-smertescore på 1.-6. dag. Det er i øjeblikket ikke anbefalet at behandle obstetrisk PDPH med GONB pga. manglende evidens (204).
NEUROLOGISKE KLAGER EFTER FØDSLEN
EW og LF
REKOMMANDATIONER
FLOW CHART FOR UDREDNING AF NEUROLOGISKE KLAGER EFTER FØDSLEN
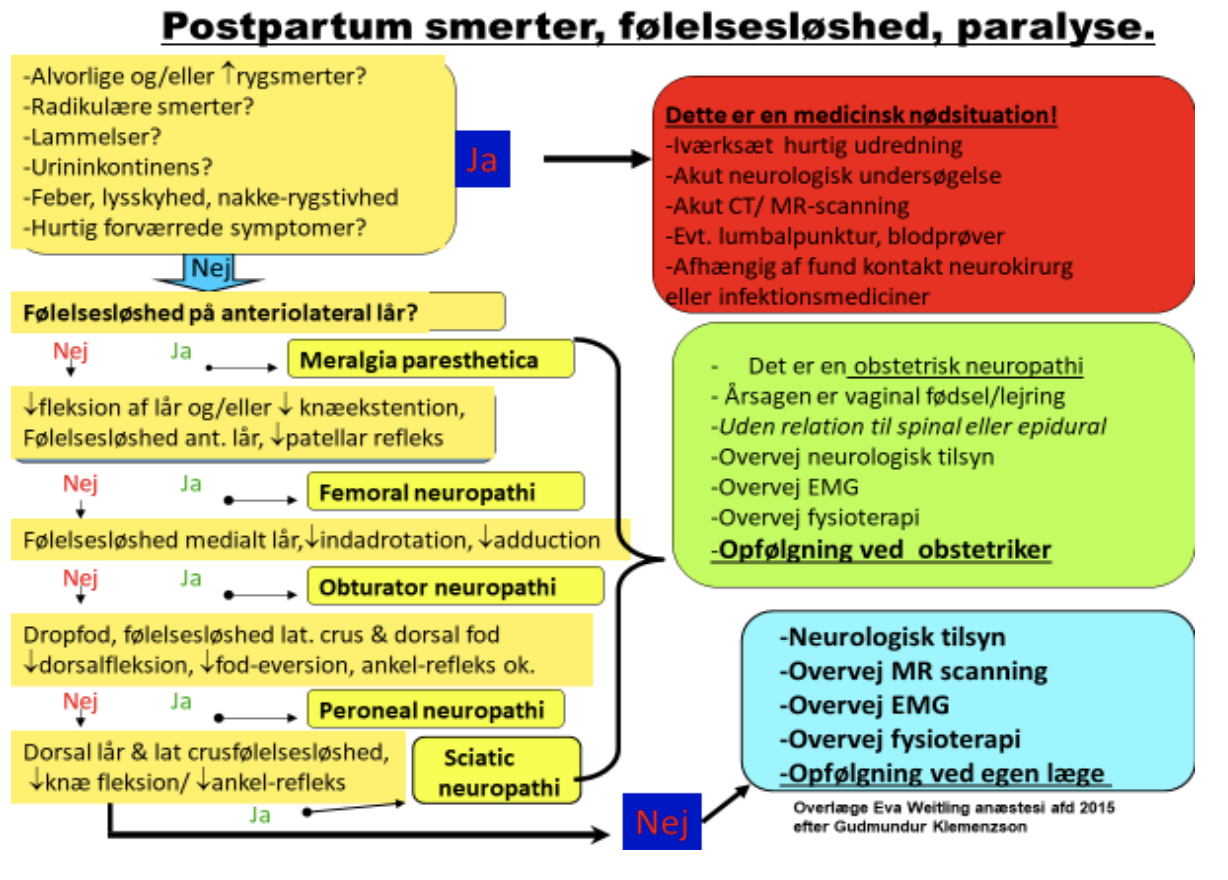
BAGGRUND FOR REKOMMANDATIONER
Hovedparten af neurologiske komplikationer efter fødsel skyldes nervetryk pga. langvarig fødsel og/eller uhensigtsmæssig lejring under fødslen. Hyppigst ses unilateralt sensorisk og motorisk deficit. Symptomerne vil aftage indenfor 6 uger til 2 måneder hos langt de fleste (229).
Incidensen af neurologiske komplikationer efter fødsel estimeres til 0,92% (230).
Incidensen af permanent nerveskade efter regional blokade estimeres til at være 1 ud af 80.000 til 1 ud af 320.425 (108).
Neurologiske komplikationer sekundært til regional blokade skyldes skade på medulla og/eller nerverødder pga. traume, neurotoxicitet, infektion, iskæmi eller hæmatom.
Flowchart udarbejdet af E Weitling på baggrund af referencer samt foredrag af G Klemenzson.
APPENDIX 1
INFORMATION TIL KVINDEN
Information om Fødeepidural – Hvad du har brug for at vide?
Dette er en kortfattet information
Du kan få mere information på dit fødested og eventuelle spørgsmål kan rettes til din jordemoder, fødselslægen eller anæstesilægen.
HVAD ER EN FØDEEPIDURAL
- En fødeepidural er en blokade af de smerteførende nerver fra fødselsvejen
- De smerteførende nerver kommer fra lænderyggen i det område, hvor epiduralkatetret lægges ind
- Igennem epiduralkatetret kan der indsprøjtes lokalbedøvende medicin under hele fødslen
ANLÆGGELSE AF FØDEEPIDURAL
- Du vil få lagt drop i en blodåre i hånden eller armen
- Huden på ryggen vil blive afvasket, og der vil blive lagt lokalbedøvelse
- Under anlæggelse af epiduralen er det vigtigt, at du sidder eller ligger helt stille
- Derfor skal du sige til, hvis du får en ve
- Epiduralkatetret føres ind igennem en nål til det sted, hvor de smerteførende nerver ligger
- Nålen fjernes og katetret bliver liggende
- Katetret sættes fast med plaster på din ryg, så du kan bevæge dig frit
- Det tager sædvanligvis under 20 min at lægge en epidural og 10-20 minutter inden smertelindringen virker
- Af og til virker epiduralen ikke godt nok og må justeres eller lægges om
FORDELE VED EN FØDEEPIDURAL
- Oftest opnås en særdeles god smertelindring
- Du vil som regel stadig kunne bevæge dig og eventuelt gå lidt omkring med støtte
- En fødeepidural påvirker ikke barnet under fødslen
- Fødeepiduralen kan ved behov ofte anvendes til kejsersnit ved at indsprøjte en stærkere dosis lokalbedøvelse i epiduralkatetret
EVENTUELLE BIVIRKNINGER AF FØDEEPIDURAL
- Blodtryksfald, kløe og feber kan forekomme
- Ved temperatur > 38 grader vil behandling med antibiotika blive overvejet
- Forbigående muskelsvaghed i benene, især hvis der gives ekstra doser af stærkere lokalbedøvelse
- Nedsat fornemmelse af blærefyldning og risiko for delvis eller helt manglende evne til at tømme blæren så længe epiduralen virker. Blæren tømmes da med kateter
- Epiduralen kan forlænge fødslen, dog oftest ubetydeligt
- Der kan være ømhed ved indstiksstedet, men oftest af få dages varighed
- Længerevarende rygsmerter er IKKE udløst af epiduralen, men forekommer hyppigt i forbindelse med graviditet og fødsel
- Der er en risiko på ca. 1 % for at epidural-nålen laver et lille hul i den hinde, der omgiver rygmarven. Dette vil ofte medføre behandlingskrævende hovedpine, der typisk opstår 1-2 dage efter fødslen. Hovedpinen er stillingsafhængig og forværres når du sidder og står og lindres når du ligger. Du skal henvende dig til fødestedet, hvis du får sådan en hovedpine derhjemme
REFERENCER
- Sundheds-og Ældreministeriet. Bekendtgørelse om information og samtykke i forbindelse med behandling og ved videregivelse og indhentning af helbredsoplysninger m.v. BEK nr 509 af 13/05/2018 (Gældende). Vol. 12, Retsinformation.dk. 2020.
- White LA, Gorton P, Wee MYK, Mandal N. Written information about epidural analgesia for women in labour: Did it improve knowledge? Int J Obstet Anesth. 2003;12(2):93–7.
- Gerancher JC, Grice SC, Dewan DM, Eisenach J. An evaluation of informed consent prior to epidural analgesia for labor and delivery. Int J Obstet Anesth. 2000;9(3):168–73.
- Jackson A, Henry R, Avery N, VanDenKerkhof E, Milne B. Informed consent for labour epidurals: What labouring women want to know. Can J Anesth. 2000;47(11):1068–73.
- Ayling L, Henry A, Tracy S, Donkin C, Kasparian NA, Welsh AW. How well do women understand and remember information in labour versus in late pregnancy? A pilot randomised study. J Obstet Gynaecol (Lahore). 2019;39(7):913–21.
- Bethune L, Harper N, Lucas DN, Robinson NP, Cox M, Lilley A, et al. Complications of obstetric regional analgesia: How much information is enough? Int J Obstet Anesth. 2004;13(1):30–4.
- Broaddus BM, Chandrasekhar S. Informed consent in obstetric anesthesia. Anesth Analg. 2011;112(4):912–5.
- Meng ZH, Wolberg AS, Monroe DM, Hoffman M. The effect of temperature and pH on the activity of factor VIIa: implications for the efficacy of high-dose factor VIIa in hypothermic and acidotic patients. J Trauma. 2003 Nov;55(5):886–91.
- Middle J V., Wee MYK. Informed consent for epidural analgesia in labour: A survey of UK practice. Anaesthesia. 2009;64(2):161–4.
- DSOG: Den latente fase af fødslen.
- DSOG: Smertelindring under fødslen – medicinsk.
- Mardirosoff C, Dumont L, Boulvain M, Tramè MR. Fetal bradycardia due to intrathecal opioids for labour analgesia: a systematic review [Internet].
- Anim-Somuah M, Smyth RMD, Cyna AM, Cuthbert A. Epidural versus non-epidural or no analgesia for pain management in labour. Vol. 2018, Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd; 2018.
- Weiniger CF, Wand S, Nadjari M, Elchalal U, Mankuta D, Ginosar Y, et al. Post-void residual volume in labor: A prospective study comparing parturients with and without epidural analgesia. Acta Anaesthesiol Scand. 2006;50(10):1297–303.
- Caracostea G, Stamatian F, Lerintiu M, Herghea D. The influence of maternal epidural analgesia upon intrapartum fetal oxygenation. J Matern Neonatal Med. 2007;20(2):161–5.
- Ane F, Nordentoft C, Hoffgaard AC, Bertelsen A, Henriques C, Brix C, et al. Fosterovervågning under fødslen – indikationer. Dsog. 2017;1–70.
- ACOG, Plante LA, Gaiser RR. ACOG Practice Bulletin. Clinical Management Guidelines for Obstetrician – Gynecologists. Obstet Gynecol. 2019;133(76):168–86.
- American Society of Anesthesiologists. Practice Guidelines for Obstetric Anesthesia: An Updated Report by the American Society of Anesthesiologists Task Force on Obstetric Anesthesia and the Society for Obstetric Anesthesia and Perinatology. Anesthesiology. 2016 Apr;124(2):270–300.
- Jp N. Jones L, Othman M, Dowswell T, Alfirevic Z, Gates S, Newburn M, Jordan S, Lavender T, Neilson JP. 2012;
- Anim-Somuah M, Smyth RMD, Cyna AM, Cuthbert A. Epidural versus non-epidural or no analgesia for pain management in labour. Vol. 2018, Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd; 2018.
- Hawkins JL. Abnormal Presentation and Multiple Gestation.
- Dyer RA. Hypertensive Disorders.
- Ramanathan J, Coleman P, Sibai B. Anesthetic modification of hemodynamic and neuroendocrine stress responses to cesarean delivery in women with severe preeclampsia. Anesth Analg. 1991;73(6):772–9.
- Kiely DG, Condliffe R, Webster V, Mills GH, Wrench I, Gandhi S V., et al. Improved survival in pregnancy and pulmonary hypertension using a multiprofessional approach. BJOG An Int J Obstet Gynaecol. 2010;117(5):565–74.
- Lindeman KS. Respiratory Disease.
- Spinal Cord Injury (ACOG 2002) [Internet]. 2002. p. 1–3. Available from: papers2://publication/uuid/A75FB62B-E40C-4313-B629-BEFB4952643E
- Hopkins AN, Alshaeri T, Akst SA, Berger JS. Neurologic disease with pregnancy and considerations for the obstetric anesthesiologist. Semin Perinatol [Internet]. 2014;38(6):359–69.
- Wong CA. Epidural and Spinal Analgesia: Anesthesia for Labor and Vaginal Delivery. In: Chestnut’s Obstetric Anesthesia [Internet]. Sixth Edit. Elsevier Inc.; 2019. p. 474–539.
- Gambling DR, Douglas MJ, McKay RSF. Obstetric Anaesthesia and Uncommon Disorders. Cambridge University Press; 2011.
- Murphy CJ, Stanley E, Kavanagh E, Lenane PE, McCaul CL. Spinal dysraphisms in the parturient: Implications for perioperative anaesthetic care and labour analgesia. Int J Obstet Anesth. 2015;24(3):252–63.
- Garvey GP, Wasade VS, Murphy KE, Balki M. Anesthetic and Obstetric Management of Syringomyelia during Labor and Delivery: A Case Series and Systematic Review. Anesth Analg. 2017 Sep;125(3):913–24.
- Cohen, Bahar M, Chanimov M, Cohen M. Lateral recumbent head-down posture for epidural catheter insertion reduces intravascular injection. Can J Anaesth [Internet]. 2001 [cited 2020 Jul 1];48(1):48–53.
- Cohen ML, Bahar M, Chanimov M, Cohen M. The lateral recumbent head-down position decreases the incidence of epidural venous puncture during catheter insertion in obese parturients. Can J Anaesth [Internet]. 2004 [cited 2020 Jul 1];51(6):577–80.
- Columb M, Armstrong S, Fernando R, Columb M. Cardiac index in term pregnant women in the sitting, lateral, and supine positions: an observational, crossover study. Anesth Analg [Internet]. 2011 [cited 2020 Jul 1];113(2):318–22.
- Reynolds, Reynolds F. Damage to the conus medullaris following spinal anaesthesia. Anaesthesia [Internet]. 2001 [cited 2020 Jul 1];56(3):238–47.
- Scott, Griffin R, Scott R. Forum. A comparison between the midline and paramedian approaches to the extradural space. Anaesthesia [Internet]. 1984 [cited 2020 Jul 1];39(6):584–6.
- Arbous, Leeda M, Stienstra R, Arbous M. Lumbar epidural catheter insertion: the midline vs. the paramedian approach. Eur J Anaesthesiol [Internet]. 2005 [cited 2020 Jul 1];22(11):839–42.
- SSI Nationale infektionshygiejniske retningslinier for det præ, per og postoperative område. Central Enhed for Infektionshygiejne 2. udgave 2020. 2020.
- Halpern S, Balki M, Lee Y, Halpern S. Ultrasound imaging of the lumbar spine in the transverse plane: the correlation between estimated and actual depth to the epidural space in obese parturients. Anesth Analg [Internet]. 2009 [cited 2020 Jul 1];108(6):1876–81.
- Sahin L, Sahin T, Balaban O, Sahin L. A randomized controlled trial of preinsertion ultrasound guidance for spinal anaesthesia in pregnancy: outcomes among obese and lean parturients: ultrasound for spinal anesthesia in pregnancy. J Anesth [Internet]. 2014 [cited 2020 Jul 1];28(3):413–9.
- Margarido C, Arzola C, Mikhael R, Margarido C. Spinal ultrasound versus palpation for epidural catheter insertion in labour: A randomised controlled trial. Eur J Anaesthesiol [Internet]. 2015 [cited 2020 Jul 1];32(7):499–505.
- Antibas, PL; do Nascimento Junior, P; Braz, LG; Vitor Pereira Doles, J; Modolo, NSP; El Dib R. Air versus saline in the loss of resistance technique for identification of the epidural space. Cochrane Database Syst Rev [Internet]. 2014;2014(7):CD008938.
- Aguilar J, Schier R, Guerra D, Aguilar J. Epidural space identification: a meta-analysis of complications after air versus liquid as the medium for loss of resistance. Anesth Analg [Internet]. 2009 [cited 2020 Jun 19];109(6):2012–21.
- Mhyre JM. Why Do Pharmacologic Test Doses Fail to Identify the Unintended Intrathecal Catheter in Obstetrics? Anesth Analg [Internet]. 2013 Jan [cited 2020 Jun 19];116(1):4–5.
- Camorcia M. Testing the epidural catheter. Vol. 22, Current Opinion in Anaesthesiology. 2009. p. 336–40.
- SOAP SCORE Project.
- Massoth C, Wenk M. Epidural test dose in obstetric patients: should we still use it? Curr Opin Anaesthesiol. 2019 Jun 1;32(3):263–7.
- Toledano R d’Arby, Leffert L. Neuraxial analgesia for labor and delivery (including instrumented delivery) – UpToDate [Internet]. UpToDate. 2020 [cited 2020 Jun 14]. Available from: https://www.uptodate.com/contents/neuraxial-analgesia-for-labor-and-delivery-including-instrumented-delivery?source=autocomplete&index=0~1&search=labour epidural
- Lyons GR, Kocarev MG, Wilson RC, Columb MO. A comparison of minimum local anesthetic volumes and doses of epidural bupivacaine (0.125% w/v and 0.25% w/v) for analgesia in labor. Anesth Analg. 2007 Feb;104(2):412–5.
- Hogan Q. Distribution of solution in the epidural space: Examination by cryomicrotome section. Reg Anesth Pain Med. 2002;27(2):150–6.
- Polley LS. Dose-dependent reduction of the minimum local analgesic concentration of bupivacaine by sufentanil for epidural analgesia in labor. Anesthesiology. 1998;89:626–32.
- F C. Effects of diluent volume of a single dose of epidural bupivacaine in parturients during the first stage of labor.pdf. Reg Anesth Pain Med. 1998;23(2):134–41.
- Beilin Y, Galea M, Zahn J, Bodian CA. Epidural ropivacaine for the initiation of labor epidural analgesia: A dose finding study. Anesth Analg. 1999;88(6):1340–5.
- Beilin Y, Guinn NR, Bernstein HH, Zahn J, Hossain S, Bodian CA. Local anesthetics and mode of delivery: Bupivacaine versus ropivacaine versus levobupivacaine. Anesth Analg. 2007;105(3):756–63.
- Lyons G, Columb M, Hawthorne L, Dresner M. Extradural pain relief in labour: Bupivacaine sparing by extradural fentanyl is dose dependent. Br J Anaesth. 1997;78(5):493–7.
- Shennan AH. Effect of low-dose mobile versus traditional epidural techniques on mode of delivery: a randomised controlled trial. Lancet. 2001 Jul 7;358(9275):19–23.
- Chestnut DH, Owen CL, Bates JN, Ostman LG, Choi WW GM. Continuous Infusion Epidural Analgesia during Labor: A Randomized, Double-blind Comparison of 0.0625% Bupivacaine/0.0002% Fentanyl Versus 0.125% Bupivacaine. Anesthesiology. 1988;68(5):754–9.
- Elliott RD. Continuous infusion epidural analgesia for obstetrics: bupivacaine versus bupivacaine-fentanyl mixture. 1990.
- Russell R, Quinlan J, Reynolds F, Reynolds F. Motor block during epidural infusions for nulliparous women in labour A randomized double-blind study of plain bupivacaine and low dose bupivacaine with fentanyl. Vol. 4, International Journal of Obstetric Anesthesia. 1995.
- Sultan P, Murphy C, Halpern S, Carvalho B, Sultan P, Murphy C, et al. The effect of low concentrations versus high concentrations of local anesthetics for labour analgesia on obstetric and anesthetic outcomes: a meta-analysis. Can J Anesth/J Can Anesth [Internet]. 2013 [cited 2020 Jun 14];60:840–54. Available from: www.clinicaltrials.gov
- Lund-olesen J. Abstracts for the 2019 Scandinavian Society of Anaesthesiology and Intensive Care Medicine Congress in Copenhagen. Acta Anaesthesiol Scand [Internet]. 2019 Sep 29 [cited 2020 Aug 11];63(8):ABSSUB‐212.
- Li Y, Hu C, Fan Y, Wang H, Xu H. Epidural analgesia with amide local anesthetics, bupivacaine, and ropivacaine in combination with fentanyl for labor pain relief: A meta-analysis. Med Sci Monit. 2015 Mar 29;21:921–8.
- Buyse I, Stockman W, Columb M, Vandermeersch E, Van de Velde M. Effect of sufentanil on minimum local analgesic concentrations of epidural bupivacaine, ropivacaine and levobupivacaine in nullipara in early labour. Int J Obstet Anesth. 2007 Jan;16(1):22–8.
- Beilin Y., Halpern S. Ropivacaine_Versus_Bupivacaine_for_Epidural_Labor.36. Anesth Analg. 2010;111(2):482–7.
- Toledano R d’Arby, Leffert L. Neuraxial analgesia for labor and delivery (including instrumented delivery) – UpToDate [Internet]. UpToDate. 2020 [cited 2020 Aug 11]. Available from: https://www.uptodate.com/contents/neuraxial-analgesia-for-labor-and-delivery-including-instrumented-delivery?source=autocomplete&index=0~1&search=labour epidural
- Lv BS, Wang W, Wang ZQ, Wang XW, Wang JH, Fang F, et al. Efficacy and safety of local anesthetics bupivacaine, ropivacaine and levobupivacaine in combination with sufentanil in epidural anesthesia for labor and delivery: A meta-analysis. Curr Med Res Opin. 2014 Nov 1;30(11):2279–89.
- Wong CA. 23 – Epidural and Spinal Analgesia: Anesthesia for Labor and Vaginal Delivery [Internet]. Sixth Edit. Chestnut’s Obstetric Anesthesia. Elsevier Inc.; 2020. 474–539 p.
- Hess PE, Pratt SD, Oriol NE, Mayberry LJ, Clemmens D, De A, et al. Epidural analgesia side effects, co-interventions, and care of women during childbirth: A systematic review. Eur J Obstet Gynecol Reprod Biol. 1996;219(3):94–9.
- Palanisamy A, Van de Velde M, Mercier FJ, Vercueil A, Fernando R, Carvalho B, et al. International consensus statement on the management of hypotension with vasopressors during caesarean section under spinal anaesthesia. Anaesthesia. 2017;73(1):71–92.
- Kinsella SM, Black AMS. Reporting of “hypotension” after epidural analgesia during labour Effect of choice of arm and timing of baseline readings.
- Kubli M, Shennan AH, Seed PT, Sullivan GO. ORIGINAL ARTICLE A randomised controlled trial of fluid pre-loading before low dose epidural analgesia for labour. 2003;256–60.
- Zamora. haemodynamic consequences and uterine contractions following 0,5 or 1,0 litre crystalloid infuion before obstetric epidural.
- Kinsella SM. randomized study of intravenous fluid preload before epidural analgesia during labour.
- Cleary-Goldman J. Prophylactic Ephedrine and Combined Spinal. 2005;106(3):466–72.
- Preston R, Crosby ET, Elliott RD. Maternal positioning affects fetal heart rate changes after epidural analgesia for labour. 1993;1136–41.
- Beilin Y. Improved epidural anal- gesia in the parturient in the 30° tilt position. 2009;1176–81.
- Halpern SH, Carvalho B. Patient-controlled epidural analgesia for labor. Anesth Analg. 2009;108(3):921–8.
- Heesen M, Böhmer J, Klöhr S, Hofmann T, Rossaint R, Straube S. The effect of adding a background infusion to patient-controlled epidural labor analgesia on labor, maternal, and neonatal outcomes: A systematic review and meta-analysis. Anesth Analg. 2015;121(1):149–58.
- Bl S, Zeng Y, Nna DS, Wl L, Tt O, Fj S, et al. Automated mandatory bolus versus basal infusion for maintenance of epidural analgesia in labour ( Review ). Cochrane Database Syst Rev [Internet]. 2018;(5).
- George RB, Allen TK, Habib AS. Intermittent epidural bolus compared with continuous epidural infusions for labor analgesia: A systematic review and meta-analysis. Anesth Analg. 2013;116(1):133–44.
- Nunes J, Nunes S, Veiga M, Cortez M, Seifert I. A prospective, randomized, blinded-endpoint, controlled study – continuous epidural infusion versus programmed intermittent epidural bolus in labor analgesia. Brazilian J Anesthesiol (English Ed [Internet]. 2016;66(5):439–44.
- Onuoha OC. Epidural Analgesia for Labor: Continuous Infusion Versus Programmed Intermittent Bolus. Vol. 35, Anesthesiology Clinics. W.B. Saunders; 2017. p. 1–14.
- Xu J, Zhou J, Xiao H, Pan S, Liu J, Shang Y, et al. A Systematic Review and Meta-Analysis Comparing Programmed Intermittent Bolus and Continuous Infusion as the Background Infusion for Parturient-Controlled Epidural Analgesia. Sci Rep. 2019;9(1):1–11.
- Sng BL, Sia ATH. Maintenance of epidural labour analgesia: The old, the new and the future. Best Pract Res Clin Anaesthesiol [Internet]. 2017;31(1):15–22.
- Dyer RA, Reed AR, Van Dyk D, Arcache MJ, Hodges O, Lombard CJ, et al. Hemodynamic Effects of Ephedrine, Phenylephrine, and the Coadministration of Phenylephrine with Oxytocin during Spinal Anesthesia for Elective Cesarean Delivery [Internet]. Vol. 111, Anesthesiology. 2009.
- Sharpe EE, Arendt KW. Epidural Labor Analgesia and Maternal Fever. Clin Obstet Gynecol. 2017;60(2):365–74.
- Grant GJ. Adverse effects of neuraxial analgesia and anesthesia for obstetrics – UpToDate [Internet]. 2020 [cited 2020 May 29]. https://www.uptodate.com
- Segal S. Labor epidural analgesia and maternal fever. Anesth Analg. 2010;111(6):1467–75.
- Wilson MJ, Macarthur C, Shennan A. Urinary Catheterization in Labor With High-dose Versus Mobile Epidural Analgesia: A Randomized Controlled Trial. Obstet Anesth Dig. 2009;29(4):205–6.
- Mulder FEM, Hakvoort RA, Schoffelmeer MA, Limpens J, Van der Post JAM, Roovers JPWR. Postpartum urinary retention: a systematic review of adverse effects and management. Int Urogynecol J Pelvic Floor Dysfunct. 2014;25(12):1605–12.
- Sultan P, Murphy C, Halpern S, Carvalho B. The effect of low concentrations versus high concentrations of local anesthetics for labour analgesia on obstetric and anesthetic outcomes: A meta-analysis. Can J Anesth. 2013;60(9):840–54.
- Wang TT, Sun S, Huang SQ. Effects of epidural labor analgesia with low concentrations of local anesthetics on obstetric outcomes: A systematic review and meta-analysis of randomized controlled trials. Vol. 124, Anesthesia and Analgesia. Lippincott Williams and Wilkins; 2017. p. 1571–80.
- Stoddart AP, Nicholson KEA, Popham PA. Low dose bupivacaine/fentanyl epidural infusions in labour and mode of delivery. Vol. 49, Anaesthesia. 1994. p. 1087–90.
- Yang Zhang, Qing-Rong Qin L-TH. Motor blocks and operative deliveries with ropivacaine and fentanyl for labor epidural analgesia: A meta-analysis. J Obs Gynaecol Res Vol 44, No 12 2156–2165, December 2018. 2018;
- Ohel G, Gonen R, Vaida S, Barak S, Gaitini L. Early versus late initiation of epidural analgesia in labor: Does it increase the risk of cesarean section? A randomized trial. Am J Obstet Gynecol. 2006;194(3):600–5.
- Chestnut D. et al. Chestnut’s Obstetric Anesthesia: Principles and Practice 6th Edition. In: 6th ed. 2019. p. 518.
- Rosaeg OP. et al. Epidural analgesia does not prolong the third stage of labour. CAN J ANESTH 2002. 2002;49(5):490–2.
- Kapusta L et al. THE EFFECT OF EPIDURAL ANALGESIA ON MATERNAL THERMOREGULATION IN LABOR. Int Fed Gynaecol Obstet. 1985;23:185–9.
- Mullington CJ, Low DA, Strutton PH, Malhotra S. A mechanistic study of the tremor associated with epidural anaesthesia for intrapartum caesarean delivery. Int J Obstet Anesth. 2020;
- Sessler DI. Temperature monitoring and perioperative thermoregulation. Vol. 109, Anesthesiology. Lippincott Williams and Wilkins; 2008. p. 318–38.
- Sng BL, Leong WL, Zeng Y, Siddiqui FJ, Assam PN, Lim Y, et al. Early versus late initiation of epidural analgesia for labour. Vol. 2014, Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd; 2014.
- Kvisselgaard AD, Krøigaard M, Mosbech HF, Garvey LH. No cases of perioperative allergy to local anaesthetics in the Danish Anaesthesia Allergy Centre. Acta Anaesthesiol Scand. 2017 Feb 1;61(2):149–55.
- Trautmann A, Goebeler M, Stoevesandt J. Twenty Years’ Experience with Anaphylaxis-Like Reactions to Local Anesthetics: Genuine Allergy is Rare. J Allergy Clin Immunol Pract. 2018 Nov 1;6(6):2051-2058.e1.
- Heesen M et al. Can the incidence of accidental dural puncture in laboring woman be reduced? MINERVA Anestesiol. 2013;
- Choi PT et al. PDPH is a common complication of neuraxial blockade in parturients: a meta-analysis of obstetrical studies. Can J Anaesth. 2003;May;50(5):460-9.
- Sprigge JS, Harper SJ. Accidental dural puncture and post dural puncture headache in obstetric anaesthesia: Presentation and management: A 23-year survey in a district general hospital. Anaesthesia. 2008 Jan;63(1):36–43.
- STRIDE PC, COOPER GM. Dural taps revisited. Anaesthesia [Internet]. 1993 Mar [cited 2020 Sep 15];48(3):247–55.
- Cook TM, Counsell D, Wildsmith JAW. Major complications of central neuraxial block: Report on the Third National Audit Project of the Royal College of Anaesthetists. Br J Anaesth. 2009;102(2):179–90.
- D’Angelo R, Smiley RM, Riley ET, Segal S. Serious complications related to obstetric anesthesia: The serious complication repository project of the society for obstetric Anesthesia and Perinatology. Anesthesiology. 2014;120(6):1505–12.
- Ruppen W, Derry S, McQuay H, Moore RA. Incidence of epidural hematoma, infection, and neurologic injury in obstetric patients with epidural analgesia/anesthesia. Anesthesiology. 2006;105(2):394–9.
- Von Peltz C, Bennett A, Patil V. Central neurological complications following obstetric neuraxial blockade. Curr Opin Anaesthesiol. 2019;32(3):315–24.
- Crawford et al. Some maternal complications of epidural analgesia for labour. Anaesth . 1985;
- Jenkins JG. Some immediate serious complications of obstetric epidural analgesia and anaesthesia: A prospective study of 145 550 epidurals. Int J Obstet Anesth. 2005 Jan;14(1):37–42.
- Paech MJ, Godkin R, Webster S. Complications of obstetric epidural analgesia and anaesthesia: a prospective analysis of 10 995 cases. Vol. 7, International Journal of Obstetric Anesthesia. 1998.
- Hoftman N. Unintentional Subdural Injection: A Complication of Neuraxial Anesthesia/Analgesia. Vol. 29, Anesthesiology Clinics. 2011. p. 279–90.
- Hawkins et al. Anesthesia Related Maternal Mortality in the United States: 1979-2002. Obs Gynecol. 2011;
- Reynolds F. Neurological Infections After Neuraxial Anesthesia. Vol. 26, Anesthesiology Clinics. 2008. p. 23–52.
- Wong CA, Scavone BM, Dugan S, Smith JC, Prather H, Ganchiff JN, et al. Incidence of postpartum lumbosacral spine and lower extremity nerve injuries. Obstet Gynecol. 2003;101(2):279–88.
- NAP3: Major Complications of Central Neuraxial Block in the United Kingdom – The National Institute of Academic Anaesthesia [Internet]. [cited 2020 Jun 16]. Available from: https://www.niaa.org.uk/NAP3_home?newsid=464#pt
- Pan PH, Bogard TD, Owen MD. Incidence and characteristics of failures in obstetric neuraxial analgesia and anesthesia: A retrospective analysis of 19,259 deliveries. Int J Obstet Anesth. 2004 Oct;13(4):227–33.
- Gambling D, Berkowitz J, Farrell TR, Pue A, Shay D. A randomized controlled comparison of epidural analgesia and combined spinal-epidural analgesia in a private practice setting: Pain scores during first and second stages of labor and at delivery. Anesth Analg. 2013 May;116(3):636–43.
- Booth JM, Pan JC, Ross VH, Russell GB, Harris LC, Pan PH. Combined spinal epidural technique for labor analgesia does not delay recognition of epidural catheter failures. Anesthesiology. 2016 Sep 1;125(3):516–24.
- Lee AI, McCarthy RJ, Toledo P, Jones MJ, White N, Wong CA. Epidural Labor Analgesia – Fentanyl Dose and Breastfeeding Success: A Randomized Clinical Trial. Anesthesiology. 2017 Oct 1;127(4):614–24.
- DASAIMs Obstetrisk Udvalg. Anæstesi til kejsersnit – Klinisk vejledning. http://www.dasaim.dk. www.DASAIM.dk; 2019.
- Mhyre JM, Khan FA. Anesthesia for the patient with peripartum hemorrhage. www.uptodate.com. 2018. p. 1–33.
- Russell R. The Difficult Airway: Risk, Assessment, Prophylaxis, and Management. In: Chestnut’s Obstetric Anesthesia: principles and practice [Internet]. Sixth Edit. Elsevier Inc.; 2019. p. 692–723.
- Driessen M, Bouvier-Colle MH, Dupont C, Khoshnood B, Rudigoz RC, Deneux-Tharaux C. Postpartum hemorrhage resulting from uterine atony after vaginal delivery: Factors associated with severity. Obstet Gynecol. 2011;117(1):21–31.
- Adams L, Menon R. Anaesthetic protocol for manual removal of placenta. Anaesthesia. 2013;68(1):104–5.
- Arendt K, Segal S. Why Epidurals Do Not Always Work. Rev Obstet Gynecol. 2008;1(2):49–55.
- Tsen LC, Bateman BT. Anesthesia for cesarean delivery. In: Chestnut’s Obstetric Anesthesia: principles and practice [Internet]. Sixth Edit. Elsevier Inc.; 2019. p. 568–626.
- Epidural analgesia for labour [Internet]. Frimley Health NHS. 2018.
- Francis J. Trust Guideline for the Management of Epidural Analgesia in Labour. Norfolk and Norwich University Hospitals NHS. 2018.
- Meldrum D. Regional analgesia in labour. West Suffolk NHS. 2017.
- Kingsley C, McGlennan A, Brown J, Abir G. The Labour Epidural: Troubleshooting [Internet]. 2017 [cited 2020 Jun 14].
- Hermanides J, Hollmann MW, Stevens MF, Lirk P. Failed epidural: Causes and management. Br J Anaesth [Internet]. 2012;109(2):144–54.
- DSOG. Medicinsk smertelindring under fødslen [Internet]. www.dsog.dk. 2020.
- Abouleish A, Abouleish E, Camann W. Combined spinal-epidural analgesia in advanced labour. Can J Anaesth. 1994;41(7):575–8.
- Hein A, Rösblad P, Norman M, Ryniak S, Tingåker B, Jakobsson J, et al. Addition of low-dose morphine to intrathecal bupivacaine/sufentanil labour analgesia: A randomised controlled study. Int J Obstet Anesth. 2010 Oct;19(4):384–9.
- Campbell DC, Camann WR, Datta S. The Addition of Bupivacaine to Intrathecal Sufentanil for Labor Analgesia [Internet].
- Cheng C J-C, Loke GP, Bs MB, Ming H, Mb T, Mmed BS. Either sufentanil or fentanyl, in addition to intrathecal bupivacaine, provide satisfactory early labour analgesia. Obstet Pediatr Anesth. 2001;570–4.
- Eriksson SL, Blomberg I, Olofsson C. Single-shot intrathecal sufentanil with bupivacaine in late labour – Analgesic quality and obstetric outcome. Eur J Obstet Gynecol Reprod Biol. 2003;110(2):131–5.
- Viscomi CM, Rathmell JP, Pace NL. Duration of lntrathecal Labor Analgesia: Early Versus Advanced Labor [Internet]. 1997.
- Sharpe EE, Kim GY, Vinzant NJ, Arendt KW, Hanson AC, Martin DP, et al. Need for additional anesthesia after single injection spinal analgesia for labor: a retrospective cohort study. Int J Obstet Anesth. 2019 Nov 1;40:45–51.
- Hess P. Small Dose Bupivacaine Fentanyl Spinal Analgesia combined with morphine for labor. Anest Analg. 2003;
- Anabah T, Olufolabi A, Boyd J, George R. Low-dose spinal anaesthesia provides effective labour analgesia and does not limit ambulation. South African J Anaesth Analg. 2015;21(1):27–30.
- Viitanen H, Viitanen M, Heikkilä M. Single-shot spinal block for labour analgesia in multiparous parturients. In: Acta Anaesthesiologica Scandinavica. 2005. p. 1023–9.
- Palmer CM, Maren G Van, Nogami WM, Alves D. Bupivacaine augments intrathecal fentanyl for labor analgesia. Anesthesiology. 1999;(1):0–5.
- Sia ATH, Chiu JW. Combination of Intrathecal Sufentanil 10 g Plus Bupivacaine 2.5 mg for Labor Analgesia: Is Half the Dose Enough? Anest Analg. 1999;362–6.
- Teoh WHL. Hyperbaric Bupivacaine 2,5 mg Prolongs Analgesia compared with plain bupivacaine when added to intrathecal fentanyl 25 mikrog in advanced labor. Anesth Analg. 2003;97.
- Levin A, Datta S, Camann WR. lntrathecal Ropivacaine for labor Analgesia: A Comparison with Bupivacaine [Internet].
- Ortner CM, Posch M, Roessler B, Faybik P, RÜtzler K, Grabovica J, et al. On the ropivacaine-reducing effect of low-dose sufentanil in intrathecal labor analgesia. Acta Anaesthesiol Scand. 2010 Sep;54(8):1000–6.
- Soni AK, Miller CG, Pratt SD, Hess PE, Oriol NE, Sarna MC. Low dose intrathecal ropivacaine with or without sufentanil provides effective analgesia and does not impair motor strength during labour: A pilot study. Can J Anesth. 2001;48(7):677–80.
- Anabah T, Olufolabi A, Boyd J, George R. Low-dose spinal anaesthesia provides effective labour analgesia and does not limit ambulation. South African J Anaesth Analg [Internet]. 2015;21(1):27–30.
- Paech M. Newer techniques of labor analgesia. Anesthesiol Clin North America. 2003;21(1):1–17.
- Rawal N, Holmström B. The combined spinal-epidural technique. Best Pract Res Clin Anaesthesiol. 2003;17(3):347–64.
- Mardirosoff C, Dumont L, Boulvain M, Tramèr MR. Fetal bradycardia due to intrathecal opioids for labour analgesia: A systematic review. BJOG An Int J Obstet Gynaecol. 2002;109(3):274–81.
- Chau A, Tsen LC. Update on Modalities and Techniques for Labor Epidural Analgesia and Anesthesia. Vol. 36, Advances in Anesthesia. Academic Press Inc.; 2018. p. 139–62.
- Collis RE, Davies DWL, Aveling W. Randomised comparison of combined spinal-epidural and standard epidural analgesia in labour. Lancet. 1995;345(8962):1413–6.
- COMET. Randomized controlled trial comparing traditional with two “mobile” epidural techniques: Anesthetic and analgesic efficacy. Anesthesiology. 2002;97(6):1567–75.
- Nickells JS. Speed of onset of regional analgesia in labour: A comparison of the epidural and spinal routes. Anaesthesia. 2000;55(5):489–518.
- Velde M Van De. Prospective, randomized comparison of epidural and combined spinal epidural analgesia during labor. Acta Anaesthesiol Belg.siol. 1999;50(129–36).
- Heesen M, Van De Velde M, Klöhr S, Lehberger J, Rossaint R, Straube S. Meta-analysis of the success of block following combined spinal-epidural vs epidural analgesia during labour. Vol. 69, Anaesthesia. 2014. p. 64–71.
- Niesen AD. Combined Spinal-Epidural Versus Epidural Analgesia for Labor and Delivery. clin perinatol. 2013;sept(40(3)):373–84.
- Hess PE, Pratt SD, Lucas TP, Miller CG, Corbett T, Oriol N, et al. Predictors of breakthrough pain during labor epidural analgesia. Anesth Analg. 2001;93(2):414–8.
- Hepner DL. Comparison of combined spinal-epidural and low dose epidural for labour analgesia. Can J Anaesth. 2000;47(3):232–6.
- Shennan AH. Effect of low-dose mobile versus traditional epidural techniques on mode of delivery: A randomised controlled trial. Vol. 358, Lancet. 2001.
- Norris M. Are Combined Spinal-Epidural Catheters Reliable? Int J Obs Anesth. 2000;jan(9(1)):3–6.
- Norris MC, Fogel ST, Conway-Long C. Combined spinal-epidural versus epidural labor analgesia. Anesthesiology. 2001;95(4):913–20.
- Grondin LS, Nelson K, Ross V, Aponte O, Lee S, Pan PH. Success of Spinal and Epidural Labor Analgesia. Anesthesiology. 2009;111(1):165–72.
- Simmons SW, Taghizadeh N, Dennis AT, Hughes D, Cyna AM. Combined spinal-epidural versus epidural analgesia in labour. Cochrane Database Syst Rev. 2012 Oct 17;
- Bernard JM, Le Roux D, Barthe A, Jourdain O, Vizquel L, Michel C. The dose-range effects of sufentanil added to 0.125% bupivacaine on the quality of patient-controlled epidural analgesia during labor. Anesth Analg. 2001;92(1):184–8.
- Camann W. Intrathecal sufetanil for labor analgesia. Anesthesiology. 1993;78:870–4.
- Scavone BM. Altered Level of Consciousness after Combined Spinal-Epidural Labor Analgesia with Intrathecal Fentanyl and Bupivacaine. Anesthesiology. 2002;96(4):1021–2.
- Fragneto RY, Fisher A. Mental status change and aphasia after labor analgesia with intrathecal sufentanil/bupivacaine. Anesth Analg. 2000;90(5):1175–6.
- Currier D. Dysphagia with intrathecal fentanyl. Anesthesiology. 1997;87:1570–1.
- Hamilton C. Hign sensory block after intrathecal sufenanil for labor analgesia. Anesthesiology. 1995;83:1118–21.
- Kuczkowski K. Transient Aphonia and Aphagia in a Parturient After Induction of Combined Spinal-Epidural Labor Analgesia With Subarachnoid Fentanyl and Bupivacaine. Acta Anaesthesiol Belg. 2003;54(2):165–6.
- Ahmad F. Foot Drop After Spinal Anesthesia in a Patient With a Low-Lying Cord. Int J Obs Anesth. 2006;15(3):233–6.
- Van de Velde M. Post Dural Puncture Headache Following Combined Spinal Epidural or Epidural Anaesthesia in Obstetric Patients. AnaesthIntensive Care. 2001;29:595–9.
- Suzuki N, Koganemaru M, Onizuka S, Takasaki M. Dural puncture with a 26-gauge spinal needle affects epidural anesthesia. Reg Anesth. 1995;20(2):118.
- Layera S, Bravo D, Aliste J, Tran DQ. A systematic review of DURAL puncture epidural analgesia for labor. Vol. 53, Journal of Clinical Anesthesia. Elsevier Inc.; 2019. p. 5–10.
- Heesen M. Dural puncture epidural versus conventional epidural block for labor analgesia: a systematic review of randomized controlled trials. Int J Obs Anesth. 2019;Nov(40):24–31.
- Chau A, Bibbo C, Huang CC, Elterman KG, Cappiello EC, Robinson JN, et al. Dural puncture epidural technique improves labor analgesia quality with fewer side effects compared with epidural and combined spinal epidural techniques: A randomized clinical trial. In: Anesthesia and Analgesia. Lippincott Williams and Wilkins; 2017. p. 560–9.
- Bernards CM, Kopacz DJ, Michel MZ. Effect of Needle Puncture on Morphine and Lidocaine Flux through the Spinal Meninges of the Monkey In Vitro. Anesthesiology [Internet]. 1994 Apr;80(4):853–8.
- Van De Velde M, Carvalho B. Remifentanil for labor analgesia: An evidence-based narrative review. Vol. 25, International Journal of Obstetric Anesthesia. Churchill Livingstone; 2016. p. 66–74.
- Weibel S, Jelting Y, Afshari A, Pace NL, Eberhart LHJ, Jokinen J, et al. Patient-controlled analgesia with remifentanil versus alternative parenteral methods for pain management in labour. Vol. 2017, Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd; 2017.
- Logtenberg SLM, Oude Rengerink K, Verhoeven CJ, Freeman LM, van den Akker ESA, Godfried MB, et al. Labour pain with remifentanil patient-controlled analgesia versus epidural analgesia: a randomised equivalence trial. BJOG An Int J Obstet Gynaecol. 2017 Mar 1;124(4):652–60.
- Messmer AA, Potts JM, Orlikowski CE. A prospective observational study of maternal oxygenation during remifentanil patient-controlled analgesia use in labour. Anaesthesia. 2016 Feb 1;71(2):171–6.
- Leong WL, Sng BL, Zhang Q, Han NLR, Sultana R, Sia ATH. A case series of vital signs-controlled, patient-assisted intravenous analgesia (VPIA) using remifentanil for labour and delivery. Anaesthesia. 2017 Jul 1;72(7):845–52.
- Tveit TO, Halvorsen A, Seiler S, Rosland JH. Efficacy and side effects of intravenous remifentanil patient-controlled analgesia used in a stepwise approach for labour: An observational study. Int J Obstet Anesth. 2013 Jan;22(1):19–25.
- Freeman LM, Bloemenkamp KW, Franssen MT, Papatsonis DN, Hajenius PJ, van Huizen ME, et al. Remifentanil patient controlled analgesia versus epidural analgesia in labour. A multicentre randomized controlled trial [Internet]. 2012.
- Stocki D, Matot I, Einav S, Eventov-Friedman S, Ginosar Y, Weiniger CF. A randomized controlled trial of the efficacy and respiratory effects of patient-controlled intravenous remifentanil analgesia and patient-controlled epidural analgesia in laboring women. Anesth Analg. 2014;118(3):589–97.
- Engelen S. remifentanil PCIA during labor and delivery ca we improve maternal monitoring. Acta Anaesthesiol Belg. 2016;67.
- Freeman LM, Bloemenkamp KW, Franssen MT, Papatsonis DN, Hajenius PJ, Hollmann MW, et al. Patient controlled analgesia with remifentanil versus epidural analgesia in labour: Randomised multicentre equivalence trial. BMJ. 2015 Feb 23;350.
- Marwah R, Hassan S, Carvalho JCA, Balki M. Remifentanil versus fentanyl for intravenous patient-controlled labour analgesia: An observational study. Can J Anesth. 2012 Mar;59(3):246–54.
- Messmer AID. nasal capnography during remifentanil patient-controlled analgesia in labour. Int J Obs Anesth. 2017;
- Douma MR, Verwey RA, Kam-Endtz CE, Van Der Linden PD, Stienstra R. Obstetric analgesia: A comparison of patient-controlled meperidine, remifentanil, and fentanyl in labour. Br J Anaesth. 2010;104(2):209–15.
- Phillips SN, Fernando R, Girard T. Parenteral opioid analgesia: Does it still have a role? Vol. 31, Best Practice and Research: Clinical Anaesthesiology. Bailliere Tindall Ltd; 2017. p. 3–14.
- Aaronson J, Abramovitz S, Smiley R, Tangel V, Landau R. A survey of intravenous remifentanil use for labor analgesia at academic medical centers in the United States. Vol. 124, Anesthesia and Analgesia. Lippincott Williams and Wilkins; 2017. p. 1208–10.
- Morley-Foster PK. Neonatal effects of patient-controlled in labor analgesia using fentanyl. Int J Obs Anesth. 1998;
- Camann WR. A COMPARISON OF INTRATHECAL, EPIDURAL AND INTRAVENOUS SUFENTANIL FOR LABOR ANALGESIA. Anesthesiology. 1992;77.
- Ravn A, Lyckhage LF, Jensen R. Postdural punkturhovedpine. Ugeskr Laeger [Internet]. 2018 [cited 2019 Mar 31];180:2–5.
- Figuls RM, Cosp Arevalo-RodriguezI BX, FigulsM R, CospX B, Arevalo-Rodriguez I, Ciapponi A, et al. Cochrane Library Cochrane Database of Systematic Reviews Posture and fluids for preventing post-dural puncture headache (Review) Cochrane Database of Systematic Reviews Posture and fluids for preventing post-dural puncture headache A B S T R A C T Background. 2019 [cited 2020 Aug 13];
- Russell R, Laxton C, Lucas DN, Niewiarowski J, Scrutton M, Stocks G. Treatment of obstetric post-dural puncture headache. Part 1: conservative and pharmacological management. Int J Obstet Anesth [Internet]. 2019 [cited 2019 Mar 3];
- Bezov D, Ashina S, Lipton R. Post-dural puncture headache: Part II – Prevention, management, and prognosis. Headache. 2010;50(9):1482–98.
- Bezov D, Lipton RB, Ashina S. Post-dural puncture headache: Part I – Diagnosis, epidemiology, etiology, and pathophysiology. Headache. 2010;50:1144–52.
- Headache Classification Committee of the International Headache Society (IHS) The International Classification of Headache Disorders, 3rd edition. Cephalalgia [Internet]. 2018 [cited 2019 Mar 31];38(1):1–211.
- Chin KJ, Karmakar MK, Peng P. Ultrasonography of the adult thoracic and lumbar spine for central neuraxial blockade. Anesthesiology [Internet]. 2011 Jun [cited 2016 Jan 11];114(6):1459–85.
- Perlas A, Chaparro LE, Chin KJ. Lumbar neuraxial ultrasound for spinal and epidural anesthesia: A systematic review and meta-analysis. Reg Anesth Pain Med [Internet]. 2016 Jan [cited 2016 Feb 24];41(2):251–60.
- Agerson AN, Scavone BM. Prophylactic epidural blood patch after unintentional dural puncture for the prevention of postdural puncture headache in parturients. AnesthAnalg [Internet]. 2012 Jul [cited 2019 Mar 27];115(1):133–6.
- Heesen M, Klohr S, Rossaint R, Walters M, Straube S, Van V de, et al. Insertion of an intrathecal catheter following accidental dural puncture: a meta-analysis. IntJObstetAnesth [Internet]. 2013 Jan [cited 2019 Mar 27];22(1):26–30.
- Jagannathan D, Arriaga A, Elterman K, Kodali B, Robinson J, Tsen L, et al. Effect of neuraxial technique after inadvertent dural puncture on obstetric outcomes and anesthetic complications. Int J Obstet Anesth [Internet]. 2016 [cited 2019 Mar 27];25:23–9.
- Al-metwalli RR. Epidural morphine injections for prevention of post dural puncture headache. Anaesthesia [Internet]. 2008 Aug [cited 2020 Aug 13];63(8):847–50.
- Hakim SM. Cosyntropin for prophylaxis against postdural puncture headache after accidental dural puncture. Anesthesiology [Internet]. 2010 Aug [cited 2019 Mar 27];113(2):413–20.
- Gaiser RR. Postdural puncture headache: a headache for the patient and a headache for the anesthesiologist. CurrOpinAnaesthesiol [Internet]. 2013 Jun [cited 2019 Mar 27];26(3):296–303.
- Halker RB, Demaerschalk BM, Wellik KE, Wingerchuk DM, Rubin DI, Crum BA, et al. Caffeine for the prevention and treatment of postdural puncture headache: debunking the myth. Neurologist. 2007 Sep;13(5):323–7.
- Mahmoud AAA, Mansour AZ, Yassin HM, Hussein HA, Kamal AM, Elayashy M, et al. Addition of neostigmine and atropine to conventional management of postdural puncture headache: A randomized controlled trial. Anesth Analg. 2018;127(6):1434–9.
- Sandesc D, Lupei MI, Sirbu C, Plavat C, Bedreag O, Vernic C. Conventional treatment or epidural blood patch for the treatment of different etiologies of post dural puncture headache. Acta Anaesthesiol Belg [Internet]. 2005 [cited 2019 Mar 27];56(3):265–9.
- Seebacher J, Ribeiro V, LeGuillou JL, Lacomblez L, Henry M, Thorman F, et al. Epidural blood patch in the treatment of post dural puncture headache: a double blind study. Headache [Internet]. 1989 Nov [cited 2019 Mar 27];29(10):630–2.
- van KF, Oedit R, Bakker SLM, Dippel DWJ, van Kooten F, Oedit R, et al. Epidural blood patch in post dural puncture headache: a randomised, observer-blind, controlled clinical trial. JNeurolNeurosurgPsychiatry [Internet]. 2008 May [cited 2019 Mar 27];79(5):553–8.
- Kokki M, Sjövall S, Keinänen M, Kokki H, Sjovall S, Keinanen M, et al. The influence of timing on the effectiveness of epidural blood patches in parturients. IntJObstetAnesth [Internet]. 2013 Nov [cited 2019 Mar 27];22(4):303–9.
- Beards SC, Jackson A, Griffiths AG, Horsman EL. Magnetic resonance imaging of extradural blood patches: appearances from 30 min to 18 h. BrJAnaesth [Internet]. 1993 Aug [cited 2019 Mar 27];71(2):182–8.
- Vakharia SB, Thomas PS, Rosenbaum AE, Wasenko JJ, Fellows DG. Magnetic resonance imaging of cerebrospinal fluid leak and tamponade effect of blood patch in postdural puncture headache. AnesthAnalg [Internet]. 1997 Mar [cited 2019 Mar 27];84(3):585–90.
- Russell R, Laxton C, Lucas DN, Niewiarowski J, Scrutton M, Stocks G. Treatment of obstetric post-dural puncture headache. Part 2: epidural blood patch. Int J Obstet Anesth [Internet]. 2019 Dec 22 [cited 2019 Mar 3].
- Martin R, Jourdain S, Clairoux M, Tetrault JP, Tétrault J. Duration of decubitus position after epidural blood patch. CanJAnaesth [Internet]. 1994 Jan [cited 2019 Mar 27];41(1):23–5.
- Afolabi BB, Lesi AFE, N. A. Merah. Regional versus general anaesthesia for caesarean section ( Review ). Cochrane Review. 2010.
- Diaz JH, Weed JT. Correlation of adverse neurological outcomes with increasing volumes and delayed administration of autologous epidural blood patches for postdural puncture headaches. Pain Pract [Internet]. 2005 [cited 2019 Mar 27];5(3):216–22.
- Seit Jespersen M, Jaeger PT, Aegidius KL, Meyhoff CS. Ganglion sphenopalatinum-blokade mod postdural hovedpine.
- Chambers DJ, Howells AC. Neurological complications in obstetric regional anaesthesia. 2016.
- Wong CA. Neurologic deficits and labor analgesia. Vol. 29, Regional Anesthesia and Pain Medicine. No longer published by Elsevier; 2004. p. 341–51.
