VEJLEDNING OM TRANFUSIONSMEDICINSK BEHANDLING OG MONITORERING AF BLØDENDE PATIENTER
BAGGRUNDSNOTAT
VERSION 3.0 (ENDELIG), FEBRUAR 2019.

Notatet er udarbejdet af Transfusionsmedicinsk Udvalg, DSKI, med repræsentanter fra blodbankerne i alle regioner:
Region Hovedstaden
Mikkel Gybel-Brask, Sisse R. Ostrowski, Pär I. Johansson, Jakob Stensballe,
Region Midtjylland
Trine-Line W. Korsholm, Sys Hasslund
Region Nordjylland
John Bæch, Thure M. Haunstrup, Kaspar R. Nielsen
Region Sjælland
Keld M. Homburg
Region Syddanmark
Kjell E. Titlestad, Mie Topholm Bruun
Behandlingsvejledningen har været i høring hos relevante lægevidenskabelige selskaber. Følgende faglige selskaber og deres repræsentanter har kommenteret på vejledningen og derigennem bidraget konstruktivt til den endelige version.
Dansk Kirurgisk Selskab v/ Jens Hillingsø
Dansk Thoraxkirurgisk Selskab v/ Mariann Tang & Boris Kanykhin
Dansk Ortopædisk Selskab v/ Bjarke Viberg
Dansk Selskab for Anæstesi og Intensiv Medicin v/ Lars Møller & Joachim Hoffmann-Petersen
DEFINITIONER: BLODPRODUKTER OG HÆMOSTATISKE LÆGEMIDLER
Denne vejledning beskriver behandling med blodprodukter og hæmostatiske lægemidler hos blødende patienter, hvorimod patienter med anæmi og kroniske mangeltilstande uden blødning ikke beskrives her.
Følgende blodprodukter og hæmostatiske lægemidler anvendes i behandlingen af patienter med blødning:
- Erytrocytsuspension (ES) indeholder cirka 200 ml røde blodlegemer opbevaret i 100 ml saltvand-adenin- glukose-mannitol (SAGM) samt 5-10 ml Hæmatokrit på cirka 60 %.
- Plasma består af 200-300 ml plasma, der indeholder samtlige koagulationsfaktorer og er stabiliseret med citrat-phosphat-dextrose. Kan være friskfrosset plasma (FFP) eller flydende plasma (aldrig frosset).
- Trombocytkoncentrat (TK) indeholder 200-300 mia. trombocytter, der enten er A) En pool af trombocytter fra flere bloddonorer eller B) Et afereseprodukt fra én bloddonor.
- Cryopræcipitatpool (80-120 ml) fremstilles ud fra 4 portioner donorplasma og indeholder enkelte koagulationsfaktorer i høj koncentration, især: Fibrinogen, von Willebrandfaktor, Faktor VIII, faktor XIII og
- Frysetørret plasma (Lyoplas®) er frysetørret, lyophiliseret plasma i pulverform til opblanding med 200 ml sterilt Svarer til og anvendes som FFP.
- OctaplasLG® er humant donorplasmapool, der er virusinaktiveret. Indikationer og anvendelse som for FFP. Findes i 200 portioner og gives blodtypespecifikt.
- Tranexamsyre er et antifibrinolytisk lægemiddel, der inhiberer plasminaktivering og er indiceret ved de fleste kirurgiske procedurer (ortopæd-, hjerte-, kar- og leverkirurgi m.v.), svære traumer, post-partum blødning samt andre tilstande med mistænkt/påviselig øget fibrinolytisk aktivitet og blødning.
- Protrombinkomplekskoncentrat (PCC: Octaplex®, Confidex®) indeholder koagulationsfaktorerne II, VII, IX, X, protein C og S samt heparin. Registreret og godkendt til brug i patienter med mangel på K-vitamin- afhængige koagulationsfaktorer som følge af vitamin K-antagonist
- Fibrinogenkoncentrat (RiaStap®, Fibclot®) indeholder human fibrinogen, og er indiceret ved hypofibrinogenæmi (kongenit eller erhvervet).
- Protaminsulfat reverterer effekten af hepariner og gives, når akut revertering af antikoagulation – der skyldes ufraktioneret og lavmolekylært heparin – ønskes.
- rFVIIa (NovoSeven®) er et lægemiddel, der forbedrer trombingenereringen på trombocytterne. Behandling med rFVIIa kan overvejes ved livstruende blødninger, der ikke responderer på maksimal kirurgi og transfusionsterapi. Er registreret og godkendt til behandling og forebyggelse af blødning hos patienter med hæmofili.
- Idarucizumab (Praxbind®) er et humaniseret monoklonalt antistoffragment (Fab) som bindes til dabigatran og dets metabolitter og herved neutraliserer den antikoagulante virkning. Registreret og godkendt til brug i patienter med livstruende blødning under dabigatranbehandling.
- Desmopressin (Octostim®) er en syntetisk fremstillet vasopressinanalog, de er registreret og godkendt til behandling af hæmofili A og von Willebrands sygdom type Øger frisætningen af vWF fra endothelcellerne.
FORMÅL
Formålet med denne vejledning er at give opdaterede retningslinjer for transfusionsmedicinsk behandling med blodprodukter, monitorering af blødende patienter og brug af hæmostatiske lægemidler. Det overordnede mål er at sikre optimal og rationel anvendelse af blodprodukter, samt at nedsætte mortalitet og morbiditet som følge af koagulopatisk blødning.
INTRODUKTION OG BAGGRUND
Nærværende vejledning består af et baggrundsnotat og en behandlingsvejledning. Den er udarbejdet af Transfusionsmedicinsk Udvalg under Dansk Selskab for Klinisk Immunologi (DSKI), Blodbankernes videnskabelige selskab. Vejledningen tager udgangspunkt i Sundhedsstyrelsens Vejledning om Blodtransfusion 20151 samt Sundhedsstyrelsens Nationale kliniske retningslinje (NKR) om indikation for transfusion med blodkomponenter 20142 og 20183 og er opdateret i henhold til den nyeste viden og evidens.
Siden 2007 har transfusionspraksis ændret sig i Danmark såvel som internationalt. I Danmark er forbruget af ES faldet fra 348.000 i 2007 til 205.664 per år i 20164. Sammenlignet med andre europæiske lande er ES forbruget i Danmark dog stadig højt5. Sundhedsstyrelsens vejledninger fra 2014, 2015 og 2018 anbefaler en generel restriktiv transfusionspolitik, i særdeleshed for ES, men samtidig tidlig balanceret blodkomponentterapi med anvendelse af FFP og TK til den mindre gruppe af patienter med livstruende blødning. Det er endvidere specifikt skærpet i Sundhedsstyrelsens vejledninger fra 2015 og 2018 at balanceret blodkomponentterapi skal kunne leveres inden for 15 min til patienter med livstruende blødning – uanset hvor i landet disse befinder sig. Sundhedsstyrelsen anbefaler tillige brugen af viskoelastisk hæmostasemonitorering til blødende patienter for at optimere outcome og minimere antallet af unødvendige transfusioner.
Der er siden foregående version af nærværende baggrundsnotat fra 2014 blevet publiceret vigtige videnskabelige studier med fokus på restriktiv anvendelse af ES og på monitorering af hæmostase hos patienter med blødning.
TRANSFUSION MED ERYTROCYTSUSPENSION
I 2014 publicerede Holst et al.6 resultater fra et randomiseret multicenter studie (TRISS, Transfusion In Septic Shock) af septisk shock patienter, der viser at restriktiv transfusion af ES under intensiv indlæggelse (hæmoglobin (Hb) < 4.3 mmol/l) er lige så godt, bedømt på overlevelse, antal iskæmiske events samt intensiv organstøtte, som liberal transfusion (Hb < 5.6 mmol/l) under intensiv indlæggelse. Det skal bemærkes, at randomiseringen i studiet af Holst et al. blev opretholdt, også under kirurgi.
Resultater fra FOCUS studiet7, der er et randomiseret studie af ældre patienter med kardiovaskulær sygdom (40% med iskæmisk hjertesygdom, 20% med hjertesvigt, 25% med tidl. apoplexi/TCI) i hæmodynamisk stabil fase efter operation for hoftefraktur, viser ligeledes, at restriktiv transfusion med ES (Hb < 4,8 mmol/l) er lige så godt bedømt på overlevelse, sikkerhed og funktion (gangdistance) som liberal transfusion (Hb < 6,0 mmol/l).
I et randomiseret studie på 921 patienter med akut øvre gastrointestinal blødning8 (pga. ulcus 49% eller øsofagusvaricer 21%, 31% havde cirrhose), påvises det at restriktiv transfusion med ES (Hb < 4,3 mmol/l) reducerer transfusionsbehovet og øger 45-dages overlevelse sammenlignet med liberal transfusionsstrategi (Hb < 5,6 mmol/l), når disse strategier appliceres fra den tidligste blødningsfase. Dette er endvidere bekræftet i et Cochrane-review om transfusion med ES fra 31 randomiserede studier af 12.587 patienter9 samt i en tilsvarende meta-analyse af 31 studier og 9813 patienter10.
Disse studier har givet anledning til revision af transfusionsvejledninger bl.a. fra de amerikanske blodbanker, AABB11, som overordnet anbefaler en mere restriktiv transfusionspolitik end tidligere, og fra Sundhedsstyrelsen, der i sin seneste retningslinje fra 20183 bekræfter ovenstående med en opdateret metaanalyse og afgiver en stærk anbefaling for en restriktiv transfusionsstrategi med en transfusionstrigger på <4,3 mmol/l til kredsløbsstabile patienter uden hjertesygdom med anæmi.
Kredsløbsstabilitet skal forstås som stabil puls og stabilt blodtryk, dvs. fravær af tegn på kredsløbsinstabilitet – takykardi (puls >100 bpm), hypotension (SBT <100 mmHg) eller organpåvirkning, eller hvor disse tegn med større sandsynlighed kan forklares af andre faktorer (f.eks. smerter, medicin eller dehydratio). Dette gælder også akutte præ-operative patienter.
I et randomiseret studie fra 2015 (TITRe2, Transfusion Indication Threshold Reduction studie)12 af 2003 elektive hjertekirurgiske patienter fandtes, at restriktiv (Hb < 4.7 mmol/l) og liberal (Hb < 5.6 mmol/l) transfusion med ES var associeret med sammenlignelig forekomst af det primære effektmål (alvorlig infektion, iskæmisk event af hjerte, hjerne, tarm og nyre opgjort 3 mdr. efter operation) og ligeledes ingen øget forekomst af postoperative komplikationer i samme periode. Der fandtes ingen forskel i 30-dages mortalitet (2,6% vs. 1,9%, p=0.2959) men en uventet forskel i 90-dages mortalitet, med en marginal øget overlevelse i den liberale gruppe (4,2% vs. 2,6%). TITRe2 var imidlertid ikke dimensioneret til at bedømme mortalitet og sammenlignede reelt to Hb-niveauer, der begge var liberale (5,0 vs. 5,6, med kun 0,62 mmol/l forskel), der var mange protokolafvigelser og en overraskende stor interventionseffekt.
Herudover er der tidligere publiceret data fra to mindre studier, TRIFE studiet13,14 og De Almeida et al.15, der begge rapporterer øget mortalitet i den restriktive gruppe:
TRIFE studiet13,14 er et RCT med 284 ældre, skrøbelige patienter (fra beskyttet bolig/plejehjem), der efter ortopædkirurgi randomiseredes til en transfusionstrigger på < 6 mmol/l eller en transfusionstrigger på < 7 mmol/l. Studiet finder ikke nogen forskel i de planlagte effektmål (daglig aktivitet, infektioner eller 90-dages mortalitet), men i en posthoc subgruppeanalyse findes overraskende en øget 90-dages mortalitet hos plejehjemsbeboere (36% vs. 20%) i den restriktive gruppe. TRIFE studiet var ikke dimensioneret til at bedømme mortalitet og gruppen af patienter var meget selekteret. Det er desuden vigtigt at pointere, at begge grupper repræsenterer en transfusionsstrategi, der er mere liberal end vanligt anbefales.
De Almeidas studie15 er et RCT med 198 patienter med behov for intensiv terapi efter abdominal cancerkirurgi, der randomiseredes til en restriktiv (< 4,3 mmol/l) eller liberal (< 5,6 mmol/l) transfusionsstrategi. Studiet finder, at 36 patienter (35,6%) i den restriktive gruppe og 19 patienter (19,6%) i den liberale gruppe når det primære effektmål (samlet effekt af 30 dages mortalitet og komplikationer (kardiovaskulære, ARDS, nyresvigt med behov for dialyse, septisk shock, behov for re-operation)). Studiet var ikke dimensioneret til at bedømme mortalitet og gruppen af patienter var meget selekteret. Dødeligheden skyldtes især abdominale infektioner, og der var en overraskende stor interventionseffekt.
Efterfølgende er der i 2018 publiceret resultater fra et stort, veludført, randomiseret studie i hjertekirurgiske patienter (TRICS-III)16. TRICS-III randomiserede 5243 patienter, der skulle undergå hjertekirurgi med brug af hjerte- lungemaskine, til transfusion ved en restriktiv trigger på 4,7 mmol/l eller ved en liberal trigger på 5,9 mmol/l. Det primære effektmål var et composit af død, myocardieinfarkt, apoplexi eller nyerhvervet nyresvigt med dialyse.
Studiet fandt ingen forskel på de to grupper for det primære effektmål eller for nogle af komponenterne i det sammensatte effektmål. Hertil kommer en reduktion i antallet af transfunderede ES på 30% og et fald i transfusionsraten (andelen af patienter, der modtager transfusion) på 30%.
Der er netop publiceret et follow-up studie fra TRICS-III, der rapporterer outcomes 6 måneder efter kirurgi17. Disse data bekræfter, at det er sikkert at benytte 4,7 mmol/l som transfusionstrigger i hjertekirurgiske patienter, da der ikke var nogen forskel i primære eller sekundære outcomes. Der er i data antydning af en effekt af alder, idet yngre (<45 år) kunne se ud til at have gavn af en liberal transfusionsstrategi, hvorimod ældre (>85 år) muligvis har fordel af en restriktiv strategi. Dette strider mod tidligere resultater fra intensivpatienter (TRICC), hvor de yngste patienter (<55 år) havde størst gevinst af den restriktive strategi18, og giver således ikke umiddelbar anledning til at lave aldersafhængige anbefalinger.
Samlet set giver det på baggrund af en ny metaanalyse af tilgængelige data, anledning til at, at Sundhedsstyrelsen i sin nye retningslinje fra 20183 anbefaler en restriktiv transfusionstrigger på <4,7 mmol/l til kredsløbsstabile patienter med kronisk hjertesygdom (herunder bl. a. iskæmisk hjertesygdom, klapsygdom og behandlingskrævende hypertension) og anæmi.
ALDER AF ERYTROCYTTER VED TRANSFUSION
I Danmark opbevares erytrocytter i SAG-M væske i op til 35 dage.
Der er i observationelle studier fundet en association mellem opbevaringstider af ES og overlevelse19,20, men dette har ikke kunne genfindes i de randomiserede studier, der sammenligner opbevaringstider . Tværtimod er der indikationer på, at friskt blod giver flere transfusionsreaktioner end blod med længere opbevaringstid21,22.
INFORM studiet fra 201723,24 randomiserede og analyserede data fra 20.858 patienter randomiseret 1:2 til at modtage blod med kortest mulig oplagringstid eller længst mulig oplagringstid. De opnåede en gennemsnitlig alder på blodet på hhv. 13 dage og 24 dage i de to grupper. Det primære effektmål var in-hospital mortalitet, og de fandt ingen forskel mellem de to grupper (hhv. 9,1% og 8,8%).
Der er således ikke grundlag for generelt at anbefale brug af blod med kort oplagringstid til blødende patienter – heroverfor står dog det faktum, at bl. a. mængden af kalium stiger med oplagringstiden, hvilket kan medføre risiko for hyperkaliæmi hos pædiatriske patienter og patienter med behov for massiv transfusion.
HÆMOSTASEMONITORERING VED BLØDNING
Inden for de seneste 10 år er der sket et skifte i monitorering af blødende patienter med mindsket brug af de traditionelle plasmabaserede analyser som aktiveret partiel tromboplastintid (APTT), protrombintid (PT), international normalized ratio (INR), p-fibrinogenkoncentration samt trombocyttal, til øget brug af viskoelastiske hæmostaseanalyser såsom thrombelastografi (TEG®) og rotationstrombelastometri (ROTEM®). Baggrunden for dette skift er en bedre korrelation mellem TEG®/ROTEM® og kliniske blødningstilstande sammenlignet med de plasmabaserede analyser25,26, fordi TEG®/ROTEM® udføres på fuldblod dvs. med tilstedeværelse af blodets cellulære komponenter, hvilket er en forudsætning for at vurdere patienternes evne til at generere trombin og danne koagler in vivo.
Evnen til trombingenerering er afgørende for det dannede koagels styrke og dermed for at opnå hæmostase27,28. Ydermere identificerer TEG®/ROTEM® som de eneste analyser, en patologisk øget fibrinolyse (hyperfibrinolyse), der kan optræde ved svære traumer, gynækologiske-obstetriske blødninger, samt ved iskæmi- og reperfusionsindgreb såsom hjertekirurgi med hjerte-lunge-maskine og aortakirurgi29,30.
Der er nu publiceret en række studier, fortrinsvis inden for lever- og hjertekirurgi, men også med andre typer blødende patienter, hvor det er vist, at patienter der behandles med blodprodukter baseret på TEG®/ROTEM® monitorering, har mindre blodtab, transfunderes med færre blodprodukter samt i nogle studier, en lavere frekvens af re-operation og mortalitet, sammenlignet med patienter, der behandles på baggrund af plasmabaserede koagulationsanalyser31,32.
Ydermere rapporterer et studie af 1974 traumepatienter, at TEG® analyse bedre identificerer tidligt behov for transfusion af ES, plasma og TK samt fibrinolyse sammenlignet med plasmabaserede koagulationsanalyser. Studiet konkluderer at TEG®/ROTEM® bør erstatte de plasmabaserede analyser til rutinemonitorering af traumepatienter med risiko for blødning33.
Et nyligt, mindre, randomiseret studie af 111 patienter har ligeledes vist reduceret brug af blodkomponenter og også reduceret mortalitet, når TEG®/ROTEM® bruges til at styre behandling med blodkomponenter hos blødende traumepatienter, som resusciteres primært med krystalloider34. Nationale erfaringer fra et prospektivt, observationelt studie på Rigshospitalet indikerer også at blandt massivt blødende patienter hvor transfusionsbehandlingen vejledes af TEG® og hvor der anvendes balanceret blodkomponentterapi, falder andelen af traumepatienter der dør på grund af blødning med 50% (31). Lignende resultater er rapporteret af Kashuk et al. som fandt, at TEG® guidet transfusionsterapi reducerede mortaliteten med cirka 50 % hos koagulopatiske traumepatienter35.
Et nyligt opdateret Cochrane-review undersøgte effekten af TEG®/ROTEM®-styrede algoritmer og viste signifikant reduceret plasma- og trombocytbehov, reduktion af blødning og reduceret mortalitet (RR 0,52 [95 % CI 0,28;0,95]) sammenlignet med en transfusionsstrategi styret af klinisk vurdering eller konventionelle koagulationsanalyser36. Undersøgelsen opgjorde 17 studier, heraf 15 studier inden for thoraxkirurgien – generelt var evidensen af lav kvalitet. Der var en klar reduktion i behovet for transfusion af alle typer blodprodukter. Der var ingen forskel på anvendelsen af TEG® eller ROTEM®.
I Sundhedsstyrelsens opdaterede Nationale kliniske retningslinje om indikation for transfusion med blodprodukter fra 20183 er der foretaget en ny metaanalyse, der inkluderer yderligere to studier. Her blev der ikke fundet en statistisk signifikant effekt på mortalitet ved brug af en random effects model, om end der var en klar tendens i retning af en reduktion af mortalitet ved brug af TEG®/ROTEM® (RR=0,66 [95 % CI 0,43;1,00], p=0,05).
Blødningsvolumen blev reduceret med 15 – 25 % og transfusionsrater for alle typer blodprodukter reduceredes betydeligt ved TEG®/ROTEM®-styring af transfusionsbehandlingen.
Siden 2008 har skandinaviske guidelines anbefalet, at svært blødende patienter skal behandles med balanceret blodkomponentterapi, samt at hæmostasen skal monitoreres med TEG®/ROTEM®37. Samme anbefaling har siden 2010 været givet i amerikanske lærebøger i transfusionsmedicin og i den europæiske guideline for behandling af blødende traumepatienter. Sundhedsstyrelsens retningslinje om blodtransfusion fra 20183 anbefaler at TEG®/ROTEM® såfremt disse er tilgængelige, bruges til at guide behandling med plasma og trombocytter hos blødende patienter.
TEG®/ROTEM® TEKNOLOGIEN
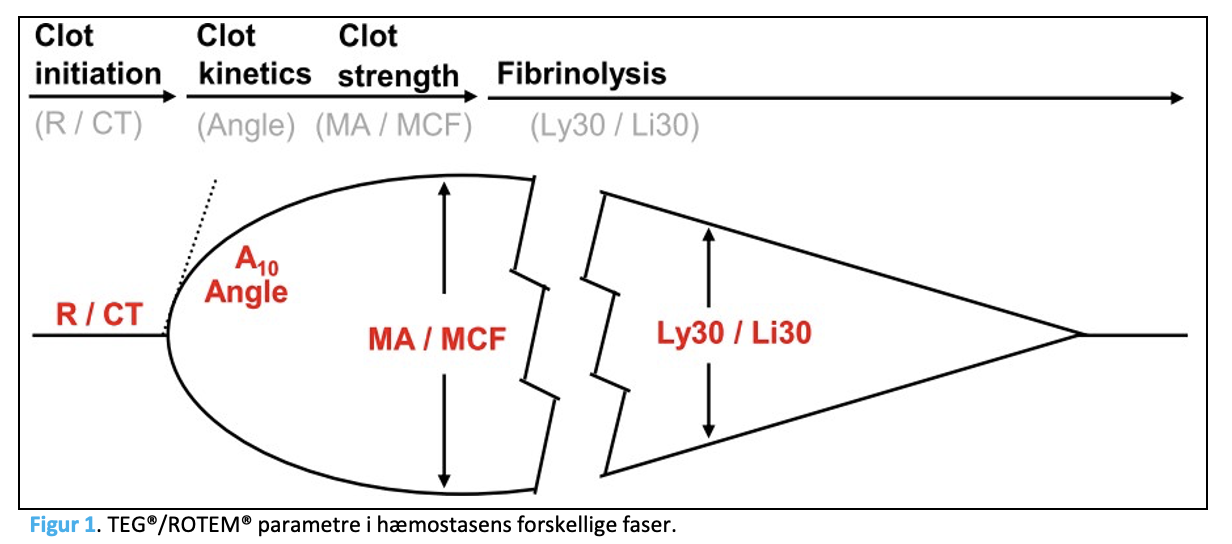
TEG®: R, Reaction time; Angle; MA, Maximum Amplitude; Ly30, fibrinolyse efter 30 min.
ROTEM®: CT, Clotting Time; A10, Amplitude efter 10 min; MCF, Maximum Clot Firmness; Li30, fibrinolyse efter 30 min.
TEG®/ROTEM® er fuldblodsanalyser, der måler koagulationsinitieringen (tiden til et koagel begynder at dannes, R/CT), hvor hurtigt koagelstyrken øges over tid (Angle), den maksimale koagelstyrke (MA/MCF) samt hvor hurtig koaglet opløses (Ly30/Li30), jf. Figur 1. Mangel på eller hæmning af koagulationsfaktorer inklusive fibrinogen og/eller trombocytter samt øget fibrinolytisk aktivitet vil afspejles ved, at en eller flere af ovenstående TEG®/ROTEM® parametre vil være udenfor det validerede referenceområde. Dette afspejler en kompromitteret hæmostase, der er associeret med øget risiko for blødning.
Det anbefales, at TEG®/ROTEM® udføres (hvis disse er tilgængelige):
- På patienter med blodtab >30 % af blodvolumen, sv.t. ATLS blødningsklasse III og IV (Dvs. ca. 1,5 liter ved legemsvægt 70 kg, karakteriseret ved takykardi og hypotension).
- Hvis administration af plasma og/eller trombocytter
- Ved sivblødning fra sår, slimhinder og/eller
- Postoperativt hos patienter med fortsat
- Ved komplekse blødningstilstande (DIC, sepsis, ECMO mm).
- Ved vedvarende transfusionsbehov på trods af behandling med blodkomponenter og/eller hæmostatiske lægemidler.
- Ved livstruende blødning (hver 30-60 min indtil kirurgisk kontrol af blødning).
ORGANISERING
TEG®/ROTEM® er akutte analyser, som bør være umiddelbart tilgængelige for den kliniske afdeling (anbefaling fra Sundhedsstyrelsen 20183), der varetager akut blødende patienter, f.eks. i tilknytning til Fælles Akut Modtagelser (FAM) og på hospitaler med akut kirurgi. Analyserne bør udføres i et standardiseret laboratorium med faste rutiner for kvalitetskontrol og med transfusionsmedicinsk ekspertise på speciallægeniveau tilgængelig for rådgivning hele døgnet. Resultat af analysen kan afgives i realtid nær patienten, f.eks. monitor på operations- eller intensivstue.
Målet er, at analysen kan startes inden for 10-15 min fra blodprøvetagning, således at tolkning og behandling kan iværksættes, så snart de første resultater foreligger (10-15 min efter analysestart). Anvendelse af citratblodprøve sikrer stabilisering under transport til laboratorium og tillader analysestart umiddelbart ved ankomst38.
Der er fremkommet nye versioner af såvel TEG® (TEG®6S39) som ROTEM (ROTEM®sigma), der er automatiserede, og som derfor kan anvendes som ægte Point-of-Care analyser, hvor det kliniske personale selv kan igangsætte analyserne bed-side. Dermed kan resultaterne være endnu hurtigere tilgængelige. Disse apparater kræver fortsat faste rutiner for validering og kvalitetskontrol udført af kompetent personale, hvorfor de fortsat anbefales forankret i afdelinger med ekspertise indenfor dette.
LIVSTRUENDE BLØDNING
Patienter med livstruende blødning præges af kredsløbssvigt (faldende blodtryk og stigende puls) og har behov for akut transfusionsbehandling samt kirurgisk og/eller endovaskulær intervention for at stoppe blødningen. Følgende definitioner for livstruende blødning har været foreslået: Transfusion med mere end 10 ES inden for 24 timer, blødning større end ét blodvolumen inden for 24 timer, blødning større end et halvt blodvolumen inden for 3 timer samt blødning over 150 ml/min. I den nyere litteratur anvendes hyppigt mere end 10 ES inden for 6 timer; men ofte vil diagnosen stilles på baggrund af konkret klinisk vurdering af tilstanden40.
Livstruende blødning medfører risiko for udvikling af koagulopati, hvilket er forbundet med dårligere prognose. Mere end 17 studier viser samstemmende i forskellige patientpopulationer, at tidlig og aggressiv behandling med plasma og TK, parallelt med ES, er associeret med øget overlevelse sammenlignet med patienter, der får standardbehandling hvor indgift af plasma og TK tidligst sker, når 1 blodvolumen er substitueret41.
Ydermere er der publiceret flere studier, der beskriver resultatet af tidlig og aggressiv ”pakkekoncept”-styret transfusionsbehandling med akutte transfusionspakker eller massive transfusionsprotokoller, hvor optøet plasma er tilgængeligt, så det kan udleveres umiddelbart sammen med TK og ES. Disse studier viser samstemmende en signifikant reduktion i mortaliteten blandt patienter, der modtager mere end 10 ES inden for det første døgn fra ankomst til hospital, sammenlignet med patienter der modtager standardbehandling med plasma og TK42-44.
I et relativt nyligt publiceret fase 3 randomiseret studie fra USA – PROPPR studiet45 – hvor 680 svært tilskadekomne traumepatienter blev randomiseret til en initial ES:plasma:TK-ratio på 4:2:0,5 (lavdosis plasma og TK) vs. 4:4:1 (højdosis plasma og TK), opnår flere i højdosisgruppen blødningskontrol (78% vs. 86%, p=0,006), mortaliteten efter 3 timer er signifikant nedsat (11,1% vs. 5,9%, p=0,0246), og der er muligvis færre i højdosisgruppen der dør opgjort efter 24 timer, sammenlignet med lavdosis gruppen (17,0% vs. 12,7%, p=0,12046).
En metaanalyse af publicerede studier på traumepatienter med livstruende blødning har vist, at tidlig og aggressiv behandling med plasma og TK er associeret med cirka 50 % reduktion i mortalitet(40). Udover reduceret mortalitet er det rapporteret, at behandling efter ”pakkekonceptet” er associeret med færre senkomplikationer såsom sepsis og abdominalt kompartmentsyndrom47.
Sundhedsstyrelsen har i forbindelse med en opdatering af den National Kliniske Retningslinje for transfusion med blodkomponenter i 20183 lavet en metaanalyse på de få randomiserede studier, der findes, og det anbefales at behandle med balanceret blodkomponentterapi i en 1:1:1 ratio fra den tidligste fase på baggrund af en reduceret 3- timers mortalitet og en øget andel af patienter, der opnår kirurgisk hæmostase. Kvaliteten af evidensen bedømmes dog som lav – primært pga. det lille antal randomiserede studier.
BRUG AF KOLLOIDER TIL BLØDENDE PATIENTER
Inden for de senere år har der været øget fokus på, at volumenterapi med syntetiske kolloider (HES, Voluven®) til patienter med livstruende blødning ikke er hensigtsmæssigt48,49. Baggrunden for dette er, at de syntetiske molekyler som disse kolloider består af, bliver inkorporeret i koaglet og resulterer i et porøst og mindre stabilt koagel. Denne kolloidinducerede koagulopati fører til øget blødning og transfusionsbehov hos forskellige typer af patienter50,51. Det er påvist, at behandling af kritisk syge patienter med HES er nefrotoksisk og associeret med øget mortalitet sammenlignet med Human Albumin og krystalloider52-54, forbundet med øget blødning, transfusionsbehov og dødelighed hos patienter med svær sepsis55-57. Syntetiske kolloider (HES, Voluven®) kan derfor ikke anbefales til blødende patienter, hverken med kontrollabel eller livstruende blødning.
BEHANDLINGSANBEFALING 1 – ERYTROCYTSUSPENSION TIL BLØDENDE PATIENTER
Anvendelse af ES kan på baggrund af en individuel klinisk vurdering overvejes, når:
Hb. < 5,6 mmol/l ved samtidig
- Livstruende blødning (præget af kredsløbssvigt).
- Akut Koronart Syndrom (AKS) i iskæmisk
Hb. < 4,7 mmol/l og samtidig
- Kronisk
Hb. < 4,3 mmol/l og/eller symptomer på anæmi, der ikke responderer på væskebehandling
- Til alle øvrige Herunder også til patienter med akut kontrollabel blødning eksemplificeret ved f.eks. akut øvre gastrointestinal blødning. (jf. Villanueva et al.8)
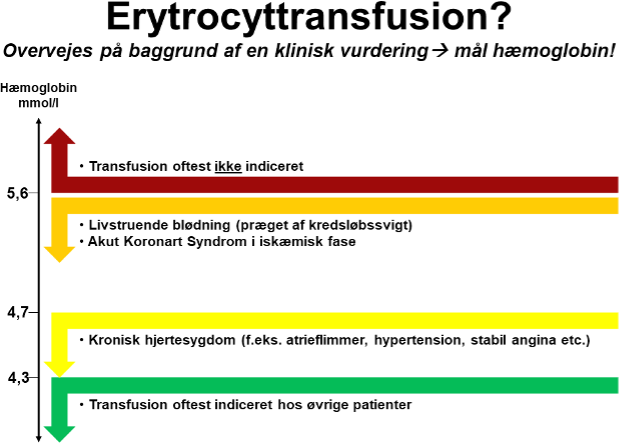
Figur 2. Illustration af hvornår transfusion med ES overvejes.
BEHANDLINGSANBEFALING 2 – BEHANDLING AF KONTROLLABEL BLØDNING
Behandling af kontrollabel blødning med plasma, TK og hæmostatiske lægemidler baseres på TEG®/ROTEM® analyse med det mål at opnå normal hæmostase vurderet ved TEG®/ROTEM® i blødningsfasen.
TEG® BEHANDLINGSALGORITME VED BLØDNING
Som standard opsættes almindelig TEG-analyse. Ved mistanke om heparinisering (eventuelt endogen) også ’hepTEG’. Hos udvalgte patientgrupper, hvor der erfaringsmæssigt forekommer fibrinogenmangel – f.eks. større blødninger, blødning fra uro-genitalområdet, efter anvendelse af hjerte-lunge-maskine/ECMO eller ved post- partumblødninger – bør der ligeledes analyseres ’funktionel fibrinogen’ (FF).
|
TEG-BEHANDLINGSALGORITME VED BLØDNING |
|||
| Variabel | Måling | Koagulopati | Behandling |
| R | 9-14 min | Koagulationsfaktorer ↓ | Plasma 20 ml/kg |
| R | >14 min | Koagulationsfaktorer ↓↓ | Plasma 30 ml/kg eller cryopræcipitatpool
5 ml/kg |
|
FFMA |
<14 mm |
Fibrinogen ↓ |
Cryopræcipitatpool 2-5 ml/kg eller fibrinogenkonc. 20-40 mg/kg |
| MA | 45-49 mm | Trombocytter ↓ | 1 TK eller TK 5 ml/kg |
| MA | <45 mm | Trombocytter ↓↓ | 2 TK eller TK 10 ml/kg |
| Ly30 | >4% | Primær hyperfibrinolyse | TXA 1-2 g IV eller 10-20 mg/kg |
|
Diff. R |
hepTEG – TEG R
>2 min |
Heparinisering |
Protaminsulfat 25-50 mg eller Plasma 10-20 ml/kg |
FFMA= Funktionel fibrinogen MA; TXA= Tranexamsyre.
Normalområder: R 3-9 min, FFMA 14-27 mm, angle 55-75 grader, MA 51-69 mm og Ly30<4%.
ROTEM® BEHANDLINGSALGORITME VED BLØDNING
Som standard opsættes tre kanaler: EXTEM, INTEM og FIBTEM. Sidste kanal kan anvendes til HEPTEM eller APTEM afhængig af den kliniske situation.
|
ROTEM-BEHANDLINGSALGORITME VED BLØDNING |
|||
| Parameter | Værdi | Koagulopati | Behandling |
| ExTEM CT | > 80 sek. | Koagulationsfaktorer ↓ | Plasma 15-25 ml/kg |
|
InTEM CT |
> 200 sek. |
Koagulationsfaktorer ↓ |
Plasma 15-25 ml/kg eller cryopræcipitatpool 5 ml/kg |
|
ExTEM A10 |
<42 mm og FibTEM
≥ 10mm* |
Trombocytter ↓ |
1 TK eller 5 ml/kg |
| ExTEM A10 | < 35 mm | Trombocytter ↓↓ | 2 TK eller 10 ml/kg |
|
FibTEM A10 |
6-9 mm |
Fibrinogen ↓ |
Cryopræcipitatpool 2-3 ml/kg eller fibrinogenkonc. 15 mg/kg |
|
FibTEM A10 |
3-6 mm |
Fibrinogen ↓↓ |
Cryopræcipitatpool 4-5 ml/kg eller fibrinogenkonc. 25 mg/kg |
|
FibTEM A10 |
0-3 mm |
Fibrinogen ↓↓↓ |
Cryopræcipitatpool 6-7 ml/kg eller fibrinogenkonc. 40 mg/kg |
| ExTEM Li 30 | < 94 % | Hyperfibrinolyse | TXA 1-2 g i.v. eller 10-20 mg/kg |
| InTEM CT / HepTEM CT |
> 1,25 |
Heparinisering |
Protaminsulfat 25-50 mg i.v. eller Plasma 10-20 ml/kg |
TXA=tranexamsyre.
Normalområder: CTEXTEM 38-79s, CTINTEM 100-240s, CTHEPTEM 100-240s, A10EXTEM 43-65mm, MCFEXTEM 50-72mm, Funktionelt
fibrinogen A10FIBTEM 7-23 mm, LI30 94-100%
- Lav fibrinogen medfører nedsat A10 (MCF) i ExTEM, hvorfor direkte tolkning på trombocytopeni kun sikkert kan anvendes ved normal
BEHANDLING AF KONTROLLABEL BLØDNING, NÅR TEG®/ ROTEM® IKKE ER TILGÆNGELIG:
Ved pågående blødning sikres balanceret blodkomponentterapi fx efter 4-10 princippet, dvs. at der efter transfusion af 4 ES suppleres med plasma og efter 10 transfusioner af ES/plasma i alt suppleres med TK. I de tilfælde hvor en kontrollabel blødningstilstand ændrer sig og bliver livstruende, skiftes der straks til balanceret blodkomponentterapi.
Det anbefales i blødningsfasen løbende at analysere:
- Trombocyttal (mål 80-100 mia/l, ellers gives trombocyttransfusion 5-10 ml/kg),
- Fibrinogen (mål > 6 mikromol/l (=2 g/l)58 , ellers cryopræcipitatpool 3-5 ml/kg eller fibrinogenkoncentrat 25 mg/kg), og
- Hæmoglobinkonc. (mål i henhold til ovenstående afsnit om ES), indtil blødningskontrol er opnået.
- Monitorering med APTT og PT/INR kan overvejes, dog er den kliniske nytteværdi i blødende patienter begrænset59.
Tranexamsyre anbefales rutinemæssigt til alle patienter, der gennemgår blødende kirurgi, uafhængigt af strategi, TEG®/ROTEM® styret eller ej, f.eks. ortopædkirurgi, traumekirurgi, gynækologisk-obstetrisk kirurgi, hjertekirurgi med brug af hjerte-lunge-maskine, leverkirurgi- samt levertransplantation60-63. I forbindelse med ortopædkirurgi og høj risiko for blødning anbefales at første dosis gives 30 min før kirurgistart.
Tranexamsyre er relativt kontraindiceret hos patienter med svær sepsis / septisk shock og hos patienter med øget trombosetendens eller pågående tromboseproces.
BEHANDLINGSANBEFALING 3 – LIVSTRUENDE BLØDNING
Behandlingsmål er at opnå Hb. niveau på 5,0-6,0 mmol/l samt normal hæmostase evalueret ved TEG®/ROTEM®
Det anbefales, at:
- Starte balanceret blodkomponentterapi med plasma, TK og ES, i form af ”transfusionspakker”, fra den tidligste fase (senest med opstart inden for 15 min. jf. Sundhedsstyrelsen retningslinje 2018)3 og fortsætte, indtil blødningen kontrolleres.
- En transfusionspakke indeholder ES, plasma og TK i et forhold, der er tilnærmelsesvis ækvivalent til fuldblod
– det konkrete forhold kan variere mellem regioner og vil afhænge af fremstillingsproceduren af blodprodukter i den lokale blodbank. Ved børn anvendes bolus 10 ml blodkomponenter/kg fordelt på 4 ml/kg ES, 4 ml/kg plasma og 2 ml/kg TK gentaget efter volumenbehov.
- ES transfunderes for at opretholde et niveau på omtrent 5,0-6,0 mmol/l for at optimere hæmostasen (dette Hb. niveau sikrer, at trombocytterne kan marginaliseres til karvæggen)64.
- Der anvendes krystalloider i mindst mulig mængde som volumenterapi i ventetiden på
- Der afstås fra behandling med syntetiske
- Gentagne doser tranexamsyre overvejes i henhold til monitorering og klinisk tilstand, f.eks. i henhold til CRASH-2 (1 g bolus + 1 g infusion over 8 timer)61. Børn <12 år: Bolus 15 mg/kg (max 1g) i.v. herefter infusion 2 mg/kg/time eller 15mg/kg per mistet blodvolumen)65. Behandling med TXA seponeres, når blødningen er ophørt.
Da det ikke på alle lokaliteter er logistisk muligt at udlevere optøet/frisk plasma inden for de anbefalede 15 min., kan plasma i den første transfusionspakke erstattes med enten én (ca. 100 ml) cryopræcipitatpool eller fire Lyoplas (4 x 200 ml) eller en kombination af Protrombinkomplexkoncentrat (PCC, 25 IE/kg) + fibrinogenkoncentrat (15-25 mg/kg) i ventetiden på optøet plasma.
MONITORERING MED TEG®/ROTEM® VED LIVSTRUENDE BLØDNING
Patienterne transfunderes balanceret med transfusionspakker og tranexamsyre som ovenfor anført, og der udføres TEG®/ROTEM® snarest muligt og derefter 15 – 30 min. efter hver hæmostatiske intervention – hvis muligt – indtil kontrol af blødningen er opnået. Samtidig analyseres Hb. Ved livstruende blødning skal der ikke afventes resultat af TEG®/ROTEM® før der påbegyndes transfusion med plasma, TK og evt. hæmostatiske lægemidler.
MONITORERING VED LIVSTRUENDE BLØDNING NÅR TEG®/ROTEM® IKKE ER TIL RÅDIGHED
Patienterne transfunderes balanceret med transfusionspakker og tranexamsyre som ovenfor anført. Når TEG®/ROTEM® ikke er til rådighed, anbefales løbende analyse af trombocyttal (mål 80-100 mia/l ellers øges dosis af trombocyttransfusion), fibrinogen (mål >6 mikromol/l ellers suppleres med cryopræcipitatpool 3-5 ml/kg eller fibrinogenkoncentrat 25 mg/kg) og Hb. (i henhold til retningslinjer angivet ovenfor) indtil hæmostase er opnået.
Monitorering med APTT og PT/INR kan overvejes, dog er den kliniske nytteværdi i blødende patienter meget begrænset59.
LIVSTRUENDE BLØDNING HOS PATIENTER I ANTITROMBOTISK BEHANDLING
Flere potente koagulationshæmmende lægemidler er inden for de seneste år blevet introduceret, herunder præparater der hæmmer koagulationsfaktor X – rivaroxaban (Xarelto®), apixaban (Eliquis®), edoxaban (Lixiana®) eller de direkte trombinhæmmere – dabigatran (Pradaxa®), bivalirudin®, argatroban (Novastan®). Herudover ses der en øget brug af de potente trombocythæmmere – ticagrelor (Brilique®), cangrelor (Kengrexal®) og prasugrel (Effient®).
Når patienter i behandling med disse præparater udvikler alvorlig eller livstruende blødning anbefales, at den tidligere skitserede strategi med transfusionspakker følges indtil kirurgisk blødningskontrol er opnået. For hvert blodvolumen der substitueres med disse pakker, reduceres koncentrationen af lægemidlerne med 25-50 % (afhængigt af distributionsvolumen). Normal hæmostase kan forventes senest, når 3-4 blodvolumina er erstattet. Undtaget herfra er dabigatran, som har et stort fordelingsvolumen (ca. 60-80 liter), hvilket forlænger effekten yderligere.
Fagudvalget for antitrombotika, Rådet for Anvendelse af Dyr Sygehusmedicin (RADS), Danske Regioner, er i januar 2016 udkommet med en vejledning66: Blødning under antitrombotisk behandling. Bilag til RADS-vejledninger om antitrombotisk behandling, se link
RADS (http://www.regioner.dk/media/1841/bloedningsbilag-januar-2016-230690_1.pdf)
Her gennemgås systematisk hvordan mild, moderat, alvorlig og livstruende blødning hos patienter i forskellige type koagulationshæmmende og trombocythæmmende behandling monitoreres, behandles og evt. reverteres, hvorfor der henvises til dette dokument.
REFERENCER
- Vejledning om Blodtransfusion, Vejledning nr. 9038 af 15. januar 2015. In. København: Sundhedsstyrelsen – Danish Health and Medicines Authority;
- National Klinisk Retningslinje om Indikation for Transfusion med Blodkomponenter 2014. In: Sundhedsstyrelsen – Danish Health and Medicines Authority;
- Nationale Kliniske Retningslinjer om Indikation for Transfusion med Blodkomponenter 2018. København: Sundhedsstyrelsen – Danish Health and Medicines Authority;
- Redegørelse for blodproduktområdet In. København: Styrelsen for Patientsikkerhed; 2017.
- Carson JL, Triulzi DJ, Ness Indications for and Adverse Effects of Red-Cell Transfusion. N Engl J Med. 2017;377(13):1261-1272.
- Holst LB, Haase N, Wetterslev J, et Lower versus higher hemoglobin threshold for transfusion in septic shock. N Engl J Med. 2014;371(15):1381-1391.
- Carson JL, Terrin ML, Noveck H, et Liberal or restrictive transfusion in high-risk patients after hip surgery. N Engl J Med. 2011;365(26):2453-2462.
- Villanueva C, Colomo A, Bosch A, et al. Transfusion strategies for acute upper gastrointestinal bleeding. N Engl J 2013;368(1):11-21.
- Carson JL, Stanworth SJ, Roubinian N, et Transfusion thresholds and other strategies for guiding allogeneic red blood cell transfusion. Cochrane Database Syst Rev. 2016;10:CD002042.
- Holst LB, Petersen MW, Haase N, Perner A, Wetterslev Restrictive versus liberal transfusion strategy for red blood cell transfusion: systematic review of randomised trials with meta-analysis and trial sequential analysis. BMJ. 2015;350:h1354.
- Carson JL, Guyatt G, Heddle NM, et al. Clinical Practice Guidelines From the AABB: Red Blood Cell Transfusion Thresholds and JAMA. 2016;316(19):2025-2035.
- Murphy GJ, Pike K, Rogers CA, et Liberal or restrictive transfusion after cardiac surgery. N Engl J Med. 2015;372(11):997-1008.
- Gregersen M, Borris LC, Damsgaard Postoperative blood transfusion strategy in frail, anemic elderly patients with hip fracture: the TRIFE randomized controlled trial. Acta Orthop. 2015;86(3):363-372.
- Gregersen M, Damsgaard EM, Borris LC. Blood transfusion and risk of infection in frail elderly after hip fracture surgery: the TRIFE randomized controlled trial. Eur J Orthop Surg Traumatol. 2015;25(6):1031-
- de Almeida JP, Vincent JL, Galas FR, et al. Transfusion requirements in surgical oncology patients: a prospective, randomized controlled Anesthesiology. 2015;122(1):29-38.
- Mazer CD, Whitlock RP, Fergusson DA, et Restrictive or Liberal Red-Cell Transfusion for Cardiac Surgery. N Engl J Med. 2017;377(22):2133-2144.
- Mazer CD, Whitlock RP, Fergusson DA, et Six-Month Outcomes after Restrictive or Liberal Transfusion for Cardiac Surgery. N Engl J Med. 2018;379(13):1224-1233.
- Hebert PC, Wells G, Blajchman MA, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical Transfusion Requirements in Critical Care Investigators, Canadian Critical Care Trials Group. N Engl J Med. 1999;340(6):409-417.
- Edgren G, Kamper-Jorgensen M, Eloranta S, et al. Duration of red blood cell storage and survival of transfused patients (CME). 2010;50(6):1185-1195.
- Wang D, Sun J, Solomon SB, Klein HG, Natanson C. Transfusion of older stored blood and risk of death: a meta-analysis. 2012;52(6):1184-1195.
- McQuilten ZK, French CJ, Nichol A, Higgins A, Cooper Effect of age of red cells for transfusion on patient outcomes: a systematic review and meta-analysis. Transfus Med Rev. 2018;32(2):77-88.
- Rygard SL, Jonsson AB, Madsen MB, et al. Effects of shorter versus longer storage time of transfused red blood cells in adult ICU patients: a systematic review with meta-analysis and Trial Sequential Analysis. Intensive Care Med. 2018;44(2):204-217.
- Cook RJ, Heddle NM, Lee KA, et al. Red blood cell storage and in-hospital mortality: a secondary analysis of the INFORM randomised controlled Lancet Haematol. 2017;4(11):e544-e552.
- Heddle NM, Cook RJ, Arnold DM, et al. Effect of Short-Term vs. Long-Term Blood Storage on Mortality after N Engl J Med. 2016;375(20):1937-1945.
- Mallett SV, Armstrong M. Point-of-care monitoring of haemostasis. 2015;70 Suppl 1:73-77, e25-76.
- Fowler A, Perry Laboratory monitoring of haemostasis. Anaesthesia. 2015;70 Suppl 1:68-72, e24.
- Rivard GE, Brummel-Ziedins KE, Mann KG, Fan L, Hofer A, Cohen Evaluation of the profile of thrombin generation during the process of whole blood clotting as assessed by thrombelastography. J Thromb Haemost. 2005;3(9):2039-2043.
- Johansson PI, Svendsen MS, Salado J, Bochsen L, Kristensen AT. Investigation of the thrombin-generating capacity, evaluated by thrombogram, and clot formation evaluated by thrombelastography of platelets stored in the blood bank for up to 7 days. Vox Sang. 2008;94(2):113-118.
- Schochl H, Frietsch T, Pavelka M, Jambor Hyperfibrinolysis after major trauma: differential diagnosis of lysis patterns and prognostic value of thrombelastometry. J Trauma. 2009;67(1):125-131.
- Kashuk JL, Moore EE, Sawyer M, et Primary fibrinolysis is integral in the pathogenesis of the acute coagulopathy of trauma. Ann Surg. 2010;252(3):434-442; discussion 443-434.
- Johansson PI, Stissing T, Bochsen L, Ostrowski SR. Thrombelastography and tromboelastometry in assessing coagulopathy in Scand J Trauma Resusc Emerg Med. 2009;17:45.
- Fahrendorff M, Oliveri RS, Johansson PI. The use of viscoelastic haemostatic assays in goal-directing treatment with allogeneic blood products – A systematic review and meta-analysis. Scand J Trauma Resusc Emerg 2017;25(1):39.
- Holcomb JB, Minei KM, Scerbo ML, et al. Admission rapid thrombelastography can replace conventional coagulation tests in the emergency department: experience with 1974 consecutive trauma patients. Ann 2012;256(3):476-486.
- Gonzalez E, Moore EE, Moore HB, et al. Goal-directed Hemostatic Resuscitation of Trauma-induced Coagulopathy: A Pragmatic Randomized Clinical Trial Comparing a Viscoelastic Assay to Conventional Coagulation Assays. Ann Surg. 2016;263(6):1051-1059.
- Johansson PI, Sorensen AM, Larsen CF, et al. Low hemorrhage-related mortality in trauma patients in a Level I trauma center employing transfusion packages and early thromboelastography-directed hemostatic resuscitation with plasma and platelets. 2013;53(12):3088-3099.
- Wikkelso A, Wetterslev J, Moller AM, Afshari A. Thromboelastography (TEG) or thromboelastometry (ROTEM) to monitor haemostatic treatment versus usual care in adults or children with bleeding. Cochrane Database Syst Rev. 2016(8):CD007871.
- Gaarder C, Naess PA, Frischknecht Christensen E, et al. Scandinavian Guidelines – The massively bleeding Scand J Surg. 2008;97(1):15-36.
- Johansson PI, Bochsen L, Andersen S, Viuff D. Investigation of the effect of kaolin and tissue-factor-activated citrated whole blood, on clot-forming variables, as evaluated by thromboelastography. 2008;48(11):2377-2383.
- Gurbel PA, Bliden KP, Tantry US, et al. First report of the point-of-care TEG: A technical validation study of the TEG-6S Platelets. 2016;27(7):642-649.
- Levi M, Fries D, Gombotz H, et Prevention and treatment of coagulopathy in patients receiving massive transfusions. Vox Sang. 2011;101(2):154-174.
- Johansson PI, Oliveri RS, Ostrowski SR. Hemostatic resuscitation with plasma and platelets in trauma. J Emerg Trauma Shock. 2012;5(2):120-125.
- Johansson PI, Stensballe J, Rosenberg I, Hilslov TL, Jorgensen L, Secher NH. Proactive administration of platelets and plasma for patients with a ruptured abdominal aortic aneurysm: evaluating a change in transfusion practice. 2007;47(4):593-598.
- Cotton BA, Reddy N, Hatch QM, et al. Damage control resuscitation is associated with a reduction in resuscitation volumes and improvement in survival in 390 damage control laparotomy patients. Ann Surg. 2011;254(4):598-605.
- Duchesne JC, Kimonis K, Marr AB, et al. Damage control resuscitation in combination with damage control laparotomy: a survival advantage. J 2010;69(1):46-52.
- Holcomb JB, Tilley BC, Baraniuk S, et Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: the PROPPR randomized clinical trial. JAMA. 2015;313(5):471-482.
- Fox EE, Holcomb JB, Wade CE, Bulger EM, Tilley Earlier Endpoints are Required for Hemorrhagic Shock Trials Among Severely Injured Patients. Shock. 2017;47(5):567-573.
- Cotton BA, Au BK, Nunez TC, Gunter OL, Robertson AM, Young Predefined massive transfusion protocols are associated with a reduction in organ failure and postinjury complications. J Trauma. 2009;66(1):41-48.
- Hartog CS, Kohl M, Reinhart A systematic review of third-generation hydroxyethyl starch (HES 130/0.4) in resuscitation: safety not adequately addressed. Anesth Analg. 2011;112(3):635-645.
- Hartog CS, Reuter D, Loesche W, Hofmann M, Reinhart K. Influence of hydroxyethyl starch (HES) 130/0.4 on hemostasis as measured by viscoelastic device analysis: a systematic review. Intensive Care Med. 2011;37(11):1725-1737.
- Fenger-Eriksen C, Tonnesen E, Ingerslev J, Sorensen B. Mechanisms of hydroxyethyl starch-induced dilutional J Thromb Haemost. 2009;7(7):1099-1105.
- James MF, Michell WL, Joubert IA, Nicol AJ, Navsaria PH, Gillespie RS. Resuscitation with hydroxyethyl starch improves renal function and lactate clearance in penetrating trauma in a randomized controlled study: the FIRST trial (Fluids in Resuscitation of Severe Trauma). Br J 2011;107(5):693-702.
- Haase N, Wetterslev J, Winkel P, Perner Bleeding and risk of death with hydroxyethyl starch in severe sepsis: post hoc analyses of a randomized clinical trial. Intensive Care Med. 2013;39(12):2126-2134.
- Zarychanski R, Abou-Setta AM, Turgeon AF, et al. Association of hydroxyethyl starch administration with mortality and acute kidney injury in critically ill patients requiring volume resuscitation: a systematic review and meta-analysis. 2013;309(7):678-688.
- Wiedermann CJ, Dunzendorfer S, Gaioni LU, Zaraca F, Joannidis Hyperoncotic colloids and acute kidney injury: a meta-analysis of randomized trials. Crit Care. 2010;14(5):R191.
- Wiedermann CJ, Joannidis M. Mortality after hydroxyethyl starch 130/0.4 infusion: an updated meta- analysis of randomized Swiss Med Wkly. 2012;142:w13656.
- Perner A, Haase N, Guttormsen AB, et al. Hydroxyethyl starch 130/0.42 versus Ringer’s acetate in severe N Engl J Med. 2012;367(2):124-134.
- Haase N, Perner A, Hennings LI, et al. Hydroxyethyl starch 130/0.38-0.45 versus crystalloid or albumin in patients with sepsis: systematic review with meta-analysis and trial sequential analysis. 2013;346:f839.
- Rossaint R, Bouillon B, Cerny V, et The European guideline on management of major bleeding and coagulopathy following trauma: fourth edition. Crit Care. 2016;20:100.
- Segal JB, Dzik WH. Paucity of studies to support that abnormal coagulation test results predict bleeding in the setting of invasive procedures: an evidence-based Transfusion. 2005;45(9):1413-1425.
- Henry DA, Carless PA, Moxey AJ, et Anti-fibrinolytic use for minimising perioperative allogeneic blood transfusion. Cochrane Database Syst Rev. 2011(3):CD001886.
- Roberts I, Shakur H, Afolabi A, et The importance of early treatment with tranexamic acid in bleeding trauma patients: an exploratory analysis of the CRASH-2 randomised controlled trial. Lancet. 2011;377(9771):1096-1101, 1101 e1091-1092.
- Hutton B, Joseph L, Fergusson D, Mazer CD, Shapiro S, Tinmouth Risks of harms using antifibrinolytics in cardiac surgery: systematic review and network meta-analysis of randomised and observational studies. BMJ. 2012;345:e5798.
- Shakur H. Effect of early tranexamic acid administration on mortality, hysterectomy, and other morbidities in women with post-partum haemorrhage (WOMAN): an international, randomised, double-blind, placebo- controlled Lancet. 2017;389(10084):2105-2116.
- Hardy JF, de Moerloose P, Samama The coagulopathy of massive transfusion. Vox Sang. 2005;89(3):123-127.
- Beno S, Ackery AD, Callum J, Rizoli Tranexamic acid in pediatric trauma: why not? Crit Care. 2014;18(4):313.
- Fagudvalget for antitrombotisk behandling. Blødning under antitrombotisk behandling, bilag til RADS- vejledning om antitrombotisk behandling, version 1. In: Rådet for anvendelse af dyr sygehusmedicin (RADS); 2016.
- Bødker Postpartum blødning – Forebyggelse og håndtering. Dansk Selskab for Gynækologi og Obstetrik (DSOG); 2018.
- Stensballe J, Henriksen HH, Johansson PI. Early haemorrhage control and management of trauma-induced coagulopathy: the importance of goal-directed Curr Opin Crit Care. 2017;23(6):503-510.
APPENDIKS 1. FULDBLODSTROMBOCYTAGGREGOMETRI (MULTIPLATE®)
Multiplate® er en trombocytfunktionsanalyse, der måler trombocytaggregation i fuldblod og derved kan identificere øget blødningsrisiko bl.a. hos patienter i trombocythæmmende behandling. Analyseprincippet er at måle trombocytaggregation i fuldblod efter stimulation med forskellige aktivatorer (agonister) og hermed vurdere graden af trombocythæmning sekundært til behandling med acetylsalicylsyre (ASA), NSAID, ADP- og GPIIb/IIIa-receptor hæmmere.
Multiplate® analyse anbefales til blødende patienter/patienter, der skal gennemgå invasive procedurer/kirurgi ved:
- Kendt/mistænkt trombocythæmmende
- Mistænkt trombocytdefekt/von Willebrand-faktor
Multiplate® aktivatorer
| Navn | Aktivator (agonist) | Trombocytaggregation |
| TRAPtest | TrombinReceptor AktiverendePeptid (TRAP) | Maksimal |
| ADPtest | Adenosin DiPhosphat (ADP) | ADP-induceret |
| ASPItest | Arachidonsyre | Cyclooxygenase-
/thromboxaninduceret |
| RISTOtest | RISTOcetin | Ristocetin- og vWF-induceret |
Ved trombocyttal < 50-100 mia/l er variationen af resultatet øget, således at der ikke skelnes mellem nedsat respons pga. lavt trombocyttal eller behandling med trombocythæmmere.
Multiplate® normalværdier hos raske
|
Test |
Normalværdier, raske (95 % CI) | Betydelig øget blødningsrisiko |
Påvirkes af |
| TRAPtest | 92-151 U | < 92 U | GPIIb/IIIa hæmmere (ReoPro, Integrillin) |
|
ADPtest |
55-117 U |
< 50 U |
ADP receptor hæmmere (Clopidogrel, Prasugrel, Ticagrelor) eller GPIIb/IIIa hæmmere |
|
ASPItest |
79-141 U |
< 40 U |
ASA, NSAID eller GPIIb/IIIa hæmmere |
|
RISTOtest |
65-116 U |
< 35 U |
vWD, Bernard-Soulier, ASA, NSAID |
vWD = von Willebrand Disease (mangel på/dysfungerende von Willebrand Faktor); U = Unit.
Analysen bør suppleres med TEG®/ROTEM®. Multiplate®/TEG®/ROTEM® værdier i referenceområdet medfører oftest ikke øget blødningsrisiko ved invasive indgreb/kirurgi og i de tilfælde er prohæmostatisk intervention sjældent indiceret.
APPENDIKS 2. EFFEKTEN AF ANTITROMBOTIKA PÅ TEG®/ROTEM® OG MULTIPLATE®
| Medicin | TEG® | ROTEM® | Multiplate® |
| Trombocythæmmere | |||
| GPIIb/IIIa hæmmer (ReoPro®, Integrilin®, Aggrastat®) |
Kun ReoPro®: MA↓ |
Kun ReoPro®
MCF↓ |
TRAPtest ↓, ADPtest ↓ ASPItest ↓ |
| ADP receptor hæmmer
(Plavix®, Efient®, Brilique®, Cangrelor®) |
Upåvirket |
Upåvirket |
ADPtest ↓ |
|
ASA, NSAID (Hjertemagnyl®, Kodimagnyl®, etc.) |
Upåvirket |
Upåvirket |
ASPItest ↓ |
| Dipyridamol (Persantin®) |
Upåvirket |
Upåvirket |
Upåvirket |
| Epoprostenol/Iloprost (Flolan®, Ilomedin®) |
Upåvirket |
Upåvirket |
Upåvirket |
| Antikoagulantia | |||
| Vit. K antagonister (Marevan®, Marcoumar®) | R ↑, α ↓, MA ↓1) | CT ↑, α/A10 ↓, MCF ↓1) |
Upåvirket |
| Heparin (UFH), LMWH (Fragmin®, Innohep®, Klexane®) |
R ↑, α ↓, MA ↓1,2) |
CT ↑, α/A10 ↓, MCF ↓1,2) |
Upåvirket |
| Indirekte FXa hæmmer (Arixtra®) (Pentasacharid) |
R ↑, α ↓, MA ↓ |
CT ↑, α/A10 ↓, MCF ↓ |
Upåvirket |
| Direkte FXa hæmmer (Xarelto®, Eliquis®, Lixiana®) |
ACT↑ (rTEG), R (↑) |
CT (↑) |
Upåvirket |
|
Direkte thrombin hæmmer (Pradaxa®, Angiox®, Novastan®) |
R ↑, α ↓, MA ↓1) |
CT ↑, α/A10 ↓, MCF ↓1) |
Upåvirket |
| Antitrombin
(Antitrombin III®, Atenativ®) |
R ↑, α ↓, MA ↓1) | CT ↑, α/A10 ↓, MCF ↓1) |
Upåvirket |
| Fibrinolytika | |||
| Actilyse®, Metalyse® Rapilysin®, Streptase® |
Ly30 ↑ |
ML ↑ / Li30 ↓ |
Upåvirket |
TEG®: R=Reaktionstid; α=angle; MA=Maximum Amplitude; Ly30=Lysis efter 30 min.
ROTEM®: CT=Clotting Time; α=Angle; MCF=Maximum Clot Firmness; ML30=Maximum Lysis efter 30 min.
1) Ved stigende grad af koagulationshæmning vil TEG®/ ROTEM® ændres progressivt: Først R/CT ↑, herefter α ↓ og endelig MA/MCF ↓ påvirkes da den nedsatte trombin generering påvirker både klot opbygningshastighed (α) samt -styrke (MA/MCF).
2) Effekten af hepariner neutraliseres i Heparinase-TEG eller HepTEM.
APPENDIKS 3. SÆRLIGE KLINISKE PROBLEMSTILLINGER
POSTPARTUM BLØDNING
Postpartumblødning behandles jf. retningslinjer fra Dansk Selskab for Obstetrik og Gynækologi67. Der gives initialt krystalloid 1 -2 l, hvorefter kredsløbet revurderes. Tidlig tranexamsyre 1 g. iv. jf. WOMAN-studiet63 ved blødning > 500 ml. gentaget efter 30 min. eller efter 10 blodkomponenter.
Livstruende blødning præget af kredsløbsinstabilitet behandles med balanceret blodkomponentterapi og målstyret hæmostatisk behandling med blodkomponenter og farmaka efter TEG®/ROTEM®. jf. nærværende vejledning.
Ved kontrollabel blødning og i stabil fase anbefales restriktiv transfusionstrigger på højest 4,3 mmol/l.
HJERTEPATIENTER/HJERTEKIRURGISKE PATIENTER
Patienter med kronisk hjertesygdom uden pågående iskæmi anbefales transfunderet efter en restriktiv transfusionstrigger på 4,7 mmol/l jf. TRICS-III16. Dette gælder for ikke-kirurgiske patienter med kronisk hjertesygdom og kirurgiske patienter med kronisk hjertesygdom før, under og efter kirurgi – såvel hjertekirurgi som anden kirurgi.
Ved akut iskæmi er transfusionstriggeren ikke undersøgt i større randomiserede studier, men det anbefales at benytte en trigger på 5,6 mmol/l.
KIRURGI
Ved elektiv/subakut kirurgi kan patientens hæmoglobin/jerndepoter med fordel optimeres forud for operation. Ved kirurgi med forventet blødning/transfusionsbehov bør der indgives tranexamsyre 1 g. iv. ved start for at begrænse blødning og reducere behovet for blodtransfusion. Tranexamsyre 1 g. iv. kan gentages under operationen ved sivblødning eller efter blødning sv.t. ca. ½ blodvolumen.
Har pt. kendt eller mistænkt koagulopati inkl. utilstrækkelig pausering af antikoagulantia eller antitrombotika anbefales præoperativ TEG®/ROTEM® og evt. trombocytfunktionstestning.
Der kan initialt anvendes krystalloid til substitution. Ved udvikling af koagulopatisk, sivende, mikrovaskulær blødning bruges straks hæmostatisk monitorering med TEG®/ROTEM® og målstyret behandling med blodkomponenter og hæmostatiske farmaka for at optimere koagulationen, så der kan opnås kirurgisk hæmostase.
Som udgangspunkt transfunderes først med erytrocytter ved en hæmoglobinkonc. <4,3 mmol/l (4,7 mmol/l ved hjertesygdom hos pt.) før, under og efter operationen. I tilfælde af livstruende/ukontrollabel blødning anvendes balanceret blodkomponentterapi jf. nærværende vejledning.
TRAUMER
Tidlig (præ-hospital) anvendelse af tranexamsyre iv. Om muligt præ-hospital indgift af blodkomponenter (erytrocytsupension, plasma eller LyoPlas®). Efter ankomst til hospital gives tranexamsyreinfusion jf. CRASH-II61 og ved hæmodynamisk instabilitet gives fra tidligste fase balanceret blodkomponentterapi jf. nærværende vejledning evt. under tryk eller ved brug af blodmølle.
Tidlig monitorering med TEG®/ROTEM® og målstyring af blodkomponentterapi og behandling med hæmostatiske farmaka – særligt fibrinogenkoncentrat68. Ved mistanke om trombocythæmmende behandling tillige tidlig trombocytfunktionstestning.
Ved stabil patient/kontrollabel blødning bør anvendes en transfusionstrigger på 4,3 mmol/l (hhv. 4,7 mmol/l ved kronisk hjertesygdom hos patient).
INTENSIV TERAPI – ITA
Generelt anbefales restriktiv transfusionsstrategi med erytrocytter til patienter på ITA jf. TRISS-studiet6. På grund af risikoen for at udvikle eller forværre forbrugskoagulopati/dissemineret intravaskulær koagulation (DIC) anbefales som udgangspunkt ikke transfusion af plasma eller trombocytter til ikke-blødende patienter. Behandlingen ved DIC bør rettes mod patientens grundsygdom, og den symptomatiske behandling af koagulopatien bør konfereres med hæmostasespecialist (blødingsvagt eller hæmatolog).
Hæmostasemonitorering med TEG®/ROTEM® anbefales ved sivblødning/mikrovaskulær blødning og forud for invasive procedurer. TEG®/ROTEM®-værdier udenfor normalområdet hos ikke blødende patienter bør ikke føre til transfusion af blodprodukter.
