.
ERNÆRING TIL KRITISK SYGE
National Behandlingsvejledning 2024
Udarbejdet af:
Jørgen Wiis, Overlæge, Intensiv Terapi Klinik 4131, Rigshospitalet
Lise Skyttegaard Balkert, Afdelingslæge, NIA, Anæstesiologisk-Intensiv Afdeling V, Odense Universitetshospital
Meike Tomesch Behadi, Overlæge, Thorax Intensiv Afsnit TIA, Aalborg Universitetshospital
Camilla Rødbro Dalgaard, Afdelingslæge, Thorax anæstesi og inteniv, Aalborg Universitetshospital
Pernille Haure, Overlæge, Neurointensivt Afsnit NOTIA, Aalborg Universitetshospital
Dorte Illum, Overlæge, Intensiv Afdeling ITA, Aarhus Universitetshospital
Margrethe Jermiin Jensen, Afdelingslæge, VITA/BTY Anæstesiologisk-Intensiv Afdeling V, Odense Universitetshospital
Pia Lawson-Smith, Overlæge, Afdelingen for bedøvelse og intensiv behandling, Neurocentret, Rigshospitalet
Jens Michelsen, Overlæge, ITA Anæstesiologisk-Intensiv Afdeling V, Odense Universitetshospital
Ulrik Skram, Overlæge, Intensiv Afdeling, Nordsjællands Hospital
Velkommen til en revideret 2024 udgave af DASAIM’s Nationale Behandlings Vejledning om Ernæring til kritisk syge. Vi har i et vist omfang anvendt definitioner og rekommendationer fra European Society of Parenteral and Enteral Nutrition’s ”ESPEN practical and partially revised guideline: Clinical nutrition in the intensive care unit af 2023[3] og ESPENS vejledning fra 2018[4]. ESPENs vejledninger er ikke fuldt anvendelige i klinisk daglig praksis, da mange af hverdagsudfordringerne fortsat ikke dækkes. Med kapitlet ”Få ernæringen til at fungere” forsøger vi at råde bod på dette. Vi har tilstræbt at udvikle en skarpt skåret dansk vejledning med algoritmer og overskuelige tabeller, som vi håber er let at bruge i jeres hverdag. Algoritmer, tabeller og figurerne 1,4,7,8,11 kan frit og meget gerne kopieres.
Figur 2,3,5,6,9,10,12 skal I søge om tilladelse til at anvende i offentligt materiale.
Dette er ikke et juridisk dokument. Husk at behandlingsvejledninger, som ordet siger, er vejledende, og at den behandlende læge efter individuelt kvalificeret skøn kan fravige disse.
Arbejdsgruppen
Generelle behov: |
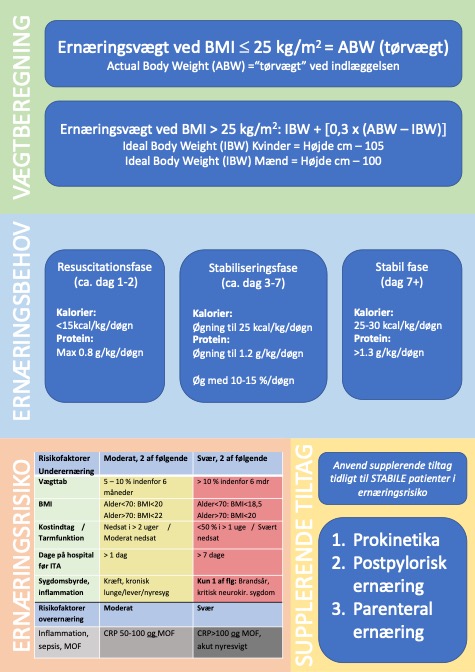
| 1. Ernæring til kritisk syge skal være differentieret, behovsrelateret og målrettet med udgangspunkt i sygdomsfaser, patientens vægt, sygelighed og risiko for sygdomsrelateret underernæring. |
| 2. Ernæringsvægt: BMI£25 kg/m2: ABW. BMI>25 kg/m2: IBW + [1/3 x (ABW–IBW)]. |
| 3. Efter stabilisering skal den kritisk syge patient screenes for reel ernæringsmæssig risiko. |
| 4. Dag 1: Forsigtig ernæringsstart efter stabilisering til maksimalt 60% dag 3, dag 8 stiles mod fuld ernæring. Supplerende tiltag skal overvejes efter dag 3 til stabile patienter i svær ernæringsmæssig risiko. Undgå overernæring. Indirekte kalorimetri kan med fordel anvendes. |
| 5. I stabil fase: 25-30 kalorier / >1,3 g protein / 0,7-1,5 g fedt per kg/dag. |
| 6. Nitrogenbalancen og proteinbehovet kan beregnes ved at måle døgnurin karbamidudskillelsen. |
| 7. Glutamin: Anvendes KUN til patienter med monoorgansvigt i form af tarmsvigt. |
| 8. Omega 3-fedtsyrer: Ingen generel anbefaling. Arginin, Immunonutrition cocktail: Kan ikke anbefales. |
| 9. Vitaminer: Uvist, hvor stort behovet for vitaminer og sporstoffer er hos kritisk syge. Giv anbefalede daglig dosis til raske. Kun D vitamin ved svær mangel. Højdosis supplement kan medføre hypervitaminose og antioxidant toxicitet og anbefales ikke. Vandopløselige (B+C) tabes under CRRT eller exudative tilstande og skal erstattes. |
| 10. Antioxidanter: Højdosis monoterapi med Vitamin A/C/E, Selenium, Zink anbefales ikke. |
Få ernæringen til at fungere: |
| 1. Enteral ernæring: Er indtaget <60% af vurderet behov efter 48 timer anlægges ernæringssonde og startes EN. Produktet målrettes patientens behov. Ventrikelretention, diarré, obstipation: Følg forslag til algoritmer for udredning og behandling. Faste: Patienter med sikker luftvej skal kun faste til indgreb efter grundig individuel vurdering. |
| 2. Probiotika anbefales ikke. |
| 3. Parenteral ernæring: Bruges som total PN (TPN) eller som supplement (SPN), når oralt indtag og/eller enteral ernæring ikke kan gennemføres eller er kontraindiceret. SPN startes på 3-7 dagen afh. af ernæringsrisiko og stabilitet. Komponenterne fås i adskilte opløsninger og i 2 eller 3 kammerposer. Max. doser: Glucose 5 mg/kg/min. Aminosyrer 2 g/kg/døgn. Lipid 1,5 g/kg/døgn). |
| 4. Blodsukkerniveau: 6-10 mmol/l anbefales, 10-14 accepteres hos diabetikere med høj HbA1c |
| 5. Malnutrition, Refeeding: Giv tiamin og opnå akut mineralkontrol. Langsom ernæringsstart efter skema. Mål dagligt elektrolytter inkl. Mg og fosfat. Reducér ernæring ved fortsat hypofosfatæmi. |
| 6. Svær overvægt: OBS malnutrition. Samme behov per kg ernæringsvægt som andre. IBW + 1/3 x(ABW-IBW) |
| 7. Ældre: Følg vanlige retningslinjer. OBS malnutrition, sarkopeni, skrøbelighed. |
| 8. Overgang til stationær afdeling: Ernæringsmål nået. Læg realistisk ernæringsplan for afdelingen. FØLG OP. |
Ernæring ved specifikt organsvigt: |
| 1. Tarmsvigt, korttarmssyndrom: Ernæres parenteralt, optitreres som andre patienter. Store væske, elektrolyt, protein og bikarbonat tab fra tarm og fistler skal erstattes. |
| 2. Leversvigt: Tidlig EN med et standardprodukt foretrækkes. OBS encephalopati, aspirationsrisiko, hypoglykæmi, hyponatriæmi. Ikke indikation for forgrenede aminosyrer. |
| 3. Akut pankreatit: Tidlig EN fremfor PN. Læg NG-sonde, overvej tidligt ND/J-sonde. Start med fuldproteinprodukt. Skift hurtigt til peptidbaseret/MCT-produkt ved intolerance (diarré/steatoré). |
| 4. KOL: Ofte ernæringstruet, overvej tidlig EN og SPN. Giv ernæring under langvarig NIV.
ARDS: EN opstartes efter vanlige kriterier for kritisk syge. Bugleje kontraindicerer ikke EN. ECMO: EN opstartes efter vanlige kriterier for kritisk syge. |
| 5. Nyreinsufficiens: Proteinkatabole, risiko for malnutrition. CRRT: Erstat tabt protein, sporstoffer, vitaminer. Kronisk nyreinsufficiens: Ernæres normalt. |
| 6. Traume: Følg generelle retningslinjer for ernæring til kritiske syge patienter. |
| 7. Svær neurokirurgisk sygdom: Behov øges med traume sværhedsgrad. Hvis ikke kalorimetri: 25-30 kcal/kg tidligt. Protein: 1,5-2,5 g/kg. Tidlig NJ-sonde eller PN. Acceptér kun moderate aspirater. |
| 8. Cervikalt medullært tværsnitssyndrom: IKKE hypermetabole, men massivt proteinkatabole. 20-25 kcal/kg. Risiko for hyperalimentation. Anvend højproteinprodukter. LAXANS, tidlig fast tarmtømningsregime. |
| 9. Brandsår>20%: Ekstremt stresskatabole, STORT makro og mikronæringsbehov. |
Ernæring til kritisk syge, generelle behov
Ernæring til kritisk syge skal være differentieret, behovsrelateret og målrettet. Der tages udgangspunkt i sygdomsfaser, patientens vægt, konstitution, generelle sygelighed og risiko for sygdomsrelateret underernæring. Overernæring kan være skadelig.
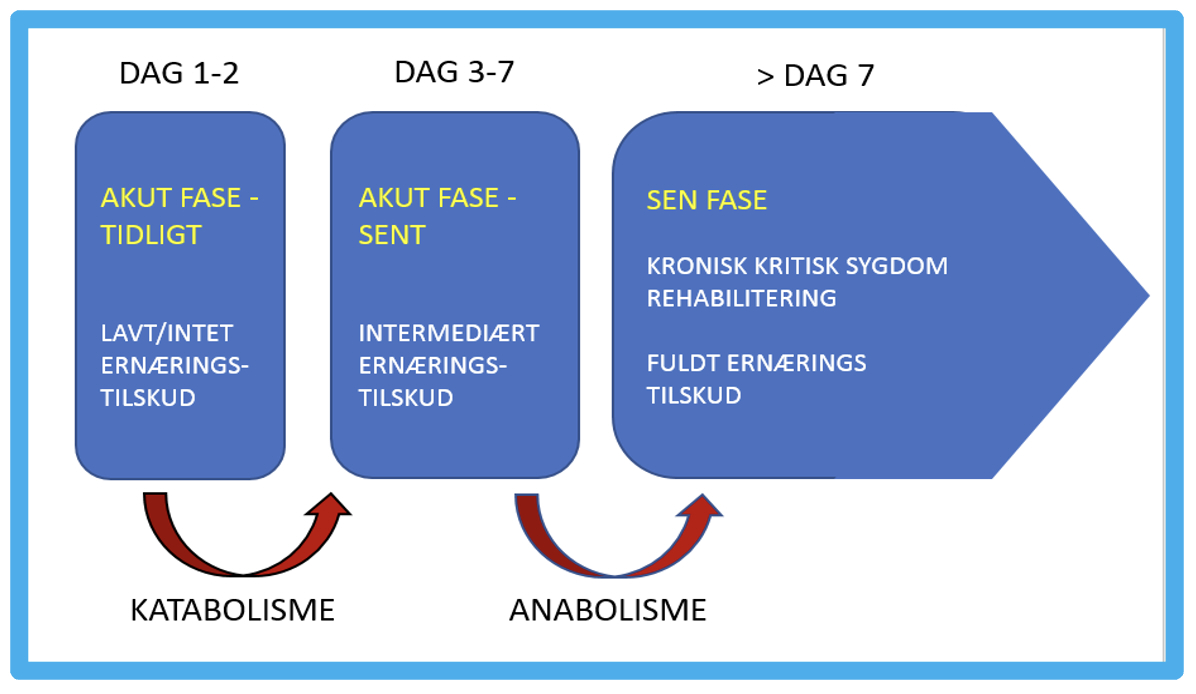
Figur 1. Akut, stabiliserende, protraheret eller kronisk kritisk sygdom fordrer differentieret tilgang til ernæringsterapi. Egen illustration.
Faser
De forskellige stadier af kritisk sygdom med hyperinflammation, katabolisme og metabolisk ustabilitet med betydeligt muskeltab efterfulgt af en stabiliseringsfase og gradvis overgang til anabolisme stiller krav til en differentieret fase inddelt tilgang til ernæring [3, 4].
Ernæringsvægt Anvend som udgangspunkt tørvægt = Actual Body Weight (ABW) i beregningerne, altså patientens habituelle vægt FØR væskeresuscitation.
BMI £ 25 kg/m2: Anvend aktuel kropsvægt (ABW). BMI > 25 kg/m2: Beregn justeret kropsvægt = ideal kropsvægt IBW + [1/3 x (ABW – IBW)].
IBW kg:
Kvinder = 0,9 x (Højde cm – 105). Mænd = 0,9 x Højde cm – 100.
Simpel IBW kg: Kvinder = Højde – 105. Mænd = Højde – 100. Beregnet IBW kg: (2,2 x BMI) + (3,5 x BMI x [Højde m – 1,5]). [3, 4, 6]
Screening
Efter stabilisering skal den kritisk syge patient screenes for reel ernæringsmæssig risiko og for at undgå overernæring.
Alle nyindlagte hospitalspatienter skal ernæringsscreenes. I Danmark anvendes Nutrition Risk Screening (NRS) 2002 [7]. Alle kritisk syge er i henhold til NRS 2002 i ernæringsmæssig risiko. European Society of Parenteral and Enteral Nutrition (ESPEN) vurderer, at alle intensivpatienter med over 2 dages indlæggelse er i risiko for underernæring. I den heterogene intensivpopulation findes såvel velnærede akut syge som langvarigt kronisk syge, der rammes af akut sygdom. Kakektiske eller underernærede patienter tåler dårligt langvarig faste under akut kritisk sygdom. Men også overernæring under akut kritisk sygdom kan være skadelig [2, 8-10]. Det er derfor væsentligt at finde de kritisk syge med størst gavn af tidlig målrettet ernæringsterapi. Den ideelle model til ernæringsscreening af kritisk syge er endnu ikke beskrevet [4]. Nutric Score [1] vurderer 10 umiddelbart relevante parametre for ernæringsrisiko hos kritisk syge.
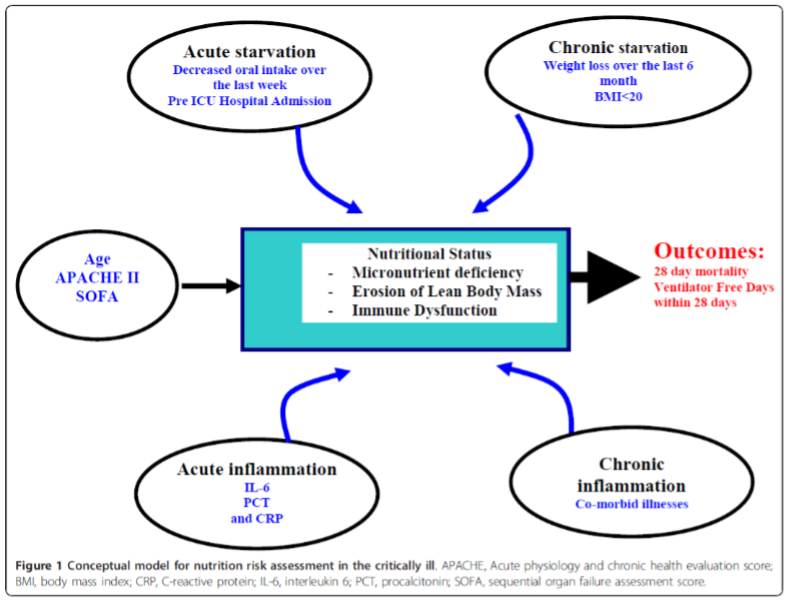
Figur 2. Nutric Score. Efter Heyland et al [1]. Open access.
I retrospektive kohorter fandt man, at patienter med Nutric Score >5, som nåede deres ernæringsmål, havde reduceret mortalitet, mens patienter med Nutric Score<5 havde øget eller uændret mortalitet ved fuld ernæring[1, 11]. Nutric Score fandt bemærkelses-værdigt ingen relation mellem langvarigt vægttab eller lav BMI og mortalitet, hvorfor disse parametre blev udeladt af den endelige score. Akut sygelighed i form af APACHE II og SOFA score vægtede man derimod med 5/10. ESPEN anbefaler stadig ikke fuldt at anvende Nutric score men anbefaler dog i risikovurderingen pragmatisk (ikke valideret) at inddrage: Patienter med ITA ophold >2 dage, respiratorbehandling, infektion, ikke ernæret >5 dage eller svær kronisk sygdom. Nyerere studier finder, at sepsis, hyperinflammation beskrevet ved CRP>100 og multiorgan dysfunktion omvendt er forbundet med negativt outcome ved fuld ernæring [12-14]. Endnu er disse parametre ikke integreret i den internationale litteratur om ernæringsrisiko som defineret modvægt mod forcering af ernæring til ustabile kritisk syge. Signalerne mod dårlig outcome ved overernæring ved hyperinflammation og ustabilitet blandt kritisk syge er dog så stærke, at vi vælger at integrere dem med de kendte parametre fra NRS 2002 og ESPENs GLIM kriterier [15] i en endnu ikke valideret samlet vurdering af risikofaktorer for under- og overernæring. Vores tabel for kombineret risikoberegning:
| Risiko for underernæring | Moderat, 2 af følgende | Svær, 2 af følgende |
| Vægttab | 5 – 10 % indenfor 6 måneder | > 10 % indenfor 6 måneder |
| BMI ifht alder år | <70: BMI<20, >70: BMI<22 | <70: BMI<18.5, >70: BMI<20 |
| Kostindtag / Tarmfunktion | Nedsat >2 uger / Noget nedsat | <50 % i > 1 uge / Svært nedsat |
| Dage på hospital før ITA | > 1 dag | > 7 dage |
| Sygdomsbyrde, kronisk | Kræft, lunge/lever/nyre-syg |
Ernæringsmål
Forsigtig ernæringsstart efter stabilisering til maksimalt 60% dag 3 og 100% efter dag 7. Supplerende tiltag bør overvejes efter dag 3 til stabile patienter i svær ernæringsmæssig risiko. Undgå overernæring.
I den tidlige hypermetaboliske fase, hvor den endogene energiproduktion når 500-1400 kcal/dag, bør overernæring undgås [4, 16, 17]. For tidlig fuld ernæring øger risikoen for refeeding [18]. Et retrospektivt materiale justeret for sygelighed undersøgte relationen mellem målt energibehov og indgivne kalorier og fandt en U-formet relation til mortalitet.
![Figur 3. Kalorie- eller proteinindgift og mortalitet. Bearbejdet efter Zusman et al [3]. Open acess.](https://dasaim.dk/wp-content/uploads/2019/05/Screenshot-2023-10-14-at-21.50.23.png)
Figur 3. Kalorie- eller proteinindgift og mortalitet. Bearbejdet efter Zusman et al [2]. Open acess.
Der ses øget mortalitet ved >110% og <50% kalorie indgift af Resting Energi Expenditure, REE under ITA-indlæggelsen. Kalorieoptimum synes at ligge ved 75% af målte. Samme relation sås ikke for protein indgift [2]. Nyeste evidens i en population matchet for ernæringsmsæssig risiko viser, at tidlig endnu kraftigere restriktion af kalorier og protein er associeret med hurtigere rekonvalscens og færre især gastrointestinale komplikationer [17]. ESPEN er nu mere tilbageholdende end tidligere og anbefaler hypokalorisk ernæring i tidlig fase af kritisk sygdom og at give <70% af beregnet kaloriebehov i første uge til velnærede patienter [3]. ESPEN foreslår, at ved stabilitet og måling af REE kan energitilbuddet efter dag 3 gradvist øges til 80-100% af REE, men prospektive data savnes for denne anbefaling. Forceret ernæring til patienter i høj ernæringsmæssig risiko skal nøje overvejes pga. risiko for overernæring og refeeding syndrom. Stabile patienter bør nå ernæringsmål indenfor 7-8 dage af akut kritisk sygdom [4, 8, 19, 20].
1-3-7+
Ernæringsmål til kritisk syge skal sammenfattes ved at vurdere ernæringsterapiens timing, rute, kalorie- og protein mål samt ernæringsrisiko.
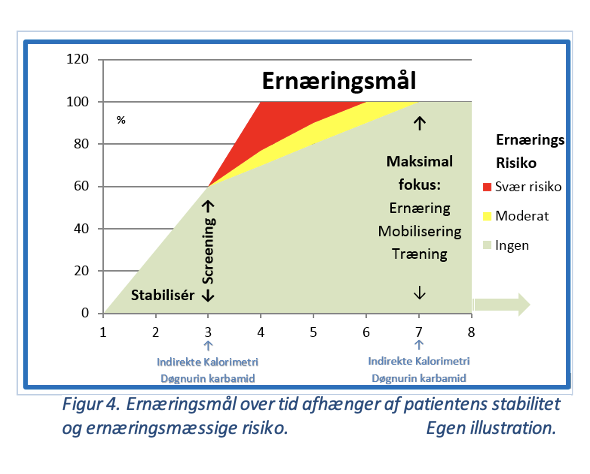
Figur 4. Ernæringsmål over tid afhænger af patientens stabilitet og ernæringsmæssige risiko.
Egen illustration.
Dag 1: Start peroral eller enteral ernæring hvis patienten ikke er i svært shock, ukontrollabel hypoksæmi eller svær acidose [4, 21]. Graden af shock defineres ikke af ESPEN. Vi foreslår et stabiliseret lavt vasopressorbehov og laktat, før ernæring startes. OBS refeeding syndrom hos malnutrierede.
Dag 3: Beregn/mål patientens 100% ernæringsmål. Nå maksimalt 60% af patientens beregnede/målte fulde ernæringsmål på dag 3. Foretag ernæringsmæssig risikovurdering (screening). Er patienten mere stabil, og tåles ernæringen, øges trinvis med 10-15% per dag. Fortsat OBS refeeding syndrom hos malnutrierede.
| Screening viser | Strategi | Mål |
| Svær risiko | Start supplerende tiltag: Prokinetisk behandling, postpylorisk ernæring, parenteral ernæring | Hvis stabil: Nå 100% senest dag 4
Undgå refeeding |
| Moderat risiko | Overvej supplerende tiltag | Hvis stabil: Nå 100% senest dag 5-7
Undgå refeeding |
| Ingen risiko | Fortsæt optitrering af oral/enteral ernæring | Max. 60% dag 3. Forcér ikke
Byg gradvis op til 100% dag 8 |
Efter dag 7: Alle stabiliserede patienter skal være 100% ernæret (beregnet eller målte behov) evt. ved supplerende tiltag: Prokinetisk behandling, postpylorisk ernæring, parenteral ernæring.
Specifikke ernæringsbehov
| Fase | % af ernæringsmål | Kalorier/kg | Protein/kg | Fedt/kg | |
| Dag 1-3 | Resuscitation | 0 -> max. 60 | <15 | <0.8* | <0,6*** |
| Dag 4-7 | Stabilisering | 60 -> 100 | 15 -> 25 | 0.8 -> 1.2** | <1,0*** |
| Dag 7+ | Stabil | 100 | 25-30 | ³1.3** | 0,7-1,5 |
*Stor agtpågivenhed ved hyperinflammation, ukontrollabel sepsis, multiorgandysfunktion, AKI
**Agtpågivenhed ved hyperinflammation, ukontrollabel sepsis, multiorgandysfunktion, AKI
***Forfatternes vurdering, ikke beskrevet i litteraturen
Energibehov, kulhydratbehov, indirekte kalorimetri
I tidlig fase af kritisk sygdom anbefales hypokalorisk ernæring, ikke over 60% af energibehovet (REE). I stabil fase gives 25-30 kalorier/kg/dag. Undgå overernæring. Overvej at reducere ernæring ved insulin resistens. Energibehovet kan måles ved indirektekalorimetri.
Glukose (kulhydrat) er det foretrukne substrat for produktion af energi i hjerneceller, røde blodlegemer, immunceller, nyremedulla og øjne. Kulhydrat bør udgøre 50 – 70 % af den samlede energiindgift, dog under 5 mg/kg/minut. Endogen glukose produktion er øget under kritisk sygdom men reduceres ikke ved tilskud af ernæring eller insulin. Tidlig glucoseindgift under stressmetabolisme menes at dæmpe proteolyse, men medfører insulin resistens, hyperglykæmi, hyperkapni, lipogenese og immunsvækkelse [16]. Tidlig ernæring under stress eller faste kan hæmme autofagi, der renser celler for restprodukter og sikrer cellernes homøostase [22].
Tegn til insulinresistens kan være insulinbehov >120 IE/døgn under pågående ernæringsterapi hos en ikke-diabetisk patient [9]. Ernæringsindgiften bør reduceres, eller non-protein energi ratio for glukose/lipid sænkes fra standard 60/40 under tæt observation af se-triglycerid. Beregningsformler for kaloriebehov er utallige. Faisy-Fagon formlen synes at fungere bedst hos repiratorpatienter, da den inkluderer respiratorisk minutvolumen og patientens temperatur [23]. Formlerne fejlkalkulerer op mod 60% sammenlignet med indirekte kalorimetri (IC), hvorfor ESPEN anbefaler, at energibehovet bestemmes ved IC – især til intensivpatienter med >7 dages indlæggelse og til svært overvægtige. Kalorimetret sat tæt på respiratortuben anvender målte koncentrationer af FiO2, FeO2 og FeCo2 samt mængden af expireret gas per minut til at beregne VO2 (L/min) og VCO2(L/min) [24]. VO2 og VCO2 bruges ved hjælp af Weirs ligning til at beregne EE (kcal/dag).
Weir’s ligning: EE = [(VO2 x 3.941) + (VCO2 x 1.11) + (urin N2 x 2.17)] x 1.44
I klinisk praksis på den intuberede intensiv patient afspejler resting energy expenditure (REE) patienternes totale energibehov (TEE). Metoden bør kun være vejledende, da den er behæftet med 10-15% måleusikkerhed. RCTs med patientrelevante outcomes ved IC vs. formler savnes. Men IC er den sikreste metode til at undgå overernæring hos kritisk syge. Haves IC ikke til rådighed, er REE bedømt fra VO2 via et pulmonalis kateter (Ficks metode) eller VCo2 målt fra respirator mere præcise end beregningsformlerne. [25, 26]. En udførlig gennemgang af IC med teorien bag metoden, dens anvendelse og begrænsninger kan ses i [25, 26].
Proteinbehov
Under stabil kritisk sygdom gives som udgangspunkt 1,3 g protein/kg/dag. I tidligste fase af kritisk sygdom anbefales ikke over 60%, svarende til maksimalt 0,8 g protein/kg/dag. Ved CRRT gives ekstra aminosyrer svarende til 0,2 g/liter ultrafiltrat. Kvælstofbalancen og proteinbehovet kan beregnes ved at måle døgnurinkarbamidudskillelsen.
Kritisk sygdom med svær inflammation og immobilisering medfører udtalt proteolyse med muskeltab op til 1-1,5 %/dag i den første uge. Herefter aftager muskelhenfaldet [27]. Isotop studier på septiske patienter viser, at der samtidig sker muskel proteinsyntese, men at patienterne er i uundgåelig negativ kvælstofbalance [28]. Talrige observationelle studier har vist forbedret outcome af høj proteinindgift til ikke-septiske kritisk syge [12]. Mens samlet lav proteinindgift er associeret med den højeste mortalitetsrisiko, er høj proteinindgift i de første 3-5 dage på intensiv afdeling også associeret med øget mortalitet [29]. RCTs har dog ikke kunne genfinde positiv effekt, hverken ved isoleret høj proteinindgift, i kombination med øget energi indgift eller med fysisk aktivitet [12].
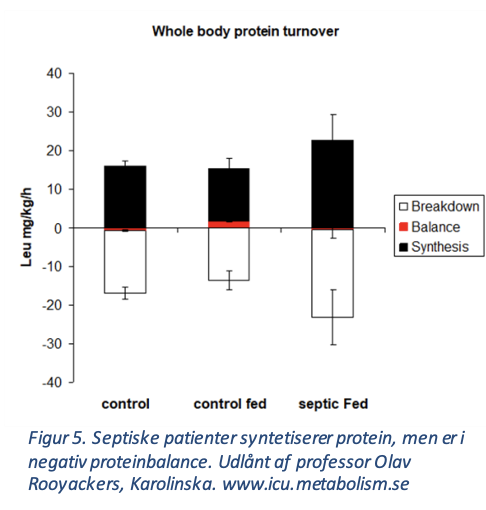
Figur 5. Septiske patienter syntetiserer protein, men er i negativ proteinbalance.
Udlånt af professor Olav Rooyackers, Karolinska. www.icu.metabolism.se
Aminosyreindgift over synteseevnen medfører høj plasma karbamid, øger renal karbamid udskillelse og bedrer ikke outcome [9]. Et nyt studie med 1300 septisk shockerede patienter i høj ernæringsmæssig risiko gav 1,6 g protein/kg vs 0,9 g/kg indenfor 96 timer fra ITA-indlæggelsen. Man fandt ingen effekt af høj dosering i den samlede population men højere plasma karbamid. Blandt patienter med AKI stadie 1-3 og høj SOFA score (³9) sås derimod øget tid til udskrivelse og øget 60 dages mortalitet [14]. Mens tidlig proteinindgift i høj grad hæmmer autofagi, viser nye isotopstudier, at muskelproteinsyntesen bedres i den post-akutte fase [3, 30]. Samlet må disse observationer tale for en differentieret tilgang til proteinadministrationen: Tidlig tilbageholdenhed især under hyperinflammation, sepsis, AKI og multiorgandysfunktion efterfulgt af gradvis øgning efter metabolisk stabilisering og først fuld behandling i stabil fase, hvor øget mobilisering og fysioterapi kommer mere i fokus. Selvom tilgangen kan virke velovervejet, er der dog fortsat behov for velgennemførte RCTs til at understøtte en sådan strategi [4].
Der findes simple metoder til vejledning af patienternes proteinbehov. Monitorering af proteinbehovet ved urinopsamling og beregning af nitrogenbalancen er mulig [31]:
Proteinbehov (g/dag) = (dU-karbamid (mmol/d) x 0,18) + 25 g for fæcestab
Ved hæmodialyse: Daglig stigning i p-karbamid (mmol/l) x vægt (kg) x 0,11) + (dU-karbamid mmol x 0,18) + 25 g for fæcestab (+ 16 g tab i dialysefiltret/IHD) [32, 33]. Ved CRRT: Tillæg 0,2 g/liter ultrafiltrat/dag svarende til aminosyretabet i ultrafiltratet [34].
Validiteten øges ved at tage et gennemsnit af urinopsamlinger i eksempelvis 3 følgende dage. Ses en øget karbamidudskillelse efter øgning i proteintilbuddet uden anden væsentlig forklaring som gastrointestinal blødning eller betydelig vævsnedbrydning, bør man dæmpe proteinindgiften og foretage ny kontrol [9]. Metoden er relativt upræcis, da proteintab fra hud ikke indgår, og tabet fra fæces varierer. ESPEN anbefaler metoden til måling af proteinbehovet til adipøse kritisk syge og generelt ved tvivlstilfælde [4, 35]. Endnu enklere kan man hos en stabil kritisk syge patient anvende plasma karbamid/kreatinin-ratio (UCR). Høj UCR ved stabil kreatinin kan tyde på aminosyre overernæring. Holder UCR sig lav under gradvis øget proteintilbud, tåles den ekstra indgift [36]. UCR har sine begrænsninger: Høj ratio grundet høj karbamid men lav kreatinin ses ved pågående katabolisme, cellehenfald, efter større blødning, dehydratio/prærenalt nyresvigt eller kortikosteroider. Lav UCR ses ved muskelhenfald, malnutrition, lavproteindiæt, kakeksi, svær lever dysfunktion, SIADH, rhabdomyolyse og graviditet. Mere avancerede metoder beskrives i litteraturen men synes ikke endnu at have anvendelighed i en dag til dag praksis. Mest omtalt er Bioelektrisk impedans analyse (BIA), ultralyd af rectus femoris, CT abdomen niveau L3 eller DEXA-scanning. BIA kan bruges til indirekte vurdering af kropssammensætning ved at måle modstand og reaktans i kroppen, når den udsættes for lavfrekvent vekselstrøm. Ved CT L3 angives muskelmassen som det samlede areal af muskelvæv ved tredje lændehvirvel (L3), i cm2/m2. Dual-energy X-ray Absorptiometry (DEXA-scanning) anvender lavdosis røntgenstråling og bruges især til måling af knogletæthed, men kan også estimere muskelmasse [36, 37].
Lipidbehov
Fedt administreres dagligt med 0,7-1,5 g/kg/døgn. Infusion indgives over 12-24 timer, bør ikke overstige 0,15 g/kg/time. Fedtopløselige vitaminer gives som tilskud dagligt.
Fedt kan administreres enteralt og parenteralt. Anbefalet dosis til kritisk syge er i al væsentlighed ikke kendt, især ikke i ustabile faser. Ved stabilitet gives fedtsubstitution med 0,7-1 g/kg/døgn (max. 1,5 g/kg/døgn) indgivet over 12-24 timer [4, 38]. Enterale ernæringsprodukter indeholder 40-65 g fedt/l. Intravenøse fedtemulsioner bør bestå af en blanding af forskellige fedtsyrer som mellem-kædede (MCT), n-9 mono-umættede og n-3 polyumættede fedtsyrer [39]. Anbefalet daglig minimum indtag af kombineret Eicosapentaensyre (EPA) og Docosahexaensyre (DHA) er 500 mg. Infusion af fedt bør ikke overstige 0,15 g/kg/time. S-triglycerid og leverfunktionstal bør bestemmes 2 gange/uge og skal foregå under pågående infusion af parenteral ernæring. S-triglycerid bør ikke overstige 4,6 mmol/l.
Ved kritisk sygdom og AKI ses nedsat lipoprotein lipase aktivitet og dermed tendens til hyperlipidæmi.
Fedt overbelastningssyndrom kendetegnes ved hyperlipidæmi, feber, anæmi, leukopeni, trombocytopeni, koagulopati, hepato-splenomegali og koma. Dette ses sjældent og primært ved infusion af sojaoliebaseret fedtemulsion, som det anvendes i den hyppigst brugte form af propofol. Fedt induceret pankreatitis ses sjældent ved s-triglycerid <12 mmol/l. Hyperlipidæmi er immunsupprimerende. Både fedt og glukose kan medføre fedtlever [40]. Langtids parenteral ernæring kan være associeret til leverdysfunktion (PNALD). Intravenøs lipidsubstitution kan i reduceret dosis gives til leverinsufficiente patienter. Til parenteralt langtidsernærede patienter med leverdysfunktion (transaminasestigning) og cholestase er der beskrevet bedring ved overgang til fedtemulsion med omega-3-fedtsyrer [10, 41]. Fedtemulsioner baseret alene på soyabønneolie bør undgås pga. proinflammatoriske effekter [39]. Propofol 10 mg/ml og 20 mg/ml indeholder 0,1 g triglycerid/ml og 1,1 kcal/ml. og kan medvirke til overernæring og hyperlipidæmi. Fedtopløselige vitaminer tilsættes dagligt – også under lipidpause.
Immunonutrition
Immunonutrition betegner standard ernæring (enteral eller parenteral), der tilsættes et eller flere immunologisk aktive stoffer som f.eks. glutamin, arginin, omega-3 fedtsyrer eller nukleotider. Hensigten med immunonutriton er at påvirke den kritisk syge patients immunforsvar i positiv retning og derved forbedre outcome.
Glutamin
Enteral eller parenteral glutamin anbefales ikke til ustabile kritisk syge, især ikke til patienter med lever-/nyresvigt eller brandsår. Parenteral glutamin gives KUN til patienter med monoorgansvigt i form af tarmsvigt. Behandlingstiden er uvis.
Glutamin er en ikke-essentiel aminosyre men depleteres ved kritisk sygdom. Glutamin syntetiseres primært i skeletmuskulatur, er vigtig for proteinsyntese og et væsentligt næringsstof for lymfocytter, makrofager og tarmmucosaceller. Plasma glutamin er ofte lav blandt kritisk syge. Der ses U-formet association til mortalitet [42]. Glutamin er den mest potente gluconeogene og ureogene aminosyre, hvilket kan forklare øget mortalitet ved glutamin administration ved leversvigt, hvor hyperammoniæmi ikke cleares. Enteral glutamin fås ikke i Danmark. ESPEN’s fortsatte anbefaling af enteral glutamin til traumepatienter er baseret på få små RCTs og kan ikke støttes. Et nyt stort randomiseret multicenterstudie med enteral glutamin til svært forbrændte patienter viser øget mortalitet [43]. Parenteralt supplement med glutamin til kritisk syge har været hyppigt anvendt i Danmark. Metaanalyser har vist reduceret hospitalsmortalitet og infektiøse komplikationer men er stærkt vægtet af ældre ringe single center studier. Et stort MRCT med glutamin til shockerede patienter med 2 organsvigt i dosis > 0,6 g/kg viste øget mortalitet og indlæggelsestid (JW36). En metaanalyse med parenteralt glutamin supplement 0,3-0,5 g/kg til hæmodynamisk og metabolisk stabile kritisk syge uden lever- eller nyresvigt viste signifikant reduceret hospitalsmortalitet, infektiøse komplikationer og indlæggelsestid. I ingen af metaanalyserne er der givet langtidsbehandling >14 dage [3]. Vi kan på det foreliggende evidensgrundlag ikke anbefale behandling med glutamin til kritisk syge.
.
Omega 3-fedtsyrer, Arginin, Immunonutrition cocktails
Højdosis oliven- eller fiskeolie kan ikke anbefales til kritisk syge.
Arginin må ikke gives til septiske patienter.
Studier med intravenøse lipidemulsioner baseret på olivenolie eller fiskeolie viser, at disse er veltålte. Studierne er ofte små, præget af høj risiko for bias og lavt evidensniveau [4]. 3-7 gange anbefalet døgndosis enteral EPA og DHA i fiskeolie eller γ-Linolensyre (GLA) i hjulkroneolie er administreret til kritisk syge. Studier af patienter med ALI, ARDS eller sepsis har vist positive effekter. Men en post hoc analyse af en større MRCT med højdosis ω-3-fedtsyrer i en immunonutrition cocktail fandt øget mortalitet blandt medicinske patienter. Et systematisk review af enteral ω-3, GLA og antioxidanter viser ingen fordele ved beriget højdosis enteral fedtsyre administration [44]. Arginin er en essentiel aminosyre under kritisk sygdom involveret i NO-dannelse, proteinsyntese og immunomodulation. Mangel kan påvirke mikrocirkulation, sårheling og T-cell funktionen. Men arginins opregulering af INOS aktivitet og øget NO-produktion kan forårsage større hæmodynamisk instabilitet og organdysfunktion. Arginin skal undlades til septiske patienter men kan potentielt have plads som supplement til præoperative og postoperative ikke-septiske kirurgiske patienter, til stabile traumepatienter og patienter med traumatisk hjerneskade [20]. ESPEN omtaler ikke længere arginin eller immuno-nutrition cocktails [4]. Vi kan ikke anbefale højdosis oliven- eller fiskeolie, arginin eller immunonutrition cocktails til kritisk syge.
Mikronæringsstoffer, antioxidanter, vitaminer, sporstoffer
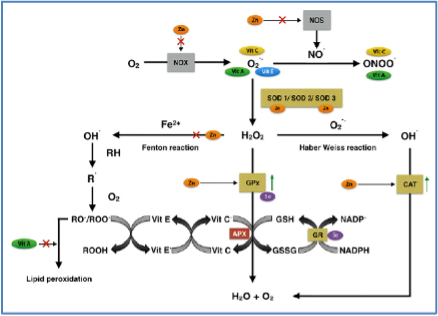
Figur 6. Efter Koekkoek et al [45].
Erhvervet tilladelse.
Vitaminer er essentielle organiske, og mineraler er essentielle uorganiske mikronæringsstoffer, som er nødvendige i små mængder i føden for raske og syge. Antioxidanter er en del af et komplekst endogent forsvar, beregnet til at beskytte væv mod skader fra oxidativt stress – en væsentlig mekanisme i patofysiologien ved kritisk sygdom og udviklingen af organsvigt. Oxidativt stress opstår ved øget dannelse af reaktive ilt -og nitrogenforbindelser (frie radikaler). Antioxidanter neutraliserer frie radikaler ved at donere en elektron til det frie radikal. Antioxidanten eksisterer i både reduceret og oxideret tilstand og kan fungere både som antioxidant og prooxidant. Mikronæringsstoffer med primært antioxidante egenskaber er kobber, selenium, zink, vitamin A, C og E.
Ved øget metabolisme stiger behovet for specielt vandopløselige vitaminer, som er coenzymer i en række metaboliske processer. Plasmaværdier af vitaminer og sporstoffer hos kritisk syge er svære at tolke, da distributionen i kropsvæskerne ændres, mængden af transportproteiner falder, og der kan være øget cellulær optagelse [45]. Tab af de vandopløselige vitaminer B og C kan øges f.eks. under CRRT eller ved exudative tilstande og skal erstattes. Men til den generelle ITA-population er effekten ved at substituere ved paraklinisk mangel ikke klarlagt [46]. Det er stadig helt uvist, hvor stort behovet for vitaminer og sporstoffer generelt er hos kritisk syge [45]. Hvor den kliniske effekt af behandling ikke er belyst og ikke er vist at være vital -som ved eksempelvis målt zinkmangel- bør man overveje at undlade at substituere paraklinisk mangel. Overordnet virker det logisk i det mindste at supplere med den anbefalede daglige dosis til raske (RDA) [47]. Det er ikke usandsynligt, at højere doser kan have gavn. Men på den anden side kan højdosis supplement inducere hypervitaminose og antioxidant toxicitet, især hos patienter med lever-/nyreinsufficiens [45]. Ved indgift af 1.500 kcal enteral ernæring med moderne sondeernæringsprodukter indgives vitaminer og mineraler svarende til rekommanderet dagligt indtag for raske personer. Parenteral ernæring tilsættes standard doser af vand- og fedtopløselige vitaminer og sporstoffer. Forslag til bioækvivalent dosering af mineraler, vitaminer og sporstoffer kan ses i figur 7.
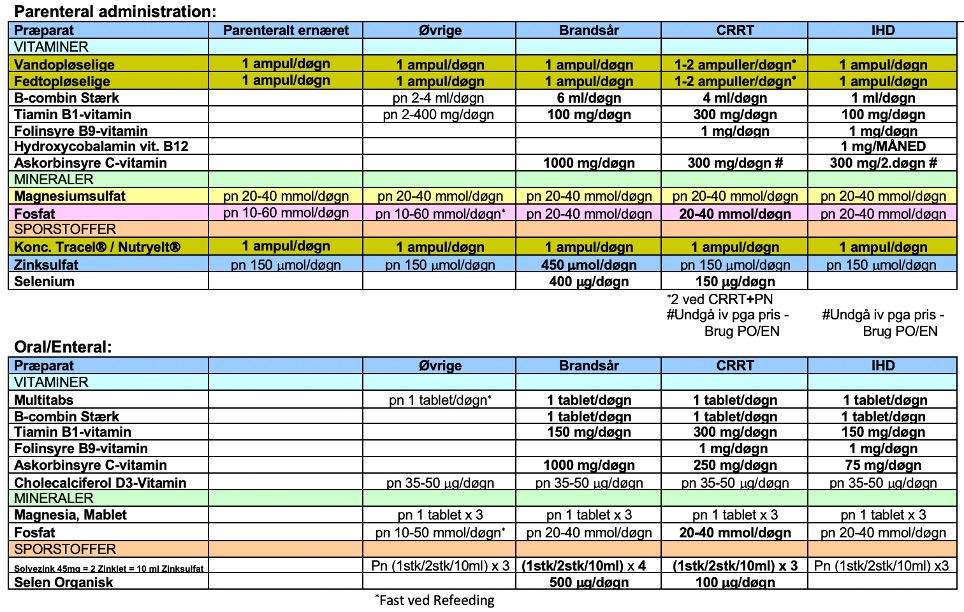
Figur 7. Eksempel på protokol for vitaminer og sporstoffer til kritisk syge.
Egen illustration. Kopiér gerne.
Højdosis monoterapi med antioxidanter, især Selenium og Vitamin C, er undersøgt i RCTs men anbefales fortsat ikke af ESPEN [4, 20]. Et nyligt stort MRCT med højdosis vitamin C til kritisk syge finder øget organpåvirkning og dødelighed [48]. Højdosis monoterapi studier med Vitamin A, Vitamin E og Zink er få [45]. Vi kan aktuelt ikke anbefale højdosis behandling med disse vitaminer og sporstoffer til andre end brandsårspatienter.
At anvende antioxidant cocktails til patienter med sepsis eller ARDS kan virke meningsfuldt. Eksempelvis regenerer Askorbinsyre α-Tocopherol. Nyere veludførte multicenterstudier med antioxidant cocktails har dog ikke vist gavn [49, 50]. Vi finder ikke indikation for supplement med højdosis antioxidanter til kritisk syge [3].
Også vitamin D mangel er hyppigt forekommende under kritisk sygdom og associeret til dårligt outcome. Dosis til kritisk syge er ukendt [51]. Anbefalet daglig dosis til raske er 400 IE (10 µg), svarende til 1 standardtablet Vitamin D3 [52]. En metaanalyse med studier efter 2014 på kritisk syge med anvendt stor loading dosis op til 540.000 IE D3 (cholecalciferol) fandt ingen effekt [53]. I det klart største af studierne fandt man nedsat mortalitet i en prædefineret subgruppe med svær D-vitamin mangel (25-hydroxy vitamin D <30 nmol/l). Et MRCT med 2400 patienter, The VITDALIZE Study, med højdosis D3 til patienter i svær D-vitamin mangel forventes publiceret ultimo 2025 (ClinicalTrials.gov: NCT03188796). ESPEN kommer ikke længere med en anbefaling om at give høj dosis D3 til patienter med D3 mangel [3]. Vi afventer det randomiserede studie før en endelig anbefaling. Vi anbefaler at teste langtidssyge patienter for D3 mangel. Substitutionsdosis kan være 1400-2000 IE (35-50 µg) per dag.
Fysisk aktivitet og ernæring
Øget proteinindtag sammen med fysisk aktivitet ser lovende ud, men evidensen er endnu ikke tung nok til at komme med anbefalinger.
Ved kritisk sygdom ses udtalt proteolyse og muskeltab, som er associeret med ICU acquired weakness. Der er muligvis behov for større proteinindgift og fysisk aktivitet for at overkomme denne anabole modstand – specielt i gruppen af ældre patienter, der er malnutrierede eller i risiko for at blive det. Træning/fysisk aktivitet er i flere studier foreslået at være effektivt til at forebygge dette [3, 4]. I nogle studier ser det ud til at reducere morbiditet og øge aktivitetsniveauet, men der er divergerende resultater. Øget proteinindtag sammen med fysisk aktivitet ser ligeledes lovende ud, men evidensen er endnu ikke tung nok til, at vi ønsker at komme med anbefalinger.
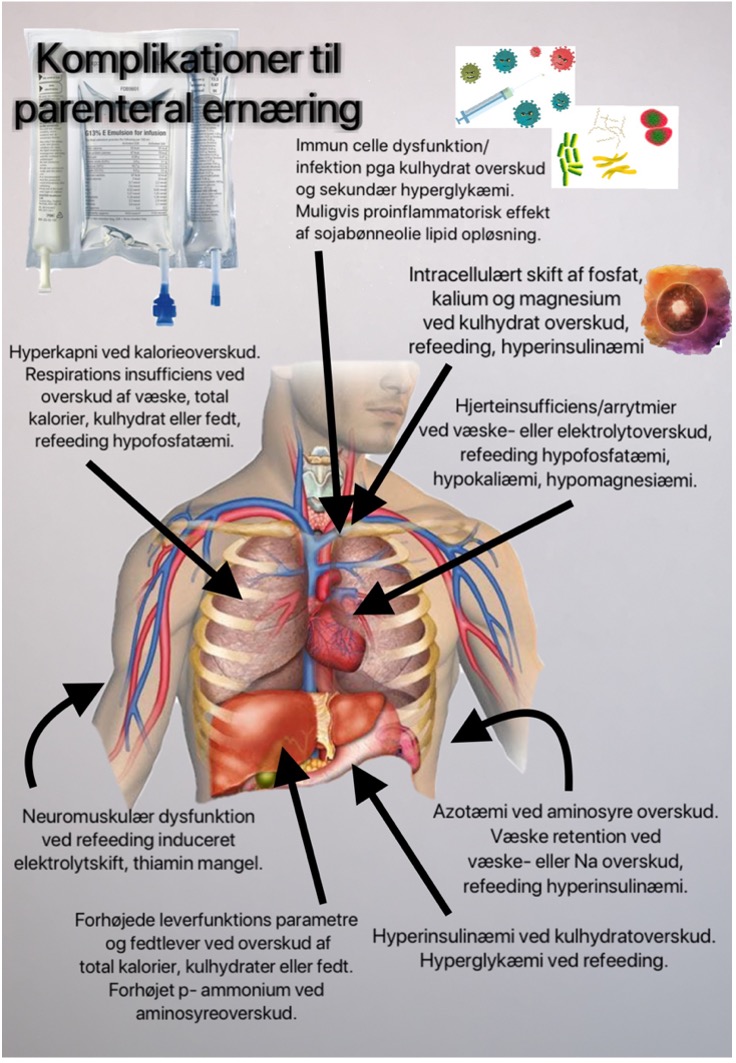
Kliniske og parakliniske indikationer på overdosering af næringsstoffer
Overernæring af patienter skal erkendes for at undgå bivirkninger og potentielle komplikationer.
Denne tabel sammenfatter nogle kliniske og parakliniske tegn til overdosering af makronæringsstoffer.
| Kalorier | Protein | Fedt |
| Høje blodsukkerniveauer uden kendt DM eller højdosis steroid | P-karbamid >30 mM uden blødning/AKI/cellehenfald | P-triglycerid >4,6 mM |
| Højt insulinbehov, eks. >120 ie/dag
uden kendt DM |
Stigende P-karbamid/kreatinin ratio | Leverenzymforhøjelse/-steatose |
| Manglende respiratoraftrapning i respiratorisk stabil fase (hyperkapni) | Stigende P- eller U-karbamid ved øget proteinindgift | Fedt overbelastnings syndrom |
| RQ-ratio >1 ved indirekte kalorimetri | Propofol relateret infusions syndrom | |
| Ventrikelretention | Ventrikelretention | Ventrikelretention |
| Hyperglykæmi og samtidig laktat stigning ikke forklaret ved anden årsag | ||
| Fosfat <0,65 mmol/l eller fald i fosfat >0,16 mmol/l efter start af ernæring |
Figur 8. Komplikationer til overdosering med parenteral ernæring.
Egen illustration
Få ernæringen til at fungere
Enteral ernæring
Patienter, der ikke indenfor 48 timer efter indlæggelse på intensiv afdeling selv kan indtage >60% af det vurderede ernæringsbehov ved peroralt indtag, bør have anlagt en ernæringssonde og starte enteral ernæring, hvis ikke der er kontraindikationer.
Det kan være praktisk udfordrende at ernære den kritisk syge patient. Den akutte sygdom og dens kaskade af metaboliske processer medfører en svær katabol tilstand og den intensive behandling indebærer ofte store mængder væske, sedativa, opioider, vasopressorer og måske muskelrelaxantia samt lang tids immobilisation. Dette er alle faktorer, som øger risikoen for ernæringsintolerance bl.a. pga ventrikleretention og obstipation. Patienternes komorbiditeter som f.eks. diabetes, tarmsygdomme, nyre- og leversygdomme samt neurologiske sygdomme og fedme øger også risikoen for vanskeligheder med at ernære patienterne sufficient. Derfor er det vigtigt, at afdelingen har en procedure for, hvordan man starter ernæringsterapi, og hvordan ernæringen følger patientens sygdomsforløb og monitoreres under indlæggelsen.
Ernæringsterapi bør, hvis der ikke er kontraindikationer (se flowchart), påbegyndes senest 48 timer efter indlæggelse på intensiv, hvis det vurderes, at patienten ikke selv kan indtage nok føde. Fravær af tarmlyde, flatus eller afføring giver ikke kontraindikation mod at starte enteral ernæring.
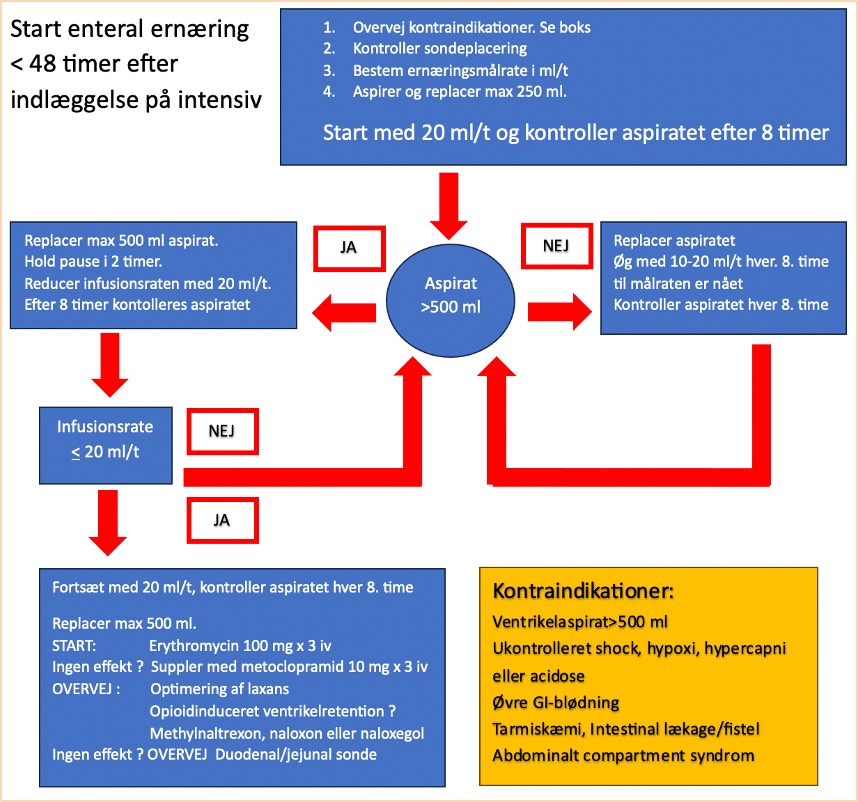
Det anbefales at starte ernæringen enteralt via sonde i ventriklen med afdelingens standard sonde-ernæringsprodukt, og det anbefales initielt at give sondeernæringen over døgnets 24 timer. Senere kan ernæringen gives over kortere intervaller eller evt. som boli. Patienternes hovedgærde bør hvis muligt eleveres 30-45 grader, når der gives sondeernæring. Enteral ernæring bør ikke gives til en patient uden sikker luftvej, hvis vedkommende ikke er tilstrækkelig vågen. Dette gælder fx patienter med afcuffet tube, der således ikke bør have sondeernæring om natten pga. aspirationsfaren. Selvom der ikke er vist forskelle i outcome på, om tidlig ernæring startes enteralt eller parenteralt [10, 54-56], anbefales det som udgangspunkt at starte enteralt og først senere i forløbet eventuelt supplere med eller overgå til parenteral ernæring [8].
Vi anbefaler at følge ovenstående flowchart ved start af ernæringsterapi. Selvom det er vist, at kontrol af ventrikelaspirat ikke er et validt mål for størrelsen af ventrikelindholdet [57-59], anbefaler vi, at der under optrapning af ernæringsterapien kontrolleres aspirat hver 8. time.
Når ernæringen først er etableret, er der ikke evidens for rutinemæssigt at måle ventrikelaspiratets størrelse. Når sondeernæringen skal startes, gør man således følgende:
1. Bestem patientens ernæringsbehov for energi og protein enten ved indirekte kalorimetri eller beregning.
2. Bestem hvilken type sondeernæring, der skal anvendes og beregn hvor stort et volumen patienten skal have.
3. Anlæg ernæringssonde.
4. Sondeernæringen startes efter ovenstående flowchart.
Anlæggelse og kontrol af sonder
Ernæringen gives som udgangspunkt via en naso– eller orogastrisk sonde. Anlæggelse af en fødesonde skal lægeordineres, ligesom der i afdelingen skal foreligge en instruks omhandlende behandling med fødesonden, procedurer ved anlæggelse og kontrol af sondens placering. Placeringen af sonden skal kontrolleres før hver indgift og ved kontinuerlig indgift skal sondens placering kontrolleres 1 x per vagt.
Sondens placering skal markeres ved at mærke sonden ved næsefløjen. Røntgenkontrol med kontrast er naturligvis den sikreste metode, men ved gentagne procedurer er den uhensigtsmæssig, både stråle-hygiejnisk, logistisk og økonomisk. Sonder med guidewire bør dog altid kontrolleres radiologisk efter anlæggelse. For at udelukke, at sonden er placeret i luftvejene, kan man anvende flg. kontrolprocedurer:
| 1. Sprøjt 30 ml luft i sonden, stetoskopér efter boblelyde fra ventriklen |
| 2. Man aspirerer ventrikelindhold fra sonden |
| 3. Man måler pH<5 i det aspirerede |
Hvis to af metoderne indikerer, at sonden er beliggende i ventriklen, kan sonden anvendes – ellers bør der foretages røntgenkontrol. Er der kirurgisk kontraindikation mod en gastrisk sonde, har patienten behandlingsrefraktær ventrikel-retention eller stor risiko for aspiration (f.eks. ved nedsat bevidsthedsniveau uden sikker luftvej), kan det overvejes at anlægge en sonde i duodenum eller jejunum. Disse sonder, evt. med dobbeltløb (ventrikelben til samtidig aspiration fra ventriklen), kan anlægges gastroskopisk under røntgengennemlysning eller ved magnetisk vejledning for specialsonder. Ved aspiration af sondemad fra ventrikelbenet, skal sondens placering kontrolleres, da ernæringsbenet kan være displaceret til ventriklen. Er der på den anden side intet at aspirere fra ventrikelbenet, men kliniske tegn på ventrikelretention (opløb af maveindhold), kan sonden være for dybt placeret med ventrikelbenet i duodenum. Placeringen verificeres radiologisk.
PEG/PEJ-sonder kan overvejes ved behov for langvarig sondeernæring. Anlæggelse og kontrol er en kirurgisk procedure.
Ventrikelretention
Ventrikelaspirat kontrolleres hver 8. time i opstartsfasen, herefter er der ikke indikation – udover som evt del i kontrol af sondeplacering.
Erythromycin er 1. valgs prokinetikum.
Morfinantagonister giver mening ved store doser morfika.
Ventrikelretention, som er forsinket eller manglende tømning af ventriklen til duodenum, ses hyppigt hos kritisk syge patienter og er associeret til øget mortalitet og LOS på intensivafdelingen [60]. Det er en indikator for sygdommens sværhedsgrad men kan også være et symptom på overernæring.
Ventrikelretention kan umuliggøre enteral ernæring og medicin administration. Ventrikelretention defineres på mængden af ventrikelaspirat og på symptomer som opkastning, kvalme eller regurgitation af maveindhold. Det anbefales ikke at kontrollere aspiratets størrelse rutinemæssigt i internationale guidelines. Flere undersøgelser har vist, at der ikke er sammenhæng mellem mængden af ventrikelaspirat og indholdet i ventriklen bedømt ved ultralyd [58, 59]. Der er ingen sammenhæng mellem aspiratets størrelse og hyppigheden af aspiration og pneumoni [61, 62]. Vi anbefaler dog stadig at kontrollere mængden under optrapning af sondeernæring hver 8. time og reducere indgiften ved målte aspirater >500 ml [62]. Når først ernæringen er etableret, er der ikke indikation for at kontrollere aspiratets størrelse rutinemæssigt.
Ved symptomer som opkastning, kvalme, regurgitation af maveindhold til svælget eller munden, mavesmerter eller opdrevet abdomen bør man nedsætte mængden af sondeernæring og starte prokinetisk behandling efter ovenstående flowchart, hvis der ikke er medicinske eller kirurgiske kontraindikationer mod dette. En mekanisk årsag skal selvfølgelig haves in mente.
Ved behov for prokinetika er første valg erythromycin 100 mg x 3-4 iv [60, 63, 64]. Hvis der er manglende effekt efter 1-2 doser erythromycin, suppleres med dopamin-2 antagonisten metoclopramid 10 mg x 3 iv.
Begge stoffer øger motiliteten i antrum og øvre tyndtarm, og begge kan øge QT-intervallet og medføre maligne arytmier. Derfor bør EKG kontrolleres, specielt hvis der behandles med andre QT-forlængende farmaka (f.eks. metadon og fluoquinoloner). Både erythromycin og metoclopramid kan medføre takyfylaksi med manglende effekt efter 3-5 dage, og behandlingen bør derfor ikke fortsætte længere.
Hvis der behandles med store mængder opioid, kan den beskrevne prokinetiske behandling suppleres med en opioid-antagonist [65-67].
Naloxon gives enteralt. Naloxon er en my-opioidreceptor antagonist og en tertiær amin, der passerer blodhjernebarrieren og ophæver opioidets effekt ved iv-indgift.
Ved enteral administration er der 100% first pass effekt i leveren, og naloxon kommer således ikke i det systemiske kredsløb, men ophæver opioidets effekt i mavetarmkanalen. Vi foreslår, at man starter med 2 mg x 3 i sonden. Dosis kan øges til 4-6 mg x 3.
Methylnaltrexon (MNT) gives subcutant. MNT er en perifert virkende my-opioidreceptor antagonist, der ophæver opioidets effekt i mavetarmkanalen (ventrikeltømning, peristaltik og sekretion). MNT er en positivt ladet kvarternær amin, der ikke passerer en intakt blodhjernebarriere og derfor ikke ophæver den analgetiske effekt. MNT gives sc hver 2. dag, og dosis afhænger af vægt og nyrefunktion – se promedicin. Naloxegol (Moventig) er en perifert virkende opioidantagonist, der ikke passerer en intakt blodhjernebarriere. Gives som tablet. 12,5-25 mg dagligt.
Methylnaltrexon og naloxegol bør undgås i det akutte forløb hos patienter med mistanke om betydelig beskadigelse af blod-hjernebarrieren og deraf følgende risiko for øget passage til CNS. I disse tilfælde vil enteral Naloxon være at foretrække. Det gælder også patienter med medullære læsioner.
Enteral naloxon kan være svær at administrere, hvis der allerede er ventrikelretention. I tilfælde hvor der planlægges længerevarende sedation/analgesi, kan man starte behandling med naloxon administreret i sonden samtidig med start på sondeernæring. Der skal være opmærksomhed på, at enteral naloxon ikke kan anvendes til patienter med svært nedsat leverfunktion eller med TIPS (portosystemisk shunt).
Hvis der ikke er effekt af de nævnte medicinske tiltag, kan der anlægges duodenal eller jejunal ernæringssonde.
Obstipation
Obstipation er en hyppigt forekommende tilstand hos kritisk syge og kan ses som en markør for den primære sygdoms sværhedsgrad. Den intensive behandling med sedativa, opioider, vasopressorer, relax-antia, antikolinergika, elektrolytforstyrrelser og immobilisation øger risikoen for udvikling af obstipation.
Obstipation defineres som manglende afføring i > 3 døgn og derudover ses hård afføring, besværlig tarmtømning og abdominal distension, som kan kompromittere respiratoraftrapning, ernæring og mobilisering.
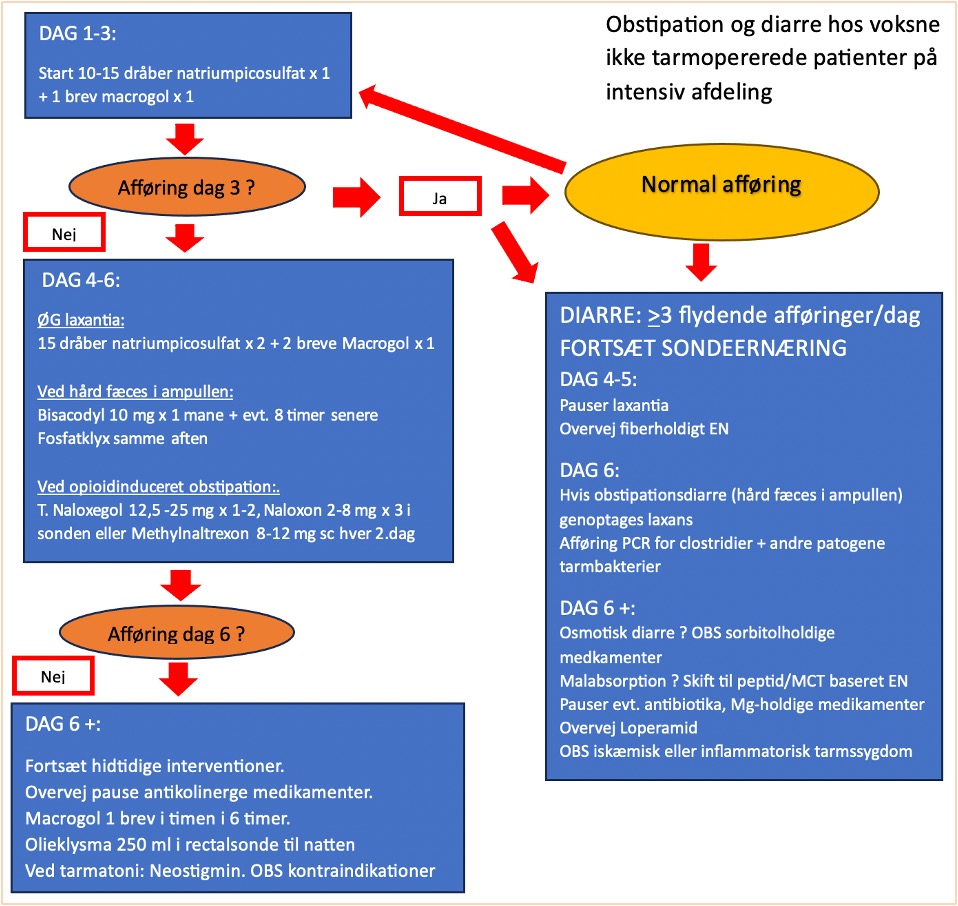
Undersøgelser tyder på, at forebyggelse og behandling af obstipation forkorter LOS på ITA samt tiden i respirator [68, 69]. Vi anbefaler derfor, at der findes en obstipationsprotokol i afdelingen som ovenstående flowchart, og at der startes laxantiabehandling, når enteral ernæring startes. Man kan indlede med et peristaltikfremmende og/eller et osmotisk virkende laksans fx natriumpicosulfat eller macrogol [70-73].
Gives store mængder opioid, kan den laxerende behandling suppleres med en passende opioidantagonist (se nedenstående skema samt kommentarer i afsnit om ventrikelretention) [74-78].
Laksantia kan opdeles efter virkningsmåde:
| Gruppe | Navn | Dosis | Virkning | Obs |
| 1. Osmotisk virkende | Macrogol
Laktulose Sorbitol Magnesium/ elektrolyt- holdige præparater |
1 br. x1-2 | Øger tarmindholdets volumen og osmolaritet. Derved øges peristaltikken, og det medfører, at salt- og vandsekretionen i colon øges, hvorved fæces bliver løsere. | Nedsætter farmakas optag i tarmen => Giv aftendosis. Laktulose anvendes på special indikation (hepatisk encephalopati). Ikke som vanligt laxantia pga. risiko for dannelse af tarmluft og udspilet abdomen |
| 2. Peristaltik
fremmende |
Bisacodyl
Natrium- Picosulfat |
15 mg rektalt
15 dr. x 1-2 |
Virker via nerve-plexerne til den glatte muskulatur i tarmvæggen. Øger tarmens peristaltik. Hæmmer absorptionen, øger sekretion af salt og vand i tarmen. | |
| 3. Laksantia med effekt i rectum | Glycerol
Fosfat |
1 klyx x 1 | Virker blødgørende på fæces og ved at fremkalde defækationsrefleks | |
| 4. Opioid-antagonister | Methyl-
naltrexon |
12 mg sc. hver 2. d.
Afhængig af vægt og nyre-funktion |
Perifert virkende my-opioid receptor antagonist. Ophæver opioids effekt i gastrointestinal kanalen (ventrikeltømning, peristaltik og sekretion). Et positivt ladet (ved fysiologisk pH) kvarternært amin med lav fedtopløselighed. Passerer ikke en intakt blodhjerne barriere; ophæver ikke opioidets analgetiske effekt | Påvirker ikke QT-intervallet.
Mulig effekt efter 30 min. Ikke i akut fase ved beskadiget blod-hjernebarriere. Kontraindiceret ved mistanke om gastro-intestinal obstruktion eller perforationsrisiko. |
| Naloxegol | 12,5-25 mg x1 | Perifert virkende my-opioid receptor antagonist. Administreres som tabletter. Giv 2 timers ernæringspause inden. Passerer ikke en intakt blod-hjernebarriere. | Påvirker ikke QT-intervallet.
Ikke ved ventrikelretention. Ikke i akut fase ved beskadiget blod-hjernebarriere. |
|
| Naloxon | 2-3 mg x3
Anvend iv-formu-leringen i sonden |
My-opioidreceptor antagonist. Tertiær amin, fedtopløselig, passerer blodhjerne barrieren. Næsten 100% first pass effekt i leveren, naloxon kommer ikke i blodbanen, ophæver ikke opioidets analgetiske effekt. Virker efter 12-24 timer. | Påvirker ikke QT-intervallet.
Ikke ved ventrikelretention, risiko for GI-obstruktion, perforation, cirrhose eller TIPS |
|
| 5. Bulk-laksativa | Ex. frøskaller | Anbefales ikke til kritisk syge patienter, da det kræver indtag af en del vand | ||
| 6.Neostigmin | Inf: 0,4
(-0,8) mg/t. Bolus: iv 0,25-0,5 mg x 4-6 |
Cholinesterasehæmmer, der kan anvendes ved tarmatoni | Skal konfereres m. kirurg. 24 t uden effekt: Stop. Kontraindikation: mistanke om GI-obstruktion. Giv altid 0,2 – 0,4 mg atropin eller 0,1 mg robinul for at undgå bradykardi |
Diarré
Diarre er hyppigt forekommende hos kritisk syge patienter og defineres som mere end 3 flydende afføringer per dag. Man kan anvende Bristol skalaen til at beskrive afføringen. Diarre har mange uheldige følgevirkninger. Det kan medføre dehydrering og elektrolytforstyrrelser og kan give hudløshed og sårdannelse omkring endetarmsåbningen. Det kan være en stor belastning for den vågne patient og afstedkomme ubehagelige situationer. Hvis patienten har diarre om natten, medfører det også forstyrret nattesøvn. Derudover er diarre hos patienterne en stor arbejdsbelastning for plejepersonalet.
Hvis patienten har diarre, skal laxantiabehandlingen seponeres – dog ikke ved obstipationsdiarre, og ernæringsterapien skal fortsættes.
Alle sondeernæringsprodukter er glutenfri med meget lavt indhold af laktose og tåles af de fleste.
Man kan overveje at skifte til et fiberholdigt sondemadspræparat.
For at beskytte huden omkring endetarmsåbningen kan man lægge en sonde med cuff op i rectum og på den måde samle diarreen i en pose og undgå hudkontaminering – dette kun ved vandtynd diarre. Sondesystemet skal skylles 3 gange i døgnet. En anden mulighed er at klistre et posesystem fast omkring endetarmsåbningen for på den måde at opsamle diarreen.
Det er vigtigt at søge årsagen til diarreen og løbende erstatte væske- og elektrolyttab [79, 80].
Årsager til diarré:
| Infektion | Clostridium Difficile. Risikofaktor: Antibiotika, protonpumpehæmmer Vira: Roskildesyge (norovirus, rotavirus eller adenovirus). |
Kontaminering af sondemaden.Bivirkning medicinAntibiotika, prokinetika (erythromycin, metoclopramid), laxantiaIskæmisk colitisFor tidlig sondeernæring ved septisk shock? => høj mortalitetMalabsorptionPancreasinsufficiensOsmotisk diarréHøj osmolaritet i det enterale ernæringsprodukt eller medikamenterObstipationsdiarréMassiv obstipation kan ledsages af diarré
Vi anbefaler at følge ovenstående flowchart mhp. at diagnosticere årsagen til diarreen og behandle den.
Er der mistanke om malabsorption, kan der skiftes til et produkt baseret på peptider og mellem-kædede fedtsyrer, der lettere optages i tarmen. Har patienten et perkutant galdedræn (PTC-dræn), kan galden gives tilbage i en enteralt placeret sonde for at bedre fedtoptagelsen i tarmen og undgå diarre.
Fasteregler på intensiv afdeling
Kritisk syge intuberede eller tracheotomerede patienter faster ofte unødigt til diverse procedurer som f.eks. scanninger, operationer eller anden diagnostisk. Denne praksis kan medføre, at patienten ikke når sit ernæringsmål med stort energi- og proteindeficit til følge.
Ultralydsvejledt vurdering af ventrikelindholdet er mere nøjagtig end aspiration og har vist, at der ikke sammenhæng mellem fastetid og indholdet af ventriklen hos patienter på intensiv afdeling [57-59].
ASPEN anbefaler, at man undgår faste af rutinemæssige årsager som f.eks. ved procedurer, der medfører korterevarende sænkning af hovedgærdet (fra de anbefalede 30-45 grader) [81].
Et randomiseret studie med 1130 mekanisk ventilerede patienter med en gennemsnitsalder over 62 år viste, at risikoen for reintubation eller død 7 dage efter ekstubation var lige stor uanset, om patienterne havde fået sondeernæring eller fastet op til ekstubationen [82]. De ikke-fastende patienter kunne tværtimod ekstuberes hurtigere, når de var vurderet klar hertil, kunne udskrives hurtigere og havde færre tilfælde med hypoglykæmi. Over en trediedel af patienterne havde risikofaktorer som stroke, neuromuskulær sygdom, diafragmadysfunktion eller delir. Man bemærker, at over 80% af patienterne var medicinske, og at der var flere med insufficient hostekraft i fastegruppen.
Vi anbefaler derfor, at patienter, der er vurderet klar til ekstubation på intensiv, som ikke har tegn på ventrikelretention, vurderes at have sufficient hostekraft og ikke for nyligt er abdominalt opererede, ikke behøver at faste før ekstubation. Med hensyn til procedurer udenfor intensivafdelingen, anbefaler vi, at intuberede eller tracheotomerede patienter som udgangspunkt ikke behøver at faste før disse procedurer – dog bør man aftale fremgangsmåden med anæstesiologerne.
| Vi anbefaler fasteperiode i følgende situationer: |
| Kirurgiske indgreb i abdomen under fascien |
| Skopier i øvre- eller nedre gastrointestinalkanal – også TEE |
| Kirurgiske indgreb i bugleje |
| Kirurgiske indgreb i øvre – og nedre luftveje, hvor den sikre luftvej kan tabes og tubeskift kan komme på tale – dette gælder også tracheotomi på OP eller intensiv |
| Scanninger, hvor patienten SKAL være fastende efter lokale retningslinjer f.eks. PET-CT |
| Patienter med kendt ventrikelretention |
| Patienter med insufficient hostekraft |
| Gravide |
Patienterne må altid få den medicin i sonden, der ikke kan pauseres, selvom de faster.
OBS sukkerholdig medicin og PET-CT.
Der kan evt. gøres ultralydsscanning af ventriklen inden ekstubation eller andre procedurer for at sikre sig, at ventriklen ikke er fyldt.
Ernæringsprodukter
Produkter som kan anvendes til ernæring af kritisk syge betegnes officielt som ”fødevarer med særlige medicinske formål”. Det er fødevarestyrelsen, www.foedevarestyrelsen.dk, der sikrer, at anvendelsen er ”sikker, gavnlig og effektiv til opfyldelse af de særlige ernæringsmæssige krav hos de personer, som produkterne er beregnet til”. Kravene til produkterne er:
• ”produkterne skal som udgangspunkt indeholde alle næringsstoffer i balanceret mængde svarende til de nordiske næringsstofanbefalinger, især hvis de anvendes som eneste ernæringskilde. • amino- og fedtsyreprofilen skal være egnet til, at produktet kan opfylde sit formål.
• produkterne skal overholde de minimums- og maksimumsgrænser for indhold af vitaminer og mineraler, der er anført i bekendtgørelse om fødevarer til særlige medicinske formål.” Fødevarer med særlige medicinske formål må kun sælges gennem hospitaler, apoteker, lægeledede kliniker og kliniske diætister. Kilde: www.pro.medicin.dk.
Medicinske ernæringsprodukter kan inddeles i orale, enterale og parenterale ernæringsprodukter. Hver gruppe indbefatter produkter til
• Supplering af en anden form for ernæring. Disse produkter indeholder IKKE alle komponenter til at dække et fuld ernæringsbehov
• Fuld ernæring. Tilgodeser alle ernæringsbehov
• Evt. produkter til specielle ernæringsbehov
.
Orale Ernæringsprodukter
| Mælkebaserede ernæringsdrikke | Saftbaserede ernæringsdrikke |
| Kan anvendes som eneste ernæringskilde | Egnet til patienter som har højt energibehov |
| Kan give problemer mht. smagen, som nogen patienter afviser | Dækker IKKE fuld ernæringsbehov, skal kun bruges som supplement |
| Kan have højt indhold af protein (op til 27 % af energiindhold) | Smager bedre |
| Har forskellig osmolaritet og kan indeholde fibre | Indeholder færre mineraler og sporstoffer |
| Desuden findes mælkebaseret pulver, creme, is og budding |
Mange ernæringsdrikke kan have en høj osmolaritet (>300 mosm/l) og kan derfor give problemer med
blandt andet vandflux ind i ventriklen og diarre, hvis de gives i en ventrikelsonde. En oversigt over orale
ernæringsprodukter på det danske marked findes på
www.pro.medicin.dk/Laegemiddelgrupper/Grupper/309014#a000
Enterale ernæringsprodukter
Oral eller enteral ernæring kan være fuldgyldig eller supplerende. Alle produkter er glutenfri og har et lavt indhold af laktose og kan anvendes ved gluten- og laktoseintolerans.
Indholdet af energi og protein samt typen af protein varierer.
Fås med og uden fibre.
Fiberrige sondemadsprodukter frarådes ved hæmodynamisk ustabile patienter og ved tarmiskæmi.
Enterale ernæringsprodukter er beregnet til at blive givet via en sonde beliggende i gastrointestinalkanalen.
Produkterne kan indeholde protein på forskellige måder:
• Polymerisk (helprotein)
• Oligomerisk (peptid)
• Monomerisk (aminosyre)
Oligomeriske diæter bliver bedst optaget i tarmsystemet og bliver anvendt ved patienter med kompromitteret tarmsystem. Produkter med protein i form af aminosyrer har ofte for høj osmolaritet og kan give bivirkninger i form af dumping og diarre.
Animalsk protein optages lettere end vegetabilsk protein, derfor er proteinkilden ved enteral ernæring mælkeprotein. Der findes plantebaserede produkter baseret på soya-eller ærteprotein, som kan anvendes, hvis de har en tilsvarende aminosyre score. Det er ikke dokumenteret, at man optager plantebaseret protein bedre, hvis man har levet plantebaseret i mange år.
Alle præparater er glutenfri og har enten et lavt indhold af laktose (0,5g/100g) eller er klinisk laktosefri (0,025 g/100 g).
Produkterne kan inddeles i
Standardprodukter:
Standardsammensætning af ernæringskomponenter, som skal erstatte almindelig kost.
Egnet til personer med nedsat eller forstyrret evne til at indtage, fordøje eller udskille almindelige
fødevarer eller bestemte næringsstoffer.
Fiberrige sondemadsprodukter:
Der har været øget opmærksomhed på rollen af fiberrig enterale ernæringsprodukter. Fiber fungerer som næring for bakterier og beskytter derfor tarmmukosaen samt fremmer en fordelagtig udvikling af tarmfloraen. Desuden promoverer fiber en fermentation med produktion af korte fedtsyrer (short chain fatty acids SCFA), som bliver metaboliseret og modvirker produktion af proinflammatoriske metabolitter. Dette kan være forklaringen på, at der i litteraturen er tendens til at kritisk syge på fiberrig diæt viser en forbedret tarmflora og tarmbarriere, mindre inflammation på længere sigt, mindre tid i respirator og lavere mortalitet. Evidensen er dog begrænset af heterogenitet af studier, små patientpopulationer og publikations bias [73, 83, 84]. Der er dog fortsat usikkerhed om den ideelle dosis af fiber og sammensætning af opløselige og uopløselige fiber.
Ved patienter med diarre kan man forsøge fiberrige ernæringsprodukter til forbedring af tarmfloraen.
Produkter med opløselige fiber øger vandvolumen i tarmen, fremmer produktion af SCFA og gør afføringen blødere. Denne effekt kan hjælpe ved obstipation. Uopløselige fiber forkorter tiden af passagen af afføring gennem tarmen. Guidelines anbefaler indtil videre ikke anvendelse af produkter med uopløselige fibre.
Fiberrige sondemadsprodukter frarådes ved hæmodynamisk ustabile patienter og ved tarmiskæmi.
Produktvalg:
Primært skal man efterkomme patientens behov for energi og protein. Der kan dog være flere hensyn at tage, og her må man vælge det bedst egnede produkt eller kombinere flere.
Der anbefales at have et standardprodukt og et produkt med høj proteinindhold på lager. Vær opmærksom på muligheden for at give højprotein (evt. 10 g protein/100 ml) ernæringsdrikke i sonden som tilskud til EN.
Til overhydrerede patienter og patienter med ventrikelretention kan et energitæt og proteintæt produkt være en fordel.
Sondemad med lav natrium, kalium og fosfatindhold kan være nyttig samt et produkt rig på kostfibre ved hæmodynamisk stabile patienter med diarre.
Til personer med sygdomme, som kræver speciel diæt, f.eks. stofskiftesygdomme, leverinsufficiens,
nyresygdomme kan man rekvirere specielle produkter ved behov, da de ikke bruges tit og ofte bliver for gamle. Det må bemærkes, at specialprodukterne er væsentligt dyrere end standardprodukterne.
En opstilling og sammensætning af de forskellige produkter sondemad kan blandt andet findes på
www.pro.medicin.dk/Laegemiddelgrupper/Grupper/309012#a000
Parenteral ernæring, produkter og additiver
Parenteral ernæring skal bruges som total PN eller som supplement (SPN), når oralt indtag og/eller enteral ernæring ikke kan gennemføres eller er kontraindiceret.
SPN startes på 3-7 dagen afhængig af ernæringsrisiko og stabilitet.
PN er ikke relateret til nosokomielle infektioner. Komponenterne i parenteral ernæring fås i adskilte opløsninger og i 2 eller 3 kammerposer.
Max. doser:
Glucose 5 mg/kg/min.
Aminosyrer 2 g/kg/døgn
Lipid 1 g/kg/døgn (max 1,5 g/kg/døgn)
Ved parenteral ernæring (PN) forstås ernæring indgivet intravenøst. Parenteral ernæring er et medicinsk ernæringsprodukt. Enteral ernæring (EN) foretrækkes fremfor PN hos kritisk syge patienter. Hos de patienter, hvor EN ikke tolereres i løbet af den første uge på intensiv på trods af at alle strategier til at opnå EN er forsøgt, bør man overveje behandling med PN. Det optimale tidspunkt for start af PN er usikker. Overernæring med PN er associeret med større risiko for infektion og øget mortalitet. Dog ses der ikke øget risiko for infektion, hvis EN og PN gives i samme ernæringsmængde.
Produkter: PN er en blanding af separate komponenter, som indeholder lipidemulsioner, glucose, aminosyrer, vitaminer, elektrolytter, mineraler, sporstoffer og vand. Hovedindholdet er glucose, lipid og protein. Sammensætningen tilsvarer fuld ernæring. Lipid tilfører kalorier og forhindrer fedtsyremangel. 25-30 % af det totale kalorieindhold består af lipider. Oftest anvendes industrielt fremstillede standardprodukter bestående af flere-kammerposer. De produkter der findes på markedet kan ses på https://pro.medicin.dk/Laegemiddelgrupper/Grupper/79026 samt på producenternes hjemmesider.
Start af parenteral ernæring og monitorering heraf: Når PN startes, er det vigtigt at undgå overernæring. Kritisk syge patienter skal ikke ernæres fuldt fra indlæggelsens start men optrappes til fuld ernæring i løbet af de første 3-7 dage. Optimal glykæmisk kontrol er vigtig. Indgift af glucose og lipider kan føre til hyperglykæmi og påvirket leverfunktion. Indgiften af glucose må ikke overstige 5 mg/kg/min. Overskydende indgift af glucose kan resultere i hyperglykæmi samt hypertriglyceridæmi, der fører til fedtlever. En øget mængde glucose i blodet inducerer hepatisk lipogenese, og hyperglykæmi inducerer øgede insulinniveauer, hvilket fører til mere lipogenese. Intravenøst lipid anbefales til 1 g/kg/døgn – mængden kan dog øges, hvis dette tolereres, men må ikke overstige 1,5 g/kg/døgn. Ved for stor lipidindgift kan ses nedsat lungefunktion og immunsupression. Propofol er også en kilde til fedtsyrer og indeholder 1,1 kcal/ml. Hvis PN skal gives mere end 10 dage, er det vigtigt at indgive adækvat niveau af de essentielle fedtsyrer, DHA og EPA fra fiskeolie samt -linolensyre og linolsyre fra planteolier og soyaolie, som er tilsat PN. Op til 0,1-0,2 g/kg/døgn) kan gives.
Elektrolytter, sporstoffer og vitaminer bør tilføres dagligt sammen med PN. Se generelle kapitel omhandlende mikronæringsstoffer, antioxidanter, vitaminer og sporstoffer.
Hygiejnen omkring de iv-katetre, der bruges til PN, bør være i top for at undgå infektioner. På grund af høj osmolaritet, som kan irritere venerne, skal PN administreres gennem et centralt venekateter. Hvis PN skal gives perifert, skal det være i en begrænset periode af få dage og være et produkt, der er beregnet hertil med lavere osmolaritet < 900mOsm. Patienten bør vejes dagligt, da der er risiko for overhydrering ved at nå ernæringsmål med hyposomolære produkter. Hyperglykæmi behandles med insulin, se kapitel angående blodsukkerkontrol. Ved forhøjet p-triglycerid > 4,6 mmol skal lipidindgiften reduceres eller pauseres ved meget høje værdier. Ved samtidig propofol indgift må man reducere propofol dosis eller skifte sedationsstrategi [3, 85-87].
| Indikationer for parenteral ernæring |
| Kan opstartes, når alle strategier til at opnå sufficient ernæring med PO eller EN er forsøgt |
| Hvis EN er kontraindiceret bør PN opstartes indenfor 3-7 dage. Se kapitel om generelle behov |
| Kan være indiceret hos en stabil kirurgisk patient efter tarmiskæmi, blindlukning/obstruktion eller compartment |
| Ved anastomoselækage eller fistler, hvor anlæggelse ernæringssonde distalt ikke er muligt |
| Ved extuberede patienter med dysfagi, høj risiko for aspiration og hvor der ikke er mulighed for postpylorisk ernæring |
| Mens synketræning udføres og ventrikelsonden er seponeret i forbindelse med optimering af træning |
| Monitorering af PN ernæringsterapi | |
| Hver 2-4 time | Blodsukker |
| Dagligt
CRRT og refeeding syndrom |
Karbamid, kreatinin, elektrolytter Fosfat, Magnesium
Vægt |
| 2 x/uge | Levertal, infektionstal, albumin, fosfat, magnesium, Zink.
P-Triglycerid/lipidtest |
Probiotika
Behandling med probiotika anbefales ikke til kritisk syge patienter.
Fæcestransplantation kan evt. anvendes til udvalgte patienter med behandlingsresistent Cl.difficile infektion.
Under kritisk sygdom ses store og hurtigt indsættende ændringer af tarmens mikrobiom, oftest multifaktorielt betinget grundet anvendelse af syrepumpehæmmere, katekolaminer, bredspektrede antibiotika, mekanisk ventilation samt evt. den tilgrundliggende sygdom.
Typisk ses et massivt fald i det totale antal anaerobe bakterier inkl. lactobacilli og bifidobacteria med tilsvarende fald i produktionen af kortkædede fedtsyrer, som bl.a. udgør vigtige næringssubstrater for enterocytterne. Stigende pH i fæces er i en intensiv kohorte vist at være stærkt associeret til incidens af bakteriæmi samt mortalitet [88], ligesom et fald i anaerobe korrelerer med øget mortalitet hos patienter med MODS [89].
Probiotika er levende mikroorganismer, som ved peroral eller enteral indgift kan tilføre en forbedring af værtens sundhedstilstand. De bedst undersøgte er stammer af mælkesyrebakterier (lactobacilli og bifidobacteria) samt gærsvampe (saccharomyces).
Det videnskabelige rationale for probiotisk behandling til kritisk syge patienter omfatter: kompetitiv hæmning af intestinal overvækst af patogene tarmbakterier, styrkelse af tarmmucosas barrierefunktion, immunomodulation og produktion af baktericide forbindelser [90].
Flere tidligere studier og metaanalyser vedr. anvendelse af probiotika til kritisk syge, intuberede patienter har indikeret en reduktion i forekomsten af ventilator-associated pneumonia (VAP) og ICU LOS [91, 92]. Studierne har generelt været små og med varierende definitioner på VAP. Det nyligt publicerede ROCIT studie var en MRCT omfattende 221 kritisk syge patienter, hvor interventionsgruppen modtog peroral behandling med Lactobacillus plantarum påbegyndt indenfor 48 timer efter ITA-indlæggelse og fortsat i 60 dage [93]. Behandlingen var sikker, men uden effekt på endepunkterne mortalitet og incidens af nosokomielle infektioner. En stor RCT (PROSPECT) omfattende 2653 kritisk syge patienter randomiseret til daglig enteral indgift af Lactobacillus rhamnosus vs. placebo fandt ingen forskel i incidensen af VAP (primært endepunkt) eller i nogen af de 20 præspecificerede sekundære endepunkter inkl. antibiotikabrug, diarré, LOS eller mortalitet [94]. 16 patienter i interventionsgruppen fik påvist vækst af L. rhamnosus sv.t. sterile sites, heraf 11 med positive bloddyrkninger.
På baggrund af den foreliggende evidens kan behandling med probiotika ikke anbefales til kritisk syge patienter, ej heller til specifikke subgrupper af disse.
Autolog eller heterolog fækal mikrobiota transplantation (FMT) har vist sig effektiv til behandling af fulminant eller recidiverende enterocolitis med multiresistent Cl. Difficile samt til eradikation af andre multiresistente patogene tarmbakterier [95, 96]. Behandlingen kan være indiceret til udvalgte kritisk syge patienter, men indikationen må afvejes i forhold til antibiotikatrykket mod mikrobiomet og bør stilles i samråd med lokal gastroenterologisk afdeling.
Blodsukkerkontrol
Tidligere studier tydede på, at stram blodsukkerkontrol var forbundet med lavere mortalitet [97]. Denne tilgang resulterede i væsentlig flere tilfælde med hypoglykæmi. Svær hypoglykæmi hos kritisk syge patienter har i flere studier vist at være en uafhængig risikofaktor for mortalitet. Til gengæld har senere studier vist, at en mere liberal tilgang til blodsukkerniveauet ikke er så skadeligt som tidligere frygtet – især blandt patienter, der i forvejen er kendt med diabetes og vant til at have et forhøjet Hba1C. Udover vigtigheden i at undgå hypoglykæmi viser flere studier, at man bør sætte ind på flere områder i forhold til blodsukkerkontrol mhp. at opnå et bedre outcome. Dette drejer sig om både blodsukkermål, glykæmisk variabilitet og time in target range. Alle faktorer er vist at være med til at bedre outcome hos kritisk syge patienter [98, 99]. Flere undersøgelser tyder også på, at ikke-diabetikere eller meget velregulerede diabetes patienter tåler hyperglykæmi dårligere end diabetikere, der i forvejen er kendt med et højere Hba1C [100, 101]. I Surviving Sepsis Campaign fra 2021 [102] anbefales det at tilstræbe et blodsukker-(BG)-mål på 8-10 mmol/l samt at starte insulinterapi ved blodsukker på ≥10 mmol/l. The American Diabetes Association [103] har i 2021 offentliggjort en større rapport på baggrund af de seneste forskningsresultater og anbefaler et blodsukkerinterval hos langt de fleste patienter på 7.8-10 mmol/l samt at starte insulinterapi intravenøst ved blodsukker på ≥10 mmol/l. Hos udvalgte patienter f.eks. postoperative og hjerteopererede foreslås blodsukkermålet reduceret til 6,1-7,8 mmol/l, såfremt dette kan gøres uden større risiko for hypoglykæmi.
Kritisk sygdom medfører øget insulinresistens samt hyperglykæmi [101, 104, 105]. Hos diabetikere uden- eller med nedsat insulinproduktion kan der opstå insulinmangel og som følge heraf, kan der udvikles ketoner, hvilket kan føre til metabolisk acidose og ketoacidose [105-107]. Diabetikere, som behandles med en SGLT-2 hæmmer, kan i forbindelse med kritisk sygdom udvikle insulinmangel selv med et normalt blodsukker og dermed udvikle euglykæmisk ketoacidose [107, 108]. Her er det relevant at måle blodketoner ved et nær-normalt blodsukker samt metabolisk acidose [105-107].
Blodsukker niveau: Vi anbefaler blodsukkermål hos kritisk syge intensive patienter på 6-10 mmol/l [109].
BG-mål 6-10
Hypoglykæmi under insulinbehandling:
Pause vanlig anti-diabetesmedicin.
Omlægning af s.c langtidsvirkende basal insulin til hurtigtvirkende intravenøs basalinsulin, som anses som minimumdosis.
Falder blodsukkeret til under 6 mmol/l behandles dette med kulhydrater – enten startes eller øges ernæringen, der gives glukose enteralt eller suppleres med glukoseinfusion. Insulininfusionen pauseres midlertidig, hvis der opstår hypoglykæmi ved blodsukker på ≤ 4 mmol/l. Ved valg af glukoseinfusion bør vælges mindst 10% glukoseinfusion for at undgå udvikling af hyponatriæmi.
Administration:
Hurtigtvirkende insulin bør administreres som PN-dosis eller infusion.
Der anbefales intravenøs insulinindgift [110, 111] frem for subkutan administration mhp. at sikre præcis absorption samt minimere risikoen for blodsukker-variabiliteten. Insulinen kan gives som PN, hvis der skønnes et lavt behov, og patienten ikke er kendt med insulinbehandlet diabetes mellitus. Ellers anbefales det at opstarte insulin som infusion.
Målehyppighed og metode: Anslagstiden på Insulin givet subkutant er ca. 30 min. IV insulin virker hurtigere [111]. Udfordringen ved kritisk syge er en øget variabilitet og mange ukendte faktorer der påvirker blodsukkeret og anslagstiden af insulin. Som udgangspunkt anbefales blodsukkerkontrol hver time [106, 109], indtil blodsukkeret er stabilt hos kritisk syge patienter. Hvis der forekommer hypoglykæmi, må hyppigheden øges. Således er målehyppigheden noget der tilpasses løbende. For mest muligt præcist blodsukker anbefales prøve fra venøst eller arterielt blod fremfor kapillærprøve grundet risiko for overestimering af BG hos patienter med subkutant ødem, shock og hypoksæmi ved kapillærprøve [97]. I et protraheret men ellers stabilt intensiv forløb kan kapillærprøve overvejes af ressourcemæssige årsager.
Ketonbestemmelse: Blodketon måling anbefales hos kritisk syge diabetikere med metabolisk acidose, der opfylder kriterierne for ketoacidose (BG>15 mmol/l, pH<7,30 og/eller HCO3⁻ <18 mmol/l). Diabetes patienter, der indenfor de sidste 4 dage har været i behandling med SGLT-2-hæmmer og som samtidig opfylder kriterierne for ketoacidose (fraset et BG>15mmol/l), bør få kontrolleret blodketoner for at udelukke, at patienten også har euglykæmisk ketoacidose eller er på vej til udvikling af dette.
Ernæring og insulinterapi: Det giver mest stabile blodsukre, når kulhydraterne administreres som kontinuerlig enteral ernæring, parenteral ernæring eller glukoseinfusion. Når patienter begynder at indtage forskellige kulhydratholdige fødeemner per os, vil blodsukkeret og blodsukkervariabiliteten udfordres. Strategien for at håndtere dette vurderes i de enkelte situationer. Følgende forslag til at opnå bedre kontrol kan overvejes:
– vælge ernæringskilder uden- eller med begrænset mængde kulhydrater
– give insulinbolus i forbindelse med måltidet
– behandle hyperglykæmi efter måltidet med justering af insulindosis eller ved at give korrektionsinsulin jf. sliding scale [104, 105]
Overgang fra intensiv til stamafdeling: Perorale antidiabetes medicin startes op på sengeafdelingen, når patienten er stabil og spiser sufficient. Patienter, der har brug for intravenøs korrektionsinsulin eller insulininfusion, skal overgå til subkutant regime typisk med langtidsvirkende basalinsulin. Dosis vurderes ud fra døgnets sidste totale insulin behov. Når der skiftes fra intravenøst insulin til subkutant langtidsvirkende, anbefales det at have et overlap på 2-4 timer, så patienten sikres sufficient insulin i kroppen. Der skal altid ordineres blodsukkermåling x 5 i døgnet samt foreligge en ordination på korrektionsinsulin efter sliding scale. Det kan være relevant med et diabetestilsyn mhp. planlægning og opfølgning.
Ernæring ved malnutrition og refeeding syndrom
Mistanke om risiko for Refeeding?
Kontrollér Kalium/Calcium/Fosfat/Magnesium.
FØR ernæringsstart og dagligt.
Giv Tiamin 200 mg x2 po/iv + B-combin po/iv.
Substituér elektrolytterne, ISÆR Kalium.
Start med 8-10 kcal/kg/døgn, trap langsomt op til 25 kcal/kg/døgn i løbet af 5-7 dage.
SKRU NED ved vedvarende Fosfat<0,71.
Rehydrer varsomt
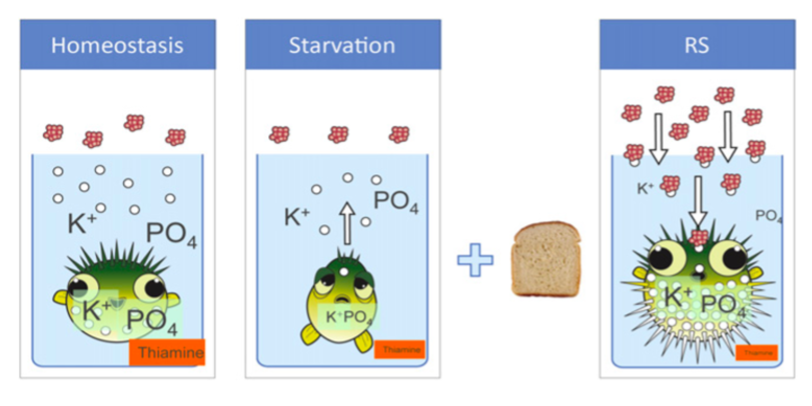
Figur 9. Glukose til langvarigt fastende.
Erhvervet tilladelse.
Kronisk underernærede patienter (geriatriske, onkologiske, korttarm/malabsorption, misbrugere) har høj risiko for udvikling af refeeding syndrom (RS) ved opstart af målrettet ernæringsterapi. Kritisk syge med BMI < 20 har højere mortalitet end normal-/overvægtige, hvilket sandsynligvis afspejler malnutrition. RS kan dog også ses ved normal ernæringstilstand eller højt BMI som et refeeding lignende syndrom med elektrolytforskydninger. Op mod 50 % af kritisk syge er vurderet i risiko for RS ved indlæggelsen på intensiv. RS er en potentielt livstruende og ofte underdiagnosticeret tilstand. Studier har vist, at kun 14-50% af læger og diætister kan identificere risikopatienter og -faktorer. Den kronisk underernærede/fastende patient er kendetegnet ved en katabol metabolisme med overvejende fedtforbrænding, svind af energireserver og intracellulære elektrolytter (væsentligst fosfat, magnesium og kalium) samt depletering af thiamin og andre vitaminer. Ved genstart af ernæring ændres metabolismen abrupt i anabol retning med overvejende (fosfat- og thiamin-krævende) glukoseforbrænding og stigende insulinproduktion, hvilket medfører cellulært influx af de depleterede elektrolytter og resulterende hypofosfatæmi, -magnesiæmi og -kaliæmi samt thiaminmangel. Sideløbende ses stigende P-natrium og væskeretention. Thiamin-behovet er stærkt øget. Derangementet medfører nedsat ATP-produktion, lactacidose og membraninstabilitet med kliniske manifestationer i f.a. muskelsvaghed, respirationsinsufficiens, hjertesvigt, tachyarytmier, rhabdomyolyse, konfusion og kramper samt risiko for udvikling af Wernicke-Korsakoff syndrom.
RS kan udvikles hurtigt over timer til dage. Kliniske manifestationer ses typisk ved P-fosfat < 0,32 mM, resp. P-Mg++ < 0,45 mM.
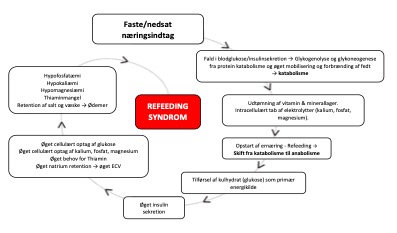
Figur 10. Refeeding syndrom, fysiologi. Bearbejdet fra http://www.udem.insel.ch/fileadmin/UDEM/pdf/Wichtige_Abbildungen/RFS_Pathophysiologie_EN_171017.pdf, by courtesy of Prof. Dr. med. Z. Stanga, Dept for Diabetes, Nutritional Medicine and Metabolism, Bern University Hospital and University of Bern, Switzerland
Der eksisterer ingen international konsensus vedr. diagnostiske kriterier for RS; hypofosfatæmi er en paraklinisk nøgleparameter, men der angives varierende cutoff værdier/procentuel nedsættelse for at opfylde diagnosen, ligesom flere forfattere argumenterer for at faldende P-magnesium og/eller -kalium skal tillægges samme diagnostiske vægt som fosfat [112]. ESPEN og Dansk Selskab for Klinisk Ernæring (DSKE)
anvender flg. parakliniske kriterier [3, 113-115]:
| Definition Refeeding syndrom |
| Efter ernæringsstart: |
| P-fosfat < 0,65 mM eller
fald i P-fosfat på mere end 0,16 mM |
Identifikation af risikopatienter:
Screening-værktøjer (NICE, SNAQ) samt biokemiske markører (IGF-1, leptin), har vist ringe prædiktiv værdi.
Vi anbefaler ASPEN`s og DSKE’s konsensus kriterier [116]:
| Moderat risiko (min. 2 kriterier opfyldt) | Høj risiko (1 kriterium opfyldt) |
| BMI 16-18,5/m2 | BMI < 16/m2 |
| Utilsigtet vægttab > 5% over 1 md. | Utilsigtet vægttab > 7,5% (3 mdr.) eller 10% (6 mdr.) |
| Lille eller intet kostindtag i 5-6 dage | Lille eller intet kostindtag i > 7 dage |
| Normale eller let nedsatte S-værdier af Mg++, K+ eller fosfat før ernæringsstart | Moderat til svært nedsatte S-værdier af Mg++, K+ eller fosfat før ernæringsstart |
| Mildt til moderat tab af fedt- og/eller muskelmasse | Svært tab af fedt- og/eller muskelmasse |
| Moderat kronisk sygdom | Svær kronisk sygdom |
Ernæring, elektrolyt og vitaminbehandling
Ved opfyldte risikokriterier anbefaler vi:
| Plan for ernæringsterapi ved RS | OBS! | |||||
| Fast substitution (før ernæringsstart) med thiamin, B-combin og multivitamin i min. 10 dage | Thiamin 200 mg x 2 i.v. i min. 3 dage, herefter reduktion til 200 mg x 1 eller tabl. 300 mg x 1
B-Combin F 2 ml i.v. x 1 i.v. i min. 3 dage, herefter evt. skift til tabl. x 1-2 Multivitamin 1 tabl. X 1 |
|||||
| Kontrol af fosfat, calcium, magnesium, kalium og zink før ernæringsstart og herefter dagligt | Ved biokemisk refeeding hypofosfatæmi dog kontrol 2-3 gange dagligt | |||||
| Substitution af fosfat
Eksempel på substitutionsprotokol: |
Plasma fosfat | Form | 40-60 kg | 61-80 kg | 81-120 kg | >120 kg |
| 0,70-0,55 mM/L | Po mixtur
Iv |
10 mM
do |
15 mM
do |
20 mM
do |
25 mM
do |
|
| 0,54-0,32 mM/L | Po
Iv |
20 mM
do |
30 mM
do |
40 mM
do |
50 mM
do |
|
| <0,32 mM/L | Po
Iv |
Nej
30 mM |
Nej
40 mM |
Nej
50 mM |
Nej
60 mM |
|
| Magnesium og zink | I h.h.t. lokal instruks | |||||
| Ernæring skal startes forsigtigt med 8-10 kcal/kg/døgn og trappes langsomt op til 25 kcal/kg/døgn i løbet af 5-7 dage til ernæringsmålet er nået. | Ved fald i P-fosfat < 0,65 mM anbefales kalorierestriktion til 20 kcal/time i min. 2 døgn, herefter gradvis optitrering til kaloriemålet over 2-3 dage.
Ved fornyet fald i P-fosfat (trods substitutionsbehandling) i denne periode anbefales fornyet kalorierestriktion i 2 døgn [3, 114]. |
|||||
Ernæring ved svær overvægt (BMI > 30 kg/m2)
Overvægtige er en heterogen gruppe hvad angår muskelmasse og metabolisme.
Hospitalsindlagte overvægtige patienter har høj risiko for malnutrition.
Overvægtige har samme energi- og proteinbehov per kg ernæringsvægt som normalvægtige.
Overvægtige kritisk syge skal behandles med samme ernæringsprodukter som normalvægtige.
WHO definerer svær overvægt med BMI≥30 som en tilstand med overskud eller unormal fedtakkumulation og med øget risiko for dårligt helbred. Prævalensen er generelt stigende, og det afspejles også på intensivafdelingerne. Anbefalingen af ernæring hos overvægtige kritisk syge patienter er ikke ensrettet verden over. SCCM/ASPEN anbefaler f.eks. hypokalorisk ernæring, hvorimod ESPEN anbefaler isokalorisk ernæring til denne patientkategori [3, 117]. Malnutrition hos overvægtige er velkendt – over 50% af hospitalsindlagte med BMI>25 viser tegn til dette og ved BMI>30 findes en odds ratio på 1.5 for underernæring. Overvægt i sig selv synes ofte at blive fejltolket som en ernæringsmæssig ressource. Overvægtige modtager sjældnere ernæringsscreening sammenlignet med normal- og undervægtige [116]. Over 10% af ældre har sarkopeni. Kritisk syge overvægtige har generelt øget risiko for overernæring og metaboliske komplikationer (hyperglykæmi, hyperkapni, hypertriglyceridæmi, leversteatose og overhydrering) [118]. Kritisk syge med BMI>40 har højere mortalitet end normalvægtige, hvorimod patienter med BMI på 30-40 har højere morbiditet, men lavere mortalitet end andre vægtgrupper. Dette ”obesity paradox” er dog omdiskuteret grundet lav kvalitet af evidensen [119]. Prædiktive formler hos overvægtige er upræcise, idet BMI alene kan repræsentere store forskelle i alder, muskelmasse, fedtrelaterede stofskifteændringer samt øvrig komorbiditet. Om muligt bør energibehovet bestemmes ved indirekte kalorimetri og proteinbehovet ved beregning af nitrogenbalancen2. Alternativt bestemmes ernæringsbehovet hos patienter med BMI>25 ud fra ”adjusted body weight”:
BMI ≦ 25 kg/m2: Anvend aktuel kropsvægt (ABW = tørvægten)
BMI > 25 kg/m2: Anvend justeret kropsvægt = ideal kropsvægt IBW + [1/3 x (ABW- IBW)]
Ernæring til ældre
Vælg ernæring efter øget ernæringsrisko.
Undgå uhensigtsmæssige faste/pauser i ernæringen.
Ved patienter på oral kost, tag hensyn til småt spisende.
Øget opmærksomhed på sufficient ernæring og væskeindtag ved udskrivelse af patienten fra intensivafdeling og overvej konsultation af diætist.
Ældre er defineret som personer over 65 år. Risikoen for malnutrition, dehydratio, sarkopeni og deraf hyppigt følgende skrøbelighed er ofte øget hos ældre patienter inden hospitalisering og indlæggelse på intensivafdeling [120]. Sarkopeni: Uplanlagt vægttab, som kan udvikle sig til underernæring fremmer tab af muskelmasse. Skrøbelighed (Frailty): Øget sårbarhed overfor stress. Ældre er ofte udfordret af lavere muskelmasse og -styrke grundet aldersrelateret ombygning af musklen med tab af muskelfibre og indlagring af fedt. Immunsystemet har også aldersymptomer med tab af muskelmasse gennem en kronisk inflammatorisk tilstand [121]. Sarkopeni giver lavere fysisk og mental formåen og kan medføre øget afhængighed af andre. Malnutrition hos ældre patienter er vist at være en prædiktor for lang indlæggelsestid og høj mortalitet [122]. Underernæring før hospitalisering kan skyldes mistet appetit, forandring af smagssanser, tyggevanskeligheder, synkeproblemer og dysfungerende mavetarmkanal. Cerebrovaskulære tilfælde med tab af funktionsevne og kognitiv forværring er en signifikant risiko for malnutrition [122]. Således forværrer malnutrition ældres fysiske og mentale evne til at klare sig og nedsætter deres livskvalitet. Ikke alle patienter med øget skrøbelighed er malnutrierede, men malnutrition øger risikoen for skrøbelighed. En kombination af skrøbelighed og malnutrition er vist at øge mortaliteten signifikant [123, 124]. Derfor kan man med fordel screene ældre kritisk syge patienter for malnutrition og skrøbelighed udover den generelle ITA-rutinescreening for ernæringsstatus [4]. Undersøgelser viser, at selv en kortere periode med kritisk sygdom blandt ældre medfører øget tab af muskelvæv, anabolisk resistance bla. for aminosyrer, tab af knoglemasse, immundysfunktion og dårlig sårheling. Disse følgevirkninger er mere udtalte end hos yngre patienter. Der er begrænset evidens for effekt af ernæring specielt rettet mod ældre. Ældre har en reduceret evne til at omsætte protein til opbygning af muskelmasse. Sufficient ernæring og øget proteintilbud kan bevirke opbygning af muskelmasse også ved ældre kritisk syge i stabil fase [125]. En bekymring for ældre patienters evne til at omsætte øget proteintilbud har vist sig at være ubegrundet. Dickerson et al kunne vise at karbamid værdier hos ældre kritisk syge gennemsnitlig ikke har været øget i forhold til yngre [120].
Overgang til stationær afdeling
Der sker et stort tab i ernæringstilbuddet ved overgang til stationært afsnit.
Vi har ansvar for, at det postintensive forløb er bedst muligt.
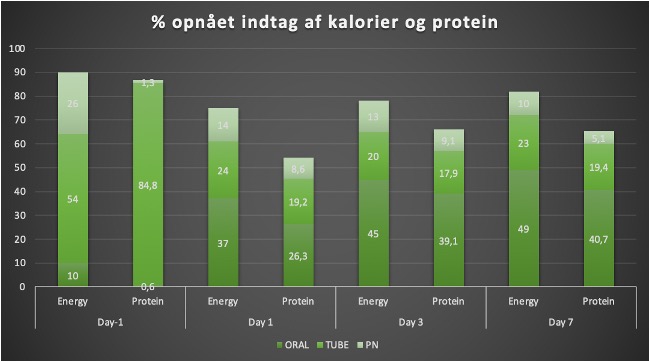
Figur 11. Ernæringstab ved udskrivelse til stationær afdeling efter intensiv terapi.
Egen illustration, ref. 128
Ved afslutningen af intensiv-forløbet er fokus omkring patienten skiftet fra livredning til optimal ernæring, mobilisering og træning [4]. Næsten alle patienter når nu deres ernæringsmål. Der findes fortsat kun få og små observationelle studier om ernæringsterapi til overlevere efter kritisk sygdom. De viser samstemmende, at patienterne udsættes for et stort ernæringstab ved overgang fra intensiv ernæringsterapi, op til 30-40% de første dage. På 7. dag på stamafdelingen har patienterne endnu ikke nået det ernæringtilbud, som de modtog ved ITA-udskrivelsen [126-128]. Patienterne ønsker deres sonder seponeret og kan ikke spise tilstrækkeligt selv. Et evt. CVK bruges stadig men sjældent til parenteralt ernæringstilskud. Det stationære afsnit ernæringsscreener og kostregistrerer unødigt igen de første dage på stamafdelingen i stedet for at fortsætte ernæringsmålene fra intensiv afdeling. Men nok så væsentligt er der ingen eller dårlig overlevering til vores kolleger i det stationære afsnit. For at undgå ernæringstabet til de – måske af alle – hospitalspatienter, der har allermest behov for optimal ernæringsterapi, anbefaler vi:
Læg en realistisk ernæringsplan ved ITA udskrivelse
Vælg en ernæringsstrategi som kendes og kan anvendes af stamafdelingen.
Giv personligt en præcis og opnåelig ernæringsplan til næste behandler. Efter langvarige intensivforløb: Lad stamafdelingens modtagende team besøge patienten før udvisitationen. Læg fælles ernæringsplan.
Plan for fysioterapi? Er der behov for diætist?
Screen ikke igen, FORTSÆT ernæringsterapien.
Hav et fælles integreret computersystem til ernæringsterapi.
Post ITA udskrivelsesteam: Fungerer ernæringsplanen?
Monitorering af ernæringsterapi
Ernæringsplan og monitorering øger fokus og faktisk indgift af ernæring. Elektronisk monitorering er en fordel. Vi foreslår følgende, inspireret af [3, 4]:
| Formål | Monitorering | Detaljer |
| Vurdering af evt ernæringsmæssige risikofaktorer | Screening | Refeeding, B-vitaminer?
Ernæringsrisiko Beregning af ernæringsvægt |
| Beregning af ernæringsbehov, afhængigt af sygdomsfase | Energi: IC eller beregning
Protein: Døgn U-karbamid/beregning |
2 x ugtl:
Døgnurin karbamid (til beregning af proteinbehov/N-balance) |
| Sikre, at patienten får den ordinerede ernæring | Ordination – art og mængde
Indgift – art og mængde Årsager til evt fravigelse |
Fasteperioder |
| Opmærksomhed på evt bivirkninger/komplikationer til ernæringen | Klinik – GI-symptomer
Laboratorieundersøgelser |
Distension, smerter, diarré, obstipation, aspirater
Dgl: Væsketal inkl. fosfat og magnesium. Fosfat evt hyppigere ved refeeding syndrom. Blodsukker hver 2.-4 t, specielt i opstartsfasen og ved ændringer i patientens tilstand og/eller ændringer i ernæringsindgift. 2 x ugtl: Levertal, Zink Se-triglycerid ved parenteral ernæring og større propofol doser. |
| At sikre, at den ernæringsterapi, der er planlagt på intensiv afdeling, kan ses og videreføres på stamafdeling eller andet sygehus. | Dokumentation i ernæringsmodul
mundtlig overlevering evt kontakt til diætist |
|
| At lette muligheden for evaluering af afdelingens ernæringspolitik | Audit | N-balance
Beregning af ernæringsdeficit (planlagt indgift i forhold til faktisk) Vægt – siger mest om ernæringsstatus i rehabiliteringsfasen |
Ernæring ved specifikt organsvigt
Ernæring ved tarmsvigt, herunder korttarmssyndrom
Patienter med varigt behov for parenteral ernæring skal henvises til specialafdeling. Patienter med ikke fungerende tarm skal som udgangspunkt ernæres parenteralt.
Der kan være store elektrolyt-, protein- og bikarbonattab fra tarmfistler.
Tarmsvigt opdeles i 3 former:
Type 1: Kortvarigt og forbigående – oftest perioperativt.
Type 2: Metabolisk ustabile patienter, som kræver parenteral ernæring og væske gennem længere tid (> 2 uger). Dette ses i forbindelse med sepsis, multiorgansvigt eller fistler med store væske- og proteintab til følge.
Type 3: Kronisk tilstand, som kræver langvarig parenteral ernæring. Type 1 og 2 tarmsvigt ses ofte i forbindelse med kritisk sygdom, og tilstanden er som udgangspunkt reversibel. Patienter med åbentstående abdomen har ikke nødvendigvis tarmsvigt, og de skal ernæres som andre kritisk syge patienter – helst enteralt. Man taler om type 3 tarmsvigt, når der er < 150 cm fungerende tyndtarm tilbage. Det kan f.eks. være efter kirurgi pga. iskæmisk eller inflammatorisk tarmsygdom. Som udgangspunkt skal patienter med en ikke-fungerende tarm ernæres parenteralt, og ernæringen skal titreres op som ved enteral ernæring. Der kan være store væske-, elektrolyt -, protein – og bikarbonattab fra tarmen og eventuelle fistler. Disse tab skal erstattes intravenøst. Ligeledes tabes både vand- og fedtopløselige vitaminer. Man skal være opmærksom på, at mange af disse patienter er i meget dårlig ernæringstilstand og kan udvikle refeedingsyndrom med behov for intravenøst tiamin og øvrige B-vitaminer samt fosfat og magnesium. Hvis patienten får et varigt behov for parenteral ernæring eller væske, skal patienten henvises til specialafdeling tidligt i forløbet:
1. Region Nordjylland: Center for Ernæring og Tarmsygdomme, Gastroenterologisk Afdeling, Aalborg Universitetshospital.
2. Region Midtjylland: Lever-, Mave- og Tarmsygdomme, Aarhus Universitetshospital.
3. Region Syddanmark: Afdeling for medicinske tarmsygdomme S, Odense Universitetshospital.
4. Region Hovedstaden: Afdeling for tarmsvigt og leversygdomme, Rigshospitalet.
5. Region Sjælland: Sjællands Universitetshospital, Køge.
Ernæring med leversygdomme
Patienter med akut og akut i kronisk leversvigt har ustabil metabolisme med risiko for refeeding syndrom.
Der tilstræbes dog tidlig enteral ernæring.
Hepatisk encephalopati kan være indikation for tidlig parenteral ernæring.
Patienter med akut leversvigt er cirkulatorisk ustabile og har en ustabil katabol metabolisme. Der ses hypoglykæmi pga. tømning af glycogendepoterne, ophørt gluconeogenese og hyperinsulinæmi pga. manglende omsætning af insulin i leveren. Der ses også forhøjet laktatniveau pga. manglende clearence i leveren. Der er stor risiko for et refeeding syndrom lignende billede, og der skal substitueres med B-vitaminer samt fosfat, magnesium og andre elektrolytter efter behov. Indirekte kalorimetri anbefales fremfor beregninger af ernæringsbehovet, og energi og protein skal gives i mængder som til andre kritisk syge. Det anbefales at give tidlig oral/enteral ernæring fremfor parenteral. Risikoen for bakteriel tarmtranslokation er stor hos disse patienter, og enteral ernæring nedsætter denne risiko [129]. Sondeernæring kan gives på en almindelig nasogastrisk sonde med anvendelse af et standard produkt [130]. Der kan anvendes den samme laxantiabehandling til disse patienter som til andre krítisk syge. Hvis patienten har hepatisk encephalopati er det vigtigt at sikre daglig afføring, og i denne situation kan man med fordel anvende laktulose, der udover at virke laxerende også hæmmer ammoniums optagelse fra tarmen.
Patienter med akut leversvigt er per definition bevidsthedspåvirkede pga. hepatisk encephalopati, hvilket kan gøre ernæring i ventriklen for risikabel. Her vil der være indikation for anlæggelse af duodenal/jejunal ernæringssonde, hvis de kirurgiske/billeddiagnostiske ressourcer er til stede. Parenteral ernæring må overvejes, hvis der ikke er en sikker luftvej. Ellers er indikationen for parenteral ernæring den samme som hos andre kritisk syge.
Der er ikke indikation for tilskud med forgrenede aminosyrer (valin, leucin og isoleucin) i intensivt regi.
Patienter med andre leversygdomme som alkoholisk hepatit og levercirrhose, der indlægges på intensiv, er ofte i dårlig ernæringstilstand, og de skal ernæres som sådan.
Har patienterne kendte esophagusvaricer, er dette ikke en kontraindikation for at anlægge nasogastriske sonder. Dog skal man konferere med mavetarmkirugerne, hvis der for nyligt er gjort banding.
Ernæring ved akut pankreatit
Der tilstræbes tidlig enteral ernæring.
Opmærksomhed på exokrin pancreasinsufficiens.
Kritisk syge patienter med akut pankreatit skal ernæres som andre kritisk syge patienter afhængig af sygdommens faser og sværhedsgrad samt patientens almentilstand og ernæringsstatus. Det har tidligere været kutyme ikke at ernære patienter med pankreatit oralt eller enteralt for at undgå stimulation af enzymproduktionen fra pankreas. Nu anbefales det at ernære disse patienter oralt eller enteralt fremfor parenteralt. Kan de aktuelle ernæringsmål ikke nås ved oral ernæring indenfor 48 timer på intensiv, bør der startes ernæring via nasogastrisk sonde [131-133]. Hvis der tilkommer ventrikelretention pga. gastroparese eller duodenal obstruktion pga. inflammation i området, anbefales det at anlægge nasoduodenal eller – jejunal ernæringssonde og ernære den vej fremfor parenteralt.
Det anbefales at starte den enterale ernæring med at almindeligt helprotein produkt. Hvis der kommer symptomer på exokrin pankreainsufficiens som malabsorption med diarré/steatorré, abdominal distension eller smerter kan det overvejes at skifte til et sondeernæringsprodukt baseret på peptider og mellemkædede fedtsyrer. Det anbefales ikke at supplere med immunonutrition. Til patienter med kronisk pankreatit og kendt exokrin pankreasinsufficiens på intensiv afdeling med indikation for sondeernæring, kan man vælge at ernære med et produkt baseret på peptider, eller man kan vælge at fortsætte enzymsubstitutionen sammen med et standard helprotein sondeernæringsprodukt. Enzymerne (Creon) kan opløses og indgives i ernæringssonden som bolus, men det kan ofte give problemer med tilstopning af sonden. Enzymerne kan også blandes op i sondeernæringen. Dog kan mavesyren inaktivere enzymerne, så hvis enzymerne indgives i ventriklen, kan der suppleres med PPI behandling [134].
Ernæring ved lungesvigt
KOL: Ofte ernæringstruet, overvej tidlig EN og SPN.
Giv ernæring under langvarig NIV. ‘
ARDS: EN opstartes efter vanlige kriterier for kritisk syge.
Bugleje kontraindicerer ikke EN.
ECMO: EN opstartes efter vanlige kriterier for kritisk syge.
KOL
Utilsigtet vægttab og underernæring ses ofte hos patienter med KOL, da de vurderes at være moderat hypermetaboliske i hvile med et forhøjet hvileenergiforbrug (REE) – formentligt på baggrund af det øgede respiratoriske arbejde. Ernæringsbehovet hos patienter med KOL er altid en individuel vurdering ud fra den kliniske tilstand – stabil eller i exacerbation, og ligeledes skal sværhedsgraden af KOL også tages i betragtning. Energiindtaget er oftest kompromitteret grundet åndenød, behandling med non invasiv ventilation (NIV) eller respirator. Desuden oplever patienten ofte appetitløshed. Tidlig opstart af ernæring er vigtig, hvor oral indgift bør foretrækkes, hvis patienten kan spise selv. Ved NIV/respiratorbehandling bør ventrikelsonde anlægges og EN opstartes hurtigt. Ernæringsscreening, optimal planlægning af ernæringsbehov og intensiv indgift er vigtig for at optimere patientens outcome. Der bør ligeledes være en opfølgning på stamafdelingen og i primærplejen, og ernæring bør kombineres med fysisk aktivitet for at opnå de bedste resultater [135-137].
ARDS
Tidlig EN bør opstartes < 48 timer efter indlæggelse på et intensivt afsnit efter vanlige retningslinjer for kritisk syge. Bugleje kontraindicerer ikke EN. Meget få studier viser, at mængden af residualvolumen er den samme som hos en patient i rygleje. Der er ikke set øgning i aspiration/opkastning og ej heller ventilator associeret pneumoni (VAP). Man kan dog overveje, om prokinetika bør startes, eller om ventrikelsonden skal placeres i duodenum, hvis der er mistanke til ventrikelretention. PN opstartes på samme indikationer, som hos andre kritisk syge [138, 139].
ECMO
Opstart af ernæring til kritisk syge patienter på ECMO følger de vanlige retningslinjer for kritisk syge og bør opstartes hurtigst muligt når pt er stabiliserede på ECMO. Det er vigtigt tidligt at opstarte ernæring for at undgå kritisk malnutrition/underernæring[140].
Ernæring ved nyresvigt
Målrettet ernæringsterapi under hensyntagen til den akutte sygdoms sværhedsgrad.
Ved CRRT ses aminosyretab med behov for ekstra proteintilførsel.
Ved CRRT ses ekstra energitilførsel pga. glukose og citrat.
Ved CRRT tabes vandopløslige vitaminer og sporstoffer.
Kritisk syge patienter med akut nyresvigt eller et akut i kronisk nyresvigt skal i princippet ernæres som andre kritisk syge – se det generelle afsnit. Patienter med nyresvigt har en ustabil katabol metabolisme i den akutte fase og skal ernæres målrettet under hensyntagen til patientens almene tilstand og den akutte sygdoms faser og sværhedsgrad, således at man hverken under – eller overernærer patienten. Nyreinsufficiente er i speciel risiko for både over-og underernæring, og det anbefales at måle energibehovet ved indirekte kalorimetri og estimere proteinbehovet ved døgnurin og/eller dialysatopsamling og måling af karbamidudskillelsen. Det er vigtigt at have en udgangsvægt (ernæringsvægt) og veje patienten hyppigt, da patientens vægt kan svinge meget [141]. Ved behov for dialyse ændres ernæringsbehovet afhængigt af dialyseform og – intensitet.
 Figur 12 [5]
Figur 12 [5]
Hvis patienten får behandling med kontinuerlig renal replacement terapi (CRRT) tabes der aminosyrer i dialysatet, og det anbefales derfor at øge den daglige proteinindgift med 0,2 gram/liter ultrafiltrat/dag eller ca 10-20 gram per dag [142]. Ligeledes tabes også vandopløslige vitaminer, sporstoffer og mineraler i dialysatet, og det anbefales også at substituere disse. Se figur 12 for målte tab af mikronæringsstoffer ved CRRT, og referencens forslag til substitution. Afhængig af patientens blodsukker kan en del af glucosen i dialysevæskerne tilføres patienten og give et ekstra energitilskud. Ved citratdialyse vil en del af citraten ligeledes overføres til patienten, forbrændes i Krebs cyklus og tilføre energi – op mod 200-500 kcal/d afhængig af flowforhold i dialysen. Denne ekstra energitilførsel kan i den akutte ustabile resucitationsfase medføre, at patienten får symptomer på overernæring. Der tabes også aminosyrer, vitaminer og sporstoffer ved intermitterende hæmodialyse (IHD) bare i mindre grad afhængig af IHD hyppigheden. Til sondeernærede patienter, som er på IHD og eventuelt er udfordret af hyperfosfatæmi, kan man vælge et produkt med lavt fosfatindhold.
Ernæring ved traume
Ernæring som andre kritisk syge.
Risiko for gastrointestinale opioidbivirkninger.
Vigtigt at få anlagt relevante ernæringssonder under primær kirurgi.
Traumepatienter skal ernæres efter de samme generelle principper som for andre kritisk syge. Der er ikke indikation for at supplere traumepatienternes ernæring med glutamin eller andre immunologisk aktive stoffer. Sporstoffer og vitaminer skal substitueres på vanlig indikation.
Multitraumatiserede kan have store bløddelslæsioner og mange frakturer, som medfører immobilisation med muskelhenfald og stort opioidbehov. Der er derfor risiko for såvel ventrikelretention som obstipation, og det er vigtigt at have fokus på laxantiabehandling. Behandlingen kan evt. suppleres med en opioidantagonist. Hvis patienter har skade i hoved-hals regionen, er det vigtigt at få anlagt ernæringssonde tidligt i forløbet – gerne under de første kirurgiske indgreb, hvor man har optimale forhold til at anlægge sonden. Patienter med abdominale skader skal også ernæres efter de samme retningslinjer som andre. Ved ventrikel – eller duoneallækage er det afgørende for at gennemføre enteral ernæring, at der anlægges duodenal – eller jejunal ernæringssonde tidligt i forløbet. Hvis der er duodenal lækage og anlægges aflastende perkutant galdevejsdræn (PTC-dræn), kan galden gives tilbage i duodenal/jejunalsonde mhp. bedre absorption af fedtstoffer.
Ved stor ascitesproduktion fra åbent abdomen eller i dræn kan der tilføres ekstra 15- 30 g protein per liter eksudat [143, 144].
Ernæring ved kritisk neurokirurgisk sygdom
Behovet for såvel energi som protein stiger med sværhedsgraden af hovedtraumet/blødningen.
Kontinuerlig enteral ernæring med højt proteinindhold startes indenfor 24 (-48 t), når patienten er hæmodynamisk stabil. Fuld ernæring indenfor 5 døgn (allersenest dag 7).
Er indirekte kalorimetri og døgnurin karbamid måling ikke muligt, foreslås energiindgift på 25-30 kcal/kg ernæringsvægt/dg og 1,5-2,5 g protein/kg/dg.
Ved ventrikelretention bør man allerede på dag 3 overveje sekundære tiltag med erythromycin og evt tillæg af metoklopramid, alternativt jejunum sonde eller supplerende/fuld parenteral ernæring.
Aspirater op til 250 ml accepteres ved hovedgærde < 30 grader.
Anbefalet BS niveau 6-10 mmol/l.
TBI, SAH og ICH
Der findes ganske få nyere RCT’er, der vedrører ernæring til patienter med kritisk neurokirurgisk sygdom og evidensniveauet er generelt lavt.
Gruppen vurderer på baggrund af tilgængelige data, at ernæringsbehovet hos patienter med SAH og (intensivt behandlingskrævende) ICH med rimelighed kan sidestilles med behovet hos patienter med moderat til svær traumatisk hjerneskade.
Metabolisme/katabolisme: Der foreligger ikke større systematiske studier, som sammenligner og nuancerer eventuelle forskelle i det stressmetabole respons ved de 3 i øvrigt væsensforskellige tilstande – TBI, SAH og ICH – eller korrelerer disse til sværhedsgrad. Svært hovedtraume [145, 146], SAH [147] og ICH [148] udløser på grund af et udtalt systemisk inflammatorisk respons en hypermetabol tilstand proportionalt med sværhedsgraden og afhængigt af variable som paralyse, sedationsgrad og temperatur [149]. Dette i modsætning til iskæmisk stroke, hvor det ikke ses i nær samme grad [150]. Ved alle tilstandene ses energiforbrug på over 150 % af forudsagte værdier (120 til 250 %) og for TBI gælder det forhøjede energiforbrug såvel under sedation [151] som i opvågnings- og rehabiliteringsfasen. Ved både TBI og SAH stiger såvel energibehov som proteinudskillelse i løbet af den første uge [152]. De fleste patienter med såvel TBI som SAH er svært katabole, med massiv muskelnedbrydning og muskeltab på op til 1 kg pr dag [144], med en varighed langt ud over det akutte forløb [153].
Timing: Der er i flere studier fundet reduceret risiko for komplikationer og dødelighed ved hurtig opnåelse af sufficient ernæring ved TBI [154, 155]. Både ASPEN/SCCM [144] og ESPEN [4] anbefaler, at man starter ernæring indenfor de første 24(-48) timer, når patienten er hæmodynamisk stabil, og Brain Trauma Foundation anbefaler, at patienter med TBI ernæres fuldt indenfor de første 5 – allerhøjest 7 – døgn [156].
Administration: Enteral ernæring anbefales til patienter med svær TBI, men med en lav grænse for at skifte til eller supplere med PN, hvis EN ikke fungerer [4, 144, 156]. Kontinuerlig infusion af sondemad anbefales, da det ser ud til at tåles bedre end bolusdoser [4], har bedre effekt på nitrogenbalancen hos TBI patienter [157] og formodes at give mere jævn blodsukker regulation. De nyeste guidelines fra Brain Trauma Foundation anbefaler at anvende jejunal sonde [156]. Placeringen af disse er noget mere omstændelig og ressourcekrævende end gastriske sonder og anbefales i ESPEN guidelines, hvis man har let adgang til anlæggelse og ved persisterende ventrikelretention trods diverse andre tiltag [4].
Behov: Mange studier har vist, at det er svært at opnå fuldt ernæringsmål og mange TBI-patienter har store energi- og protein deficits, der varer udover indlæggelsen på intensivt afsnit, medførende betydelige mangler gennem hele indlæggelsen. Dette gælder specielt patienter, der ernæres oralt [155]. Der ses således vægttab på > 30% hos 2/3 af patienterne i løbet af de første 2-6 måneder efter hovedtraume [151]. Negativ energi- og nitrogenbalance hos TBI patienter er associeret til øget morbiditet og mortalitet [158]. Deficits er bl.a betinget af ventrikelretention og faste til diverse operationer og undersøgelser [4, 159]. Hos TBI-patienter kan ses stor diskrepans mellem beregning af energibehovet og det hvileenergiforbrug (REE), der findes ved indirekte kalorimetri [160]. Härtl et al fandt et plateau for nedsat mortalitet på 25 kcal/kg/dg [154] og et andet studie målte gennemsnitligt dagligt energiforbrug på 27-28 kcal de første 3-7 dage hos normoterme patienter med svær TBI, stigende til 33 kcal i 2. uge [149]. Et lignende niveau er fundet hos SAH patienter [152]. Et niveau på 30-32 kcal i den stabile fase anbefales bl.a af Dickerson [161]. Hvis man ikke anvender døgnurin-karbamid til beregning af udskillelse og erstatter i henhold hertil, foreslås i ASPEN/SCCM guidelines [144] at give 1,5-2,5 g protein/kg/dg, mens flere advokerer for 2-2,5 g/dg [146]. Fuldt proteinload kan være svært at opnå hos denne patientkategori, specielt hvis der gives store doser propofol [159]. Der skal derfor oftest anvendes ultra højprotein produkt for at kunne dække proteinbehovet uden at overernære energimæssigt [162].
Gastrointestinal intolerance: Hos patienter med svært kranietraume ses tidlig øvre gastrointestinal intolerance hos 45-50% [146, 151] og persisterer oftest de første 1-2 uger efter traumet. Risikoen øges ved forhøjet intrakranielt tryk (ICP) [163]. I de danske retningslinjer for behandling af patienter med svært kranietraume anbefales, at elevation af hovedgærdet begrænses til 15°. pga. risiko for faldende vævsoxygenering (pbtO2) ved yderligere elevation [164]. Grundet formodet øget risiko for aspiration anbefales derfor kun at acceptere aspirater op til 250 ml.
TBI-patienter har ringe effekt af metoklopramid [163] og det anbefales i ESPEN, at 1. valg ved ventrikelretention er erythromycin i op til 3 døgn, evt suppleret med metoklopramid ved utilstrækkelig effekt efter 1 døgn [4].
Immunomodulerende ernæring: Anbefales ikke [156].
Glykæmisk kontrol: Hyperglykæmi reflekterer formentlig alvorligheden og intensiteten af stressresponset efter cerebral insult. Både tidlig og sen hyperglykæmi er forbundet med dårligt outcome hos patienter med svær TBI [165], SAH [166] og ICH [167]. I flere studier er fundet, at en akut reduktion i blodglukose kan inducere cerebral metabolisk krise ved SAH, med stigning i laktat/pyruvat-ratio ledsaget af cerebral hypoglykæmi, selvom blodglukose forbliver i normalområdet [168, 169]. Stram blodsukkerkontrol øger risikoen for dette og ser ud til at øge mortalitet og ICU LOS [170-172]. Anbefalet Blodsukkerniveau 6-10 mmol/l [4, 170].
Cervikalt medullært tværsnitssyndrom (ASCI, acute spinal cord injury)
Patienter med ASCI udviser ikke hypermetabolisme,
men massiv proteinkatabolisme og obligatorisk
negativ kvælstofbalance.
Indirekte kalorimetri (IC) kan med fordel anvendes.
Kaloriebehov 20-25 kcal/kg.
Proteinbehov 1,0-1,3 g/kg/døgn.
Overvej højprotein ernæringsprodukter.
Høj risiko for paralytisk ileus/subileus.
Iværksæt tidligst muligt prokinetisk behandling og fast tarmtømningsregime.
Anbefalingerne gælder primært de første 4 uger efter traumet hos patienter med høje cervikale læsioner (C2-C5), dvs. traumatisk tetraplegi, som er afhængige af mekanisk ventilation. Modsat andre traumepatienter udviser patienter med SCI ikke hypermetabolisme. Der ses massiv protein wasting og negativ kvælstofbalance og et målt kalorieforbrug på 10-50% under den beregnede REE (Resting energy expenditure) [173, 174]. Hyppigt ses vægttab på 10-20% indenfor 4-8 uger efter traumet, hvoraf 85% udgøres af fedtfri kropsmasse [175]. Stofskifteændringerne kan tilskrives svær denerveringsatrofi af skeletmuskulaturen proportionalt med læsionens sværhedsgrad (komplet/inkomplet) og højden af tværsnitsniveauet. Den negative N-balance er obligatorisk og kan ikke korrigeres ved høj aminosyreindgift. Overfodring (beskrives i det generelle kapitel) er i sig selv en risiko [176]. En proteinindgift på 1,0-1,3 g/kg ernæringsvægt/døgn i den akutte fase (0-4 uger) anbefales (expert opinion; manglende data). Indirekte kalorimetri (IC) kan med fordel anvendes til estimering af kaloriebehovet [174, 177, 178]. Hvis denne metode er utilgængelig, anvendes Penn State formlen, som ved ASCI viser god korrelation med IC [177]. Ved anvendelse af Harris-Benedict formlen anbefales en reduceret aktivitets-og stressfaktor dvs. gange det udregnede basal metabolisk rate med maksimalt 1,2 i den akutte fase og under tidlig rehabilitering for ikke at overestimere kaloriebehovet [179]. Tidlig enteral ernæring anbefales som ved anden kritisk sygdom [180, 181]. Højproteinprodukter (90-100g/L) med relativt lavtkalorieindhold (1000-1200 kcal/L) kan have plads ved ASCI. Parasympatisk denervering med nedsat gastrisk motilitet og paralytisk ileus kan, specielt i kombination med evt. cervikal immobilisering, medføre ventrikelretention. Tidlig prokinetisk behandling kan således være indiceret [173, 181, 182]. Ved persisterende ventrikelretention bør anlægges nasojejunal sonde [183]. Dysfagi er et hyppigt problem, og perkutan endoskopisk gastrostomi (PEG-sonde) kan være indiceret [174]. PEG-sonde kan være et godt alternativ med lav komplikations rate hos patienter, der ikke tolererer oral kost [184].
I de initiale 4-6 uger efter traumet vil patienten være i spinalt shock med såvel somatisk som visceralspinal arefleksi. Grundet parasympatisk denervering er paralytisk tyndtarms-og colonileus/-subileus tilstand næsten uundgåelig [182]. Så længe tarmen er atonisk, vil daglig digital udrømning og evt. lavement være nødvendigt. Det er væsentligt at iværksætte udrømningsregimet snarest muligt efter stabilisering af columna og vitale funktioner, helst fra dag 1. Der anvendes forskellige regimer afhængigt af, om den bulbo-kavernøse refleks er til stede. Dette skal kontrolleres dagligt de første 3 dage efter indlæggelsen [179]. Hvis vending af patienten er kontraindiceret, må anvendes tube klysma minimum x 1 dagligt. Vedrørende nærmere detaljer henvises til specialvejledninger fra rygmarvsklinikker.
Ernæring ved brandsår
Brandsårspatienter med over 20 % forbrænding er ekstremt stresskatabole med stort energi- og proteinbehov.
Kapillærlækage og eksudation fra sårsekreter medfører øget proteinomsætning og stort behov for mikronæringsstoffer.
Alle brandsårspatienter behandles profylaktisk med højdosis PPI.
Brandsårspatienter med over 20% forbrænding er udsat for et enormt stressrespons og er svært hyper-metaboliske i uger efter deres traume. Umiddelbart efter traumet er der en periode på timer til få dage med hæmodynamisk instabilitet, reduceret vævsperfusion og frisættelse af katekolaminer. Dette og hyppigt behov for sedation medfører lavere total iltoptagelse (VO2) og metabolisme. Energibehovet er øget med REE x 1,8-2,5 i usederet tilstand frem til nekrektomifasen [185, 186], men er målt til halvering ved dyb sedation. Hyppige målinger med indirekte kalorimetri er derfor vigtig. Patienten ernæres som udgangspunkt efter skema:
| Energi | 20 kcal/kg + 50 kcal/% TBSA |
| Protein | 1 g/kg + 2 g/% TBSA |
| TBSA: | Total Burn Surface Area.
Reduceres ved huddække |
Nitrogentabet fra såreksudater er enormt medfølgende kraftigt øget proteinomsætning. Proteinbehovet kan være øget x 2-3 frem til opnået huddække i forhold til det generelle behov hos andre kritisk syge. Ved bevaret diurese kan måling af døgnurin karbamid udskillelse anvendes til vurdering af proteinbehov og nitrogenbalancen. Ernæring startes efter resuscitationsdøgnet. Tidlig enteral ernæring til forbrændte kan være en udfordring pga. tarmødem eller stort vasopressorbehov men bedrer outcome. Der anvendes højprotein produkter. Supplerende parenteral ernæring startes efter dag 3 grundet stort ernæringsbehov og bør hurtigt nå fuld dosering. Se det generelle kapitel for indikationer på overernæring. Få timer efter alvorlig forbrænding ses diffus hæmorrhagisk gastroduodenitis pga. stress. Alle brandsårs-patienter skal have profylaktisk højdosis protonpumpe hæmmer. Kapillærlækage og store sår med eksudation indtil huddække medfører behov for store mængder vitaminer, især vandopløselige, mineraler og sporstoffer. Se doser i det generelle afsnit. Immunonutrition og højdosis antioxidantterapi har internationalt haft forholdsmæssig stor plads ved ernæring til forbrændte. Især har glutamin og højdosis vitamin C været i fokus. Enteral glutamin er nu testet i et stort MRCT uden effekt [43]. Højdosis vitamin C er ikke fuldt belyst til brandsårspatienter. Til patienter med højt vasopressorbehov ses øget mortalitet i interventionsgruppen [52]. Et stort MRCT: VItamin C in Thermal injuRY: The VICToRY Trial, ClinicalTrials.gov ID NCT04138394 er undervejs. Vi afventer VICToRY, før vi eventuelt kan anbefale højdosis vitamin C til patienter med større brandsår. Nogle brandsårscentre anvender beta-blokkere som Propranolol eller Oxandrolon til at dæmpe patienternes udtalte hypermetabolisme forårsaget af katekolaminer. Der ses insulinresistens, lipolyse, proteolyse og knogletab samt betydeligt øget krav til hjertets arbejde, hvorfor beta-blokade synes nærliggende. Talrige studier har vist klinisk effekt, men der savnes fortsat større RCT’er med patientnære outcomes. Vi kan ikke komme med en anbefaling om generel brug af beta-blokkere til svært forbrændte.
Referencer:
1. Heyland, D.K., et al., Identifying critically ill patients who benefit the most from nutrition therapy: the development and initial validation of a novel risk assessment tool. Crit Care, 2011. 15(6): p. R268.
2. Zusman, O., et al., Resting energy expenditure, calorie and protein consumption in critically ill patients: a retrospective cohort study. Crit Care, 2016. 20(1): p. 367.
3. Singer, P., et al., ESPEN practical and partially revised guideline: Clinical nutrition in the intensive care unit. Clin Nutr, 2023. 42(9): p. 1671-1689.
4. Singer, P., et al., ESPEN guideline on clinical nutrition in the intensive care unit. Clin Nutr, 2018.
5. Shaikhouni, S. and L. Yessayan, Management of Acute Kidney Injury/Renal Replacement Therapy in the Intensive Care Unit. Surg Clin North Am, 2022. 102(1): p. 181-198.
6. Peterson, C.M., et al., Universal equation for estimating ideal body weight and body weight at any BMI. Am J Clin Nutr, 2016. 103(5): p. 1197-203.
7. Kondrup, J., et al., Nutritional risk screening (NRS 2002): a new method based on an analysis of controlled clinical trials. Clin Nutr, 2003. 22(3): p. 321-36.
8. Casaer, M.P., et al., Early versus late parenteral nutrition in critically ill adults. N Engl J Med, 2011. 365(6): p. 506-17.
9. Allingstrup, M.J., et al., Early goal-directed nutrition versus standard of care in adult intensive care patients: the single-centre, randomised, outcome assessor-blinded EAT-ICU trial. Intensive Care Med, 2017. 43(11): p. 1637-1647.
10. Reignier, J., et al., Enteral versus parenteral early nutrition in ventilated adults with shock: a randomised, controlled, multicentre, open-label, parallel-group study (NUTRIREA-2). Lancet, 2018. 391(10116): p. 133-143.
11. Compher, C., et al., Greater Protein and Energy Intake May Be Associated With Improved Mortality in Higher Risk Critically Ill Patients: A Multicenter, Multinational Observational Study. Crit Care Med, 2017. 45(2): p. 156-163.
12. Weijs, P.J., et al., Early high protein intake is associated with low mortality and energy overfeeding with high mortality in non-septic mechanically ventilated critically ill patients. Crit Care, 2014. 18(6): p. 701.
13. Merker, M., et al., Association of Baseline Inflammation With Effectiveness of Nutritional Support Among Patients With Disease-Related Malnutrition: A Secondary Analysis of a Randomized Clinical Trial. JAMA Netw Open, 2020. 3(3): p. e200663.
14. Heyland, D.K., et al., The effect of higher protein dosing in critically ill patients with high nutritional risk (EFFORT Protein): an international, multicentre, pragmatic, registry-based randomised trial. Lancet, 2023. 401(10376): p. 568-576.
15. Jensen, G.L., et al., GLIM Criteria for the Diagnosis of Malnutrition: A Consensus Report From the Global Clinical Nutrition Community. JPEN J Parenter Enteral Nutr, 2019. 43(1): p. 32-40.
16. Tappy, L., et al., Effects of isoenergetic glucose-based or lipid-based parenteral nutrition on glucose metabolism, de novo lipogenesis, and respiratory gas exchanges in critically ill patients. Crit Care Med, 1998. 26(5): p. 860-7.
17. Reignier, J., et al., Low versus standard calorie and protein feeding in ventilated adults with shock: a randomised, controlled, multicentre, open-label, parallel-group trial (NUTRIREA-3). Lancet Respir Med, 2023. 11(7): p. 602-612.
18. Koekkoek, K. and A.R.H. van Zanten, Nutrition in the ICU: new trends versus old-fashioned standard enteral feeding? Curr Opin Anaesthesiol, 2018. 31(2): p. 136-143.
19. Wischmeyer, P.E., Tailoring nutrition therapy to illness and recovery. Crit Care, 2017. 21(Suppl 3): p. 316.
20. Taylor, B.E., et al., Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). Crit Care Med, 2016. 44(2): p. 390-438.
21. Reintam Blaser, A., et al., Early enteral nutrition in critically ill patients: ESICM clinical practice guidelines. Intensive Care Med, 2017. 43(3): p. 380-398.
22. Dikic, I. and Z. Elazar, Mechanism and medical implications of mammalian autophagy. Nat Rev Mol Cell Biol, 2018. 19(6): p. 349-364.
23. Zusman, O., et al., Predictive equations versus measured energy expenditure by indirect calorimetry: A retrospective validation. Clin Nutr, 2018.
24. Oshima, T., et al., Indirect calorimetry in nutritional therapy. A position paper by the ICALIC study group. Clin Nutr, 2017. 36(3): p. 651-662.
25. Stapel, S.N., et al., Ventilator-derived carbon dioxide production to assess energy expenditure in critically ill patients: proof of concept. Crit Care, 2015. 19: p. 370.
26. Oshima, T., et al., Can calculation of energy expenditure based on CO2 measurements replace indirect calorimetry? Crit Care, 2017. 21(1): p. 13.
27. Ishibashi, N., et al., Optimal protein requirements during the first 2 weeks after the onset of critical illness. Crit Care Med, 1998. 26(9): p. 1529-35.
28. Rooyackers, O., et al., Whole body protein turnover in critically ill patients with multiple organ failure. Clin Nutr, 2015. 34(1): p. 95-100.
29. Koekkoek, W., et al., Timing of PROTein INtake and clinical outcomes of adult critically ill patients on prolonged mechanical VENTilation: The PROTINVENT retrospective study. Clin Nutr, 2018.
30. Casaer, M.P., et al., Role of disease and macronutrient dose in the randomized controlled EPaNIC trial: a post hoc analysis. Am J Respir Crit Care Med, 2013. 187(3): p. 247-55.
31. Dickerson, R.N., et al., Using nitrogen balance in clinical practice. Hospital Pharmacy, 2005. 40(12): p. 1081-1085
32. Ikizler, T.A., et al., Amino acid and albumin losses during hemodialysis. Kidney Int, 1994. 46(3): p. 830-7.
33. Prado de Negreiros Nogueira Maduro, I., et al., Total nitrogen and free amino acid losses and protein calorie malnutrition of hemodialysis patients: do they really matter? Nephron Clin Pract, 2007. 105(1): p. c9-c17.
34. Fiaccadori, E., G. Regolisti, and A. Cabassi, Specific nutritional problems in acute kidney injury, treated with non-dialysis and dialytic modalities. NDT Plus, 2010. 3(1): p. 1-7.
35. Singer, P., et al., ESPEN Guidelines on Parenteral Nutrition: intensive care. Clin Nutr, 2009. 28(4): p. 387-400.
36. Wischmeyer, P.E., et al., Personalized nutrition therapy in critical care: 10 expert recommendations. Crit Care, 2023. 27(1): p. 261.
37. Lærebog i Klinisk Ernæring, Kapitel 7. Munksgaards Forlag 2023.
38. Arrazcaeta, J. and S. Lemon, Evaluating the significance of delaying intravenous lipid therapy during the first week of hospitalization in the intensive care unit. Nutr Clin Pract, 2014. 29(3): p. 355-9.
39. Calder, P.C., et al., Lipids in the intensive care unit: Recommendations from the ESPEN Expert Group. Clin Nutr, 2018. 37(1): p. 1-18.
40. Elwyn, D.H. and S. Bursztein, Carbohydrate metabolism and requirements for nutritional support: Part III. Nutrition, 1993. 9(3): p. 255-67.
41. Berger, M.M., et al., Monitoring nutrition in the ICU. Clin Nutr, 2018.
42. Rodas, P.C., et al., Glutamine and glutathione at ICU admission in relation to outcome. Clin Sci (Lond), 2012. 122(12): p. 591-7.
43. Heyland, D.K., et al., A Randomized Trial of Enteral Glutamine for Treatment of Burn Injuries. N Engl J Med, 2022. 387(11): p. 1001-1010.
44. Zhu, D., et al., Enteral omega-3 fatty acid supplementation in adult patients with acute respiratory distress syndrome: a systematic review of randomized controlled trials with meta-analysis and trial sequential analysis. Intensive Care Med, 2014. 40(4): p. 504-12.
45. Koekkoek, W.A. and A.R. van Zanten, Antioxidant Vitamins and Trace Elements in Critical Illness. Nutr Clin Pract, 2016. 31(4): p. 457-74.
46. Vesterlund, G.K., et al., Effects of magnesium, phosphate, or zinc supplementation in intensive care unit patients-A systematic review and meta-analysis. Acta Anaesthesiol Scand, 2023. 67(3): p. 264-276.
47. https://pub.norden.org/nord2023-003/nord2023-003.pdf.
48. Zhang, M. and D.F. Jativa, Vitamin C supplementation in the critically ill: A systematic review and meta-analysis. SAGE Open Med, 2018. 6: p. 2050312118807615.
49. Heyland, D.K., et al., Glutamine and antioxidants in the critically ill patient: a post hoc analysis of a large-scale randomized trial. JPEN J Parenter Enteral Nutr, 2015. 39(4): p. 401-9.
50. van Zanten, A.R., et al., High-protein enteral nutrition enriched with immune-modulating nutrients vs standard high-protein enteral nutrition and nosocomial infections in the ICU: a randomized clinical trial. JAMA, 2014. 312(5): p. 514-24.
51. Putzu, A., et al., Vitamin D and outcomes in adult critically ill patients. A systematic review and meta-analysis of randomized trials. J Crit Care, 2017. 38: p. 109-114.
52. Lamontagne, F., et al., Intravenous Vitamin C in Adults with Sepsis in the Intensive Care Unit. N Engl J Med, 2022. 386(25): p. 2387-2398.
53. Langlois, P.L., et al., Vitamin D supplementation in the critically ill: A systematic review and meta-analysis. Clin Nutr, 2018. 37(4): p. 1238-1246.
54. Harvey, S.E., et al., Trial of the route of early nutritional support in critically ill adults. N Engl J Med, 2014. 371(18): p. 1673-84.
55. Lewis, S.R., et al., Enteral versus parenteral nutrition and enteral versus a combination of enteral and parenteral nutrition for adults in the intensive care unit. Cochrane Database Syst Rev, 2018. 6(6): p. CD012276.
56. Doig, G.S., et al., Early parenteral nutrition in critically ill patients with short-term relative contraindications to early enteral nutrition: a randomized controlled trial. JAMA, 2013. 309(20): p. 2130-8.
57. Nguyen, M., et al., Fasting does not guarantee empty stomach in the intensive care unit: A prospective ultrasonographic evaluation (The NUTRIGUS study). Anaesth Crit Care Pain Med, 2021. 40(6): p. 100975.
58. Bouvet, L., et al., Reliability of gastric suctioning compared with ultrasound assessment of residual gastric volume: a prospective multicentre cohort study. Anaesthesia, 2020. 75(3): p. 323-330.
59. Hamada, S.R., et al., Ultrasound assessment of gastric volume in critically ill patients. Intensive Care Med, 2014. 40(7): p. 965-72.
60. Gungabissoon, U., et al., Prevalence, risk factors, clinical consequences, and treatment of enteral feed intolerance during critical illness. JPEN J Parenter Enteral Nutr, 2015. 39(4): p. 441-8.
61. Reignier, J., et al., Effect of not monitoring residual gastric volume on risk of ventilator-associated pneumonia in adults receiving mechanical ventilation and early enteral feeding: a randomized controlled trial. JAMA, 2013. 309(3): p. 249-56.
62. Montejo, J.C., et al., Gastric residual volume during enteral nutrition in ICU patients: the REGANE study. Intensive Care Med, 2010. 36(8): p. 1386-93.
63. Nguyen, N.Q., et al., Erythromycin is more effective than metoclopramide in the treatment of feed intolerance in critical illness. Crit Care Med, 2007. 35(2): p. 483-9.
64. Lewis, K., et al., The efficacy and safety of prokinetic agents in critically ill patients receiving enteral nutrition: a systematic review and meta-analysis of randomized trials. Crit Care, 2016. 20(1): p. 259.
65. Arpino, P.A. and B.T. Thompson, Safety of enteral naloxone for the reversal of opiate-induced constipation in the intensive care unit. J Clin Pharm Ther, 2009. 34(2): p. 171-5.
66. Patel, P.B., et al., Methylnaltrexone for the treatment of opioid-induced constipation and gastrointestinal stasis in intensive care patients. Results from the MOTION trial. Intensive Care Med, 2020. 46(4): p. 747-755.
67. Sawh, S.B., et al., Use of methylnaltrexone for the treatment of opioid-induced constipation in critical care patients. Mayo Clin Proc, 2012. 87(3): p. 255-9.
68. de Azevedo, R.P., et al., Daily laxative therapy reduces organ dysfunction in mechanically ventilated patients: a phase II randomized controlled trial. Crit Care, 2015. 19(1): p. 329.
69. Prat, D., et al., Constipation in critical care patients: both timing and duration matter. Eur J Gastroenterol Hepatol, 2018. 30(9): p. 1003-1008.
70. Hay, T., et al., Constipation, diarrhea, and prophylactic laxative bowel regimens in the critically ill: A systematic review and meta-analysis. J Crit Care, 2019. 52: p. 242-250.
71. McClave, S.A., Nutrition, defecation, and the lower gastrointestinal tract during critical illness. Curr Opin Clin Nutr Metab Care, 2022. 25(2): p. 110-115.
72. Oczkowski, S.J.W., et al., The Use of Bowel Protocols in Critically Ill Adult Patients: A Systematic Review and Meta-Analysis. Crit Care Med, 2017. 45(7): p. e718-e726.
73. Green, C.H., R.A. Busch, and J.J. Patel, Fiber in the ICU: Should it Be a Regular Part of Feeding? Curr Gastroenterol Rep, 2021. 23(9): p. 14.
74. Patanwala, A.E., et al., Pharmacologic management of constipation in the critically ill patient. Pharmacotherapy, 2006. 26(7): p. 896-902.
75. Rauck, R.L., Treatment of opioid-induced constipation: focus on the peripheral mu-opioid receptor antagonist methylnaltrexone. Drugs, 2013. 73(12): p. 1297-306.
76. Rotshteyn, Y., T.A. Boyd, and C.S. Yuan, Methylnaltrexone bromide: research update of pharmacokinetics following parenteral administration. Expert Opin Drug Metab Toxicol, 2011. 7(2): p. 227-35.
77. Gibson, C.M. and S.E. Pass, Enteral naloxone for the treatment of opioid-induced constipation in the medical intensive care unit. J Crit Care, 2014. 29(5): p. 803-7.
78. van der Spoel, J.I., et al., Neostigmine resolves critical illness-related colonic ileus in intensive care patients with multiple organ failure–a prospective, double-blind, placebo-controlled trial. Intensive Care Med, 2001. 27(5): p. 822-7.
79. de Brito-Ashurst, I. and J.C. Preiser, Diarrhea in Critically Ill Patients: The Role of Enteral Feeding. JPEN J Parenter Enteral Nutr, 2016. 40(7): p. 913-23.
80. Sripongpun, P., et al., Diarrhea in tube-fed hospitalized patients: Feeding formula is not the most common cause. J Gastroenterol Hepatol, 2021. 36(9): p. 2441-2447.
81. Boullata, J.I., et al., ASPEN Safe Practices for Enteral Nutrition Therapy [Formula: see text]. JPEN J Parenter Enteral Nutr, 2017. 41(1): p. 15-103.
82. Landais, M., et al., Continued enteral nutrition until extubation compared with fasting before extubation in patients in the intensive care unit: an open-label, cluster-randomised, parallel-group, non-inferiority trial. Lancet Respir Med, 2023. 11(4): p. 319-328.
83. Reis, A.M.D., et al., Use of dietary fibers in enteral nutrition of critically ill patients: a systematic review. Rev Bras Ter Intensiva, 2018. 30(3): p. 358-365.
84. Liu, T., et al., Effect of dietary fiber on gut barrier function, gut microbiota, short-chain fatty acids, inflammation, and clinical outcomes in critically ill patients: A systematic review and meta-analysis. JPEN J Parenter Enteral Nutr, 2022. 46(5): p. 997-1010.
85. Hamdan, M. and Y. Puckett, Total Parenteral Nutrition, in StatPearls. 2023: Treasure Island (FL) ineligible companies. Disclosure: Yana Puckett declares no relevant financial relationships with ineligible companies.
86. Berlana, D., Parenteral Nutrition Overview. Nutrients, 2022. 14(21).
87. https://pro.medicin.dk/Laegemiddelgrupper/Grupper/79010, w.p.m.d.
88. Klingensmith, N.J. and C.M. Coopersmith, The Gut as the Motor of Multiple Organ Dysfunction in Critical Illness. Crit Care Clin, 2016. 32(2): p. 203-12.
89. Shimizu, K., M. Ojima, and H. Ogura, Gut Microbiota and Probiotics/Synbiotics for Modulation of Immunity in Critically Ill Patients. Nutrients, 2021. 13(7).
90. Akrami, K. and D.A. Sweeney, The microbiome of the critically ill patient. Curr Opin Crit Care, 2018. 24(1): p. 49-54.
91. Zeng, J., et al., Effect of probiotics on the incidence of ventilator-associated pneumonia in critically ill patients: a randomized controlled multicenter trial. Intensive Care Med, 2016. 42(6): p. 1018-28.
92. Batra, P., K.D. Soni, and P. Mathur, Efficacy of probiotics in the prevention of VAP in critically ill ICU patients: an updated systematic review and meta-analysis of randomized control trials. J Intensive Care, 2020. 8: p. 81.
93. Litton, E., et al., Early and sustained Lactobacillus plantarum probiotic therapy in critical illness: the randomised, placebo-controlled, restoration of gut microflora in critical illness trial (ROCIT). Intensive Care Med, 2021. 47(3): p. 307-315.
94. Johnstone, J., et al., Effect of Probiotics on Incident Ventilator-Associated Pneumonia in Critically Ill Patients: A Randomized Clinical Trial. JAMA, 2021. 326(11): p. 1024-1033.
95. Baunwall, S.M.D., et al., Faecal microbiota transplantation for first or second Clostridioides difficile infection (EarlyFMT): a randomised, double-blind, placebo-controlled trial. Lancet Gastroenterol Hepatol, 2022. 7(12): p. 1083-1091.
96. Minkoff, N.Z., et al., Fecal microbiota transplantation for the treatment of recurrent Clostridioides difficile (Clostridium difficile). Cochrane Database Syst Rev, 2023. 4(4): p. CD013871.
97. van den Berghe, G., et al., Intensive insulin therapy in critically ill patients. N Engl J Med, 2001. 345(19): p. 1359-67.
98. Juneja, D., D. Deepak, and P. Nasa, What, why and how to monitor blood glucose in critically ill patients. World J Diabetes, 2023. 14(5): p. 528-538.
99. Yu, G., et al., Association of the time in targeted blood glucose range of 3.9-10 mmol/L with the mortality of critically ill patients with or without diabetes. Heliyon, 2023. 9(3): p. e13662.
100. Zhang, C., et al., Relationship between stress hyperglycemia ratio and allcause mortality in critically ill patients: Results from the MIMIC-IV database. Front Endocrinol (Lausanne), 2023. 14: p. 1111026.
101. Fakhry, S.M., et al., Hyperglycemia in nondiabetic adult trauma patients is associated with worse outcomes than diabetic patients: An analysis of 95,764 patients. J Trauma Acute Care Surg, 2022. 93(3): p. 316-322.
102. Evans, L., et al., Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med, 2021. 47(11): p. 1181-1247.
103. American Diabetes, A., 15. Diabetes Care in the Hospital: Standards of Medical Care in Diabetes-2021. Diabetes Care, 2021. 44(Suppl 1): p. S211-S220.
104. Wang, L., et al., Intensive insulin therapy in sepsis patients: Better data enables better intervention. Heliyon, 2023. 9(3): p. e14063.
105. Kristensen, P.L., et al. Den indlagte patient med diabetes. Dansk Endokrinologisk Selskab. 2022. https://endocrinology.dk/nbv/diabetes-melitus/den-indlagte-patient-med-diabetes/10.
106. Fisker, L., et al. Diabetes og kirurgi. Dansk Endokrinologisk Selskab. 2021. https://endocrinology.dk/nbv/diabetes-melitus/diabetes-og-kirurgi/.
107. Fisker, F., N. Moller, and E.S. Lauritzen, [Sodium-glucose-cotransporter 2 inhibitor-associated euglycaemic diabetic ketoacidosis]. Ugeskr Laeger, 2019. 181(21).
108. Halvorsen, S., et al., 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. Eur Heart J, 2022. 43(39): p. 3826-3924.
109. Honarmand, K., et al., Society of Critical Care Medicine Guidelines on Glycemic Control for Critically Ill Children and Adults 2024. Crit Care Med, 2024.
110. Skjaervold, N.K., et al., Pharmacology of intravenous insulin administration: implications for future closed-loop glycemic control by the intravenous/intravenous route. Diabetes Technol Ther, 2012. 14(1): p. 23-9.
111. https://pro.medicin.dk/Medicin/Praeparater/3234#a108.
112. Friedli, N., et al., Revisiting the refeeding syndrome: Results of a systematic review. Nutrition, 2017. 35: p. 151-160.
113. da Silva, J.S.V., et al., ASPEN Consensus Recommendations for Refeeding Syndrome. Nutr Clin Pract, 2020. 35(2): p. 178-195.
114. Doig, G.S., et al., Restricted versus continued standard caloric intake during the management of refeeding syndrome in critically ill adults: a randomised, parallel-group, multicentre, single-blind controlled trial. Lancet Respir Med, 2015. 3(12): p. 943-52.
115. Vinter-Jensen, L., Klinisk retningslinje: Refeeding syndrom. Dansk Selskab for Klinisk Ernæring. https://dske.dk/onewebmedia/Klinisk%20Retningslinje%20-%20Refeeding%20Syndrom%20-%2012.05.23.pdf.
116. Agarwal, E., et al., Malnutrition, poor food intake, and adverse healthcare outcomes in non-critically ill obese acute care hospital patients. Clin Nutr, 2019. 38(2): p. 759-766.
117. Compher, C., et al., Guidelines for the provision of nutrition support therapy in the adult critically ill patient: The American Society for Parenteral and Enteral Nutrition. JPEN J Parenter Enteral Nutr, 2022. 46(1): p. 12-41.
118. Dickerson, R.N., Metabolic support challenges with obesity during critical illness. Nutrition, 2019. 57: p. 24-31.
119. Schetz, M., et al., Obesity in the critically ill: a narrative review. Intensive Care Med, 2019. 45(6): p. 757-769.
120. Dickerson, R.N., et al., Influence of aging on nitrogen accretion during critical illness. JPEN J Parenter Enteral Nutr, 2015. 39(3): p. 282-90.
121. McKendry, J., A.C.Q. Thomas, and S.M. Phillips, Muscle Mass Loss in the Older Critically Ill Population: Potential Therapeutic Strategies. Nutr Clin Pract, 2020. 35(4): p. 607-616.
122. Kagansky, N., et al., Poor nutritional habits are predictors of poor outcome in very old hospitalized patients. Am J Clin Nutr, 2005. 82(4): p. 784-91; quiz 913-4.
123. Choe, Y.R., et al., Interaction between frailty and nutritional status on mortality and long-term hospitalization in older Koreans: A retrospective analysis of data from the 2008 Survey on Health and Welfare Status of the Elderly in Korea. Arch Gerontol Geriatr, 2018. 76: p. 106-113.
124. Yannakoulia, M., et al., Frailty and nutrition: From epidemiological and clinical evidence to potential mechanisms. Metabolism, 2017. 68: p. 64-76.
125. Dickerson, R.N., Nitrogen Balance and Protein Requirements for Critically Ill Older Patients. Nutrients, 2016. 8(4): p. 226.
126. Moisey, L.L., J.L. Merriweather, and J.W. Drover, The role of nutrition rehabilitation in the recovery of survivors of critical illness: underrecognized and underappreciated. Crit Care, 2022. 26(1): p. 270.
127. Slingerland-Boot, R., et al., Prospective observational cohort study of reached protein and energy targets in general wards during the post-intensive care period: The PROSPECT-I study. Clin Nutr, 2022. 41(10): p. 2124-2134.
128. Wiis, J., Nutrition gap after discharge from maximized intensive care nutritional therapy. Clnical Nutrition, ESPEN. Abstract, 2021. vol 46: p 550-51. https://doi.org/10.1016/j.clnesp.2021.09.031.
129. Kappus, M.R., Acute Hepatic Failure and Nutrition. Nutr Clin Pract, 2020. 35(1): p. 30-35.
130. Bischoff, S.C., et al., ESPEN practical guideline: Clinical nutrition in liver disease. Clin Nutr, 2020. 39(12): p. 3533-3562.
131. Canamares-Orbis, P., G. Garcia-Rayado, and E. Alfaro-Almajano, Nutritional Support in Pancreatic Diseases. Nutrients, 2022. 14(21).
132. Kanthasamy, K.A., V.S. Akshintala, and V.K. Singh, Nutritional Management of Acute Pancreatitis. Gastroenterol Clin North Am, 2021. 50(1): p. 141-150.
133. Jablonska, B. and S. Mrowiec, Nutritional Support in Patients with Severe Acute Pancreatitis-Current Standards. Nutrients, 2021. 13(5).
134. Phillips, M.E., et al., Consensus for the management of pancreatic exocrine insufficiency: UK practical guidelines. BMJ Open Gastroenterol, 2021. 8(1).
135. Beijers, R., M.C. Steiner, and A. Schols, The role of diet and nutrition in the management of COPD. Eur Respir Rev, 2023. 32(168).
136. Collins, P.F., et al., Nutritional support in chronic obstructive pulmonary disease (COPD): an evidence update. J Thorac Dis, 2019. 11(Suppl 17): p. S2230-S2237.
137. Bellini, L.M., Malnutrition in advanced lung disease. UpToDate. https://www.uptodate.com/contents/malnutrition-in-advanced-lung-disease?search=copd%20nutrition&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1
138. Umbrello, M., J.J. Marini, and P. Formenti, Metabolic Support in Acute Respiratory Distress Syndrome: A Narrative Review. J Clin Med, 2023. 12(9).
139. Savio, R.D., et al., Feasibility, tolerance and effectiveness of enteral feeding in critically ill patients in prone position. J Intensive Care Soc, 2021. 22(1): p. 41-46.
140. Dresen, E., et al., Medical nutrition therapy in patients receiving ECMO: Evidence-based guidance for clinical practice. JPEN J Parenter Enteral Nutr, 2023. 47(2): p. 220-235.
141. Sabatino, A., et al., Energy and Protein in Critically Ill Patients with AKI: A Prospective, Multicenter Observational Study Using Indirect Calorimetry and Protein Catabolic Rate. Nutrients, 2017. 9(8).
142. Nadamuni, M., A.H. Venable, and S.C. Huen, When a calorie isn’t just a calorie: a revised look at nutrition in critically ill patients with sepsis and acute kidney injury. Curr Opin Nephrol Hypertens, 2022. 31(4): p. 358-366.
143. Hourigan, L.A., et al., Loss of protein, immunoglobulins, and electrolytes in exudates from negative pressure wound therapy. Nutr Clin Pract, 2010. 25(5): p. 510-6.
144. McClave, S.A., et al., Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr, 2016. 40(2): p. 159-211.
145. Foley, N., et al., Hypermetabolism following moderate to severe traumatic acute brain injury: a systematic review. J Neurotrauma, 2008. 25(12): p. 1415-31.
146. Quintard, H. and C. Ichai, Nutritional and metabolic supplementation for the injured brain: an update. Curr Opin Crit Care, 2019. 25(2): p. 126-131.
147. Badjatia, N., et al., Relationship between energy balance and complications after subarachnoid hemorrhage. JPEN J Parenter Enteral Nutr, 2010. 34(1): p. 64-9.
148. Esper, D.H., W.M. Coplin, and J.R. Carhuapoma, Energy expenditure in patients with nontraumatic intracranial hemorrhage. JPEN J Parenter Enteral Nutr, 2006. 30(2): p. 71-5.
149. Ridley, E.J., et al., Measured energy expenditure in mildly hypothermic critically ill patients with traumatic brain injury: A sub-study of a randomized controlled trial. Clin Nutr, 2021. 40(6): p. 3875-3882.
150. Frankenfield, D.C. and C.M. Ashcraft, Description and prediction of resting metabolic rate after stroke and traumatic brain injury. Nutrition, 2012. 28(9): p. 906-11.
151. Krakau, K., et al., Metabolism and nutrition in patients with moderate and severe traumatic brain injury: A systematic review. Brain Inj, 2006. 20(4): p. 345-67.
152. Nyberg, C., et al., Daily systemic energy expenditure in the acute phase of aneurysmal subarachnoid hemorrhage. Ups J Med Sci, 2019. 124(4): p. 254-259.
153. Horn, S.D., et al., Enteral Nutrition for Patients With Traumatic Brain Injury in the Rehabilitation Setting: Associations With Patient Preinjury and Injury Characteristics and Outcomes. Arch Phys Med Rehabil, 2015. 96(8 Suppl): p. S245-55.
154. Hartl, R., et al., Effect of early nutrition on deaths due to severe traumatic brain injury. J Neurosurg, 2008. 109(1): p. 50-6.
155. Chapple, L.S., et al., Energy and protein deficits throughout hospitalization in patients admitted with a traumatic brain injury. Clin Nutr, 2016. 35(6): p. 1315-1322.
156. Carney, N., et al., Guidelines for the Management of Severe Traumatic Brain Injury, Fourth Edition. Neurosurgery, 2017. 80(1): p. 6-15.
157. Mazaherpur, S., et al., The Effect of Continuous Enteral Nutrition on Nutrition Indices, Compared to the Intermittent and Combination Enteral Nutrition in Traumatic Brain Injury Patients. J Clin Diagn Res, 2016. 10(10): p. JC01-JC05.
158. Kurtz, P. and E.E.M. Rocha, Nutrition Therapy, Glucose Control, and Brain Metabolism in Traumatic Brain Injury: A Multimodal Monitoring Approach. Front Neurosci, 2020. 14: p. 190.
159. Buckley, C.T., et al., Improvement in Protein Delivery for Critically Ill Patients Requiring High-Dose Propofol Therapy and Enteral Nutrition. Nutr Clin Pract, 2021. 36(1): p. 212-218.
160. McEvoy, C.T., et al., Resting energy expenditure in non-ventilated, non-sedated patients recovering from serious traumatic brain injury: comparison of prediction equations with indirect calorimetry values. Clin Nutr, 2009. 28(5): p. 526-32.
161. Dickerson, R.N., et al., A reappraisal of nitrogen requirements for patients with critical illness and trauma. J Trauma Acute Care Surg, 2012. 73(3): p. 549-57.
162. Singer, P., Protein metabolism and requirements in the ICU. Clin Nutr ESPEN, 2020. 38: p. 3-8.
163. Dickerson, R.N., et al., Disparate response to metoclopramide therapy for gastric feeding intolerance in trauma patients with and without traumatic brain injury. JPEN J Parenter Enteral Nutr, 2009. 33(6): p. 646-55.
164. Welling, K.L., et al., [Neurointensive care of severe traumatic brain injury]. Ugeskr Laeger, 2010. 172(29): p. 2091-4.
165. Hermanides, J., et al., Glycaemic control targets after traumatic brain injury: a systematic review and meta-analysis. Crit Care, 2018. 22(1): p. 11.
166. Kruyt, N.D., et al., Hyperglycemia and clinical outcome in aneurysmal subarachnoid hemorrhage: a meta-analysis. Stroke, 2009. 40(6): p. e424-30.
167. Fogelholm, R., et al., Admission blood glucose and short term survival in primary intracerebral haemorrhage: a population based study. J Neurol Neurosurg Psychiatry, 2005. 76(3): p. 349-53.
168. Helbok, R., et al., Systemic glucose and brain energy metabolism after subarachnoid hemorrhage. Neurocrit Care, 2010. 12(3): p. 317-23.
169. Zetterling, M., et al., Relation between brain interstitial and systemic glucose concentrations after subarachnoid hemorrhage. J Neurosurg, 2011. 115(1): p. 66-74.
170. Kramer, A.H., D.J. Roberts, and D.A. Zygun, Optimal glycemic control in neurocritical care patients: a systematic review and meta-analysis. Crit Care, 2012. 16(5): p. R203.
171. Plummer, M.P., et al., Cerebral metabolic effects of strict versus conventional glycaemic targets following severe traumatic brain injury. Crit Care, 2018. 22(1): p. 16.
172. Guilfoyle, M.R., et al., Characterising the dynamics of cerebral metabolic dysfunction following traumatic brain injury: A microdialysis study in 619 patients. PLoS One, 2021. 16(12): p. e0260291.
173. Jia, X., et al., Critical care of traumatic spinal cord injury. J Intensive Care Med, 2013. 28(1): p. 12-23.
174. Thibault-Halman, G., et al., Acute management of nutritional demands after spinal cord injury. J Neurotrauma, 2011. 28(8): p. 1497-507.
175. Rodriguez, D.J., E.C. Benzel, and F.W. Clevenger, The metabolic response to spinal cord injury. Spinal Cord, 1997. 35(9): p. 599-604.
176. Todd, S.R., et al., Update on postinjury nutrition. Curr Opin Crit Care, 2008. 14(6): p. 690-5.
177. Ramirez, C.L., et al., Validation of predictive equations to assess energy expenditure in acute spinal cord injury. J Trauma Acute Care Surg, 2018. 85(5): p. 984-991.
178. Nevin, A.N., et al., Investigation of measured and predicted resting energy needs in adults after spinal cord injury: a systematic review. Spinal Cord, 2016. 54(4): p. 248-53.
179. Consortium for Spinal Cord, M., Early acute management in adults with spinal cord injury: a clinical practice guideline for health-care professionals. J Spinal Cord Med, 2008. 31(4): p. 403-79.
180. Rowan, C.J., et al., Is early enteral feeding safe in patients who have suffered spinal cord injury? Injury, 2004. 35(3): p. 238-42.
181. Dvorak, M.F., et al., Early versus late enteral feeding in patients with acute cervical spinal cord injury: a pilot study. Spine (Phila Pa 1976), 2004. 29(9): p. E175-80.
182. Krogh, K., C. Mosdal, and S. Laurberg, Gastrointestinal and segmental colonic transit times in patients with acute and chronic spinal cord lesions. Spinal Cord, 2000. 38(10): p. 615-21.
183. Davies, A.R., et al., Randomized comparison of nasojejunal and nasogastric feeding in critically ill patients. Crit Care Med, 2002. 30(3): p. 586-90.
184. Frost, R.A., et al., The role of percutaneous endoscopic gastrostomy in spinal cord injured patients. Paraplegia, 1995. 33(7): p. 416-8.
185. Clark, A., et al., Nutrition and metabolism in burn patients. Burns Trauma, 2017. 5: p. 11.
186. Rousseau, A.F., et al., ESPEN endorsed recommendations: nutritional therapy in major burns. Clin Nutr, 2013. 32(4): p. 497-502.
Arbejdsgruppen