Hyponatriæmi hos kritisk syge
Natriumfolderen er en kort vejledning vedhæftet som pdf
Udarbejdet af arbejdsgruppe under DASAIM
Godkendt af DASAIM: 19. februar 2024
Gyldig fra: 19. februar 2024
Revision senest: 2028
Tovholder/korrespondance:
Christian Overgaard Steensen (Region Hovedstaden) E-mail: christian.overgaard.steensen@regionh.dk
Arbejdsgruppe/Referenter:
Jens Michelsen (Region Syd), Frank Hansen (Region Syd), Zahida Ali (Region Nord), Henrik Gammelager (Region Midt), Masja Bluhme Hoe (Region Midt), Helle Scharling Pedersen (Region Sjælland), Christoffer Grant Sølling (Region Midt), Ulrikka Nygaard (Region Hovedstaden, Dansk Pædiatrisk Selskab), Christian Trolle (Region Midt, Dansk Endokrinologisk Selskab).
Interessekonflikter:
Ingen i gruppen har meldt om interessekonflikter.
Indledning
Hyponatriæmi er hyppig ved ankomst til intensiv, men induceres også hyppigt under indlæggelse.1-7 Hyponatriæmi hos kritisk syge er associeret med øget mortalitet i observationelle studier.1-7 Plasma natriumkoncentrationen (PNa) er afgørende for toniciteten og dermed cellestørrelsen. Derfor kan hyponatriæmi – fald i PNa – i sig selv forårsage hjerneødem, kramper, hjerneskade og død.8 Ved tilstande med rumopfyldende intrakraniel proces/potentielt forhøjet intrakranielt tryk (ICP) – f.eks. meningitis, anoxisk/iskæmisk hjerneskade og traumatisk hjerneskade – kan selv et mindre fald i PNa (2-4 mmol/l) øge ICP kritisk.9 Omvendt kan hurtig korrektion af hyponatriæmi – og hurtig øgning af PNa fra et normalt niveau – i sig selv forårsage hjerneskade og død pga. osmotisk demyelinisering.8 10
Hos raske børn og voksne reguleres PNa nøje mellem 137 -144 mmol/l, bl.a. ved tørst, ikke-tørst, kvalme, indtagelse af vand og renal regulation. De normale regulationsmekanismer er ofte kompromitterede hos den kritisk syge (f.eks. cerebral påvirkning, nyresvigt og diuretikabehandling), kombineret med, at væsken gives iv/sonde, og dermed bypasser normal tørst/kvalme regulation. Derfor er det behandlernes ansvar at patienten som udgangspunkt ikke påføres hyponatriæmi. Det kræver viden om hvad der bestemmer PNa og rationel behandling med væske og diuretika. Mindre fald i PNa (PNa 130-136 mmol/l) forårsaget af Ringer-laktat/acetat kan accepteres hos patienten uden risiko for forhøjet ICP ved behov for stor væskeindgift (f.eks. ved svær forbrænding) eller ved svær acidose.
Ændringer siden 2020-udgaven:
- “Svære symptomer” er skrevet ud som bevidsthedsændring/konfusion/kramper
- Anvendelse af 5-10 ml/kg/time vand eller 5 % glukose til ønsket PNa ved overkorrektion
- Opdateret afsnit om osmotisk demyeliniserings syndrom
- Oversigt over hyppigt anvendte iv-væskers indikation, indhold og effekt på PNa
Forkortelser
ADH Antidiuretisk Hormon, arginin vasopressin, avp
CRRT Continuous Renal Replacement Therapy
ECV Ekstracellulær Volumenet
EFWC Elektrolytfri Vandclearance
ICP Intracranial Pressure
ICV Intracellulær Volumenet
PNa Plasma natriumkoncentrationen
PNakorrigeret Plasma natriumkoncentrationen korrigeret for hyperglykæmi
SIADH Syndrome of Inappropriate ADH (der skelnes mellem forbigående og persisterende SIADH)
UK Urin kaliumkoncentrationen
UNa Urin natriumkoncentrationen
PNa, tonicitet, hyperglykæmi og elektrolytfri vandclearance
Natrium er den kvantitativt vigtigste osmolyt i ekstracellulær volumenet (ECV) og kalium i intracellulær volumenet (ICV). Natrium og kalium bevæger sig ikke frit over cellemembranen i modsætning til vand. Derfor bestemmes PNa af forholdet mellem kroppens mængde af frit natrium, kalium og vand:11 12

Dvs. PNa ændres af ændringer i natrium-, kalium- og vandbalancerne. Natrium- og kaliumbalancerne estimeres som forskellen mellem input og output. Vandbalancen estimeres bedst ved vejning og se ændring fra udgangsvægt (indlæggelse/oplyst) og dag til dag ændringer.
PNa ændres fra PNa1 til PNa2 ved ændring i vandbalancen (∆TBW), ændringer i natrium- og kaliumbalancen (∆(Na+ + K+)) og ved estimeret total kropsvand (TBW), hvor TBWkvinder~kropsvægt x 0.5 og TBWmænd~kropsvægt x 0.6:8
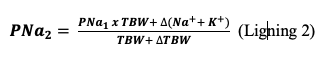
PNa udtrykker toniciteten i plasma og dermed fordelingen af vand mellem ECV og ICV. Ved fald i PNa stiger vandindholdet i cellerne; omvendt reduceres vandindholdet i cellerne ved stigning i PNa.8 En vigtig undtagelse er ved hyperglykæmi (eller andre tilstande med osmotisk aktive partikler i ECV, f.eks. mannitol). De osmotisk aktive glukosemolekyler flytter vand fra cellerne til ECV. Derfor skal den målte PNa korrigeres for det øgede blodsukker (> 12 mmol/l) for at udtrykke toniciteten:13
PNamålt + 0,4 x (Blodsukker – 5 mmol/l) = PNakorrigeret
PNa reguleres tæt hos den raske. Vandinput reguleres af tørst og kvalme. Udskillelsen af natrium, kalium og vand reguleres renalt. Urinens bidrag til ændringer i PNa afgøres ud fra den elektrolytfri vandclearance (EFWC), hvor UK og UNa er kalium- og natriumkoncentrationen i urinen: 12

Urinens bidrag til PNa ændringer kan derfor praktisk bestemmes ud fra spot urin Na (UNa) og K (UK):
Ved UNa + UK > PNa bidrager urinen til et fald i PNa
Ved UNa + UK < PNa bidrager urinen til en stigning i PNa
EFWC kan også appliceres på andre væsker, men for praktiske formål er væsketab udover urin, altid med UNa + UK < PNa, hvilket vil sige at vandtab overstiger salttab og derfor alt andet lige vil bidrage til øgning i PNa.
Fritvandsclearance FWC = urinvolumen x ![]() , kan ikke anvendes, da osmolalitetsbestemmelsen inkluderer karbamid.8 Karbamid passerer cellemembranen – er en ineffektiv osmolyt – og bidrager derfor ikke kvantitativt til PNa.12 Bidraget ved osmotisk karbamid diurese (hyperalimination) er inkluderet i EFWC.
, kan ikke anvendes, da osmolalitetsbestemmelsen inkluderer karbamid.8 Karbamid passerer cellemembranen – er en ineffektiv osmolyt – og bidrager derfor ikke kvantitativt til PNa.12 Bidraget ved osmotisk karbamid diurese (hyperalimination) er inkluderet i EFWC.
Ved måling af PNa skal som udgangspunkt anvendes samme metode, da der kan være forskel på PNa (2-4 mmol/l) ved bestemmelse på blodgasanalyseapparat og på klinisk biokemisk afdeling.14
Hyponatriæmi med ændret bevidsthed og forebyggelse af overkorrektion
Hyponatriæmi kan forårsage hjerneødem, hjerneskade og død hos børn og voksne. Det kliniske billede er afgørende, og der skelnes ikke mellem, hvor hurtigt hyponatriæmien formodes at være opstået (akut vs kronisk) eller hvad mekanismen er.8 15-17 Kombinationen af ændret bevidsthedsniveau/konfusion/kramper og hyponatriæmi er en akut behandlingskrævende tilstand, som skal behandles med vægtdoseret bolus hyperton NaCl.18 Hurtig øgning af PNa på 4-6 mmol/l er oftest tilstrækkeligt til at reducere symptomerne/hjerneødemet. 8 15Der er ikke vist sammenhæng mellem ICP og GCS, og der kan være behandlingskrævende højt tryk ved GCS 15, FOURscore 16/16 alene med konfusion.16 Samtidig kan der være diskrepans mellem ICP og CT-cerebrum,19 derfor opstartes behandling af hyponatriæmi inden evt. CT-cerebrum til differentialdiagnostik.
Ved tilstande med øget ICP (f.eks. meningitis, intrakraniel blødning, kramper, forudgående hypernatriæmi og anoxi/iskæmi) kan selv et mindre fald i PNa (2-4 mmol/l) være kritisk, da det er den relative ændring i PNa, som øger hjernens vandindhold. Derfor kan behandling med bolus hyperton NaCl være påkrævet selv ved en PNa højere end 130 mmol/l.8
Samtidig med behandlingen af hyponatriæmien, overvejes og behandles altid alternative årsager til bevidsthedsændring (f.eks. hypoglykæmi, meningitis, intrakraniel blødning, apoplexi, intoksikation m.m.).
En for hurtig korrektion af PNa kan forårsage osmotisk demyeliniseringssyndrom (ODS). Osmotisk demyelinisering er skade i hvid substans, med et klinisk spektra fra tetraplegi og coma ved læsion centralt i pons til nedsat kraft, tremor, bevægelsesforstyrrelser adfærdsforstyrrelser, neurokognitive forstyrrelser og psykatriske forstyrrelse ved mindre udtalt læsion i pons og ved ekstrapontine læsioner.20 21. Skaden udvikler sig over 1–7 døgn og kan derfor ikke klinisk erkendes umiddelbart ved stigning i PNa, samtidig er osmotisk demyelinisering ofte først synlig på MRC efter mere end 14 dage.22 Tilstanden er potentielt reversibel over måneder. Derfor er hyppigheden af osmotisk demyelinisering og sikker korrektionshastighed i den enkelte patient ikke kendt og svær at erkende i retrospektive studier, særligt når der er fokus på at undgå overkorrektion.23 Da tilstanden er alvorlig og alle patienter kan udvikle osmotisk demyelinisering, undgås overkorrektion og efterfølgende hypernatriæmi hos alle.8 10 15 16 24
Hyponatriæmi og ændret bevidsthed/konfusion/kramper/muskelrigiditet
Primær behandling:
- Sikre ABC
- Behandle anden livstruende tilstand
- Blodgasanalyse: Glukose (hypo- og hyperglykæmi behandles) og elektrolytter
Ved svære symptomer og PNa mindre end 130 mmol/l:
- Intravenøs eller intraossøs bolus 1 ml/kg 1 mmol/ml NaCl over få minutter.
Alternativt bolus af 2 ml/kg 0,5 mmol/ml (3 %) NaCl
Behandlingen øger umiddelbart PNa ca. 2 mmol/l - Målet er at reducere symptomer. Effekten af en bolus ses inden for få minutter. Behandlingen gentages indtil der er givet 3 gange i alt inden for 15 minutter og kun, hvis der fortsat er påvirket bevisthedsniveau
- Er der fortsat påvirket bevisthedsniveau efter 3 boli, sikres at PNa er steget 6 mmol/l (ellers sikres dette med ekstra bolus) og andre årsager til bevidsthedsændringen forfølges
- Når symptomerne er aftaget, og/eller der er givet 3 boli/PNa er øget 6 mmol/l, afhænger evt. yderligere væskebehandling af formodede årsager til hyponatriæmien og ændringer i PNa
- Thiamin og B-combin gives på vid indikation10
Undgå overkorrektion af alle patienter for at reducere risikoen for osmotisk demyelinisering.
- Maksimal korrektion:
- Patienter uden risikofaktorer øges maksimalt 8 mmol/l per 24 timer.
- Højrisikopatienter øges maksimalt med 6 mmol/l per 24 timer:
- Fejlernæret (f.eks. alkoholisme, anorexi, cancer)
- Svær leversygdom
- Alkoholisme
- Svær hypokaliæmi (PK < 2,5 mmol/l)
- Lav PNa (< 115 mmol/l)
- Undgå efterfølgende udvikling af hypernatriæmi (PNa > 144 mmol/l)17 23
- Fremskriv maksimal korrektion i journal/plan til PNa er normaliseret (f.eks. hos patient uden risikofaktorer med PNa 121 mmol/l kl 1200 17/5. Noter: PNa 129 mmol/l kl. 1200 den 18/5 og 137 mmol/l kl. 1200 den 19/5) samt tiltag hvis dette overskrides.
- Tæt monitorering af PNa og diureser. eks. bestemmes PNa, hver 60/120 minutter i 6 timer eller til PNa er stabil. PNa skal som udgangspunkt bestemmes ved samme metode.
- Overkorrektion skyldes hyppigst store diureser. Dette kan modvirkes (og evt. overkorrektion kan korrigeres) med 5-10 ml/kg/time vand per os/sonde som første valg til ønsket PNa alternativt tilsvarende i.v. infusion 5 % glukose (NB undgå hyperglykæmi).18 Infusionsmængden justeres i forhold til PNa. Ved ukontrollabel stigning i PNa pga. store diureser kan der anvendes desmopressin (Minirin®) 1-2 µg i.v. (voksne), 20 µg nasalt (voksne) eller 120 µg smelt tablet (voksne) og 0,025 µg/kg i.v. (børn). Gentages ved behov, evt. hver 8. time.
- Da tilstanden er dynamisk, og kun inputsiden kendes, kan PNa ikke forudsiges/beregnes præcist. Det er imidlertid vigtigt at vide at PNa bestemmes af vand- og kationbalancerne (jf ligning 1 side 3), så PNa kan kontrolleres. Heraf fremgår, at PNa kan øges meget ved store diureser og, at kaliumbalancen påvirker PNa lige så meget som natriumbalancen.
Hyponatriæmi og CRRT
Ved CRRT (og konventionel hæmodialyse) er der stor risiko for overkorrektion. Årsagen er at CRRT-væskerne har en natriumkoncentration tæt på 140 mmol/l og man derfor risikere for hurtig korrektion af PNa.
Stigningen i PNa ved CRRT kan kontrolleres ved følgende tiltag:
- Ved at nedsætte effektiviteten/clearance ved at reducere udløbsdosis, dvs. anvende protokol for en lavere vægtklasse hvis patienten tåler dette.8 17
- Ved lav udgangs PNa vil det ofte også være nødvendigt med samtidig i.v. infusion af 5 % glukose.25 Forslag til opstarts infusion hastigheder:
a. Voksne: 250 ml/time 5 % glukose i.v. med tilsvarende væsketræk plus et evt. væsketræk til afvanding.
b. Børn: 3 ml/kg/time 5 % glukose i.v. og et tilsvarende væsketræk plus et evt. væsketræk til afvanding.
Infusionshastigheden/væsketræk justeres ud fra hyppige PNa målinger og pauseres ved CRRT nedetid. Det er afgørende at undgå hyperglykæmi og ved evt. hyperglycæmi behandles med insulin og ikke ved reduktion af infusionshastigheden af glukose.
Udredning og endelig korrektion af hyponatriæmi
Generelt:
Fraset iatrogen hyponatriæmi udredes vedvarende hyponatriæmi altid og om muligt i samarbejder med endokrinolog eller pædiater.
Endelig og sikker korrektion afhænger af mekanismerne bag hyponatriæmien. Ved udredning er det vigtigt at:
- Ofte er der flere mekanismer og systematisk udredning er afgørende.26 27
- Klinisk vurdering af volumenstatus er upålidelig. Hypovolæmi (Na-tab) og normovolæmi (Syndrome of Inappropriate ADH [SIADH]) kan sjældent adskilles klinisk, men først erkendes som respons på behandling.8 28
- Ofte er mekanismerne bag hyponatriæmien forbigående hos den kritisk syge.8
- Opstart ikke infusion 0.9% NaCl – à la 50 ml/time: Virkningen på PNa er uforudsigelig og det kan føre til yderligere overhydrering og yderligere fald i PNa (Se under Syndrome of inappropriate ADH s.10). Mistænkes hypovolæmi gives bolus 5-10 ml/kg til effekt på cirkulationen.
Standardudredning:
- Afdækning af vand-, natrium- og kaliumbalancerne i henhold til ligning 1 s.3. Stort vandindtag/hypotone væsker? Tørst? Kvalme? Stort output (opkast, diarré, brandsår, blødning, sved, urin)?
- Vejning diagnosen og monitorering af behandlingen (vandbalancen). Sammenlign med bedste udgangsvægt og daglige ændringer som udtryk for ændring i total kropsvand.
- Komorbiditet (hjerte-/lever-/nyresvigt/binyrebarkinsufficiens)?
- Medicin associeret med hyponatriæmi (se Tabel 1 s.15).
- Urinens påvirkning af PNa vurderes ud fra urinmængde og EFWC på spot urin:
- UNa + UK > PNa; urinen bidrager til hyponatriæmien.
- UNa + UK < PNa; urinen modvirker hyponatriæmien og der er risiko for overkorrektion.
- Effekt af behandling på PNa og vægt, f.eks. efter indgift af 0.9% NaCl.
Hyponatriæmimekanismer og behandling:
A. Natrium-tab (f.eks. blødning, opkast, diarré, renale tab, sved – ”fyrbøder kramper”) oftest kombineret med hypotone væsker p.o. eller i.v.. Hypovolæmien fører til 1) non-osmotisk ADH-sekretion med nedsat renal vandudskillelse samt 2) sekundær hyperaldosteronisme med nedsat renal natriumudskillelse. Fraset tilstande med renal salt wasting ses derfor ofte en lav UNa. Hypovolæmi behandles med 0,9 % NaCl/ringer-laktat/acetat. Der er stor risiko for overkorrektion når hypovolæmien korrigeres: Det non-osmotiske stimulus for ADH-sekretionen falder, og der kan opstå store vanddiureser (UNa + UK << PNa), og PNa stiger hurtigt.
Cerebral/renal salt wasting er kendetegnet ved store diureser med UNa + UK > PNa og vægttab (i modsætning til SIADH, hvor diureserne er små og der oftest er vægtøgning). Behandlingen er hyperton NaCl i.v., korrektion af evt. hypovolæmi med 0.9% NaCl og evt. fludrocortisonacetat p.o. (Florinef®) (voksne: 0.05-0.3 mg/døgn; børn 150 µg/m2/døgn). Renal salt wasting kan ses iatrogent efter behandling med hyperton NaCl til behandling af forhøjet ICP.9 Her udtrappes hyperton NaCl langsomt evt. kombineret med fludrocortisonacetat p.o. (Florinef®). Hos stabil patient kan estimeret behov (døgndiureser x UNa) evt. forsøges dækket via 0.9% NaCl (154 mmol/l natrium) iv svarende til diureser og resten med bordsalt (1 g ~17 mmol) under fortsat monitorering (PNa og vægt) og daglig justering. Ex. patient med døgndiurese på 3 liter med UNa 180 mmol/l svt. 3 l x 180 mmol/l = 540 mmol Na+-udskillelse i døgnet, det kan forsøges dækket med 3 liter 0.9% NaCl ~ 3 l x 154 mmol/l = 462 mmol natrium og 5 g (~85 mmol Na+) bordsalt svarende til ca. 540 mmol Na+.
B. Hyponatriæmi forværret/udløst af medicin. Hyppigst thiazider; antidepressiva og antiepileptika, men talrige medikamina kan medvirke til hyponatriæmi. Se Tabel 1 s.15. Medicin seponeres, pauseres eller dosisreduceres. NB seponering/pausering kan føre til overkorrektion.
C. Natrium- og vandretention ved hjerte- og leverinsufficiens behandles med væske- og natriumrestriktion og optimering af hæmodynamik evt. med spironolacton og ACE-hæmmer (hjerteinsufficiens). Ved nyreinsufficiens behandles med væskerestriktion og evt. dialyse (NB korrektionshastighed ved dialyse). Tilstande med natriumretention er ikke en kontraindikation for at behandle med hyperton NaCl ved hyponatriæmi med ændret bevidsthed. Natriummængden ved denne behandling er lille i forhold til patientens samlede natriummængde, men ABC-årsag gennemgås/behandles før hyperton NaCl indgift.
D. Endokrinologiske sygdomme. Binyrebarkinsufficiens er en potentielt dødelig og overset årsag til hyponatriæmi. Binyrebarkinsufficiensen kan være såvel primær (adrenal), sekundær (hypofysær) som tertiær (pga. glukokortikoid behandling): https://endocrinology.dk/nbv/hypofyse-og-binyresygdomme/binyrebarkinsufficiens/. Aktuel glukokortikoidbehandling eller behandling inden for de sidste 3 mdr. bør skærpe mistanken (kan ses ved såvel i.v., i.m., p.o., topical som inhalationspræparater). Tillige særlig mistanke ved patienter i immunonkologisk behandling, ved CNS-sygdom, DIC-patienter, hypofysetumor eller adrenal tumor samt ved vedvarende hypotensive patienter eller patienter med samtidig uafklaret høj kalium.
På vid indikation udføres Spot-kortisol og P-ACTH fulgt af synacthen-test. Ved livstruende symptomer afventes P-kortisol svar ikke før behandling påbegyndes. Behandlingen er hormonsubstitution med hydrokortison (Solu-cortef®) (voksne initialt 100 mg i.v. derefter 50 mg i.v. hver 6. time; børn 2 mg/kg i.v. hver 6. time). Behandlingen kan føre til PNa-overkorrekton. Udredning og behandling i samarbejde med endokrinolog: https://endocrinology.dk/nbv/hypofyse-og-binyresygdomme/binyrebarkinsufficiens/.
Hyponatriæmi ses i sjældne tilfælde ved svær hypothyreose (Høj TSH og lav T4).
E. Syndrome of inappropriate ADH (SIADH) forårsager hyponatriæmi ved samtidig indtag/infusion af hypotone væsker, da den renale vandudskillelse er nedsat uhensigtmæssigt. SIADH er kendetegnet ved små diureser med UNa + UK > PNa og ofte vægtøgning (i modsætning til Cerebral salt wasting/renal salt wasting, hvor diureserne er store og der er vægttab). I svære tilfælde kan 0.9 % NaCl (154 mmol/l Na) forværre hyponatriæmien. Årsagen er UNa > 154 mmol/l, hermed udskilles den indgivne mængde natrium i et mindre volumen end indgivet, resten tilbageholdes og PNa falder. Dette kan være med til at adskille tilstanden fra hyponatriæmi med natriumtab, hvor PNa stiger efter indgift (indgiften af natrium korrigerer hypovolæmien og dermed forsvinder stimulus for ADH-sekretionen og der opstår polyuri). SIADH opdeles af praktiske/kliniske årsager i:8
- Forbigående SIADH: Den hyppigste form og ofte med vægtøgning. Skyldes non-osmotisk ADH-sekretion udløst af forbigående tilstande som kvalme, smerter, postoperativt, infektion, CNS-sygdom (f.eks. meningitis) og/eller medicin. Behandles med væskerestriktion (med mindre der er tegn til hypovolæmi så behandles med 0.9% NaCl), undgå hypotone væsker og evt. hyperton NaCl. Der er risiko for overkorrektion, når udløsende årsag behandles/forsvinder.
- Persisterende SIADH: Sjælden. Kan skyldes f.eks. paraneoplastisk fænomen, autoimmun encephalitis, V2-receptor gain of function og reset osmostate. Behandles med væskerestriktion, Na-tilskud og loop diuretika, evt. hyperton NaCl eller V2-receptorantagonister (vaptaner). Vandbalancen følges med vejning. Samtidig udredes for årsager til SIADH (f.eks. occult cancer, hvor c. pulmonis og c. oropharyngealis er hyppige årsager).
Se i øvrigt: https://endocrinology.dk/nbv/andre-endokrinologiske-sygdomme/hyponatriaemi/
F. Low solute intake/underernæring ses ved alkoholisme (beer potomania), cancer, anorexia nervosa og fejlernæring hos ældre (tea and toast syndrome). Stærkt nedsat protein og saltindtag reducerer nyrernes evne til at udskille vand, da nyrerne ikke kan udskille rent vand. Behandles med ernæring, thiamin og B-combin.10 NB refeeding syndrom og overkorrektion.
G. Polydipsi/overdrevet vandindtag evt. kombineret med reduceret renal vandudskillelse (A til F). Obs. overkorrektion.
Forebyggelse af hospitalserhvervet hyponatriæmi
Hospitalserhvervet hyponatriæmi kan være farligt pga. udvikling af hjerneødem, og er associeret til øget morbiditet og mortalitet.3 4 6 8. Hospitalserhvervet hyponatriæmi kan forebygges ved at anvende intravenøse væsker med samme omhu som anden medicin og monitorer behandlingen med måling af PNa og vejning. Generelt er viden om iv-væskers indhold og effekt på PNa begrænset i danske akutmodtagelser.29 Kritisk syge har ofte non-osmotisk ADH-sekretion (pga. nedsat perfusion, smerte, kvalme, postoperativt, CNS-sygdom, infektion og medicin m.m.) og/eller nedsat nyrefunktion.9 30 Dette medfører nedsat renal vandudskillelse. Indtag eller infusion af hypotone væsker kan derfor forårsage hyponatriæmi. Det perorale indtag er oftest nedsat pga. kvalme, men intravenøse væsker by-passer denne regulation. Infusionsvæsker, som er svært hypotone i patienten, er f.eks. 5 % Glukose (”isotonisk glukose”), 10 % Glukose, Darrow-glukose, Kalium-natrium-glukose, Hydreringsvæske “SAD”, og Rehydrex (Se Tabel 2 Hyppigt anvendte væsker). Uden for patienten er disse væsker isotone, men glukosen forbrændes/optages i cellerne hurtigt efter infusion, og dermed bliver væskerne reelt svært hypotone. Ringer-acetat, ringer-laktat, plasmalyte, benelyte er moderat hypotone i patienten (lavere natriumindhold og acetat/laktat/gluconat forbrændes), og kan derfor forårsage mindre fald i PNa i forhold til 0.9% NaCl.9 31 0,9 % NaCl (Isotonisk NaCl) er reelt isotonisk i patienten, men kan forårsage metabolisk acidose.
Hypotone væsker kan være et rationelt valg, men det er vigtigt at monitorere PNa nøje.
Særlig forsigtighed hos:
Børn. Børns basale vandbehov udregnes ofte ud fra Holliday/Segar’s formel (4:2:1 reglen) og har traditionelt været erstattet med Darrow-glukose eller tilsvarende svært hypoton væske.32 Holliday/Segar’s formel tager ikke højde for nedsat vandudskillelse hos det kritisk syge barn, hvorfor der er stor risiko for overdosering og hyponatriæmi. Barnehjernen er relativt stor ift. kraniekassens størrelse. Derfor er barnet i særlig risiko for øget ICP ved fald i PNa.33 34 Anvend evt. Na140K15 5% glukose, 5 % Glukose i 0,9 % NaCl, Plasmalyte Glukos 50 mg/ml eller tilsvarende færdigblandet væske (Se Tabel 2 Hyppigt anvendte væsker)25. Oftest mangler kritisk syge børn på intensiv ikke vand – er overhydrerede/vægtøget – og en rationel tilgang er at dække et evt. glukosebehov (~4 mg/kg/min) med en mere koncentreret glukoseopløsning – 50% – 500 mg/ml – glukose- så vandindgiften reduceres.9 Monitorer og juster behandlingen ud fra PNa, PK, blodsukker og daglig vejning. Skift hurtigst muligt til p.o. indgift.
Patient med risiko for forhøjet ICP. Dvs. tilstand som kan forårsage forhøjet ICP som meningitis, hovedtraume, cerebral iskæmi/anoxi, kramper, CNS-tumor, akut svært leversvigt, hydrocephalus, subarachnoidal blødning og intracerebral blødning kombineret med ændret bevidsthed. Her kan selv mindre fald i PNa (2-4 mmol/l) øge ICP kritisk, hvorfor disse patienter som udgangspunkt ikke må udvikle hyponatriæmi/falde i PNa. 9 Derfor behandles som udgangspunkt med 0,9 % NaCl. Moderat hypotone væsker (Ringers laktat/acetat, Plasmalyte, Benelyte) og svært hypotone væsker bør som udgangspunkt undgås. 9 31 35
Spinal cord injury. Pga. risiko for yderligere medullær skade ved ødem undgås hyponatriæmi de første syv døgn.
Kramper. Hyponatriæmi sænker krampetærsklen som følge af ødem, nedsat kloridkonduktans og frigivelse af excitatoriske neurotransmittere (eks. glutamat).36 Det er derfor vigtigt at disse patienter ikke påføres hyponatriæmi.
Svært leversvigt. Patienter med akut svært leversvigt har ofte forhøjet ICP og må ikke falde i PNa.37 38 Svært akut leversvigt behandles med højdosis dialyse og her er det afgørende at opretholde PNa-niveau evt. med 0.5-4 mmol/kg/time 1 mmol/ml hyperton NaCl infusion og sikring af cerebralt perfusionstryk (MAP 80 mmHg). Kronisk svært leversvigt medfører ofte sekundær hyperaldosteronisme med svær natriumretention, ødemer og ascites. Derfor er natriumrestriktion/spironolacton ofte en del af grundbehandlingen. Imidlertid har disse patienter ofte også non-osmotisk ADH-sekretion med reduceret renal vandudskillelse. Derfor kan infusion af svært hypotone væsker forårsage overhydrering, hyponatriæmi og forværring af hepatisk encephalopati.9 Det er uhensigtsmæssigt blindt at behandle med 2-3 liter 5 % glukose dagligt, da det med stor sandsynlighed føre til fald i PNa og overhydrering/vægtøgning. Ved behov for glukosetilførsel kan med fordel anvendes mere koncentrerede glukoseopløsninger end 5 % – 55 mg/ml Glukose f.eks. 50 % – 500 mg/ml – Glukose og patienten følges med PNa og vejning.
Patienter med svært leversvigt kan også udvikle sepsis, brandsår, blødning og hypovolæmi, som kræver øgning af ECV med natriumholdige væsker, men det terapeutisk interval er lille, hvorfor de skal monitoreres tæt.
Tabel 1. Medicin associeret med hyponatræmi (ikke udtømmende)

Tabel 2. Hyppigt anvendte intravenøse væsker – Farve reflekterer tonicitet efter indgift
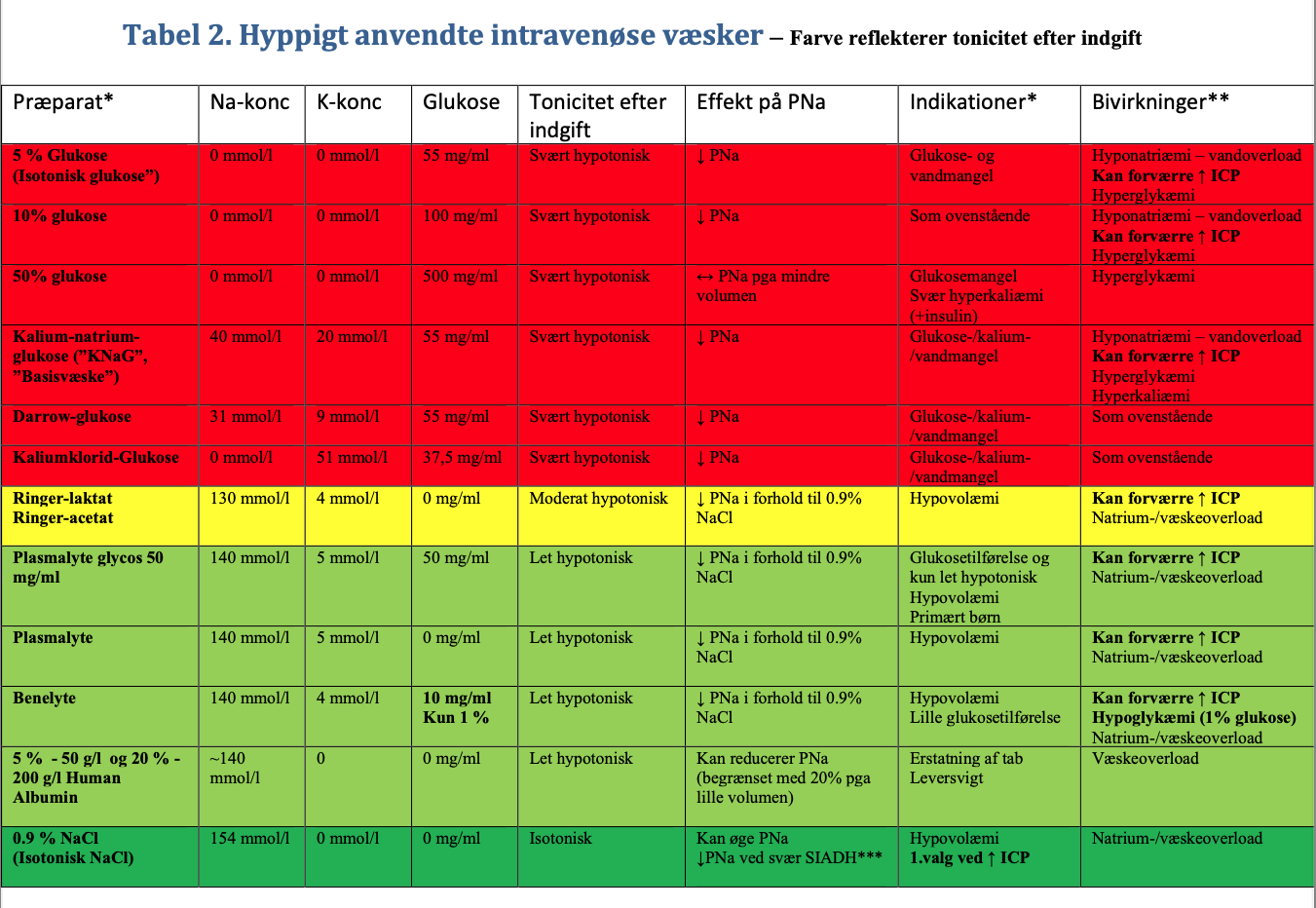
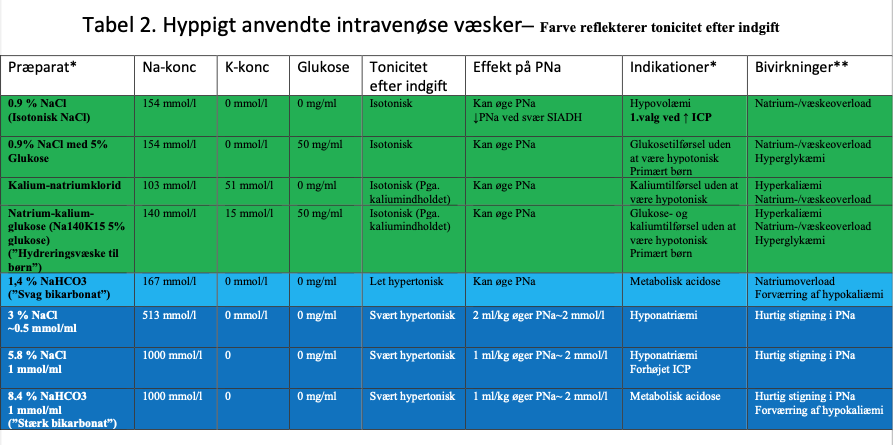
* Ikke alle i.v. væsker/indikationer/bivirkninger/indholdsstoffer er nævnt. Se evt. produktresuméet for den enkelte væske
** SID = Strong ion difference her approximeret som [Na+]-[Cl-]. I plasma er SID~40 mmol/l. Fald i SID reducerer pH. Stigning i SID øger pH.
*** Ved svær SIADH med UNa + UK > 154 mmol/l reducerer 0.9 % NaCl (Na 154 mmol/l) PNa.
Reference List
1. Holland-Bill L, Christiansen CF, Heide-Jorgensen U, et al. Hyponatremia and mortality risk: a Danish cohort study of 279 508 acutely hospitalized patients. Eur J Endocrinol 2015;173(1):71-81. doi: 10.1530/EJE-15-0111
2. Stelfox HT, Ahmed SB, Khandwala F, et al. The epidemiology of intensive care unit-acquired hyponatraemia and hypernatraemia in medical-surgical intensive care units. Crit Care 2008;12(6):R162.
3. Sakr Y, Rother S, Ferreira AM, et al. Fluctuations in serum sodium level are associated with an increased risk of death in surgical ICU patients. Crit Care Med 2013;41(1):133-42.
4. Darmon M, Timsit JF, Francais A, et al. Association between hypernatraemia acquired in the ICU and mortality: a cohort study. NephrolDialTransplant 2010;25(8):2510-15.
5. Funk GC, Lindner G, Druml W, et al. Incidence and prognosis of dysnatremias present on ICU admission. Intensive Care Med 2010;36(2):304-11.
6. Wald R, Jaber BL, Price LL, et al. Impact of hospital-associated hyponatremia on selected outcomes. ArchInternMed 2010;170(3):294-302.
7. DeVita MV, Gardenswartz MH, Konecky A, et al. Incidence and etiology of hyponatremia in an intensive care unit. ClinNephrol 1990;34(4):163-66.
8. Overgaard-Steensen C, Ring T. Clinical review: practical approach to hyponatraemia and hypernatraemia in critically ill patients 1. Crit Care 2013;17(1):206.
9. Lunoe M, Overgaard-Steensen C. Prevention of hospital-acquired hyponatraemia: individualised fluid therapy. Acta Anaesthesiol Scand 2015;59(8):975-85. doi: 10.1111/aas.12522 [published Online First: 2015/05/12]
10. Tandukar S, Sterns RH, Rondon-Berrios H. Osmotic Demyelination Syndrome following Correction of Hyponatremia by </=10 mEq/L per Day. Kidney360 2021;2(9):1415-23. doi: 10.34067/KID.0004402021 [published Online First: 20210708]
11. Edelman IS, Leibman J, O’Meara MP, et al. Interrelations between serum sodium concentration, serum osmolarity and total exchangeable sodium, total exchangeable potassium and total body water. JClinInvest 1958;37(9):1236-56.
12. Rose BD. New approach to disturbances in the plasma sodium concentration. AmJMed 1986;81(6):1033-40.
13. Hillier TA, Abbott RD, Barrett EJ. Hyponatremia: evaluating the correction factor for hyperglycemia. AmJMed 1999;106(4):399-403.
14. Nanda SK, Ray L, Dinakaran A. Agreement of arterial sodium and arterial potassium levels with venous sodium and venous potassium in patients admitted to intensive care unit. J Clin Diagn Res 2015;9(2):BC28-30. doi: 10.7860/JCDR/2015/12418.5602 [published Online First: 20150201]
15. Spasovski G, Vanholder R, Allolio B, et al. Clinical practice guideline on diagnosis and treatment of hyponatraemia. Eur J Endocrinol 2014;170(3):G1-47. doi: 10.1530/EJE-13-1020 [published Online First: 20140225]
16. Behandlingsvejledning DES-N. Hyponatriæmi 2023 [Available from: https://endocrinology.dk/nbv/andre-endokrinologiske-sygdomme/hyponatriaemi/2023.
17. Overgaard-Steensen C, Ring T. Disorders of Sodium and Water Balance. Critical Care Nephrology Third Edition2019.
18. Baek SH, Jo YH, Ahn S, et al. Risk of Overcorrection in Rapid Intermittent Bolus vs Slow Continuous Infusion Therapies of Hypertonic Saline for Patients With Symptomatic Hyponatremia: The SALSA Randomized Clinical Trial. JAMA Intern Med 2021;181(1):81-92. doi: 10.1001/jamainternmed.2020.5519
19. Winkler F, Kastenbauer S, Yousry TA, et al. Discrepancies between brain CT imaging and severely raised intracranial pressure proven by ventriculostomy in adults with pneumococcal meningitis. J Neurol 2002;249(9):1292-7. doi: 10.1007/s00415-002-0844-8 [published Online First: 2002/09/21]
20. King JD, Rosner MH. Osmotic demyelination syndrome. Am J Med Sci 2010;339(6):561-7. doi: 10.1097/MAJ.0b013e3181d3cd78
21. Martin RJ. Central pontine and extrapontine myelinolysis: the osmotic demyelination syndromes. JNeurolNeurosurgPsychiatry 2004;75 Suppl 3:iii22-iii28.
22. Miller GM, Baker HL, Jr., Okazaki H, et al. Central pontine myelinolysis and its imitators: MR findings. Radiology 1988;168(3):795-802. doi: 10.1148/radiology.168.3.3406409
23. MacMillan. Osmotic Demyelination Syndrome in Patients Hospitalized with Hyponatremia. N Engl J Med 2023;2:1. doi: 10.1056/EVIDoa2200215
24. Sterns RH, Rondon-Berrios H, Adrogue HJ, et al. Treatment Guidelines for Hyponatremia: Stay the Course. Clin J Am Soc Nephrol 2023 doi: 10.2215/CJN.0000000000000244 [published Online First: 20230628]
25. Yessayan L, Yee J, Frinak S, et al. Continuous Renal Replacement Therapy for the Management of Acid-Base and Electrolyte Imbalances in Acute Kidney Injury 1. AdvChronicKidney Dis 2016;23(3):203-10.
26. Clayton JA, Le Jeune IR, Hall IP. Severe hyponatraemia in medical in-patients: aetiology, assessment and outcome. QJM 2006;99(8):505-11.
27. Shapiro DS, Sonnenblick M, Galperin I, et al. Severe hyponatraemia in elderly hospitalized patients: prevalence, aetiology and outcome. InternMedJ 2010;40(8):574-80.
28. Chung HM, Kluge R, Schrier RW, et al. Clinical assessment of extracellular fluid volume in hyponatremia. AmJMed 1987;83(5):905-08.
29. Sindahl P, Overgaard-Steensen C, Wallach-Kildemoes H, et al. Are Further Interventions Needed to Prevent and Manage Hospital-Acquired Hyponatraemia? A Nationwide Cross-Sectional Survey of IV Fluid Prescribing Practices. J Clin Med 2020;9(9) doi: 10.3390/jcm9092790 [published Online First: 20200829]
30. Moritz ML, Ayus JC. Maintenance Intravenous Fluids in Acutely Ill Patients. N Engl J Med 2015;373(14):1350-60. doi: 10.1056/NEJMra1412877
31. Young JB, Utter GH, Schermer CR, et al. Saline versus Plasma-Lyte A in initial resuscitation of trauma patients: a randomized trial. Ann Surg 2014;259(2):255-62. doi: 10.1097/SLA.0b013e318295feba
32. Holliday MA, Segar WE. The maintenance need for water in parenteral fluid therapy. Pediatrics 1957;19(5):823-32.
33. Arieff AI, Ayus JC, Fraser CL. Hyponatraemia and death or permanent brain damage in healthy children. BMJ 1992;304(6836):1218-22. doi: 10.1136/bmj.304.6836.1218
34. Moritz ML, Ayus JC. Hospital-acquired hyponatremia: why are there still deaths? Pediatrics 2004;113(5):1395-6. doi: 10.1542/peds.113.5.1395
35. Lombardo S, Smith MC, Semler MW, et al. Balanced Crystalloid versus Saline in Adults with Traumatic Brain Injury: Secondary Analysis of a Clinical Trial. J Neurotrauma 2022;39(17-18):1159-67. doi: 10.1089/neu.2021.0465
36. Overgaard-Steensen C. Initial approach to the hyponatremic patient. Acta AnaesthesiolScand 2011;55(2):139-48.
37. Murphy N, Auzinger G, Bernel W, et al. The effect of hypertonic sodium chloride on intracranial pressure in patients with acute liver failure. Hepatology 2004;39(2):464-70.
38. Bernal W, Wendon J. Acute liver failure. N Engl J Med 2013;369(26):2525-34. doi: 10.1056/NEJMra1208937
