UDARBEJDET AF ARBEJDSGRUPPE UNDER DASAIM
Arbejdsgruppen
Tovholder: Anne Sofie Andreasen
Korrespondance: Anne Sofie Andreasen
Arbejdsgruppe:
Mik Wetterslev
Jeppe Bove
Jens Lindhardt Palm
Line Agger Kolstrup
Søren Kristen Lundgaard Hoffmann
Anne Sofie Andreasen
Fra Dansk Cardiologisk Selskab:
Axel Brandes
Jesper Kjærgaard
Thomas Kümler
Taksigelse:
Morten Hylander Møller for gennemlæsning og kommentering af manuskriptet
Interessekonflikter: Ingen
Forord og formål
Enhver læge med behandlingsansvar for kritisk syge patienter vil jævnligt skulle håndtere akut opstået atrieflimren (AF). Samlet set er den tilgængelige evidens om den mest hensigtsmæssige håndtering af nyopstået AF (NOAF) hos intensivpatienter begrænset, herunder overordnede behandlingsstrategier (rytmekontrol vs. frekvensregulering), valg af specifikke lægemidler, AK-behandling og behov for kardiologisk opfølgning. På nuværende tidspunkt findes ingen regionale eller nationale behandlingsvejledninger for håndtering af kritisk syge patienter med AF. Dansk Selskab for Anæstesiologi og Intensiv Medicin (DASAIM) etablerede derfor i 2018 en arbejdsgruppe med det formål at udarbejde en operationel klinisk behandlingsvejledning og samtidig belyse den eksisterende evidens på området. Arbejdsgruppen udgøres af medlemmer af DASAIM, og vejledningen er udarbejdet i samarbejde med fagrepræsentanter fra Dansk Cardiologisk Selskab (DCS). Den oprindelige intention var at udarbejde en GRADE-baseret guideline, men pba. den kvantitative og kvalitative begrænsede litteratur har det ikke været muligt at komme med fyldestgørende kliniske evidensbaserede rekommandationer målrettet intensivpatienter. Vi har i stedet valgt at udarbejde en operationel behandlingsvejledning, som integrerer anbefalinger fra European Heart Rhythm Associations (EHRA) [1], Dansk Cardiologisk Selskab [2] og tilgængelig evidens identificeret ved litteratursøgningen. Vores intention er, at behandlingsvejledningen kan yde støtte til håndtering af AF i intensiv regi.
Forkortelser
AF: Atrieflimren
AK: Antikoagulant / Antikoagulerende
AMI: Akut myokardieinfarkt
DC-konvertering: Direct current-konvertering
DCS: Dansk Cardiologisk Selskab
DVT: Dyb venetrombose
EHRA: European Heart Rhythm Association
GRADE: Grading of Recommendations Assessment, Development and Evaluation
HR: Heart rate
ITA: Intensiv afdeling
LE: Lungeemboli
LVEF: Left ventricle ejection fraction
NOAF: New-Onset Atrial Fibrillation
NOAK: Non-vitamin K antagonist Oral Anti-Koagulant
PICO: Population, Intervention, Comparator og Outcomes.
RVR: Rapid Ventricular Response
SR: Sinusrytme
TTE: Transthorakal ekkokardiografi
VTE: Venøs tromboemboli
Definition af atrieflimren
Supraventrikulær takyarytmi karakteriseret ved ukoordinerede atriale depolariseringer og dermed ophævet mekanisk funktion af atrierne.
Diagnosticering af atrieflimren
Diagnosen AF stilles ved 12-punkts EKG, telemetri eller anden form for kontinuerlig overvågning af hjerterytmen med en minimumsvarighed på 30 sekunder. Elektrokardiografisk ses manglende eller ikke veldefinerede p-takker, som er erstattet af en flimrende isoelektrisk grundlinje og uregelmæssig afstand mellem QRS-komplekserne. I tilfælde af 3. grads AV-blok kan AF dog være regelmæssig; frekvensen vil i så tilfælde oftest være langsom. Episoder af NOAF, for eksempel set på monitoren, bør bekræftes og dokumenteres ved 12-aflednings EKG af hensyn til dokumentation og planlægning af den videre behandling.
Klassifikation af atrieflimren
New-onset atrial fibrillation (NOAF): Førstegangsdetektion af AF hos patienter uden tidligere AF i anamnesen.
Paroksystisk AF: Selvlimiterende episoder af AF, der i mange tilfælde varer <2 døgn; kan dog vare op til 7 døgn. Episoder, der konverteres indenfor 7 døgn, kaldes også paroksystisk.
Persisterende AF: Episoder af AF, der varer >7 døgn inkl. episoder, der kræver konvertering for at genetablere sinusrytme (SR).
Langvarig persisterende AF: AF, der har varet ≥1 år, men med forsat indikation for rytmekontrollerende behandling.
Permanent AF: AF, hvis tilstedeværelse er accepteret, og hvor der ikke findes grundlag for (yderligere) forsøg på konvertering til SR. NB! Alle typer kan være førstegangstilfælde på det tidspunkt, hvor diagnosen stilles (http://nbv.cardio.dk/af).
Baggrund
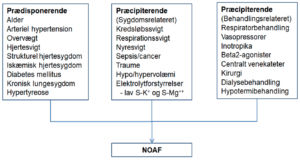
Atrieflimren (AF) er den hyppigst forekommende rytmeforstyrrelse ved akut kritisk sygdom med rapporteret hyppighed varierende fra ca. 2-44 % [3, 4]. Arytmien er associeret med forlænget indlæggelsesvarighed, øget dødelighed og risiko for tromboemboliske events [3, 5, 6]. Udvikling af AF i forbindelse med akut kritisk sygdom er ofte multifaktorielt betinget. Der eksisterer en række disponerende og modificerbare risikofaktorer, som både kan føre til udvikling og vedligeholdelse af AF [3, 7-9] (Fig.1). Arytmi-episoder i forbindelse med kritisk sygdom er ofte selvlimiterende [7, 10] og balancen mellem gavnlige/skadelige effekter af anvendte behandlinger for denne patientkategori er forsat utilstrækkelig belyst [3]. Det er velbeskrevet, at AF er forbundet med forskellige komplikationer i form af forværring af iskæmisk hjertesygdom, udvikling af takykardiinduceret hjertesvigt og en forøget risiko for tromboemboliske events på længere sigt [6, 11-15]. Desuden vil accelereret ventrikelfrekvens og ophævet pumpefunktion af atrierne i varierende grad kunne medføre nedsat slagvolumen og cardiac output samt evt. udvikling af kredsløbssvigt og på længere sigt diastolisk dysfunktion [16-19]. Samlet set vil disse faktorer kunne medvirke til akut destabilisering eller yderligere forværring af den kritisk syge patient.
De overordnede behandlingsmål for AF i intensivt regi er således: 1) at sikre kredsløbsstabilitet, 2) undgå uhensigtsmæssig kardiel belastning og 3) minimere risikoen for udvikling af ovennævnte AF-associerede komplikationer.
Figur 1. Risikofaktorer og tilstande associeret med atrieflimren
Metodebeskrivelse
Behandlingsvejledningen har til formål at være et overordnet værktøj til håndtering af AF hos den kritisk syge patient på ITA og samtidig belyse den nuværende evidens. Vi har i arbejdsgruppen forsøgt at fokusere på de væsentligste kliniske problemstillinger under danske forhold og samtidig gøre vejledningen så operationel som muligt. De fokuserede kliniske spørgsmål er udarbejdet via PICO-modellen (Population, Intervention, Comparator og Outcomes).
Systematiske litteratursøgninger blev udført i databaserne PubMed, Embase og Cochrane Library (senest opdateret i august 2020). Systematiske reviews med meta-analyser, randomiserede forsøg og observationelle studier på intensivpatienter blev prioriteret som primær litteratur. Alle studier blev gennemgået uafhængigt af to personer fra arbejdsgruppen. Udvælgelsen af primærstudier og dataekstraktion blev endeligt foretaget, efter uoverensstemmelser blev diskuteret af to andre fra gruppen. Der blev samlet inkluderet 12 studier [20-31]. Metodevurdering og risk of bias blev udført for de primære studier ved brug af Newcastle Ottawa scale for observationelle studier og Cochrane Risk of Bias tool for randomiserede forsøg. Eftersom størstedelen af evidensen for de kliniske spørgsmål stammer fra heterogene og ikke-randomiserede studier, er der ikke udført meta-analyser, og data præsenteres derfor deskriptivt. Sammenfatning og graduering af evidensen er baseret på GRADE (Grading of Recommendations Assessment, Development and Evaluation) [32]. En klinisk anbefaling for eller imod en behandlingsstrategi/intervention tog udgangspunkt i det prædefinerede PICO-spørgsmål. Ved mangelfuld eller tvetydig evidens ud fra litteratursøgningen og GRADE-vurderingen [32] blev anbefalinger fra EHRA og DCS medindtaget [1, 2]. Den samlede litteraturgennemgang er vedhæftet som appendix til vejledningen.
Overordnet klinisk forskningsspørgsmål:
Hvilke behandlingsstrategier og interventioner bør anvendes til patienter med nyopstået AF på ITA?
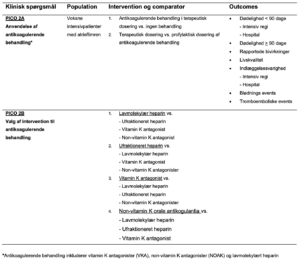
Population
Voksne patienter (medicinske såvel som kirurgiske) med NOAF indlagt på ITA. Vi opfattede dog AF hos hjertekirurgiske patienter som en unik problemstilling, og denne patientkategori blev derfor ikke medtaget ved litteraturudvælgelsen. NBV’en omfatter således ikke anbefalinger for håndtering af postoperativ AF hos de hjertekirurgiske patienter.
Interventions, Comparator og Outcomes
Vi har i arbejdsgruppen valgt at opdele de kliniske forskningsspørgsmål i to overordnede behandlingspunkter: Frekvensregulerende/rytmekontrollerende behandling og AK behandling. Disse er beskrevet i Tabel 1 og 2.
Tabel 1. Kliniske forskningsspørgsmål angående frekvens- og rytmekontrollerende behandling ud fra PICO-modellen (PICO 1)


Tabel 2. Kliniske forskningsspørgsmål angående antikoagulerende behandling ud fra PICO-modellen (PICO2)
Behandlingsvejledning
Overordnet valg af behandlingsstrategi (PICO 1A, punkt 1-4)
Rekommandationer:
Vi forslår, at der overvejes akut DC-konvertering ved hæmodynamisk kollaps som følge af AF (svag anbefaling baseret på meget lav evidens). Vi foreslår, at der hos den hæmodynamisk stabile patient med AF prioriteres i den akutte situation regulering af hjertefrekvens <110/min frem for rytmekontrol (svag anbefaling baseret på meget lav evidens).
Vi foreslår, at der ved persisterende symptomer, utilstrækkelig respons eller hæmodynamisk forværring trods optimal frekvensregulerende behandling kan tilstræbes rytmekontrol (svag anbefaling baseret på meget lav evidens). Vi afstår fra at komme med rekommandationer vedrørende timing for behandling af AF (ingen tilgængelig litteratur).
Rationale:
Arbejdsgruppen fandt ved litteraturgennemgang ingen studier, der kan underbygge en anbefaling for den overordnede behandlingsstrategi for intensivpatienter. Anbefalinger er givet med udgangspunkt i EHRA [1] og DCS [2].
Større randomiserede kliniske forsøg og systematiske reviews udført på ikke-kritisk syge patienter har ikke påvist en samlet gavnlig effekt af rytmekontrollerende strategi sammenlignet med frekvensregulerende behandling [33-38]. Enkelte studier har desuden påvist en øget risiko for bivirkninger og forlænget hospitalsindlæggelse ved rytmekontrollerende behandling [34, 38]. Anvendelse af frekvensregulerende strategi bør derfor foretrækkes som følge af ovenstående og pga. bivirkninger og risiko for proarytmier ved rytmekontrollerende behandlinger.
Valg af frekvensregulerende behandling (PICO 1B, punkt 1-5)
Rekommandationer:
Vi foreslår, at Amiodaron er første valg til frekvensregulering af NOAF hos kritisk syge patienter (svag anbefaling baseret på meget lav evidens).
Betablokade kan anvendes som alternativ frekvensregulerende behandling ved behandlingssvigt med amiodaron, såfremt LVEF er vurderet højere end 35% i forbindelse med aktuelle kritiske sygdom OG ved fravær af kontraindikationer, herunder inkompensation, pumpesvigt/LVEF < 35%, astma, ukorrigeret hypovolæmi og udtalt hæmodynamisk instabilitet (svag anbefaling baseret på meget lav evidens). Ved manglende effekt af eller kontraindikationer til amiodaron og betablokkere, kan digoxin anvendes som alternativ frekvensregulerende behandling (svag anbefaling baseret på meget lav evidens).
Calciumblokkere kan kun anvendes som frekvensregulering ved sikkert påvist normal LVEF under aktuelle kritiske sygdom (svag anbefaling baseret på meget lav evidens).
Rationale:
Behandlingsmålet ved frekvensregulering er reduktion af hjertefrekvensen, således takykardiudløste symptomer og risikoen for potentielle komplikationer minimeres. Grænsen for acceptabel hjertefrekvens kan ikke besvares ud fra vores litteraturgennemgang. DCS anbefaler hjertefrekvens under 110/min, men behandlingsmålet for intensivpatienten må bero på et individuelt klinisk skøn og løbende evaluering af behandlingsresponset.
Amiodaron er iht. anbefalinger fra DCS og det Europæiske Cardiologiske Selskab [1, 2] førstevalgspræparat til frekvensregulering af NOAF hos kritisk syge patienter med henvisning til mindre studier [31, 39].
I et større materiale på sepsispatienter (>39.000 patienter) med AF fandt Walkey et al. [29] en reduceret dødelighed ved betablokade sammenlignet med andre frekvensregulerende lægemidler (Digoxin, Amiodarone, Calciumkanal blokker). I de øvrige inkluderede studier fandtes betablokkere og Diltiazem ligeværdige i forhold til at opnå frekvensregulerende effekt, [21, 25, 26, 29]. Betablokkere har imidlertid en række generelle kontraindikationer, herunder hjertesvigt, ukendt LVEF, LVEF < 35%, hypovolæmi, svær hæmodynamisk instabilitet eller svær astma, som gør denne stofgruppe mindre universelt anvendelig på en population af intensiv-patienter end amiodaron. Calciumblokkere anvendes endvidere ikke i Danmark til patienter med reduceret LVEF eller ukendt pumpefunktion [2]. Anvendelsen af Digoxin på den multidisciplinære intensive afdeling har ikke fundet støtte i vores systematiske litteraturgennemgang. Digoxin har et snævert terapeutisk index med risiko for overdosering og toksisk effekt, især ved nyrefunktionspåvirkning og elektrolytderangering, men kan anvendes i fravær af kontraindikationer og i de situationer, hvor amiodaron er insufficient og betablokkere ikke ønskes anvendt.
Behandlingsforslag vedr. frekvensregulerende behandling
Amiodaron anvendes som førstevalg til frekvensregulerende behandling ved NOAF I fravær af kontraindikationer, ved nyligt målt LVEF > 35% og ved insufficient effekt af amiodaron kan en titrerbar betablokker med kort halveringstid, f.eks. esmolol, forsøges anvendt.
Digoxin kan anvendes til frekvensregulering ved insufficient effekt af amiodaron og kontraindikationer til betablokkere.
Valg af rytmekontrollerende behandling (PICO 1C, punkt 1-4)
Rekommandationer:
Vi foreslår akut DC-konvertering som førstevalg til patienter med hæmodynamisk kollaps som følge af AF. Hvis ingen kontraindikationer, da samtidig administration af amiodaron iv, 300 mg (svag anbefaling baseret på meget lav evidens).
Ved fravær at AF-betinget hæmodynamisk kollaps og ønske om rytmekontrol foreslår vi administration af amiodaron 300 mg iv over 30 minutter efterfulgt af kontinuerlig infusion (svag anbefaling baseret på meget lav evidens).
Vi afstår fra at komme med rekommandationer for anvendelse af propafenon og flecainid til behandling af AF i intensiv regi.
Rationale:
De hyppigst anvendte interventioner til rytmekontrol inkluderer amiodaron og DCkonvertering. På baggrund af vores systematiske litteraturgennemgang samt anbefalingerne fra EHRA og DCS foreslås amiodaron som førstevalg til farmakologisk rytmekontrol. Den nuværende evidens er begrænset, og de inkluderede studier har betydelige metodiske svagheder [20, 21, 23, 27, 29]. Med udgangspunkt i EHRA’s og DCS’s anbefalinger [1, 2] kan amiodaron anvendes som antiarytmikum til patienter med hjertesvigt (LVEF <35%) og anden strukturel hjertesygdom. Hypotension og bradykardi kan forekomme, især ved hurtig indgift.
Observationelle studier har vist, at co-administration af magnesiumsulfat potentielt kan have en synergistisk effekt med amiodaron i forhold til konvertering til SR med relativt få bivirkninger (hypotension, bradykardi og hypermagnesiæmi [1, 40, 41]. Man kan derfor overveje at supplere amiodaron-infusion med magnesium-indgift.
Som tidligere anført anbefales akut DC-konvertering ved AF-induceret kredsløbsinstabilitet af EHRA og DCS [1, 2]. DC-konvertering er associeret med få risici, men er hos den kritisk syge patient også associeret høj recidivrate af AF [24, 42]. Der kan ikke gives anbefalinger om placering af pads eller energivalg på baggrund af vores litteratursøgning. Derfor tager anbefalingen udgangspunkt i EHRA’s anbefaling.
Behandlingsforslag vedr. dosering af amiodaron
Baseret på DCS anbefales iv-bolus amiodaron 300 mg efterfulgt af kontinuerlig infusion med 15mg/kg/døgn (maks. 1200 mg/døgn), med henblik på loading med samlet dosis maks. 10 g. Infusion kan evt. skiftes til højdosis peroral behandling 400 mg * 3 dgl., når patienten er hæmodynamisk stabiliseret og ude af noradrenalinbehandling. Varighed af loading-fasen må på ITA bero på et lægeligt skøn, men kan – ofte med fordel – fortsætte, indtil patienten er loadet med 10 g i alt. Tidlig seponering af amiodaron-infusion – dvs. så snart patienten reverterer til SR – indebærer en risiko for, at patienten atter slår tilbage i AF. Efter loading-dosis på maks. 10 g amiodaron bør der konfereres med kardiolog med henblik på plan for videre amiodaron-behandling, herunder om hvorvidt amiodaron skal fortsætte som vedligeholdelsesbehandling 200 mg * 1 dgl. eller seponeres. Patienter bør ikke flyttes til stationært afsnit med højdosis peroral behandling (400 mg * 3) uden planlagt opfølgende kardiologisk tilsyn mhp. videre behandling.
Behandlingsforslag vedr. DC-konvertering
Anterior-posterior padsplacering og bifasisk waveforme anbefales. Der afgives altid synkroniseret defibrillering ved AF.
Forbehandling med amiodarone eller andet antiarytmikum.
Øget energi (200J) efter thoraxkirurgi.
Overflytning ud af ITA
Tillægspunkt vedrørende rytmekontrollerende eller frekvensregulerende behandling
Indikationen for forsat rytmekontrollerende eller frekvensregulerende behandling efter udskrivelse fra ITA indgik ikke som punkt i de prædefinerede kliniske spørgsmål. Rekommandationen er efterfølgende blevet tilføjet grundet problemstillingens kliniske relevans og baserer sig på DCS’s behandlingsvejledning.
Målet er at fastholde patienten i SR, alternativt sikre en passende frekvens af persisterende AF efter udskrivelse fra ITA. Hvis patienten allerede er opstartet i frekvensregulerende eller rytmekontrollerende behandling, kan behandlingen fortsætte efter nærmere aftale med kardiolog. Ved persisterende AF kan DC-konvertering på et senere tidspunkt blive relevant. Kardiologisk tilsyn på stamafsnit suppleret med ambulant opfølgning efter udskrivelse vil ofte være velindiceret med henblik på: 1) vurdering af indikation for fortsat frekvensregulerende eller rytmekontrollerende behandling, 2) behov for yderligere udredning og behandling og 3) stillingtagen til permanent AK-behandling.
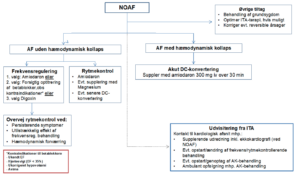
Figur 2. Behandlingsalgoritme for rytmekontrol og frekvensregulering
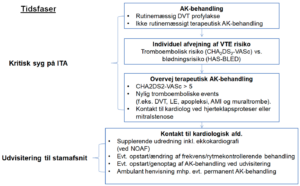
AK-behandling ved atrieflimren under ITA-indlæggelse (PICO 2A, punkt 1-2)
Rekommandationer:
Vi forslår ikke rutinemæssig opstart af terapeutisk AK-behandling på ITA ved udvikling eller detektion af AF (svag anbefaling baseret på meget lav evidens). Patienter med førstegangs-, paroksystisk, persisterende og permanent AF skal alle vurderes ud fra de samme kriterier i forhold til indikation for AK-behandling (svag anbefaling baseret på meget lav evidens).
Rationale:
Baseret på vores systematiske litteraturgennemgang anbefaler vi, at der ikke rutinemæssigt anvendes terapeutisk AK-behandling hos intensivpatienter med NOAF. To observationelle studier af hhv. 115 ITA-patienter [22] og 27.010 propensity-matchede sepsispatienter [28] fandt signifikant højere forekomst af blødninger og andre behandlingsrelaterede komplikationer hos patienter i AK-behandling sammenlignet med patienter, der ikke modtog AK-behandling. Samtidig var der ingen forskel imellem grupperne ift. rapporterede tilfælde af in-hospital stroke eller in-hospital mortalitet [28]. Der kan være individuelle faktorer, som gør, at den enkelte patient med NOAF kan profitere fra at opstarte terapeutisk AK-behandling allerede under indlæggelsen, f.eks. høj CHA2DS2-VASc score, nyligt tromboembolisk event og/eller meget langvarigt, men stabilt ITA-forløb. Fordele ved opstart af antikoagulerende behandling skal altid afvejes mod blødningsrisiko, som kan estimeres ved HAS-BLED score. Der bør konfereres med kardiologerne ved tvivl. Det bør bemærkes, at hverken CHA2DS2-VASc eller HAS-BLED er valideret på ITA populationen; scorerne kan dog give en indikation af den individuelle patiens trombose- og blødningsrisiko.
Valg af farmakologisk intervention til AK behandling (PICO 2B, punkt 1-4) Ingen rekommandation
Arbejdsgruppen fandt ingen studier, der opfyldte kriterierne ved litteraturgennemgang, som kan danne grundlag for en anbefaling vedrørende valg eller dosering af antikoagulerende intervention til intensivpatienter med AF.
Behandlingsforslag vedr. AK-behandling til ITA-patienten med NOAF
Vurderer man, at patienten med NOAF ikke kan vente med opstart af AK-behandling til efter udskrivelse fra ITA, anbefales lavmolekylvægt heparin (LMWH) i terapeutisk dosis som Best Practice grundet stofgruppens korte halveringstid sammenlignet med NOAK og muligheden for partiel revertering. Dosisreduktion (halvering af dosis) skal overvejes ved GFR < 20-30 ml/min, evt. med måling af faktor Xa 4 timer efter indgift. Indstik og kanylering indebærer minimal blødningsrisiko 24 timer efter sidste dosis LMWH i terapeutisk dosering. En forøget blødningsrisiko er til stede i 2-3 dage efter administration af NOAK ved normal nyrefunktion. Hvis man vurderer, at patienten er blandt den lille gruppe ITA-patienter, der er velegnet til opstart af peroral AK-behandling under indlæggelsen på ITA, bør stillingtagen til NOAK vs. vitamin K antagonist (VKA) ske i samråd med kardiolog. Med udgangspunkt i EHRA [1], DCS [2] og arbejdsgruppens litteraturgennemgang er ovenstående anbefalinger for antikoagulerende behandling givet.
Tillægspunkt vedrørende fortsat AK-behandling på ITA for patienter med kendt AF
Patienter på ITA med kendt AF og i fast AK-behandling forud for intensivindlæggelsen bør som udgangspunkt pausere terapeutisk dosering af AK-behandlingen under den mest akutte fase af kritisk sygdom, såfremt patienten opfylder nedenstående: CHA2DS2-VASc-score under eller lig med 5.
Ingen nylige tromboemboliske events (f.eks. DVT, lungeemboli, apopleksi) indenfor de sidste 3-6 mdr.
Ej mekanisk klap.
Intet AMI eller ingen påvist muraltrombe.
Hvis patienten opfylder en eller flere ovenstående faktorer, bør AK behandling i terapeutisk dosering overvejes under hensyntagen til blødningsrisiko og evt. kontraindikationer, som følge af den akutte sygdom.
AK-behandling ved udvisitering fra ITA
Tillægspunkt
Alle patienter med detekteret NOAF-episode i forbindelse med intensivindlæggelse bør henvises til tromboserisikovurdering i ambulant kardiologisk regi efter udskrivelse. Op mod 50% af de patienter, som under kritisk sygdom udvikler paroxystisk eller persisterende AF, har fornyede episoder efter udskrivelsen [43, 44]. Hos en del af disse patienter bliver tilbagefald af AF ikke erkendt, før de udvikler AF-associerede komplikationer, herunder iskæmisk apopleksi. AK-behandling bør overvejes ud fra en konkret afvejning af risiko for tromboemboliske events (vurderet ved CHA2DS2-VASc) sammenholdt med blødningsrisiko (vurderet ved HAS-BLED). Det gælder også efter tilfælde af nyopstået eller paroksystisk AF, der tidligere har været betragtet som ”sekundære” til akut sygdom [2]. DCS anbefaler således, at patienter med AF opstået i forbindelse med kritisk sygdom, infektion eller kirurgi bør henvises til kardiologisk opfølgning og vurdering [2].
Vi anbefaler derfor, at den enkelte ITA udarbejder en arbejdsgang i samarbejde med det lokale kardiologiske afsnit, der sikrer relevant ambulant opfølgning for patienter med NOAF under intensivindlæggelse med henblik på stillingtagen til AK-behandling, behov for forsat rytmekontrollerende eller frekvensregulerende behandling og evt. ambulant TTE, hvis denne ikke er foretaget sufficient under indlæggelsen. Patienter, der er kendt med eksisterende AF, overgår i fravær af kontraindikationer som udgangspunkt til deres vanlige behandling ved udskrivelse fra ITA.
Figur 3. Behandlingsalgoritme for antikoagulerende terapi
Referencer
1. Boriani G, Fauchier L, Aguinaga L, Beattie JM, Blomstrom Lundqvist C, Cohen A, Dan GA, Genovesi S, Israel C, Joung B, Kalarus Z, Lampert R, Malavasi VL, Mansourati J, Mont L, Potpara T, Thornton A, Lip GYH, Gorenek B, Marin F, Dagres N, Ozcan EE, Lenarczyk R, Crijns HJ, Guo Y, Proietti M, Sticherling C, Huang D, Daubert JP, Pokorney SD, Cabrera Ortega M, Chin A, (2019) European Heart Rhythm Association (EHRA) consensus document on management of arrhythmias and cardiac electronic devices in the critically ill and post-surgery patient, endorsed by Heart Rhythm Society (HRS), Asia Pacific Heart Rhythm Society (APHRS), Cardiac Arrhythmia Society of Southern Africa (CASSA), and Latin American Heart Rhythm Society (LAHRS). Europace : European pacing, arrhythmias, and cardiac electrophysiology : journal of the working groups on cardiac pacing, arrhythmias, and cardiac cellular electrophysiology of the European Society of Cardiology 21: 7-8
2. Jensen HK RN, Darkner S (2020) Behandlingsvejledning for atrieflimren og atrieflagren. In: Editor (ed)^(eds) Book Behandlingsvejledning for atrieflimren og atrieflagren. Dansk Kardiologisk Selskab, City, pp.
3. Wetterslev M, Haase N, Hassager C, Belley-Cote EP, McIntyre WF, An Y, Shen J, Cavalcanti AB, Zampieri FG, Guimaraes HP, Granholm A, Perner A, Møller MH, (2019) New-onset atrial fibrillation in adult critically ill patients: a scoping review. Intensive care medicine 45: 928-938
4. McIntyre WF, Um KJ, Cheung CC, Belley-Cote EP, Dingwall O, Devereaux PJ, Wong JA, Conen D, Whitlock RP, Connolly SJ, Seifer CM, Healey JS, (2019) Atrial fibrillation detected initially during acute medical illness: A systematic review. European heart journal Acute cardiovascular care 8: 130-141
5. Walkey AJ, Wiener RS, Ghobrial JM, Curtis LH, Benjamin EJ, (2011) Incident stroke and mortality associated with new-onset atrial fibrillation in patients hospitalized with severe sepsis. Jama 306: 2248-2254
6. Benjamin EJ, Wolf PA, D’Agostino RB, Silbershatz H, Kannel WB, Levy D, (1998) Impact of atrial fibrillation on the risk of death: the Framingham Heart Study. Circulation 98: 946-952
7. Bosch NA, Cimini J, Walkey AJ, (2018) Atrial Fibrillation in the ICU. Chest 154: 1424-1434
8. Yoshida T, Fujii T, Uchino S, Takinami M, (2015) Epidemiology, prevention, and treatment of new-onset atrial fibrillation in critically ill: a systematic review. Journal of intensive care 3: 19
9. Wu Z, Fang J, Wang Y, Chen F, (2020) Prevalence, Outcomes, and Risk Factors of New-Onset Atrial Fibrillation in Critically Ill Patients. International heart journal 61: 476-485
10. Danias PG, Caulfield TA, Weigner MJ, Silverman DI, Manning WJ, (1998) Likelihood of spontaneous conversion of atrial fibrillation to sinus rhythm. Journal of the American College of Cardiology 31: 588-592
11. Lin HJ, Wolf PA, Kelly-Hayes M, Beiser AS, Kase CS, Benjamin EJ, D’Agostino RB, (1996) Stroke severity in atrial fibrillation. The Framingham Study. Stroke 27: 1760- 1764
12. Stewart S, Hart CL, Hole DJ, McMurray JJ, (2002) A population-based study of the long-term risks associated with atrial fibrillation: 20-year follow-up of the Renfrew/Paisley study. The American journal of medicine 113: 359-364
13. Andersson T, Magnuson A, Bryngelsson IL, Frøbert O, Henriksson KM, Edvardsson N, Poçi D, (2013) All-cause mortality in 272,186 patients hospitalized with incident atrial fibrillation 1995-2008: a Swedish nationwide long-term case-control study. European heart journal 34: 1061-1067
14. Wang TJ, Larson MG, Levy D, Vasan RS, Leip EP, Wolf PA, D’Agostino RB, Murabito JM, Kannel WB, Benjamin EJ, (2003) Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation 107: 2920-2925
15. Odutayo A, Wong CX, Hsiao AJ, Hopewell S, Altman DG, Emdin CA, (2016) Atrial fibrillation and risks of cardiovascular disease, renal disease, and death: systematic review and meta-analysis. BMJ (Clinical research ed) 354: i4482
16. Clark DM, Plumb VJ, Epstein AE, Kay GN, (1997) Hemodynamic effects of an irregular sequence of ventricular cycle lengths during atrial fibrillation. Journal of the American College of Cardiology 30: 1039-1045
17. Lau CP, Leung WH, Wong CK, Cheng CH, (1990) Haemodynamics of induced atrial fibrillation: a comparative assessment with sinus rhythm, atrial and ventricular pacing. European heart journal 11: 219-224
18. Raymond RJ, Lee AJ, Messineo FC, Manning WJ, Silverman DI, (1998) Cardiac performance early after cardioversion from atrial fibrillation. American heart journal 136: 435-442
19. Viswanathan K, Daniak SM, Salomone K, Kiely T, Patel U, Converso K, Manning WJ, Silverman DI, (2001) Effect of cardioversion of atrial fibrillation on improvement in left ventricular performance. The American journal of cardiology 88: 439-441
20. Balik M, Kolnikova I, Maly M, Waldauf P, Tavazzi G, Kristof J, (2017) Propafenone for supraventricular arrhythmias in septic shock-Comparison to amiodarone and metoprolol. Journal of critical care 41: 16-23
21. Brown M, Nassoiy S, Chaney W, Plackett TP, Blackwell RH, Luchette F, Engoren M, Posluszny J, Jr., (2018) Impact and treatment success of new-onset atrial fibrillation with rapid ventricular rate development in the surgical intensive care unit. The Journal of surgical research 229: 66-75
22. Darwish OS, Strube S, Nguyen HM, Tanios MA, (2013) Challenges of anticoagulation for atrial fibrillation in patients with severe sepsis. The Annals of pharmacotherapy 47: 1266-1271
23. Gerlach AT K-GS, Dasta JF, Steinberg S, Martin LC, Cook CH (2008) Diltiazem versus amiodarone for new-onset atrial arrhythmias in non-cardiac post surgical patients: a cohort study. . Crit Care Shock 11: 94-106
24. Kanji S, Williamson DR, Yaghchi BM, Albert M, McIntyre L, (2012) Epidemiology and management of atrial fibrillation in medical and noncardiac surgical adult intensive care unit patients. Journal of critical care 27: 326.e321-328
25. Moskowitz A, Chen KP, Cooper AZ, Chahin A, Ghassemi MM, Celi LA, (2017) Management of Atrial Fibrillation with Rapid Ventricular Response in the Intensive Care Unit: A Secondary Analysis of Electronic Health Record Data. Shock (Augusta, Ga) 48: 436-440
26. Personett HA, Smoot DL, Stollings JL, Sawyer M, Oyen LJ, (2014) Intravenous metoprolol versus diltiazem for rate control in noncardiac, nonthoracic postoperative atrial fibrillation. The Annals of pharmacotherapy 48: 314-319
27. Sekhri A, Aronow WS, Sekhri V, Palaniswamy C, Chandy D, (2009) Treatment of patients with supraventricular tachyarrhythmias in a medical intensive care unit. Comprehensive therapy 35: 188-191
28. Walkey AJ, Quinn EK, Winter MR, McManus DD, Benjamin EJ, (2016) Practice Patterns and Outcomes Associated With Use of Anticoagulation Among Patients With Atrial Fibrillation During Sepsis. JAMA cardiology 1: 682-690
29. Walkey AJ, Evans SR, Winter MR, Benjamin EJ, (2016) Practice Patterns and Outcomes of Treatments for Atrial Fibrillation During Sepsis: A Propensity-Matched Cohort Study. Chest 149: 74-83
30. Balser JR, Martinez EA, Winters BD, Perdue PW, Clarke AW, Huang W, Tomaselli GF, Dorman T, Campbell K, Lipsett P, Breslow MJ, Rosenfeld BA, (1998) Betaadrenergic blockade accelerates conversion of postoperative supraventricular tachyarrhythmias. Anesthesiology 89: 1052-1059
31. Delle Karth G, Geppert A, Neunteufl T, Priglinger U, Haumer M, Gschwandtner M, Siostrzonek P, Heinz G, (2001) Amiodarone versus diltiazem for rate control in critically ill patients with atrial tachyarrhythmias. Critical care medicine 29: 1149- 1153
32. Balshem H, Helfand M, Schünemann HJ, Oxman AD, Kunz R, Brozek J, Vist GE, Falck-Ytter Y, Meerpohl J, Norris S, Guyatt GH, (2011) GRADE guidelines: 3. Rating the quality of evidence. Journal of clinical epidemiology 64: 401-406
33. Pluymaekers N, Dudink E, Luermans J, Meeder JG, Lenderink T, Widdershoven J, Bucx JJJ, Rienstra M, Kamp O, Van Opstal JM, Alings M, Oomen A, Kirchhof CJ, Van Dijk VF, Ramanna H, Liem A, Dekker LR, Essers BAB, Tijssen JGP, Van Gelder IC, Crijns H, (2019) Early or Delayed Cardioversion in Recent-Onset Atrial Fibrillation. The New England journal of medicine 380: 1499-1508
34. Wyse DG, Waldo AL, DiMarco JP, Domanski MJ, Rosenberg Y, Schron EB, Kellen JC, Greene HL, Mickel MC, Dalquist JE, Corley SD, (2002) A comparison of rate control and rhythm control in patients with atrial fibrillation. The New England journal of medicine 347: 1825-1833
35. Carlsson J, Miketic S, Windeler J, Cuneo A, Haun S, Micus S, Walter S, Tebbe U, (2003) Randomized trial of rate-control versus rhythm-control in persistent atrial fibrillation: the Strategies of Treatment of Atrial Fibrillation (STAF) study. Journal of the American College of Cardiology 41: 1690-1696
36. Hohnloser SH, Kuck KH, Lilienthal J, (2000) Rhythm or rate control in atrial fibrillation–Pharmacological Intervention in Atrial Fibrillation (PIAF): a randomised trial. Lancet (London, England) 356: 1789-1794
37. Caldeira D, David C, Sampaio C, (2012) Rate versus rhythm control in atrial fibrillation and clinical outcomes: updated systematic review and meta-analysis of randomized controlled trials. Archives of cardiovascular diseases 105: 226-238
38. Sethi NJ, Feinberg J, Nielsen EE, Safi S, Gluud C, Jakobsen JC, (2017) The effects of rhythm control strategies versus rate control strategies for atrial fibrillation and atrial flutter: A systematic review with meta-analysis and Trial Sequential Analysis. PloS one 12: e0186856
39. Clemo HF, Wood MA, Gilligan DM, Ellenbogen KA, (1998) Intravenous amiodarone for acute heart rate control in the critically ill patient with atrial tachyarrhythmias. The American journal of cardiology 81: 594-598
40. Moran JL, Gallagher J, Peake SL, Cunningham DN, Salagaras M, Leppard P, (1995) Parenteral magnesium sulfate versus amiodarone in the therapy of atrial tachyarrhythmias: a prospective, randomized study. Critical care medicine 23: 1816-1824
41. Sleeswijk ME, Tulleken JE, Van Noord T, Meertens JH, Ligtenberg JJ, Zijlstra JG, (2008) Efficacy of magnesium-amiodarone step-up scheme in critically ill patients with new-onset atrial fibrillation: a prospective observational study. Journal of intensive care medicine 23: 61-66
42. Mayr A, Ritsch N, Knotzer H, Dunser M, Schobersberger W, Ulmer H, Mutz N, Hasibeder W, (2003) Effectiveness of direct-current cardioversion for treatment of supraventricular tachyarrhythmias, in particular atrial fibrillation, in surgical intensive care patients. Critical care medicine 31: 401-405
43. Lubitz SA, Yin X, Rienstra M, Schnabel RB, Walkey AJ, Magnani JW, Rahman F, McManus DD, Tadros TM, Levy D, Vasan RS, Larson MG, Ellinor PT, Benjamin EJ, (2015) Long-term outcomes of secondary atrial fibrillation in the community: the Framingham Heart Study. Circulation 131: 1648-1655
44. Walkey AJ, Hammill BG, Curtis LH, Benjamin EJ, (2014) Long-term outcomes following development of new-onset atrial fibrillation during sepsis. Chest 146: 1187-1195
Bilag
Bilag 1A. Søgestrategi for frekvensregulerende og rytmekontrollerende behandling
PUBMED
Limits: Humans
Search strategy:
atrial fibrillation OR supraventricular arrhythmia OR tachyarrhythmia OR arrhyth*
ICU OR intensive care OR critical care
rate control OR heart rate control OR rhythm control OR antiarrhythmic OR antiarrhyth* OR anti-arrhythmic OR anti-arrhyth* OR conversion OR DC OR cardioversion
1 AND 2 AND 3
EMBASE
Limits: Human, Embase
Search strategy:
(atrial fibrillation or supraventricular arrhythmia or tachyarrhythmia or arrhyth*).mp. [mp=title, abstract, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword, floating subheading word, candidate term word]
(icu or intensive care or critical care).mp. [mp=title, abstract, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword, floating subheading word, candidate term word]
(rate control or heart rate control or rhythm control or antiarrhythmic or antiarrhyth* or antiarrhythmic or anti-arrhyth* or conversion or DC or cardioversion).mp. [mp=title, abstract, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword, floating subheading word, candidate term word]
1 AND 2 AND 3
Cochrane Library
Limits: None
Search strategy:
atrial fibrillation OR supraventricular arrhythmia OR tachyarrhythmia OR arrhyth* in Title Abstract Keyword
ICU OR intensive care OR critical care in Title Abstract Keyword
rate control OR heart rate control OR rhythm control OR antiarrhythmic OR antiarrhyth* OR anti-arrhythmic OR anti-arrhyth* OR conversion OR DC OR cardioversion in Title Abstract Keyword – (Word variations have been searched)
1 AND 2 AND 3
Bilag 1B. Søgestrategi for antikoagulerende behandling
PubMed
Limits: Human
Search strategy:
atrial fibrillation OR supraventricular arrhythmia OR tachyarrhythmia OR arrhyth*
ICU OR intensive care OR critical care
anticoag* OR anti-coag* OR novel oral anticoag* OR novel oral anti-coag* OR new oral anticoag* OR new oral anti-coag* OR NOAC OR non-vitamin k antagonist OR heparin OR low molecular weight heparin OR LMWH OR unfractionated heparin OR vitamin K antagonist* OR VKA
1 AND 2 AND 3
EMBASE
Limits: Human, Embase
Search strategy:
atrial fibrillation or supraventricular arrhythmia or tachyarrhythmia or arrhyth*).mp. [mp=title, abstract, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword, floating subheading word, candidate term word]
ICU or intensive care or critical care).mp. [mp=title, abstract, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword, floating subheading word, candidate term word]
anticoag* or anti-coag* or novel oral anticoag* or novel oral anti-coag* or new oral anticoag* or new oral anti-coag* or NOAC or non-vitamin k antagonist or heparin or low molecular weight heparin or LMWH or unfractionated heparin or vitamin K antagonist* or VKA).mp. [mp=title, abstract, heading word, drug trade name, original title, device manufacturer, drug manufacturer, device trade name, keyword, floating subheading word, candidate term word]
1 AND 2 AND 3
Cochrane Library
Limits: None
Search strategy:
atrial fibrillation OR supraventricular arrhythmia OR tachyarrhythmia OR arrhyth* in Title Abstract Keyword
ICU OR intensive care OR critical care in Title Abstract Keyword
anticoag* OR anti-coag* OR novel oral anticoag* OR novel oral anti-coag* OR new oral anticoag* OR new oral anti-coag* OR NOAC OR non-vitamin k antagonist OR heparin OR low molecular weight heparin OR LMWH OR unfractionated heparin OR vitamin K antagonist* OR VKA in Title Abstract Keyword – (Word variations have been searched)
1 AND 2 AND 3
Bilag 2A. Flowchart for litteratursøgning og studieselektion for frekvensregulerende og rytmekontrollerende behandling

Bilag 2B. Flowchart for litteratursøgning og studieselektion for antikoagulerende behandling
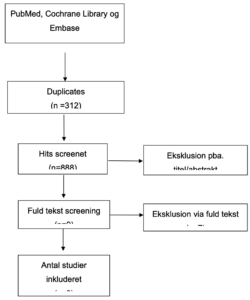
Bilag 3. Resultatgennemgang af inkluderede studier
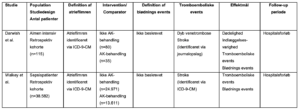
Tabel B1. Karakteristika for inkluderede studier vedrørende frekvens- og rytmekontrollerende behandling
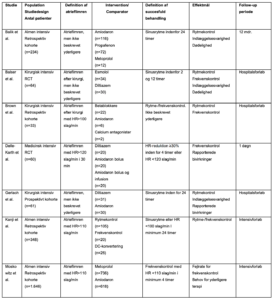

Tabel B2. Resultater fra inkluderede studier vedrørende frekvens- og rytmekontrollerende behandling
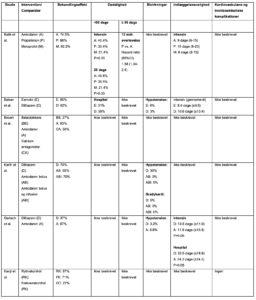
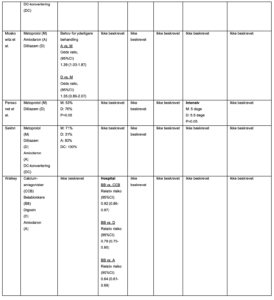
Table B3. Karakteristika for inkluderede studier vedrørende antikoagulerende behandling
Tabel B4. Resultater fra inkluderede studier vedrørende antikoagulerende behandlinger

Bilag 4: Kvalitetsvurdering af primære studier
Table B5. Newcastle-Ottawa skala (observationelle studier)
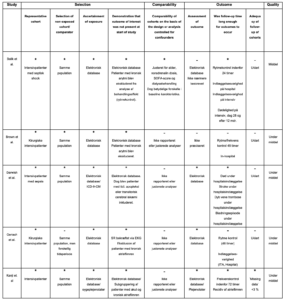
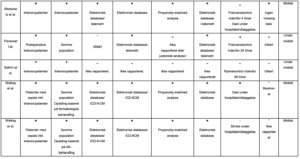
Table B6. Cochranes risk-of bias (randomiserede forsøg)

Bilag 5A. Vurdering af evidensniveau (GRADE) for randomiserede forsøg
PICO 1b. Valg af farmakologisk intervention til frekvenskontrollerende behandling
Betablokkere vs. andre frekvenskontrollerende interventioner

Referencer
- Balser JR, Martinez EA, Winters BD, et al. Beta-adrenergic blockade accelerates conversion of postoperative supraventricular tachyarrhythmias. Anesthesiology 89: 1052-1059
PICO 1b. Valg af farmakologisk intervention til frekvenskontrollerende behandling
Calciumantagonister vs. andre frekvenskontrollerende interventioner

Referencer
- Balser JR, Martinez EA, Winters BD, et al. Beta-adrenergic blockade accelerates conversion of postoperative supraventricular tachyarrhythmias. Anesthesiology 89: 1052-1059
- Delle Karth G, Geppert A, Neunteufl T, et al. Amiodarone versus diltiazem for rate control in critically ill patients with atrial tachyarrhythmias. Crit Care Med. 2001;29(6):1149-1153.
Bilag 5B. Vurdering af evidensniveau (GRADE) for observationelle studier
PICO 1a. Valg af overordnet behandlingsstrategi ved AF
1. Farmakologisk rytmekontrollerende intervention og/eller DC-konvertering vs. ingen behandling
Kommentar: Arbejdsgruppen identificerede ingen relevante studier ved litteraturgennemgang
2. Tidlig vs. sen indsættende behandling ved detektion af AF
Kommentar: Arbejdsgruppen identificerede ingen relevante studier ved litteraturgennemgang
3. Frekvenskontrollerende behandling vs. ingen behandling
Kommentar: Arbejdsgruppen identificerede ingen relevante studier ved litteraturgennemgang
4. Rytmekontrol vs. frekvenskontrol

Referencer
- Kanji S, Williamson DR, Yaghchi BM, Albert M, McIntyre L; Canadian Critical Care Trials Group. Epidemiology and management of atrial fibrillation in medical and noncardiac surgical adult intensive care unit patients. Journal of critical care 27: 326.e321-328
PICO 1b. Valg af farmakologisk intervention til frekvenskontrollerende behandling
1. Betablokkere vs. andre frekvenskontrollerende interventioner
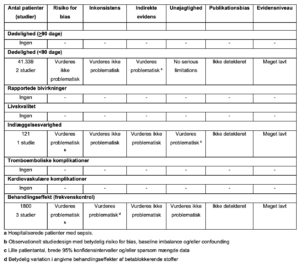
Referencer
- Brown M, Nassoiy S, Chaney W, et al. Impact and treatment success of new-onset atrial fibrillation with rapid ventricular rate development in the surgical intensive care unit. J Surg Res. 2018;229:66-75.
- Moskowitz A, Chen KP, Cooper AZ, Chahin A, Ghassemi MM, Celi LA. Management of Atrial Fibrillation with Rapid Ventricular Response in the Intensive Care Unit: A Secondary Analysis of Electronic Health Record Data. Shock. 2017;48(4):436-440.
- Personett HA, Smoot DL, Stollings JL, Sawyer M, Oyen LJ. Intravenous metoprolol versus diltiazem for rate control in noncardiac, nonthoracic postoperative atrial fibrillation. Ann Pharmacother. 2014;48(3):314-319.
- Walkey AJ, Evans SR, Winter MR, Benjamin EJ. Practice Patterns and Outcomes of Treatments for Atrial Fibrillation During Sepsis: A Propensity-Matched Cohort Study. Chest.
2. Calciumantagonister vs. andre frekvenskontrollerende interventioner
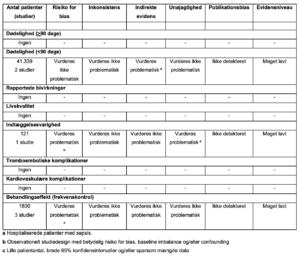
Referencer
- Brown M, Nassoiy S, Chaney W, et al. Impact and treatment success of new-onset atrial fibrillation with rapid ventricular rate development in the surgical intensive care unit. J Surg Res. 2018;229:66-75.
- Moskowitz A, Chen KP, Cooper AZ, Chahin A, Ghassemi MM, Celi LA. Management of Atrial Fibrillation with Rapid Ventricular Response in the Intensive Care Unit: A Secondary Analysis of Electronic Health Record Data. Shock. 2017;48(4):436-440.
- Personett HA, Smoot DL, Stollings JL, Sawyer M, Oyen LJ. Intravenous metoprolol versus diltiazem for rate control in noncardiac, nonthoracic postoperative atrial fibrillation. Ann Pharmacother. 2014;48(3):314-319.
- Walkey AJ, Evans SR, Winter MR, Benjamin EJ. Practice Patterns and Outcomes of Treatments for Atrial Fibrillation During Sepsis: A Propensity-Matched Cohort Study. Chest.
3. Digoxin vs. andre frekvenskontrollerende interventioner
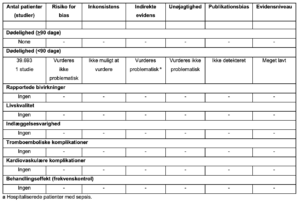
Referencer
- Walkey AJ, Evans SR, Winter MR, Benjamin EJ. Practice Patterns and Outcomes of Treatments for Atrial Fibrillation During Sepsis: A Propensity-Matched Cohort Study. Chest.
4. Magnesium vs. andre frekvenskontrollerende interventioner
Kommentar: Arbejdsgruppen identificerede ingen relevante studier ved litteraturgennemgang
5. Amiodaron vs. andre frekvenskontrollerende interventioner
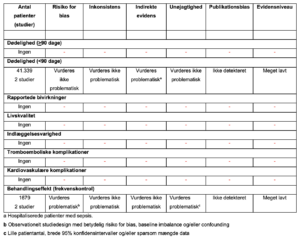
Referencer
- Brown M, Nassoiy S, Chaney W, et al. Impact and treatment success of new-onset atrial fibrillation with rapid ventricular rate development in the surgical intensive care unit. J Surg Res. 2018;229:66-75.
- Moskowitz A, Chen KP, Cooper AZ, Chahin A, Ghassemi MM, Celi LA. Management of Atrial Fibrillation with Rapid Ventricular Response in the Intensive Care Unit: A Secondary Analysis of Electronic Health Record Data. Shock. 2017;48(4):436-440.
- Walkey AJ, Evans SR, Winter MR, Benjamin EJ. Practice Patterns and Outcomes of Treatments for Atrial Fibrillation During Sepsis: A Propensity-Matched Cohort Study. Chest.
PICO 1c. Valg af farmakologisk intervention til rytmekontrollerende behandling
1. Amiodaron vs. andre rytmekontrollerende interventioner
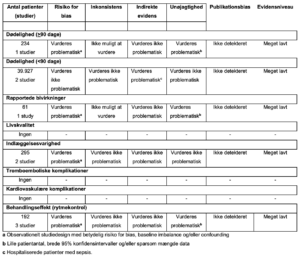
Referencer
- Balik M, Kolnikova I, Maly M, Waldauf P, Tavazzi G, Kristof J. Propafenone for supraventricular arrhythmias in septic shock-Comparison to amiodarone and metoprolol. J Crit Care.
- Brown M, Nassoiy S, Chaney W, et al. Impact and treatment success of new-onset atrial fibrillation with rapid ventricular rate development in the surgical intensive care unit. J Surg Res. 2018;229:66-75.
- Gerlach AT, Kane-Gill SL, Dasta JF, Steinberg S, Martin LC, Cook CH. Diltiazem versus amiodarone for new-onset atrial arrhythmias in non-cardiac post surgical patients: a cohort study. Crit Care Shock. 2008;11:94–106Sekhri A, Aronow WS, Sekhri V, Palaniswamy C, Chandy D. Treatment of patients with supraventricular tachyarrhythmias in a medical intensive care unit. Compr Ther. 2009;35(3-4):188- 191.
- Walkey AJ, Evans SR, Winter MR, Benjamin EJ. Practice Patterns and Outcomes of Treatments for Atrial Fibrillation During Sepsis: A Propensity-Matched Cohort Study. Chest.
2. Flecainid vs. andre rytmekontrollerende interventioner
Kommentar: Arbejdsgruppen identificerede ingen relevante studier ved litteraturgennemgang
3. Propafenon vs. other rhythm controlling agents
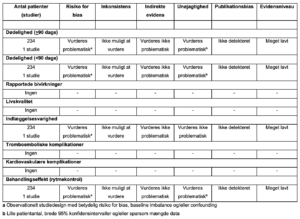
Referencer
- Balik M, Kolnikova I, Maly M, Waldauf P, Tavazzi G, Kristof J. Propafenone for supraventricular arrhythmias in septic shock-Comparison to amiodarone and metoprolol. J Crit Care.
4. Magnesium vs. andre rytmekontrollerende strategier
Kommentar: Arbejdsgruppen identificerede ingen relevante studier ved litteraturgennemgang
5. DC-konvertering vs. andre rytmekontrollerende interventioner
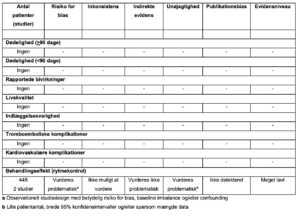
Referencer
- Kanji S, Williamson DR, Yaghchi BM, Albert M, McIntyre L; Canadian Critical Care Trials Group. Epidemiology and management of atrial fibrillation in medical and noncardiac surgical adult intensive care unit patients. Journal of critical care 27: 326.e321-328
- Sekhri A, Aronow WS, Sekhri V, Palaniswamy C, Chandy D. Treatment of patients with supraventricular tachyarrhythmias in a medical intensive care unit. Compr Ther. 2009;35(3-4):188-191.
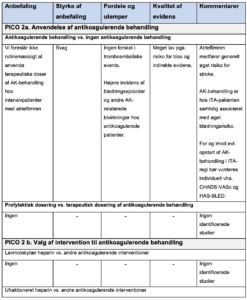
PICO 2a. Anvendelse af antikoagulerende behandling
1. Antikoagulerende behandling vs. placebo/kontrolgruppe
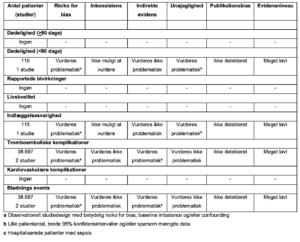
Referencer
- Darwish OS, Strube S, Nguyen HM, Tanios MA. Challenges of anticoagulation for atrial fibrillation in patients with severe sepsis. Ann Pharmacother. 2013;47(10):1266-1271.
- Walkey AJ, Quinn EK, Winter MR, McManus DD, Benjamin EJ. Practice Patterns and Outcomes Associated With Use of Anticoagulation Among Patients With Atrial Fibrillation During Sepsis. JAMA Cardiol. 2016;1(6):682-690.
2. Profylaktisk dosering vs. terapeutisk dosering af antikoagulerende behandling
Kommentar: Arbejdsgruppen identificerede ingen relevante studier ved litteraturgennemgang
PICO 2b. Valg af intervention ved behov for antikoagulerende behandling
1. Lavmolekylær heparin vs. andre antikoagulerende interventioner
Kommentar: Arbejdsgruppen identificerede ingen relevante studier ved litteraturgennemgang
2. Ufraktioneret heparin vs. andre antikoagulerende interventioner
Kommentar: Arbejdsgruppen identificerede ingen relevante studier ved litteraturgennemgang
3. Vitamin K-antagonister vs. andre antikoagulerende interventioner
Kommentar: Arbejdsgruppen identificerede ingen relevante studier ved litteraturgennemgang
4. Non-vitamin-K orale antikogulantia vs. andre antikoagulerende interventioner
Kommentar: Arbejdsgruppen identificerede ingen relevante studier ved litteraturgennemgang
Tabel 3. Kliniske anbefalinger og kvaliteten af evidensen for frekvenskontrollerende og rytmekontrollerende behandling
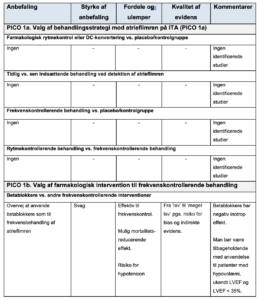

Table 4. Kliniske anbefaling og kvaliteten af evidensen for antikoagulerende behandling