National behandlingsvejledning
DSKM: Maiken Cavling Arendrup, prof, overlæge, dr. med; Lise Kristensen, overlæge, MSc
DSIM: Jannik Helweg-Larsen, overlæge, dr. med, overlæge
DASAIM: Pawel Berezowicz, overlæge; Anette Fedder, afdelingslæge; Mads Kristian Holten, overlæge; Hans Fjeldsøe-Nielsen, overlæge; Morten Steensen, overlæge
Godkendt af DASAIM/DSIT …
Gyldig fra …
Revision senest …
Nøglepunkter
Diagnostik
- Udfør diagnostiske prøver, FØR påbegyndelse af systemisk svampebehandling. Ved tvivl søg rådgivning.
- Gør laboratoriet opmærksom på mistanke om svampeinfektion
- Udbed speciesbestemmelse
- Rekvirer resistensbestemmelse ved alvorlige infektioner, behandlingssvigt og hos patienter med forudgående svampebehandling over 3 uger.
Behandling
- Tidlig og korrekt behandling øger sandsynligheden for effektiv behandling af invasive svampeinfektioner.
- Det kan være vanskeligt at skelne kolonisering fra infektion.
- Fund af candida alene i trachealsekret er ikke indikation for behandling
- Skimmelsvamp, langt hyppigst aspergillusinfektion, medfører infektion i luftveje hos svært immunsvækkede og ved svært lungesvigt forårsaget af COVID og influenza.
- Terapeutisk koncentrationsmåling anbefales ved brug af voriconazol og posaconazolmixtur.
- Beslutning om start af behandling træffes ud fra en kombination af patientens a priori risiko for invasiv svamp, klinik og resultater af mikrobiologiske undersøgelser. (For aspergillus se side 11)
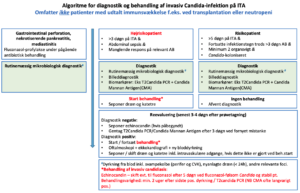
Baggrund
Invasiv svampeinfektion, defineret som infektion i normalt sterilt væv, forårsages af gær- eller skimmelsvamp. De langt hyppigste arter omfatter candida og aspergillus.
Candida species er en del af den normale flora på slimhinder, huden og i mavetarmkanalen. Denne kolonisering kan medføre slimhindeinfektioner (vaginit, stomatit) og ved barrierebrist invasiv infektion (candidæmi og dyb invasiv candidiasis)1. Candida findes ofte i luftveje hos kritisk syge grundet kolonisering fra mundfloraen, hvorimod Candida pneumoni er yderst sjælden2.
Iatrogene brud på de naturlige barrierer i form af intravaskulære katetre (CVK, arteriekanyle mfl) øger risikoen for invasiv gærinfektion mens dræn og andre fremmedlegemer (trachealtuber og -kanyler samt KAD) øger kolonisering. Det gælder ligeledes ved store huddefekter (ex. traumer og brandsår). Erhvervet resistens er usædvanlig hos gærsvampe (specielt C. albicans), hvorfor species identifikation er en god rettesnor for korrekt lægemiddelvalg (se skema side 9), med mindre patienten har fået langvarig antimykotisk behandling (>3 uger).
De hyppigste candida infektioner skyldes C. albicans, der som regel er fluconazol følsom. Derimod, er flere andre species som C. glabrata og C. krusei oftest azol resistente. Vedvarende fluconazol anvendelse kan selektere for non-albicans species mens echinocandinresistens induceres efter gennemsnitlig behandlingstid på omkring en måned.
C auris er en nyere species under udbredning. Den er ofte multiresistent, er beskrevet med høj dødelighed og årsag til hospitalserhvervet infektion3. Der er rapporteret enkeltstående tilfælde i DK.
Skimmelsvampe findes vidt udbredt i miljøet. Vi inhalerer dagligt 10-100 sporer per kubikmeter luft, hvorfor skimmelsvampe primært medfører infektioner i luftveje (bihuler og lunger). Aspergillusinfektion er sjælden hos immunkompetente kritisk syge, mens det blandt patienter med svært lungesvigt forårsaget af eksempelvis COVID og influenza har vist sig at være relativt hyppigt (5-30%). Species identifikation er vanskeligere og azolresistens i A. fumigatus er tiltagende, bl.a. som konsekvens af azolpesticid forbrug i landbruget (miljø-resistens). I den seneste danske opgørelse påvistes en resistens rate på 6% heraf halvdelen betinget af ”miljø-resistens”4.
Diagnostik af invasive gær- og skimmelsvampe
Nøglepunkter
- Udfør diagnostiske prøver, FØR påbegyndelse af systemisk svampebehandling. Ved tvivl søg rådgivning.
- Gør laboratoriet opmærksom på mistanke om svampeinfektion
- Udbed speciesbestemmelse
- Rekvirer resistensbestemmelse ved alvorlige infektioner, behandlingssvigt og hos patienter med forudgående svampebehandling over 3 uger.
- Husk terapeutisk koncentrationsmåling for itraconazol, voriconazol, flucytosin og posaconazolmixtur. Overvej derudover koncentrationsmåling for posaconazol tablet/iv og isavuconazol afh af kontekst.
Indledning
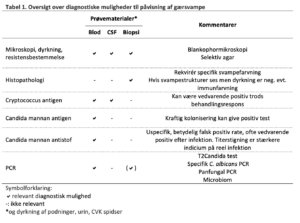
De diagnostiske metoder omfatter mikroskopi, dyrkning, resistensbestemmelse, antigen (og antistof) bestemmelse og PCR.
Resistensbestemmelse bør altid foretages ved invasive infektioner.
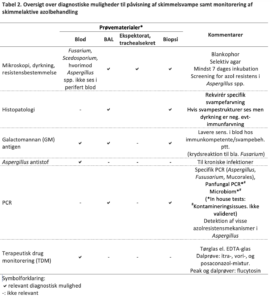
Mikroskopi og Dyrkning
er stadig en hjørnesten i svampediagnostik og dyrkning er nødvendig for at foretage resistensbestemmelse. Relevante prøver med tilstrækkelig mængde prøvemateriale bør sikres forud for iværksættelse af svampebehandling, da sensitiviteten er lavere under pågående behandling.
Sensitivitet i bloddyrkning er lav, særligt ved dyb abdominal candidiasis, hvorfor fokusopsporing med billeddiagnostik og prøvetagning fra ansamlinger er vigtig. Gør laboratoriet opmærksom på svampemistanke, da man så vil anvende specialundersøgelser som flouroscensmikroskopi og svampemedier, hvilket markant øger hastighed og sensitivitet ved undersøgelsen5-6.
Resistensbestemmelse
anbefales for svampefund associeret med invasive infektioner. Resistensbestemmelse anbefales endvidere for slimhindeinfektioner hos patienter med behandlingssvigt på tidligere svampemiddel eller recidiverende infektioner, samt for ikke-invasiv skimmelsvampinfektion, hvor behandling skønnes nødvendig (aspergillom, aspergillus bronchitis, allergisk bronkopulmonal aspergillose (ABPA) etc.).
Candida mannan antigen (og Candida mannan antistof) detektion
i blod er en følsom markør for invasiv candidiasis7-10. Positive antistof fund skal ikke opfattes som tegn på pågående svampeinfektion med unødig svampemiddel behandling til følge. Derfor anbefales det, at mannan antigen screening alene er mest hensigtsmæssig hos ITA patienter med mulig invasiv candidiasis. Mannan antigen falder langsomt efter relevant behandlet candidæmi og er derfor ikke i sig selv et udtryk for manglende behandlingseffekt. Ved negativ Candida mannan antigen (i fravær af positiv bloddyrkning) er sandsynligheden for invasiv candidiasis lille.
Candida PCR (T2Candida)
udføres på EDTA-blod og detekterer de ni hyppigste Candida arter der samlet udgør 93,1% af alle candidæmier i Danmark. Disse besvares som angivet i tabellen side 10 i behandlingsafsnittet, hvor naturligt resistensmønster er angivet.
I en dansk ITA population med høj risiko for candidainfektion var sensitivitet/specificitet for detektion af invasiv candidiasis 59/96% for T211. Dette skal sammenlignes med følgende værdier for bloddyrkning: 29/100%, og for mannan antigen 41/96%.
Kombination af diagnostiske tests
Kombineret testning øger performance.
Bloddyrkning og T2Candida: Sensitivitet: 65 / Specificitet: 96%
Bloddyrkning+mannan antigen: Sensitivitet: 53 / Specificitet: 96%8.
Ved negativ T2 (i fravær af positiv bloddyrkning) er sandsynligheden for invasiv candidiasis lille.
Negativ prædiktiv værdi af neg T2 samt neg Mannan Ag: 93% i en dansk højrisikopopulation (RH ITA)12.
Koloniseringsindeks
Ved rutine Candida overvågningsdyrkninger fra forskellige kropsområder defineres Candida koloniseringsindeks (CI) som ratio mellem det antal af anatomiske steder (eksklusiv blod eller andre sterile lokaliteter) med fund af Candida og det totale antal testede lokaliteter.
CI korrelerer til øget indlæggelsesvarighed, anvendelse af bredspektret antibiotika og invasiv svampeinfektion12,14. I klinisk praksis er metoden vanskelig at operationalisere. Den prædiktive værdi er helt afhængig af patientpopulationen, herunder prævalensen af invasiv Candida infektion og ikke tilstrækkeligt prospektivt valideret, hvorfor den ikke anbefales anvendt.
Aspergillus galactomannan antigen
i blod anbefales som screeningsundersøgelse hos neutropene patienter i risiko for invasiv aspergillose15-17. Sensitiviteten er væsentligt lavere hos patienter i svampeprofylakse18,19. I starten af dette millennium påvistes falsk positive resultater betinget af galactomannan indhold i tazobactam20-23, men dette synes ikke længere at være et problem19-22. Krydsreaktion kan ses hos spædbørn koloniseret med Bifidobacterium bakterier25. Visse andre svampe, blandt andet Penicillium, Fusarium og de endemiske dimorphe svampe indeholder også galactomannan i deres cellevæg og kan derfor give anledning til positiv galactomannan test26-28. Det anbefales, at positive serum prøver (indeks-værdi ≥0,5) verificeres med en ny prøve, da Aspergillus er ubikvitært forekommende, og der således er en risiko for forurening af prøven. Ved værdier < 0,5 bør testen gentages, hvis mistanken om Aspergillus infektion opretholdes.
Galactomannan i BAL væske har væsentligt højere sensitivitet end i blod, specielt hos ikke neutropene patienter samt hos patienter i svampebehandling24,29-32. For BAL er tilblanding af svampesporer der koloniserer luftvejene uden invasiv infektion imidlertid en risiko. Derfor er grænseværdierne for positiv og negativ test anderledes end i serum. Ved galactomannan index under 0,5 kan Aspergillus med meget høj sandsynlighed udelukkes og ved index på 3 og derover har patienten med meget stor sandsynlighed invasiv aspergillose. For indeks derimellem afhænger positiv og negativ prædiktiv værdi af patientens underliggende sygdom og af indeksets størrelse32,33. Galactomannan i BAL kan derfor besvares med forskellige grænseværdier, idet nogle laboratorier besvarer som negativ eller positiv med et cut off på 1 eller på 1.5, andre anvender tre svarmuligheder med eksempelvis <0.5 for negativ, ≥ 0.5 – <3 som svagt positiv/intermediær og ≥ 3 som stærkt positiv, eller <0.5 som negativ, ≥0.5-1 som svagt positiv og ≥ 1 som positiv. Grundlæggende afspejler disse varierende tilgange det forhold, at der ikke er en entydig grænse, der sikkert kan adskille ingen infektion fra invasiv pulmonal aspergillose. Det er derfor afgørende, at indeks værdier fortolkes i relation til patientens a priori sandsynlighed for invasiv aspergillose.
Aspergillus PCR inkl. påvisning af miljø-azol resistens
på BAL væske er en sensitiv test for Aspergillus infektion. Hvis A. fumigatus påvises, suppleres med PCR for TR34/L98H (medfører pan-azol resistens) og TR46/Y121F/T289A (medfører høj resistens for voriconazol og isavuconazol og varierende resistens mønster for itraconazol og posaconazol). Disse resistensmekanismer ses i A. fumigatus i miljøet og derfor lejlighedsvis som årsag til azolresistent infektion. PCR testen giver mulighed for at påvise resistens uden en positiv dyrkning, men fravær af de to resistens markører udelukker ikke resistens, idet andre mekanismer kan forårsage resistens blandt azol-behandlede patienter og idet resistens PCR testen er mindre følsom end Aspergillus PCR testen34,35 .
Aspergillus antistof undersøgelse
er et diagnostisk hjælpemiddel hos ikke neutropene patienter mistænkt for kronisk Aspergillus infektion36. Den har ingen plads i udredning af akut Aspergillus infektion.
Andre PCR analyser for svampe
Det er muligt at udføre specifik PCR for Aspergillus og Candida på vævsbiopsier, og på SSI er det endvidere muligt at bestille specifikke PCR analyser for Mucorales og Fusarium eller den brede bakterielle og eukaryote molekylærbiologiske analyse ”mikrobiom”. Sidstnævnte finder i princippet enhver mikrobiel DNA og et svar skal derfor ses i den kliniske kontekst og i forhold til prøvematerialets karakter for at undgå, at fundet af en kontaminant foranlediger irrelevant behandling og forsinket relevant yderligere udredning. Kontakt gerne KMA og SSI, da nye diagnostiske tests løbende indføres.
Cryptokok antigen påvisning
på spinalvæske og serum er en følsom test for cryptokok infektion. Udføres visse steder ved en hurtig test med positiv/negativ svar. En efterfølgende titer bestemmelse ved latex agglutination anbefales da denne korrelerer med infektionens sværhedsgrad. Titeren forbliver positiv længe trods relevant og effektiv behandling.
Billeddiagnostik
Ved mistanke om eller verificeret pulmonal aspergillose bør HRCT foretages. Hos den neutropene patient vokser Aspergillus angio-invasivt og medfører derfor ofte infarkt, nekrose og blødning resulterende i ”halo”-tegn i den tidlige fase efterfulgt af ”air crescent” i senere stadier37-39. Dog er der ingen specifikke radiologiske fund. CT forandringer er ofte uspecifikke hos ikke-neutropene patienter og kan derfor sjældent skelne COVID/influenza fra aspergillose. UL og CT kan identificere eller afkræfte ansamlinger ved udredning for dyb candidiasis men er ikke specifikke for invasiv candidiasis.
Ekkocardiografi (TTE/TEE) bruges ved candidæmi til påvisning og afkræftelse af endocardit.
Patologisk undersøgelse
Patologisk undersøgelse af væv (biopsi) eller væske (BAL el CSV) med anvendelse af specialfarvning for svampe (PAS og især sølvfarvning) kan give en formodning om karakteren af svampeinfektion ved vurdering af morfologi af svampe elementer (pseudohyfer, ægte hyfer, dikotom versus retvinklet forgrening, knopskydning og septate versus aseptate hyfer). I visse tilfælde kan in situ hybridisering tilvejebringe genus eller endda species identifikation27,40.
Hvis der ved histopatologisk undersøgelse påvises svampe, er der mulighed for deparaffinering af væv med efterfølgende specifikke svampePCR undersøgelser på oprenset DNA, dog skal man være opmærksom på at parafin ikke er sterilt og derfor, at der er risiko for kontamination.
Behandling
Behandlingsstrategier
Anbefalinger for behandling af invasiv candidiasis (IC) hviler på varierende evidens og er således delvist baseret på tradition og konsensus. Risici ved at overse IC eller starte sen behandling er forlænget indlæggelse og formodentlig øget mortalitet41,42,72 . Overbehandling (patient uden IC eller for lang behandling) indebærer risiko for unødige bivirkninger, interaktioner (jvf. azolers CYP450 omsætning), resistens og omkostninger (indkøb og administration af lægemiddel).
Abnorm Candida kolonisering af den intensive patient er meget hyppig og øges ved stigende varighed af indlæggelse, anti-bakteriel behandling, komorbiditet og sværhedsgrad af sygdom og er vist at være associeret med længere tid i respirator2 . Kolonisering alene kan ikke anvendes som markør for invasiv infektion43,44. Fund af Candida udelukkende i trachealsekret er ikke indikation for behandling. Inflammationsmarkører kan sjældent anvendes diagnostisk, da forhøjede inflammationsmarkører ikke kan skelne mellem bakteriel og svampeinfektion og ofte ses som normal fund hos kritisk syge.
Hos den enkelte patient er diagnosen ofte ikke sikker men kommer til at hvile på sandsynlighed og en afvejning af ovennævnte hensyn.
Beslutning om start af behandling træffes ud fra en kombination af patientens a priori risiko for invasiv svamp, kliniske tilstand og resultater af mikrobiologiske undersøgelser. Jvf. algoritme s2.
Behandlingsdefinitioner
Behandling af invasiv svampeinfektion inddeles typisk i 4 kategorier: profylakse, præemptiv, empirisk og målrettet. Udfordringen med denne klassifikation er, at invasive svampeinfektioner i klinisk praksis udgør et kontinuum, og at der i forskellige vejledninger benyttes forskellig afgrænsning. Der er et vist overlap mellem profylakse og præemptiv samt mellem præemptiv og empirisk behandling.
RADS formulering af definitionerne:
- Profylaktisk behandling: Behandling uden kliniske eller parakliniske tegn på infektion. Anvendes som fokuseret profylaktisk strategi til særlige risikopopulationer.
- Præemptiv: Behandling hvor risikofaktorer og surrogatmarkører i kombination giver mistanke om svampeinfektion, uden mikrobiologisk dokumentation
- Empirisk behandling: Behandling på grundlag af kliniske og parakliniske tegn på infektion, hvor agens/fokus ikke er kendt.
- Målrettet behandling: Behandling på grundlag af dokumenteret mikrobiologisk fund f. eks. fra blod, cerebrospinalvæske eller væske fra abdomen, pleura eller led45.
I denne vejledning benyttes præemptiv behandling ikke, da begrebet i praksis er svært at operationalisere. Det er nævnt da det ofte benyttes i andre sammenhænge.
Profylakse
Der foreligger ikke stærk evidens for profylakse46,71.
I Danmark anbefales fluconazol profylakse imod Candida kontaminering fra mave-tarm-kanalen ved mistænkt eller dokumenteret lækage fra mavetarmkanal samt ved svær pancreatit og mediastinit45.
Præemptiv behandling / Risikoscores
Man har ved hjælp af prædiktionsmodeller forsøgt at identificere risikopatienter med henblik på præemptiv behandling før udvikling af dokumenteret klinisk infektion47-49. Imidlertid er den positive prædiktive værdi (PPV) af modellerne lav, mens en lav score har en højere negativ prædiktiv værdi (NPV). Modellerne er ud fra et operationelt synspunkt fravalgt i denne vejledning, da langt de fleste kritisk syge med længere indlæggelser udvikler positiv score. Se bilag 2.
Empirisk behandling
Identifikation af subgrupper af patienter, der med høj sandsynlighed har IC, øger den prædiktive værdi af positive diagnostiske fund.
Behandlingen iværksættes ved tegn på infektion, hvor agens eller fokus ikke er kendt eller formodet ud fra diagnostiske markører59.
Det franske EMPIRICUS50 studie fra 2016 fandt ikke forskel i mortalitet mellem empirisk echinocandin og placebo. I subgruppen af svært syge (høj SOFA score) fandtes en nonsignifikant bedre overlevelse i gruppen der fik echinocandin (HR 1,69 (95% CI 0,96-2,94)), ligesom der var forskel på hvor mange der udviklede invasiv candidiasis (hhv. 3% og 12%).
Patientens risiko, jævnfør algoritmen s2, afgør den fremadrettede strategi. Overordnet er den vigtigste risikofaktor kompliceret abdominalkirurgi / perforeret hulorgan. Ved høj risiko anbefales start af behandling og udvidet diagnostik med dyrkning, biomarkør(er) samt billeddiagnostik (UL og/eller CT hvis muligt) mhp. fokus. Såfremt biomarkører, dyrkninger og billeddiagnostik ikke understøtter IC seponeres behandling dag 3-4. Ved lav risiko foretages udvidet diagnostik, mens behandling afventes til evt. positivt fund.
Behandling af dokumenteret invasiv candidiasis
Definition:
Candida species i bloddyrkninger.
Candida species i sterilt væv / vævsvæske (peritoneal-, pleura-, led- eller spinalvæske)
Dræn der har ligget i mere end 24 timer anses for koloniserede og medregnes ikke som dokumentation for IC. Derfor afgørende at dyrke ved anlæggelse af dræn i eller punktur af ansamlinger.
Præparatvalg til initialbehandling
Behandling initieres med et bredspektret fungicidt antimykotikum (echinocandin)51,52. Efter 5 døgn bør der deeskaleres til fluconazol (fungistatisk), forudsat dokumenteret eller forventet følsomhed for fluconazol, såfremt patienten er stabil og i bedring52.
Naturligt resistens mønster for de almindeligste Candida arter:

Ved invasiv Candida i CNS/øjne anbefales Ambisome eventuelt i kombination med flucytosin de første 2 uger. Echinocandiner opnår ikke tilstrækkelig koncentration i glaslegeme og cns. Ved endophtalmitis bør vitrektomi og instillation af amphotericin B overvejes.
Ved endokarditis er Ambisome alternativt echinocandin førstevalg (samt kirurgisk intervention), evt. i kombination i den indledende fase med flucytosin. Behandlingen er i alle tre tilfælde langvarig og en konsoliderende fase med et azol kan komme på tale ud fra svampens følsomhedsmønster51,52.
Behandlingsvarighed
Ved candidæmi: Fjorten dages behandling efter sidste positive bloddyrkning eller CandidaT2, hos patienter uden betydende persisterende neutropeni eller svær immunsuppresion51,52.
Husk kontroldyrkninger, eksempelvis hver anden dag efter påbegyndt behandling og evt. efter afsluttet behandling.
Dyb candidiasis: Individuel vurdering ved ekspert
Yderligere udredning og tiltag.
Centrale venekatetre skal i videst muligt omfang seponeres eller som minimum skiftes51,52. Hos patienter med dokumenteret invasiv candidiasis anbefaler såvel ESCMID som IDSA, at der foretages undersøgelse af øjenlæge mhp. udelukkelse af okulær candidiasis51,52,53,73,74. Evidensen er svag og den enkelte patient bør konfereres med øjenlæge, særligt hvis adgang til oftalmologisk undersøgelse er begrænset.
RADS anbefaler ikke, at patienten rutinemæssigt ekkokardiograferes45. Derimod anbefaler ESCMID guidelines screening for endokardit med ekkokardiografi.
Ved invasiv candidiasis er der ikke fundet belæg for rutinemæssig ultralydsundersøgelse af lever og milt med henblik på opsporing af candida udsæd.
Diagnostik og behandling
af invasiv aspergillus-infektion hos patienter med influenza eller COVID på ITA

Invasiv Aspergillus infektion
Den hyppigste præsentation af invasiv aspergillose hos intensive patienter er pulmonal aspergillose, sjældnere sinuitis og CNS infektion54.
Ved påvisning af skimmelsvamp i trachealsekret er adskillelsen mellem kolonisering og infektion vanskelig. Immunsuppression er en afgørende disponerende faktor.
Tidligere anvendte EORCT kriterier er primært beregnet på patienter med malign sygdom og vanskelige at bruge hos intensivpatienter, hvor pulmonal aspergillose ofte ses uden tilstedeværelse af klassiske EORCT risikofaktorer, f.eks. hos patienter med influenza (IAPA)56, COVID-19 (CAPA)55 eller svær KOL. Der er udviklet modificerede kriterier for invasiv aspergillose hos ikke immunkompromiterede ITA patienter samt for IAPA og CAPA. Se bilag 3.
Profylakse
Profylakse anvendes til få udvalgte højrisikopatienter, f. eks. immunsupprimerede hæmatologiske eller organtransplanterede patienter.
Behandling
Influenza-associeret invasiv pulmonal aspergillose (IAPA) og COVID associeret invasiv pulmonal aspergillose (CAPA) hos patienter med svær respirationsinsufficiens:
Svær influenza og COVID er associeret med øget risiko for invasiv aspergillusinfektion, der ofte præsenterer sig som akut tracheobronchitis. Observationsstudier indikerer, at mellem 5 og 30% af patienter indlagt på intensiv afdeling med svær influenza og COVID udvikler invasiv aspergillose. Aspergillus tracheobronchitis kan være vanskelig at diagnosticere, idet hovedmanifestationerne er tracheal og bronkial fortykkelse, hvorfor visualisering ved bronkoskopi er nødvendig.
Udredning
Patienter indlagt på ITA med influenza eller COVID udredes inden for de første 4 dage
- BAL m. mikroskopi og specifik svampedyrkning (sendes til SSI R-nr. 052) samt galactomannan + aspergillus PCR (sendes til SSI R-nr. 1066)
- Galactomannan på blod
- Ved mistanke om CNS-sygdom: CT-C med kontrast, hvis suggestiv for CNS aspergillose også lumbalpunktur med CSV PCR-undersøgelse for skimmelsvamp og galactomannan samt specifik skimmelsvamp dyrkning. Hvis CT-C viser tegn på absces kontaktes NK mhp biopsi
- Ved positiv biomarkør udføres HRCT snarest muligt
Diagnostikken gentages ved klinisk forværring eller manglende bedring – revurdering hver 3.-4. dag
Fortolkning af prøvesvar
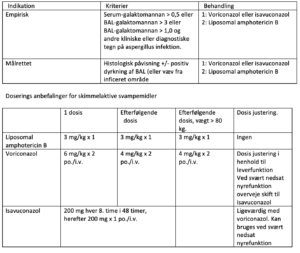
- Ved bronkoskopi-påvist tracheobronkit eller positivt prøvesvar (mikroskopi, dyrkning, BAL galactomannan (index >1,0), serum galactomannan (index >0,5) og/eller PCR på BAL) påbegyndes med det samme behandling med voriconazol IV
- Hvis BAL galactomannan er intermediær (0,5-1,0), og øvrig aspergillus diagnostik er negativ, afventes klinisk udvikling.
- Ved manglende bedring eller forværring gentages diagnostik efter 3 dage.
Behandling
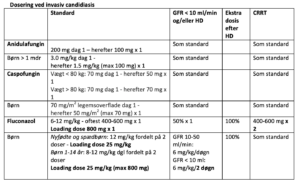
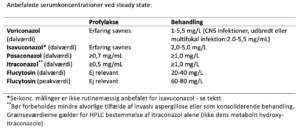
1. Valg: Voriconazol 6 mg/kg x 2 i.v. første døgn, derefter 4 mg/kg x 2 i.v.
Skift til peroral så snart det er muligt. Ved nyresvigt skiftes til tabletbehandling via NG sonde efter 1-2 dage.
P-voriconazol (NPU 27136) kontrolleres på dag 5 og herefter efter individuel vurdering.
NB: voriconazol har adskillige bivirkninger samt interaktioner via cytokrom p450 (CYP) systemet Funktion af lever, nyre og CNS skal følges
2. valg: Ændring i behandling bør diskuteres med erfaren klinisk mikrobiolog eller infektionsmediciner.
Liposomal amphotericin B (Ambisome) 3 mg/kg x 1 i.v.
Posaconazol (iv eller per os) 300 mg x 2 første døgn. 300 mg x 1 efterfølgende isavuconazol 200 mg x 3 i 48 timer, derefter 200 mg x 1
Behandlingsvarighed
Hvis mistanken om invasiv aspergillose opretholdes behandling i 6 uger, herefter vurdering ved erfaren infektionsmediciner/mykolog om behandlingen skal ophøre eller fortsætte i op til yderligere 6 uger.
Profylakse
Overvej profylakse efter prøvetagning (tbl posaconazol 300 mg x 1 dgl) ved betydende risikofaktorer:
- Hæmatologisk malignitet/knoglemarvstransplantation
- Solid organtransplantation
- Neutropeni < 0,5 ≥ 7 dage
- Steroid ≥ 20 mg/d i ≥ 10 dage
Profylakse nedsætter sensitiviteten af aspergillus diagnostik betydeligt. Man kan alternativt til profylakse gentage BAL og galactomannan i blod på dag 3-5.
Patienter på ECMO (Extracorporeal membrane oxygenation) anbefales profylakse i form af anidulafungin (primært candida profylakse). For disse patienter foretages BAL med aspergillus diagnostik, som ovenfor anført, hver 3. dag. Ved positiv aspergillus diagnostik skiftes fra anidulafungin til voriconazol. Det er vigtigt at følge p-voriconazol (NPU 27136) fra dag 5 og frem for at sikre korrekt dosering.
Empirisk behandling
Ved stærk mistanke om aspergillusinfektion startes empirisk behandling i ventetiden på prøvesvar. Førstevalg er voriconazol IV. Ved kontraindikationer til voriconazol er ambisome alternativ. Behandlingen seponeres ved negativ diagnostik.
Beslutninger om profylakse og behandling træffes ved konference mellem intensivist, infektionsmediciner og eller mykolog samt evt bagvagt fra patientens stamafdeling.
Galactomannan index svares automatisk ud som intermediær ved index 0,5-3,0. I denne patientgruppe, med høj risiko for invasiv aspergillose er cut-off værdien for positivt svar på 3,0 for høj. Der startes behandling ved galactomannan index ≥ 1,0
Hvis GM på trachealsekret er positiv (>1,0) eller intermediær (0,5-1,0), og øvrig aspergillus diagnostik er negativ, foretages BAL hvis muligt (alternativt gentagelse af GM og specifik svampedyrkning af trachealsekret) samt gentagelse af serum-GM og der udføres så vidt muligt HRCT.
Der skal ikke startes behandling ved isoleret positiv GM på trachealsekret.
Fortolkning af HRCT
Radiologiske forandringer ved CAPA er oftest uspecifikke, idet de radiologiske forandringer ved COVID-19 kan ligne CAPA og omvendt og skal derfor fortolkes med forsigtighed. Multiple pulmonale noduli eller kaviteter ses sjældent ved COVID-19 uden superinfektion og bør øge mistanken om CAPA.
Behandling
Beslutninger om behandling træffes ved konference mellem intensivist, infektionsmediciner, mykolog og/eller bagvagt fra patientens stamafdeling.
Invasiv aspergillose
Førstevalg til behandling af invasiv aspergillose (IA) er voriconazol, isavuconazol eller posaconazol. Hos mange kritisk syge patienter er iv administration eneste mulighed, da gastrointestinal optagelse er usikker. Azoler med aktivitet mod skimmelsvamp har talrige lægemiddelinteraktioner hvorfor al medicin bør gennemgås kritisk.
Andet valg til behandling af IA er liposomal amphotericin B ( Ambisome). Der er ingen evidens for kombinationsbehandling af IA.
IV formuleringen af voriconazol indeholder cyclodextrin, der udskilles via nyrene. Ved CrCl < 30 ml/min, CRRT og HD behandling er der risiko for ophobning af cyclodextrin. Betydningen af cyclodextrins toxiske effekt er usikker. Det anbefales at undgå behandling med intravenøs voriconazol i disse situationer, og i stedet anvende Intravenøs posaconazol eller isavuconazol, der er ligeværdig. IA fordrer lang behandlingsvarighed, oftest minimum 6–12 uger. Behandlingsvarighed afhænger af klinisk og HRCT respons, lokalisation og udbredning af sygdom samt grad af immunsvækkelse. Selv ved effektiv behandling kan CT-forandringer ved IA progrediere de første uger af behandlingen (som følge af immunrekonstituering), og er derfor, isoleret set, ikke tegn på behandlingssvigt57-59 .
Terapeutisk koncentrationsmåling
er altid relevant for itraconazol og posaconazol mixtur på grund af variabel gastrointestinal optagelse60-62 , for voriconazol på grund af variabel metabolisme63,64 og for flucytosin på grund af varierende renal elimination65. For posaconazol tabletten er optagelsen forbedret, men et udtræk at SSIs koncentrations målinger viser at knapt 25% af posaconazol koncentrations målingerne blandt voksne (der må formodes overvejende at få tabletter eller iv) stadigt er under 0.7 og dvs. under det anbefalede niveau for profylakse. Der er påvist sammenhæng mellem svampemiddelkoncentration, effekt og toxicitet hos både børn og voksne63,66-68. Se-konc. målinger er ikke rutinemæssig anbefalet for isavuconazol. Imidlertid viser er nyligt studie en ikke ubetydelig variation i konc i den enkelte patient over tid, samt en sammenhæng mellem serumniveaueffekt og toxicitet og et smalt terapeutisk index69. Vi anbefaler derfor at isavuconazol koncentrationsmåling som minimum foretages ved mistanke om behandlingssvigt eller toxicitet70. Steady state for azolerne nås dag 4-5. Azolerne har interaktion med en lang række andre lægemidler og ændring i co-medicinering, svampemiddel dosis samt grad af gastrointestinal optagelse har derfor indflydelse på serum koncentrationen. Serumkoncentrationen bør derfor ved målrettet behandling monitoreres 1-2 gange ugentligt indtil relevant niveau og steady state er nået og herefter cirka hver fjortende dag på trods af tidligere tilfredsstillende niveau og stabil organfunktion, da niveauet kan ændre sig gradvist under længerevarende behandling.
Flucytosin har et snævert terapeutisk index og udskillelsen er stærkt afhængig af nyrefunktion. Stoffet gives altid sammen med andre svampemidler, helt overvejende amfotericin B, der er nyretoxisk. Flucytosin serum koncentrationen bør derfor følges under behandling.
Referencer
1. Kullberg BJ, Arendrup MC: Invasive candidiasis. N Engl J Med 2015; 373: 1445–1456.
2. Meersseman W, Lagrou K, Spriet I et al.: Significance of the isolation of Candida species from airway samples in critically ill patients: a prospective, autopsy study. Intensive Care Med 2009; 35: 1526–1531.
3. Cortegiani A, Misseri G, Fasciana T et al. Epidemiology, clinical characteristics, resistance, and treatment of infections by Candida auris. J Intensive Care 2018 6: 69.
4. De første tal fra den nye overvågning af resistens i svampen Aspergillus (ssi.dk)
5. Andreas S, Heindl S, Wattky C et al. Diagnosis of pulmonary aspergillosis using optical brighteners. Eur Respir J. 2000; 15: 407-411.
6. Arendrup MC, Chryssanthou E, Gaustad P et al. Diagnostics of fungal infections in the Nordic countries: we still need to improve! Scand J Infect Dis. 2007; 39: 337-343.
7. Mikulska M, Calandra T, Sanguinetti M et al. The use of mannan antigen and anti-mannan antibodies in the diagnosis of invasive candidiasis: recommendations from the Third European Conference on Infections in Leukemia. Crit Care. 2010; 14: R222.
8. Sendid B, Poirot JL, Tabouret M et al. Combined detection of mannanaemia and antimannan antibodies as a strategy for the diagnosis of systemic infection caused by pathogenic Candida species. J Med Microbiol. 2002; 51: 433-442.
9. Oliveri S, Trovato L, Betta P et al. Experience with the Platelia Candida ELISA for the diagnosis of invasive candidosis in neonatal patients. Clin Microbiol Infect. 2008; 14: 391-393.
10. Alam FF, Mustafa AS, Khan ZU. Comparative evaluation of (1,3)-beta-D-glucan, mannan and antimannan antibodies, and Candida species-specific snPCR in patients with candidemia. BMC Infect Dis. 2007; 7: 103.
11. Arendrup MC, Andersen JS, Holten MK et al. Diagnostic performance of T2Candida among ICU patients with risk factors for invasive candidiasis. Open Forum Infect Dis. 2019; 6: ofz136.
12. Helweg-Larsen J, Steensen M, Møller Pedersen F et al. Intensive care antifungal stewardship programme based on T2Candida PCR and candida mannan antigen: A prospective study. J Fungi (Basel). 2021; 7: 1044.
13. Agvald-Ohman C, Klingspor L, Hjelmqvist H et al. Invasive candidiasis in long-term patients at a multidisciplinary intensive care unit: Candida colonization index, risk factors, treatment and outcome. Scand J Infect Dis. 2008; 40: 145-153.
14. Playford EG, Lipman J, Kabir M et al. Assessment of clinical risk predictive rules for invasive candidiasis in a prospective multicentre cohort of ICU patients. Intensive Care Med. 2009; 35: 2141- 2145.
15. Maertens J, Verhaegen J, Demuynck H et al. Autopsy-controlled prospective evaluation of serial screening for circulating galactomannan by a sandwich enzyme-linked immunosorbent assay for hematological patients at risk for invasive Aspergillosis. J Clin Microbiol. 1999; 37: 3223-3228.
16. Maertens J, Theunissen K, Verhoef G et al. Galactomannan and computed tomography-based preemptive antifungal therapy in neutropenic patients at high risk for invasive fungal infection: a prospective feasibility study. Clin Infect Dis. 2005; 41: 1242-1250.
17. Maertens J, Van Eldere J, Verhaegen J et al. Use of circulating galactomannan screening for early diagnosis of invasive aspergillosis in allogeneic stem cell transplant recipients. J Infect Dis. 2002; 186: 1297-1306.
18. Maertens J, Glasmacher A, Selleslag D et al. Evaluation of serum sandwich enzyme-linked immunosorbent assay for circulating galactomannan during caspofungin therapy: results from the caspofungin invasive aspergillosis study. Clin Infect Dis. 2005; 41:e9-e14.
19. Marr KA, Laverdiere M, Gugel A et al. Antifungal therapy decreases sensitivity of the Aspergillus galactomannan enzyme immunoassay. Clin Infect Dis. 2005; 40: 1762-1769.
20. Aubry A, Porcher R, Bottero J et al. Occurrence and kinetics of false-positive Aspergillus galactomannan test results following treatment with beta-lactam antibiotics in patients with hematological disorders. J Clin Microbiol. 2006; 44: 389-394.
21. Metan G, Ağkuş C, Buldu H et al. The interaction between piperacillin/tazobactam and assays for Aspergillus galactomannan and 1,3-beta-D-glucan in patients without risk factors for invasive fungal infections. Infection. 2010; 38: 217-221.
22. Vergidis P, Razonable RR, Wheat LJ et al. Reduction in false-positive Aspergillus serum galactomannan enzyme immunoassay results associated with use of piperacillin-tazobactam in the United States. J Clin Microbiol. 2014; 52: 2199-2201.
23. Orlopp K, von Lilienfeld-Toal M, Marklein G et al. False positivity of the Aspergillus galactomannan Platelia ELISA because of piperacillin/tazobactam treatment: does it represent a clinical problem? J Antimicrob Chemother. 2008; 62: 1109-1112.
24. Penack O, Rempf P, Graf B et al. Aspergillus galactomannan testing in patients with long-term neutropenia: implications for clinical management. Ann Oncol. 2008; 19:984-989.
25. Mennink-Kersten MA, Ruegebrink D, Klont RR et al. Bifidobacterial lipoglycan as a new cause for false-positive platelia Aspergillus enzyme-linked immunosorbent assay reactivity. J Clin Microbiol. 2005; 43: 3925-3931. doi: 10.1128/JCM.43.8.3925-3931.2005. PMID: 16081932; PMCID: PMC1233979.
26. Tortorano AM, Esposto MC, Prigitano A et al. Cross-reactivity of Fusarium spp. in the Aspergillus Galactomannan enzyme-linked immunosorbent assay. J Clin Microbiol. 2012; 50: 1051-1053.
27. Cummings JR, Jamison GR, Boudreaux JW et al. Cross-reactivity of non-Aspergillus fungal species in the Aspergillus galactomannan enzyme immunoassay. Diagn Microbiol Infect Dis. 2007; 59: 113- 115.
28. Mens H, Højlyng N, Arendrup MC. Disseminated Penicillium marneffei sepsis in a HIV-positive Thai woman in Denmark. Scand J Infect Dis. 2004; 36: 507-509.
29. Meersseman W, Lagrou K, Maertens J et al. Galactomannan in bronchoalveolar lavage fluid: a tool for diagnosing aspergillosis in intensive care unit patients. Am J Respir Crit Care Med. 2008; 177: 27-34.
30. Lerolle N, Raffoux E, Socie G et al. Breakthrough invasive fungal disease in patients receiving posaconazole primary prophylaxis: a 4-year study. Clin Microbiol Infect. 2014; 20: O952-O959.
31. Nguyen MH, Leather H, Clancy CJ et al. Galactomannan testing in bronchoalveolar lavage fluid facilitates the diagnosis of invasive pulmonary aspergillosis in patients with hematologic malignancies and stem cell transplant recipients. Biol Blood Marrow Transplant. 2011; 17: 1043- 1050.
32. D’Haese J, Theunissen K, Vermeulen E et al. Detection of galactomannan in bronchoalveolar lavage fluid samples of patients at risk for invasive pulmonary aspergillosis: analytical and clinical validity. J Clin Microbiol. 2012; 50: 1258-1263.
33. de Heer K, Gerritsen MG, Visser CE et al. Galactomannan detection in broncho-alveolar lavage fluid for invasive aspergillosis in immunocompromised patients. Cochrane Database Syst Rev. 2019; 5: CD012399.
34. Buil JB, Zoll J, Verweij PE et al. Molecular detection of azole-resistant Aspergillus fumigatus in clinical samples. Front Microbiol. 2018; 9: 515.
35. Chong GL, van de Sande WW, Dingemans GJ et al. Validation of a new Aspergillus real-time PCR assay for direct detection of Aspergillus and azole resistance of Aspergillus fumigatus on bronchoalveolar lavage fluid. J Clin Microbiol. 2015; 53: 868-874.
36. Denning DW, Cadranel J, Beigelman-Aubry C et al. Chronic pulmonary aspergillosis: rationale and clinical guidelines for diagnosis and management. Eur Respir J. 2016; 47: 45-68.
37. Hussien A, Lin CT. CT findings of fungal pneumonia with emphasis on aspergillosis. Emerg Radiol. 2018; 25: 685-689.
38. Caillot D, Couaillier JF, Bernard A et al. Increasing volume and changing characteristics of invasive pulmonary aspergillosis on sequential thoracic computed tomography scans in patients with neutropenia. J Clin Oncol. 2001; 19:253-259.
39. Caillot D, Latrabe V, Thiébaut A et al. Computer tomography in pulmonary invasive aspergillosis in hematological patients with neutropenia: an useful tool for diagnosis and assessment of outcome in clinical trials. Eur J Radiol. 2010; 74: e172-175.
40. Cuenca-Estrella M, Verweij PE, Arendrup MC et al. ESCMID* guideline for the diagnosis and management of Candida diseases 2012: diagnostic procedures. Clin Microbiol Infect. 2012; 18 Suppl 7: 9-18.
41. Garey KW, Rege M, Pai MP et al. Time to initiation of fluconazole therapy impacts mortality in patients with candidemia: a multi-institutional study. Clin Infect Dis. 2006; 43: 25-31.
42. Morrell M, Fraser VJ, Kollef MH. Delaying the empiric treatment of candida bloodstream infection until positive blood culture results are obtained a potential risk factor for hospital mortality. Antimicrob Agents Chemother. 2005; 49: 3640-3645.
43. Timsit JF, Schwebel C, Styfalova L et al. Impact of bronchial colonization with Candida spp. on the risk of bacterial ventilator-associated pneumonia in the ICU: the FUNGIBACT prospective cohort study. Intensive Care Med. 2019; 45: 834-843.
44. Huang D, Qi M, Hu Y et al. The impact of Candida spp airway colonization on clinical outcomes in patients with ventilator-associated pneumonia: A systematic review and meta-analysis. Am J Infect Control. 2020; 48: 695-701.
45. Medicinrådet/RADS: Behandlingsvejledning inklusiv lægemiddelrekommandation for systemisk antimykotisk behandling. April 2020.
46. Echeverria PM, Kett DH, Azoulay E. Candida prophylaxis and therapy in the ICU. Semin Respir Crit Care Med. 2011; 32: 159-173.
47. León C, Ruiz-Santana S, Saavedra P et al. A bedside scoring system (“Candida score”) for early antifungal treatment in nonneutropenic critically ill patients with Candida colonization. Crit Care Med. 2006; 34: 730-737.
48. Ostrosky-Zeichner L, Sable C, Sobel J et al. Multicenter retrospective development and validation of a clinical prediction rule for nosocomial invasive candidiasis in the intensive care setting. Eur J Clin Microbiol Infect Dis. 2007; 26: 271-276.
49. León C, Ruiz-Santana S, Saavedra P et al. Usefulness of the “Candida score” for discriminating between Candida colonization and invasive candidiasis in non-neutropenic critically ill patients: a prospective multicenter study. Crit Care Med. 2009; 37: 1624-1633.
50. Timsit JF, Azoulay E, Schwebel C et al. Empirical micafungin treatment and survival without invasive fungal infection in adults with ICU-acquired sepsis, Candida colonization, and multiple organ failure: The EMPIRICUS randomized clinical trial. JAMA. 2016; 316: 1555-1564.
51. Martin-Loeches I, Antonelli M, Cuenca-Estrella M et al. ESICM/ESCMID task force on practical management of invasive candidiasis in critically ill patients. Intensive Care Med. 2019; 45: 789-805.
52. Pappas PG, Kauffman CA, Andes DR et al. Clinical practice guideline for the management of candidiasis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2016; 62: e1-50.
53. Breazzano MP, Day HR Jr, Bloch KC et al. Utility of ophthalmologic screening for patients with Candida bloodstream infections: A systematic review. JAMA Ophthalmol. 2019; 137: 698-710.
54. Jenks JD, Nam HH, Hoenigl M. Invasive aspergillosis in critically ill patients: Review of definitions and diagnostic approaches. Mycoses. 2021; 64: 1002-1014.
55. Verweij PE, Brüggemann RJM, Azoulay E et al. Taskforce report on the diagnosis and clinical management of COVID-19 associated pulmonary aspergillosis. Intensive Care Med. 2021; 47: 819- 834.
56. Verweij PE, Rijnders BJA, Brüggemann RJM et al. Review of influenza-associated pulmonary aspergillosis in ICU patients and proposal for a case definition: an expert opinion. Intensive Care Med. 2020; 46: 1524-1535.
57. Patterson TF, Thompson GR 3rd, Denning DW. Practice guidelines for the diagnosis and management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2016; 63:e1-e60.
58. Ullmann AJ, Aguado JM, Arikan-Akdagli S et al. Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline. Clin Microbiol Infect. 2018; 24 Suppl 1: e1-e38.
59. Medicinrådet/RADS: Behandlingsvejledning inklusiv lægemiddelrekommandation for systemisk antimykotisk behandling – version 2.5. September 2020.
60. Krishna G, Moton A, Ma L et al. Pharmacokinetics and absorption of posaconazole oral suspension under various gastric conditions in healthy volunteers. Antimicrob Agents Chemother. 2009; 53: 958-966.
61. Krishna G, Sansone-Parsons A, Martinho M et al. Posaconazole plasma concentrations in juvenile patients with invasive fungal infection. Antimicrob Agents Chemother. 2007; 51: 812-818.
62. Crombag MR, Huisman C, Kemper EM et al. Posaconazole treatment in hematology patients: a pilot study of therapeutic drug monitoring. Ther Drug Monit. 2012; 34: 320-325.
63. Smith J, Safdar N, Knasinski V et al. Voriconazole therapeutic drug monitoring. Antimicrob Agents Chemother. 2006; 50: 1570-1572.
64. Trifilio SM, Yarnold PR, Scheetz MH et al. Serial plasma voriconazole concentrations after allogeneic hematopoietic stem cell transplantation. Antimicrob Agents Chemother. 2009; 53: 1793-1796.
65. Smith J, Andes D. Therapeutic drug monitoring of antifungals: pharmacokinetic and pharmacodynamic considerations. Ther Drug Monit. 2008; 30: 167-172.
66. Walsh TJ, Raad I, Patterson TF et al. Treatment of invasive aspergillosis with posaconazole in patients who are refractory to or intolerant of conventional therapy: an externally controlled trial. Clin Infect Dis. 2007; 44: 2-12.
67. Pascual A, Calandra T, Bolay S et al. Voriconazole therapeutic drug monitoring in patients with invasive mycoses improves efficacy and safety outcomes. Clin Infect Dis. 2008; 46: 201-211.
68. Neely M, Rushing T, Kovacs A. Voriconazole pharmacokinetics and pharmacodynamics in children. Clin Infect Dis. 2010; 50: 27-36.
69. Furfaro E, Signori A, Di Grazia C et al. Serial monitoring of isavuconazole blood levels during prolonged antifungal therapy. J Antimicrob Chemother. 2019; 74: 2341-2346.
70. Andes D, Kovanda L, Desai A et al. Isavuconazole concentration in real-world practice: Consistency with results from clinical trials. Antimicrob Agents Chemother. 2018; 62: e00585-18.
71. Bassetti M, Garnacho-Montero J, Calandra T et al. Intensive care medicine research agenda on invasive fungal infection in critically ill patients. Intensive Care Med. 2017; 43: 1225-1238.
72. Andes DR, Safdar N, Baddley JW et al. Impact of treatment strategy on outcomes in patients with candidemia and other forms of invasive candidiasis: a patient-level quantitative review of randomized trials. Clin Infect Dis. 2012; 54: 1110-1122.
73. Cornely OA, et al. ESCMID guideline for the diagnosis and management of Candida diseases 2012: non-neutropenic adult patients. Clin Microbiol Infect.2012;18(Suppl 7):19e37
74. O’Donnell M, Eller AW, Waxman EL, Clancy CJ, Nguyen MH. Screening for ocular candidiasis among patients with candidemia: Is it time to change practice? Clin Infect Dis. 2022 Mar 24:ciac233. doi: 10.1093/cid/ciac233. Epub ahead of print. PMID: 35325089.
