-udarbejdet af en arbejdsgruppe nedsat af
Dansk Selskab for Anæstesiologi og Intensiv Medicin (DASAIM) og Dansk Selskab for Intensiv Terapi (DSIT)
2013
Revideret 2021. ver 2

Redaktører:
Anette Marianne Fedder, a.fedder@dadlnet.dk
Stig Eric Dyrskog, stig.dyrskog@gmail.com
Arbejdsgruppens sammensætning
2. revideret udgave 2021
Arbejdsgruppe i alfabetisk rækkefølge:
John Bro-Jeppesen, Afdelingslæge, ph.d., dr.med., Hjertesygdomme, Aarhus Universitetshospital Niels Sanderhoff Degn, Afdelingslæge, ph.d., Neurologisk Afdeling, Aalborg Universitetshospital. Stig Eric Dyrskog, Overlæge, ph.d., Intensiv, Aarhus Universitetshospital Anette Marianne Fedder, Afdelingslæge, Akutafdelingen., Aarhus Universitetshospital Anders Grejs, Afdelingslæge, ph.d., Intensiv, Aarhus Universitetshospital Christian Hassager, Professor, Overlæge, dr.med., Kardiologisk Klinik B, Rigshospitalet Joachim Torp Hoffmann-Petersen, Overlæge, Anæstesi og Intensiv afdeling V, Svendborg Birger Johnsen, Overlæge, ph.d., Neurofysiologisk Klinik, Aarhus Universitetshospital Hans Kirkegaard, Professor, Overlæge, dr.med., Center for Akutforskning, Aarhus Universitetshospital
Lars Kjærsgaard, Overlæge, Thoraxintensivt Afsnit, Aalborg Universitetshospital Niels Heden Larsen, Overlæge, Intensiv afdeling V, Odense Universitetshospital Freddy K. Lippert, Direktør, Den Præhospitale Virksomhed–Akutberedskabet, Region Hovedstaden Emilie Ramberg, Reservelæge, Medicinsk afdeling, Amager-Hvidovre Hospital Claus Z. Simonsen, Overlæge, ph.d., Neurologisk afdeling, Aarhus Universitetshospital Ditte Gry Strange, Overlæge, Intensiv afdeling ZIT, Bispebjerg Hospital
1.udgave 2013
Arbejdsgruppe i alfabetisk rækkefølge:
Niels Sanderhoff Degn, Reservelæge, Neurologisk Afdeling, Aalborg Universitetshospital. Stig Eric Dyrskog, Afdelingslæge, ph.d., Intensiv Terapi Afsnit, Aarhus Universitetshospital Anette Marianne Fedder, Afdelingslæge, Intensiv afd I., Aarhus Universitetshospital Christian Hassager, Overlæge, dr.med., Kardiologisk Klinik B, Rigshospitalet Joachim Torp Hoffmann-Petersen, 1. Reservelæge, Anæstesiafdelingen, Vejle Sygehus Reinhold Jensen, Overlæge, Intensiv afd I., Aarhus Universitetshospital Hans Kirkegaard, Prof. Overlæge, dr.med., Intensiv afd. I, Aarhus Universitetshospital Niels Heden Larsen, Overlæge, Intensiv afd. V, Odense Universitetshospital Freddy K. Lippert, Direktør, Den Præhospitale Virksomhed–Akutberedskabet, Region Hovedstaden Emilie Ramberg, Reservelæge, Anæstesiologisk afd., Hvidovre Hospital Morten Sonne, Afdelingslæge, Neuroanæstesiologisk Klinik, Rigshospitalet Ditte Gry Strange, Overlæge, Intensiv afdeling ZIT, Bispebjerg Hospital Sven Weber, Overlæge, Thoraxintensiv Afsnit, Aalborg Universitetshospital
Repræsentanter fra øvrige selskaber:
Dansk Cardiologisk Selskab:
Christian Hassager, Overlæge, dr.med.
Dansk Neurologisk Selskab:
Niels Sanderhoff Degn
Dansk Råd for Genoplivning
Freddy K. Lippert
Neurofysiologisk konsulent:
Birger Johnsen, Overlæge, ph.d.,
Neurofysiologisk afdeling
Aarhus Universitetshospital
Neurologisk konsulenter:
Flemming Winther Bach,
klinisk professor, Overlæge, dr.med.
Neurologisk Afdeling, Aalborg Universitetshospital
Lorenz Oppel, dr.med. Univ. Kiel, Germany, Overlæge
Neurologisk Afdeling, Aalborg Universitetshospital
Formål og baggrund for guideline
Formålet med denne guideline er at forbedre og ensarte prognosticering af cerebralt outcome hos patienter med manglende opvågning efter hjertestop i Danmark. Arbejdsgruppen til udarbejdelse af guideline blev nedsat i fællesskab af Dansk Selskab for Anæstesiologi og Intensiv Medicin (DASAIM) samt Dansk Selskab for Intensiv Medicin (DSIT) i forbindelse med det årlige Intensiv Symposium Hindsgavl januar 2012, ISH 2012 Arbejdet med guideline er foregået januar 2012 til januar 2013 – litteratursøgning er afsluttet december 2012.
Udnævnt formand for gruppen Anette Marianne Fedder. Redaktører og koordinatorer for guidelines har været; Anette Marianne Fedder og Stig Eric Dyrskog.
Guideline er godkendt på det Nationale guideline møde 24. januar 2013, afholdt i forbindelse med ISH 2013.
Revideret udgave godkendt på det Nationale Guideline møde januar 2021.
Epidemiologi
I Danmark er der ca. 52001 præhospitale uventede hjertestop om året, dertil kommer ca. 2200 hjertestop på hospitalerne. Tredive dages overlevelsen efter hjertestop udenfor hospitalerne i Danmark er 16%2. Overlevelsen efter hjertestop, opstået på et hospital, veksler i litteraturen mellem 13 % og 59 % inden for de første 24 timer, mens kun 3-27 % udskrives fra hospitalet i live3-6. I Danmark er 30 dages og et årsoverlevelsen henholdsvis 28 og 22 %1 Der er varierende data for det neurologiske outcome og neurologiske sequelae7-11.
Patofysiologi
Ved hjertestop og cirkulatorisk svigt, vil hjernens energidepoter (glukose og ATP) blive brugt inden for ca. 5 min12. Vævshypoxi og energi-mangel fører til tab af den elektrokemiske transmembrane gradient og svigt af synaptisk transmission samt generering af aktionspotentialer13. Der frigives glutamat og intracellulært akkumuleres calcium, førende til celledød14. Efter reetablering af cirkulation kan reperfusion og reoxygenering føre til yderligere nervecelleskade (reperfusions skade). Den cerebrale mikrocirkulation svigter med primær hyperæmi til følge og senere global og multifokal hypoperfusion15. Reoxygenering starter desuden en kemisk kaskade med produktion af reaktive oxygen radikaler, som forårsager oxidativ skade. Ændringer i det inflammatoriske respons kan forårsage endothel aktivering, leukocyt infiltration og yderligere vævsskade i samtlige organsystemer16-19. Den synergistiske effekt af samtidig organskade reducerer det enkelte organs tolerance overfor iskæmi, og organer berørt af I/R (iskæmi/ reperfusion) frigiver inflammatoriske mediatorer, der er skadelige for andre organsystemer20,21. Nyere publikationer indeholder ikke afgørende ny viden men sumerer fint den tilgængelige viden22,23. Der fokuseres nu mere på den patofysiologiske effekt af mild TTM24,25.
Metodologiske betragtninger
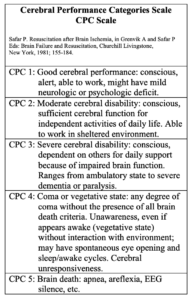
Cerebral Performance Category (CPC) score er anerkendt brugt ved kvantificering af cerebral status hos patienter genoplivet efter hjertestop26. CPC korrelerer, i nogen grad, med livskvalitet og funktionel status opgjort ved mere ressourcekrævende evalueringer27,28. CPC er dog en grov gradering og ofte grupperes der i CPC 1,2 vs, CPC 3,4,5.
Der er store begrænsninger på den nuværende evidens. Ingen undersøgelser er lavet blindet, hvorfor et formodet prognostisk negativt udfald af en neurofysiologisk test kan have medvirket til indstilling af aktiv terapi og dermed kunstigt forbedret den prognostiske værdi. Konfidensintervalet for en falsk positiv rate (FPR) for en prognostisk test afspejler blot stikprøvestørrelsen. Hvis der ikke er nogen falsk positive, kan den øvre grænse for 95% konfidensintervalet, ved små stikprøver, groft estimeres som 3/n29. Således vil den øvre grænse for 95% konfidensintervalet hvis der ikke er nogen falsk positive blandt 50 patienter være 3/50=6%. Dette skal haves i mente ved vurdering af ekstern validitet af mange relativt små undersøgelser.
Tidlige faktorer af betydning for prognosen
En række kendte tidlige faktorer har betydning for et godt outcome. Disse faktorer som primært er baseret på omstændighederne ved hjertestoppet og den tidlige behandling indgår ofte i den initiale kliniske vurdering af behandlingsmulighederne og i en samlet vurdering af om en behandling skønnes udsigtsløs.
Fra større databasestudier30 er det kendt at følgende faktorer er associeret med et godt outcome:
- Bevidnet hjertestop
- HLR før ambulancens ankomst
- Kort responstid til ambulancens ankomst
- Ventrikelflimmer som først registrerede rytme
- Lav alder
- Anvendelse af AED
Der er imidlertid ingen af disse faktorer der enkeltvis kan anvendes som indikator for prognosen. Ved en samlet vurdering styrkes beslutningsgrundlaget væsentligt, men er ingen garanti for hverken en god eller dårlig prognose. Disse oplysninger er dog væsentlige og der bør altid gøres forsøg på at dokumentere og bruge så valide oplysninger om omstændighederne ved hjertestop som muligt.
I det videre forløb er det oftest det individuelle respons på behandling, der har betydning for en vurdering af chancerne for et godt outcome og dermed behandlingsaktiviteten. De tidlige faktorer af betydning for prognosen vil sammenholdt med det kliniske forløb og den efterfølgende udredning være med til at give et samlet billede af chancerne for et godt outcome for den enkelte patient.
Neurologisk undersøgelse
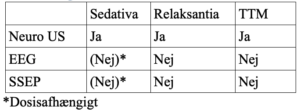
Indførslen af Targeted Temperature Managment (TTM) har gjort den neurologiske prognosticering af komatøse hjertestopoverlevere mere udfordrende. Både TTM i sig selv, samt sedativa og muskel relaksantia administreret i forbindelse med den, dæmper aktiviteten i CNS og hæmmer det motoriske respons. Pålideligheden af objektiv undersøgelse er således nedsat indtil patienten er normoterm og uden sedation31-35. TTM behandling påvirker den diagnostiske værdi af de objektive fund, som tidligere er vist med stor sikkerhed at forudsige dårligt outcome hos ikke TTM behandlede hjertestopoverlevere33-36.
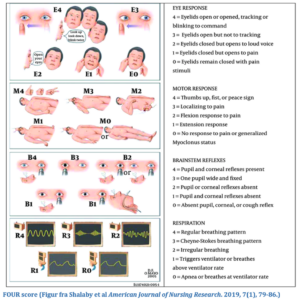
Hjernestammen er betydeligt mere resistent overfor hypoxisk-iskæmiske skader i forbindelse med hjertestop end cerebrum. Manglende hjernestamme reflekser er derfor stærke prædiktorer for et dårligt outcome, mens bevarede hjernestamme reflekser ikke nødvendigvis indebærer bevarelse af subkortikale eller kortikale funktioner34,37,38. Objektiv neurologisk undersøgelse af komatøse hjertestopoverlevere fokuserer på bevidsthedsniveau og hjernestamme funktion. Herunder er specielt det motoriske respons, der vurderes som en del af Glascow Coma Scale (GCS) eller Full Outline of UnResponsiveness score (FOUR score)39, samt pupillernes lys refleks, cornea reflekser og oculocephale reflekser vist at have prognostisk værdi34,40.
Et tidligere omfattende review som dannede grundlag for American Academy og Neurology´s guideline fra 2006 fandt at for ikke TTM-behandlede komatøse patienter, genoplivet efter hjertestop, forudsiges då rligt outcome defineret som død, koma eller svær hjerneskade med fuld plejekrævende tilstand med en Falsk Positiv Rate (FPR) på 0% ved manglende motorisk respons eller decerebrerings-rigiditet (95 % CI:0-6), manglende pupil lysrefleks, manglende cornearefleks eller manglende oculocephale-reflekser 72 timer efter genoplivning. Kombinationen af manglende motorisk respons eller decerebrerings-rigiditet og manglende hjernestamme reflekser har en FPR på 0 med (95% CI:0-3)40.
For TTM behandlede komatøse patienter efter hjertestop, er manglende motorisk respons eller decerebrerings-rigiditet fortsat associeret med då rlig prognose, men grundet høj FPR og brede konfidens intervaller er motorisk respons ikke en pålidelig prognostisk faktor og bør ikke lægges til grund for afslutning af behandling 31,32,34,38,41-50. Derimod er abnormt motorisk respons et vigtigt kriterie i udvælgelsen af de patienter hvor det er relevant at foretage neuroprognosticering51,52.
Manglende oculocephale-reflekser er associerede med då rlig prognose men er for TTM behandlede patienter kun undersøgt i relativt få studier41,43,47, og bør således ikke alene lægges til grund for afslutning af behandling.
Manglende pupil lysreflekser og manglende corneareflekser 72 timer efter hjertestop eller senere er robuste prognostiske faktorer for då rligt cerebralt outcome. Ud fra den foreliggende evidens for TTM behandlede patienter, hvor undersøgelsen lidt varierende i de enkelte studier er foretaget fra 72 timer efter hjertestop til 72 timer efter normotermi, gælder dette fortsat32,35,41,43-46,48,50,53. Der er dog for begge beskrevet enkelte falsk positive32,49,50,54,55, og da antallet af undersøgte TTM-behandlede patienter i mange studier er relativt begrænset, med tilsvarende bredde af konfidensintervaller, kan de ikke alene forudsige død, koma eller persisterende vegetativ tilstand med absolut sikkerhed. De bør derfor kombineres med andre prognostiske parametre i en multimodal tilgang inden en eventuel beslutning om at afslutte behandling31,34,37,52,56. Automatiseret infrarød pupillometri ser ud til at have både større specificet og sensitivitet54, men er de fleste steder endnu ikke tilgængelig.
Ved neurologisk undersøgelse vurderes bevidstheds niveau, herunder motorisk respons på smertestimuli, samt hjernestamme-reflekser (pupil lys reflekser, cornea reflekser og oculocephale reflekser) som er vist at have prognostisk betydning.
Bevidshedsniveau og motorisk respons:
Bedømmes ved Glascow Coma Scale og FOUR score. Selv en minimal grad af bevaret øjenåbnings respons eller verbalt respons indebærer oftest en vis grad af bevaret bevidsthed og dermed umiddelbart bedre prognose. Patienter hvor dette er til stede udgør derfor vanligvis ikke nogen prognostisk udfordring forudsat det ikke er tale om et rent refleksivt respons. Hertil kommer at det verbale respons ikke kan testes hos en intuberet patient. Det er derfor især det motoriske respons på smertestimuli, og specielt hvorvidt der er decerebrerings rigiditet eller fuldstændigt manglende respons, som er klinisk relevant ved prognosticering af komatøse hjertestopoverlevere34. Decerebrerings rigiditet, ofte også refereret til som ekstensions rigiditet, er et abnormt bevægemønster med ekstension, adduktion og pronation af overekstremiteterne, eventuelt også ekstension og plantarflektion af underekstremiteter, tænderskæren og opistotonus. Dette mønster optræder enten spontant eller oftere som respons på smerte eller anden stimulation. Patofysiologien er ikke fuldstændig afklaret men er formentlig et udtryk for påvirket integritet af corticopontine baner i mesencephalon under nucleus ruber eller øvre del af pons medførende disinhibering af reticulo- og vestibulospinale baner38,57.

Pupil lys reflekser: Direkte samt konsensuel kontraktion af pupiller som reaktion på lys. Afspejler integriteten af både nervus opticus, chiasma, tractus opticus, strukturer i mesencephalon og nervus oculomotorius57. Nyere studier forsøger at afklare betydningen af automatiseret infrarød pupillometer54.
Cornea refleks: Reflektorisk kontraktion af øjenlågene som reaktion på berøring af cornea. Udløses ved at føre f.eks. en tilspidset vattot fra lateralsiden af sclera ind over cornea. Afspejler integriteten af nervus trigeminus, strukturer i pons og nervus facialis57.
Oculocephale reflekser (Doll´s eyes): Reflektorisk konjungeret bevægelse af øjnene i modsat retning af hovedets drejning hvorefter de langsomt retunerer til udgangsstilling. Undersøges ved at holde patientens øjne åbne og passivt dreje patientens hoved rykvist fra side til side og op og ned. Herved udløses bevægelse af endolymfen i buegangene og via nervus vestibularis, vestibulærkernerne i pons, faciculis longitudinalis medialis, abducens- og oculomotorius kerner og nerver udløses de refleksive øjenbevægelser. Oculocephale reflekser afspejler således integriteten af strukturer i både pons og mesencephalon. Ved ophævede oculocephale reflekser er øjnene fikserede i orbita ved hoveddrejning. I dette tilfælde kan foretages supplerende undersøgelse af samme refleksbue ved undersøgelse af vestibulooculære reflekser (kalorisk test) som er mere robuste end oculocephale reflekser. Med patienten eleveret 30˚ skylles ydre øregang med isvand for at udløse bevægelse af endolymfen i laterale buegang. Ved bevarede vestibulooculære reflekser udløses herved en langsom tonisk konjugeret øjenbevægelse mod det skyllede øre. Den kompensatoriske nystagmus som ses hos vågne patienter ved kalorisk test ses ikke hos komatøse patienter57.
Herudover bør observeres for hosterefleks/respons på sugning og respiratorisk drive46 samt vurderes tonus, refleksforhold og eventuel øjendrejning som kan indikere mere fokal cerebral skade eller epileptiske anfalds fænomener – desuden vurderes tilstedeværelse af myoklonier34. Den prognostiske betydning af sidstnævnte er omtalt i andet afsnit. De største internationale studier på OHCA patienter bruger nu FOUR Score, der stort set undersøger samme motoriske respons, øjenreaktion, vejrtrækning og hjernestammereflekser, men systematisk og med numerisk scoring af hver undersøgelse. Dette er specielt vigtigt med det motoriske respons, da en score på M≤2 har stor betydning for at kunne opstarte neuroprognosticeringen efter 72 timer.
FOUR score
Tidspunkt for neurologisk undersøgelse
Neurologisk undersøgelse med fokus på bevidsthedsniveau, pupil lysreflekser, cornea- og oculocephale-reflekser anbefales udført dagligt i forbindelse med den løbende vurdering og behandling af patienten34,58. Et nyligt omfattende review fandt at falsk positiv raten for pupil og cornea reflekser først entydigt var 0% omkring 4-5 dage efter ROSC52.
Den definitive neurologiske undersøgelse som lægges til grund for beslutning om afslutning af behandling bør tidligst foretages 72 timer efter opnåelse af ROSC, og på patienter som med sikkerhed ikke længere er påvirkede af sedativa34,38.
Herudover bør tages hensyn til andre potentielt reversible metaboliske tilstande som kan tænkes at påvirke den objektive undersøgelse, e.g. lever og nyre funktion, elektrolytforstyrrelser med videre46.
Myoklonier
Myoklonier er gentagne ufrivillige muskelkontraktioner.
Myoklonier kan være:
- Fokale hvor blot nogle få muskler er involveret.
- Multifokale hvor mange muskler kontraherer sig asynkront.
- Generaliserede hvor de fleste muskler i kroppen er involverede på en synkroniseret måde.
Myoklonier kan opdeles i tre niveauer
- Kortvarige asynkrone, spredte muskelkontraktioner uden sikker prognostisk værdi.
- Massiv myoklonus i ansigt og den aksiale muskulatur.
- Fulminant myoklon status (Status myoklonicus).
Ved myoklon status kan rykningerne være så kraftige at patienten ryster i sengen, men ikke nødvendigvis med det symmetriske og generaliserede mønster som ses ved et generaliseret klonisk anfald.
Myoklonier kan være spontane eller udløst ved stimulation (berøring, sugning eller lyd stimulation), og opstår ofte indenfor de første 24 timer efter hjertestop men opdages ofte først når sedationen seponeres38,40.
Myoklonier opdeles i en cortical og en sub-cortical form baseret på kliniske og elektrofysiologiske karakteristika. Corticalt udløste myoklonier er ofte fokale eller multifokale og inddrager ofte ansigt og hænder, svarende til områder med stor cortical repræsentation. Sub-corticale myoklonier er generaliserede og inddrager ofte overekstremiteter og den axiale muskulatur. Ved corticalt udløste myoklonier kan registreres samtidig epileptiform aktivitet på EEG, medens der ikke er samme konsistente forandringer ved den sub-corticale form59.60. Varierende behandling er forsøgt anvendt ved myoklonier, men især den sub-corticale form er behandlingsrefraktær61-64.
Den rapporterede incidens af postanoksisk myoklon status er varierende, men formentlig lav (5%)65 – den er dog muligvis højere hos patienter efter TTM66.
Myoklon status kan ikke sikkert udelukkes ved dyb sedation og muskel relaksation, for eksempel i forbindelse med TTM. Generaliserede myoklonier kan behandles med f.eks. propofol sedation64, men dette ser ikke ud til sikkert at ændre prognosen64, der i højere grad afspejler sværhedsgrad af hjerneskaden.
Tidlig og vedvarende generaliseret myoklon status er i både retro- og prospektive undersøgelser vist at være prædiktor for et dårligt outcome, selv hvis myoklonierne ophører indenfor de første 24 timer, også efter TTM53,65-68. Der er dog ikke fundet en FPR på 0%. I et studie overlevede to patienter hvoraf den ene opnåede CPC 1-247, og andre har rapporteret FPR på henholdsvis 3%47 og 11%35 for myoklonier.
Der er sporadiske rapporter om patienter (med og uden TTM) med et godt resultat til trods for tidlige myoklonier. Disse rapporter har det fællestræk, som nævnt under EEG, at der i de fleste tilfælde er tale om hjertestop på primært hypoksisk basis67,69-72.
Neurofysiologiske undersøgelser
EEG
Monitoreringsproces
Et elektroencefalogram (EEG) er en optagelse af elektriske potentialer fra cortex, optaget med elektroder på skalpen. Det afspejler således funktionen af de corticale neuroner, der er de mest følsomme for hypoxisk-iskæmisk skade73. EEG kan anvendes både diagnostisk med henblik på status epilepticus (SE) eller prognostisk som en del af en multimodal tilgang.
EEG udføres ved standardiseret procedure med op til 25 elektroder, eller evt. færre ved simplificerede procedurer som beskrevet i litteraturen31,38,74,75. Optagelserne strækker sig typisk fra en halv til en hel time ved standard EEG. Ved længerevarende monitorering benævnes undersøgelsen kontinuerlig EEG (cEEG).
Anvendelsen af tidlig EEG/cEEG har potentialet til at detektere non-konvulsiv status epilepticus (NCSE) også under TTM og ledsagende sedation indenfor de første 12-24 timer efter ROSC38,40. Nyere studier har vist, at tidligt EEG tillige kan anvendes prognostisk specielt med hensyn til prædiktion af et godt outcome41,76,77.
Et enkelt studie har vist, at cEEG er mere sensitivitet end intermitterende standardiserede EEG optagelser for detektion af SE, men ikke bedre prognostisk78.
Ved cEEG kan der, af ressourcehensyn, benyttes et simplificeret cEEG med et begrænset antal elektroder, kombineret med en algoritme for visualisering af langsommere ændringer i EEG, for eksempel amplitude integreret EEG (aEEG). En svensk gruppe har vist at aEEG kan have klinisk værdi hos komatøse patienter75,79 – især til at monitorere for NCSE der kan være skjult hos den sederede og eventuelt relakserede patient79. Ændringer og udvikling i aEEG mønstre er vist at have prædiktiv værdi både for godt og dårligt outcome efter hjertestop75,79.Det er fundet, at optagelser med 10 elektroder kan klassificere EEG og kan anvendes til prognosticering lige så godt som med 21 elektroder80.
Der bør dog benyttes konventionelt EEG med fuldt antal elektroder og standardiserede afledninger ved behov for yderligere diagnostik, herunder bedømmelse af EEG reaktivitet ved stimulation81,82.
EEG klassifikationer
Et forslag til standardiseret EEG terminologi for kritisk syge fremsat af American Clinical Neurophysiology Society (ACNS)83 har vundet stor udbredelse og anbefales anvendt ved beskrivelse af EEG efter anoksisk hjerneskade.
EEG terminologi

Mange studier, for eksempel84-86, har samlet visse EEG mønstre i kategorier “highly malignant” eller “malignant”. Forskellige studier har dog ikke anvendt denne kategorisering konsistent52 og det anbefales at vurdere de respektive EEG mønstre for sig. Et nyere prospektivt studie af 850 hjertestoppatienter har anvendt en kategorisering som sammenholdt med tidspunkt efter hjertestop synes anvendelig både for prognosticering af godt og dårligt outcome76.
EEG kategorisering med prognostisk betydning76

EEG mønstre associeret med dårlig prognose
Isoelektrisk EEG
Isoelektisk EEG findes sjældent hos hjertestoppatienter. Et nyere studie fandt 100% specificitet både 12 og 72 timer efter hjertestop med lav sensitivitet på henholdsvis 12,9 og 7,2 %87.
Supprimeret EEG Tidligere studier som ikke anvendte standardiseret terminologi vurderede ofte isoelektrisk supprimeret og fladt (low voltage) EEG under et. Inden indførsel af TTM behandling fandtes at fladt eller isoelektrisk EEG betragtet under ét var stærkt, men ikke entydigt, associeret med dårligt outcome40.
I tidligere studier af fladt eller isoelektrisk EEG under TTM fandtes det med kontinuerlig EEG monitorering at disse mønstr var uden sikker prognostisk betydning73,75,79. Fladt EEG udviklede sig hos nogle patienter gradvist over et burst-suppression mønster til kontinuerlig aktivitet, hvilket dog kun var associeret med godt outcome hvis det skete indenfor de første 24 timer73. Selv efter opnåelse af normotermi var der i det ene studie, som anvendte et simplificeret to kanals og aEEG, en FPR på 3/9 =33% for fladt EEG75,79, mens det andet studie som anvendte kontinuerligt standard EEG fandt en FPR på 0% (95%CI 0-14)73.
Af nyere studier, som anvender den standardiserede ACNS terminologi, viser de fleste 100 % sensitivitet76,88, dog finder enkelte studier helt tidligt i forløbet inden for de første 8 timer og 12 timer enkelte falsk positive87,88.
Sammenfattende må isoelektrisk eller supprimeret EEG 24 timer efter hjertestop eller senere betragtes som et meget dårligt prognostisk tegn.
Synkrone mønstre med ≥ 50% suppression
Disse mønstre omfatter Burst-Suppression (B-S) med identiske bursts, B-S med stærkt epileptiforme bursts og generaliserede periodiske udladninger (GPDs) på en supprimeret baggrund og er i et studie omfattende 850 patienter fundet at have en specificitet på 100% for dårligt outcome allerede fra 6 timer efter hjertestop og frem76. B-S med identiske bursts er tidligere fundet at have en specificitet på 100%89 og GPDs på en supprimeret baggrund er ligeledes tidligere fundet af have 100% specificitet84,90.
Tidligere studier skelnede ikke mellem forskellige typer af B-S og fandt, at B-S under et var stærkt associeret med dårlig prognose også for TTM behandlede patienter når det optræder efter patienten er blevet normoterm47,73,75,79. B-S kan derimod godt optræde under TTM hos patienter som senere udvikler kontinuert EEG mønster og ender med godt outcome. I et studie er således beskrevet fire ud af 28 patienter med burst-suppression mønster under TTM som efterfølgende vågnede op, og hvoraf de to opnåede CPC ≤ 291. Flere nyere studier bekræfter, at B-S med ”heterogene” bursts kan ses indenfor de første 48 timer efter hjertestop hos patienter med godt outcome86,90. GPDs som ikke nødvendigvis optræder på en supprimeret baggrund, har ikke helt samme høje specificitet, som GPDs på en supprimeret baggrund87,92. Det synes således velbegrundet prognostisk at skelne mellem B-S med identiske eller stærkt epileptiforme bursts og B-S med ”hetegogene” bursts og mellem GPDs på supprimeret baggrund og GPDs på ikke supprimeret baggrund hvor de to førstnævnte sikkert udsiger en dårlig prognose.
EEG mønstre associeret med god prognose
Kontinuerligt EEG
Kontinuerlig EEG aktivitet registreret under cEEG er, også hos TTM patienter, associeret med god prognose uden at det dog kan forudsige dette med absolut sikkerhed45,73,75,79,93,94. Studier som har anvendt cEEG monitorering tyder på at associationen med godt outcome er betinget af at den kontinuerlige EEG aktivitet enten er tilstede tidligt eller udvikles indenfor de første 24 timer efter genoplivning73,95, eller i hvert fald inden normotermi75,79. Et nyere studie med serielle EEG bekræfter, at specificiteten af et kontinuerligt EEG er højest indenfor de første 36 timer efter hjertestop og viser desuden at kontinuerligt EEG med alfa aktivitet udsiger en bedre prognose end kontinuerligt EEG med theta eller endnu mindre med delta aktivitet76.
EEG reaktivitet
I tidligere studier er EEG reaktivitet blevet tillagt stor prognostisk værdi som prædiktor for dårligt outcome35,47,53,91 og som prædiktor for godt outcome i starten af TTM perioden94. Det har i nyere studier ikke kunnet bekræftes, at der skulle være en meget høj specificitet af manglende reaktivitet. Tidligt i forløbet, 12-24 timer efter hjertestop, er der fundet en specificitet på 72,9 % 85 og tilsvarende værdier på 76,9% er fundet sent i forløbet96. Tilstedeværende reaktivitet omkring 24 timer efter hjertestop er fundet at have en forholdsvis høj specificitet på 94 % med en sensitivitet på 55 % og den diagnostiske værdi falder omkring 48 timer efter hjertestop til en specificitet på 48 % og en sensitivitet på 21 %86. Et andet studie har fundet, at tilstedeværelse af reaktivitet øget den diagnostiske værdi hos patienter med et kontinuerligt eller diskontinuerligt EEG85.
EEG reaktivitet lider under manglende standardisering af procedurer for stimulation og tolkning97 og der er fundet en stor variation mellem undersøgere98. Der er begyndende tiltag for standardisering som blandt andet anbefaler gentagne testninger under EEG optagelsen99 og de bedste stimulationsmetoder er fundet at være lydstimulation ved klapning og smertestimulation ved sternal massage100.
Sammenfattende kan det ikke anbefales at anvende fravær af reaktivitet ved prognosticering af dårligt outcome, mens tilstedeværelse af reaktivitet kan betragtes som et godt prognostisk tegn.
EEG mønstre med mindre sikker prognostisk betydning
Fladt (low voltage) EEG
Nyere studier, som anvender ASCN terminologien, kan ikke bekræfte, at et fladt EEG næsten altid skulle udsige en dårlig prognose idet der er fundet specificitet på 87,9 til 100% 84,90.
Burst-suppression med “heterogene” bursts
Som beskrevet ovenfor er den prognostiske værdi af et B-S EEG med ”heterogene” bursts mindre sikker end ved B-S med identiske eller stærkt epileptiforme bursts da B-S med ”heterogene” bursts kan ses indenfor de første 48 timer efter hjertestop hos patienter med godt outcome76,86,90. B-S både med identiske eller stærkt epileptiforme bursts og med ”heterogene” bursts har en faldende sensitivitet med tiden efter hjertestop hvilket lader formode, at B-S er et forbigående fænomen tidligt efter hjertestop både for patienter med godt og med dårligt outcome52. Anvendelse af sedative kan have indflydelse på forekomsten af B-S52.
Diskontinuerligt EEG
Tre studier, som anvender ACNS definitionen af diskontinuerligt EEG, finder at specificiteten stiger med tiden efter hjertestop idet der findes specificitet på 62,4%76 til 91,9% 12 timer efter hjertestop og mellem 86,2 og 95,9% 36-72 timer efter hjertestop76,87,101.
Status epilepticus
SE efter hjertestop er stærkt associeret til dårlig prognose45,53,73,75,79,93,102,103. Nyere studier viser dog enkelte falsk positive patienter50,95,104. Der mangler en standardiseret definition af SE, og dette kan forklare forskelle i nogle studier52. Konvulsiv (CSE) og non-konvulsiv status epilepticus (NCSE) efter hjertestop kan potentielt medføre yderligere hjerneskade105 og persisterende koma. Kasuistisk er beskrevet udtalt muskelaktivitet under TTM, primært tolket som shivering og blandt andet behandlet med muskel relaksantia – hvor der senere blev påvist SE, med godt outcome efter antiepileptisk behandling106. Brug af relaksantia kan sløre kliniske symptomer på SE.
SE er rapporteret at forekomme hos op til 38% af alle voksne patienter efter hjertestop107. Hyppigheden af NCSE er ukendt, men i et retrospektivt studie med cEEG monitorering af TTM patienter (n=101) i de første 48 timer efter hjertestop blev fundet en frekvens på 12% mens frekvensen af CSE var 21%102. Et prospektivt studie med cEEG monitorering af TTM patienter (n=95) op til 120 timer efter hjertestop rapporterede en sammenlignelig frekvens for sammenlagt CSE og NCSE på 27%79.
Der er enkelte rapporter om godt neurologisk outcome hos patienter på trods af initialt SE73 hvor der er givet aggressiv antiepileptisk-behandling73,79,106-108. Beskrevne karakteristika for disse patienter var blandt andet udvikling af SE fra et kontinuerligt EEG mønster50,73,79, sent debuterende anfald90 samt bevaret reaktivitet på EEG, N20 respons på SSEP og bevarede hjernestamme reflekser107.
Ved cEEG ses SE hyppigst i genopvarmningsfasen, og mens patienter med svær anoksisk hjerneskade kan udvikle status epilepticus tidligt i forløbet på trods af pågående TTM og sedation ser det ud til, at eventuel status epilepticus hos patienter med mindre svær hjerneskade først optræder senere i forløbet når patienten genopvarmes og sedationen aftrappes79.
Nogle forfattere argumenterer for at antiepileptiske medikamenter alene hos mange patienter ikke er nok, og forbigående skal suppleres med sedativa34. Der er ikke evidens for eller konsensus omkring en standardiseret antiepileptisk behandling af patienter efter hjertestop med SE79. På baggrund af de enkelte beskrevne tilfælde med godt outcome anbefales det, at SE forsøges behandlet efter gældende lokale retningslinjer for behandling af status epilepticus.
Tidspunkt for EEG undersøgelse
Ved klinisk mistanke om SE og ved opfølgning af behandling af SE kan EEG om praktisk muligt udføres på ethvert tidspunkt i forløbet. Nyere studier har vist at timingen af EEG optagelsen har stor betydning for den prognostiske værdi41 og at EEG tidligt i forløbet under TTM, kan anvendes prognostisk77. Det er fundet, at sensitiviteten for prognosticering af dårlig outcome er højest indenfor de første 24 timer efter hjertestop med et maksimum ved 12 timer76. Prognosticering af godt outcome har den højeste sensitivitet efter 36-48 timer, dog er sensitiviteten højest efter 6 til 12 timer76.
TTM ændrer, udover at sænke metabolismen, også farmakokinetik og clearence specielt af sedativa og relaksantia, ved blandt andet at reducere aktiviteten af cytochrome P450 med op til 22% pr. grad under 37 grader74. Effekten på cytochrome P450 komplekset ser ud til at vare op til 72 timer efter opvarmning38,74. Hos især ældre med aldersvarende nedsat lever og nyrefunktion109 kan det tage lang tid før sedativa og muskel relaksantia er clearet38. Tidligere studier har vist, at sedativa, som propofol110, kan påvirke og inducere forandringer på EEG, hvilket kan påvirke fortolkning ved prognosticering. Tidligt EEG optaget under sedation har i nyere studier udelukkende vist ændring i EEG amplitude men ikke i EEG mønsterets informative værdi både under lavdosis propofol (3 mg/kg/time) samt midazolam (63 ug/kg/time)76.
Ved manglende opvågning anbefales EEG i prognostisk øjemed foretaget i sikker afstand fra ophør af sedation. Det anbefales ideelt, at dette udføres 24-72 timer efter seponering af sedation ved opnået normotermi, afhængig af farmakokinetik og clearence for de givne medikamina. Der foreligger ikke ordentlige undersøgelser for nyere kortere virkende sedativa/opioider. Patienter der ikke har været TTM behandlet formodes at være ude af sedation tidligere. Ved behov for sedation ud over de første par døgn er man derfor nødsaget til at udsætte prognosticering tilsvarende.
SSEP
SomatoSensorisk Evokerede Potentialer (SSEP) er det elektriske respons i cerebralt cortex ved stimulation af en perifer nerve, oftest n. medianus. Den hyppigst anvendte komponent af SSEP er N20, som er et cortikalt svar med en negativ polaritet og en latenstid på ca. 20 msek. SSEP er følsom for muskel-artefakter hvorfor relaksation i meget sjældne tilfælde kan være indiceret34. Sedativa og opioider har mindre indflydelse på SSEP111-113, dog har remifentanil i høje doser muligvis en deprimerende virkning på responset114. TTM reducerer nerveledningshastigheden i axonerne og reducerer synaptisk overledning115-117, hvilket kan give en lidt længere latenstid, men det påvirker ikke tilstedeværelsen af N20 responset. Tilstedeværelsen af SSEP er således en robust parameter, som ikke er betydende påvirket af sedation111-113 og slet ikke af muskelrelaxantia.
SSEP’s prognostiske betydning for dårligt outcome
Et stort systematisk review fra tiden før TTM fandt at bilateralt fravær af N20 den første uge efter hjertestop havde en falsk positiv rate på 0% (CI 0-2,0)118. Blandt 1136 komatøse patienter efter hjertestop var der ingen med bilateralt fravær af N20 respons på SSEP, der senere vågnede op119.
Efter indførelse af TTM har stort set alle studier rapporteret FPR på 0% for SSEP udført fra patienten er normoterm og formodet helt fri for sedation (mediantid 63 timer efter ROSC115) til 72 timer efter normotermi35,45,47,91,120. Nyere studier har vist en tilsvarende lav FPR på 0% for SSEP udført 6-12 timer efter hjertestop121 og efter 12 timer87. Enkelte mindre studier har vist stærkt afvigende resultater med FPR på 50%122 og 25%123 hvilket er blevet søgt forklaret med fejlbedømmelser af SSEP52.
Sensitiviteten for SSEP som prædiktor for dårlig outcome er i en oversigt fundet at være mellem 27,0 og 69,1%52.
Et studie med serielle SSEP på 55 patienter 12 til 72 timer efter hjertestop viste, at resultatet af SSEP undersøgelsen ved 12 timer kun ændrede sig hos én patient som initialt havde kortikalt svar, men senere ikke havde svar. Således var det ingen patienter med initiale kortikale svar, som senere havde svar124. Samme studie viste, at kun én type EEG mønster, nemlig et normalt kontinuerligt EEG i alfa området, kunne forudsige resultatet af SSEP undersøgelsen, i dette tilfælde tilstedeværende kortikale svar. Ingen af de øvrige EEG mønstre kunne forudsige resultatet af SSEP undersøgelsen og EEG og SSEP komplementerede således hinanden med henblik på at forudsige en dårlig prognose.
En vigtig bias for de fleste undersøgelser af SSEP, som prædiktor for et dårligt outcome er, at ingen studier er blindede og at det derfor er muligt at kendskab til resultatet af SSEP undersøgelsen har givet anledning til stop af behandling, en selvopfyldende profeti125. I et nyere review har man ud af 594 med manglende N20 respons bilateralt fundet 14 patienter med efterfølgende godt outcome96. Samme studie estimerede en FPR korrigeret for selvopfyldende profeti og fandt en FPR på 7,7% (95% CI 4-13%)96.
Et multicenter studie (n=351) har senest vist, at en multimodal tilgang baseret på SSEP kombineret med EEG prædikterede dårligt outcome uden falsk positive indenfor de første 24 timer efter ROSC med en sensitivitet på 61%87.
SSEP’s prognostiske betydning for godt outcome
Bevaret N20 respons er ikke prædiktor for godt outcome. Over halvdelen af de patienter der har bevaret N20 respons på SSEP, dør uden at have genvundet bevidsthed40-119. Det har været foreslået at fravær eller tilstedeværelse af et langsommere respons N70 (70 msec) på SSEP hos denne patientgruppe vil kunne være af prognostisk værdi126, men et multicenter kohorte studie har ikke kunnet verificere dette127.
Tidspunkt for SSEP undersøgelse
SSEP undersøgelsen er kun indiceret hos komatøse patienter, og bidrager ikke med prognostisk værdi hos patienter med en hvis grad af bevidsthed, herunder motorisk respons, bedre end ekstensions rigiditet/M2. Ligeledes er SSEP ikke indiceret, hvis EEG viser et normalt kontinuerligt mønster i alfa området.
Flere forhold taler for at tidligst at udføre SSEP undersøgelsen 48 timer efter hjertestop. Dels er sensitiviteten af SSEP undersøgelsen lavere under TTM end ved 48-72 timer, dels vil mange patienter vil udvise tegn opvågnen, hvilket overflødiggør SSEP og normalt vil man først tage stilling til eventuel afbrydelse af behandling baseret på en multimodal vurdering efter 72 timer.
Tilstedeværelse af N20 respons indenfor de første to til tre dage fra hjertestoppet kan eventuelt testes igen ved fortsat manglende opvågning, da det er beskrevet at N20 responset senere kan forsvinde115,124, formentligt som udtryk for pågående udvikling af cerebral skade, men sensitiviteten ved en sådan genundersøgelse vil være lav.
SSEP kan ikke stå alene
Selvom fravær af kortikale SSEP svar er en af de mest robuste markører for et dårligt outcome er det vigtig at pointere, på grund af 1) konfidensintervaller for FPR, 2) eksempler på falsk positive, 3) variation ved tolking og 4) bias fra selvopfyldende profeti, at undersøgelsen ikke kan stå alene, men bør indgå som en vigtig faktor i en multimodal vurdering.
Faktorer, der påvirker neurologisk og neurofysiologisk undersøgelse

Billeddiagnostiske undersøgelser
Billeddannende undersøgelser af hjernen i prognosevurdering efter hjertestop har tidligere hovedsageligt været funderet på CT-cerebrum, men udviklingen i MR-cerebrum, specielt DWI (Diffusion Weighted Images) har de senere år fået tiltagende plads i vurdering af tidlig global iskæmisk hjerneskade.
CT
CT-cerebrum anbefales tidligt i forløbet for at udelukke anden intracerebral årsag til coma, men normal tidlig CT-cerebrum (<24h) kan ikke bruges prognostisk. Nedsat diskrepans mellem grå og hvid substans i forskellige områder i hjernen er i flere studier associeret med dårligere outcome men med vidt forskellige cut-off points53,128,129. I studier har et cut-off på Houndsfeld Units (HU) ratio < 1.20-1.22 været foreslået130,131, ligesom en m-ASPECT score < =13132. Men måling af HU og m-ASPECT har ikke vundet indpas i daglig klinik. Der er behov for standardisering af både cut-off points, skannings protokoller og hvilke regioner der måles i, før CT-skanning kan anbefales som standard ved prognosevurdering.
MR
MR-skanning med DWI/ADC sekvenser til visualisering af cytotoxisk ødem som følge af den hypoxisk-iskæmisk skade kan indgå som beslutningsstøtte hos patienter med manglende opvågning efter hjertestop hvor neurologisk og neurofysiologisk undersøgelse ikke entydigt peger på dårlig prognose.
Der er publiceret en række studier af høj kvalitet indenfor de seneste 5 år der understøtter at MR-cerebrum er gennemførligt for de allerfleste patienter og kan bruges som beslutningsstøtte i den samlede prognosevurdering. ADC-værdier giver et kvantitativt mål for graden af diffusions restriktion i forskellige regioner af hjernen. Der er også for MR skanning behov for standardisering da mange af studierne måler på forskellige regioner og anvender forskellige ADC-grænseværdier52.
Som eksempel kan dog fremhæves et nyligt prospektivt studie hvor ADC-værdier <650 x 10-6 mm2/s > 10 % af hjernevævet på MR foretaget dag 2-7 havde en specificitet på 0.96 (95% CI 0.77–0.998) for forudsigelse af dårligt outcome (GOS 1-2) og en sensitivitet på 0.63 (95% CI 0.42–0.80)133.
Tidlig kvantitativ DWI MRI af høj kvalitet er en både sensitiv og specifik undersøgelse i forhold til skelnen mellem overlevelse til vegetativt stadie (GOS 1-2) eller opvågning til højere grad af bevidsthed (GOS 4-5) og er robust og upåvirkelig af temperatur kontrol og evt. rest sedation133.
Det anbefalede tidsvindue for tidlig MR-cerebrum er fra 36 timer til 4 (-7) døgn efter ROSC. DWI/ADC ændringerne efter hjertestop udvikler sig gradvist og sensitiviteten er højest 36- 97 timer efter ROSC134. Ved MR-cerebrum før 24 timer efter ROSC kan ses misvisende ADCværdier pga evt. reaktiv hyperperfusion i timerne efter cerebral iskæmi135. Ved MR-cerebrum efter (5-)7 døgn efter ROSC kan ses en pseudonormalisering af ADC-værdier40,134,136.
Andre billeddiagnostiske muligheder
MR-cerebrum mellem dag 7 og 28 med måling af ændringer i hvid substans via en standardiseret WWM-FA værdi målt ved DTI (diffusion tensor imaging) har i et observationelt europæisk multicenterstudie udført i årene 2006-2014 vist meget høj sensitivitet (90 %) og specificitet (100 %) i forhold til at prædiktere godt (CPC 1-2) versus dårligt outcome (CPC 3- 5) efter 6 mdr. hos patienter med manglende opvågning efter hjertestop, men mangler at bliver efterprøvet137.
Sammenfattende billeddiagnostik
For både CT og MR gælder at diffust ødem er korreleret til dårligt outcome efter hjertestop, Det er anbefalingen at CT cerebrum udføres tidligt i forløbet for at udelukke konkurrerende årsager til coma og at MR cerebrum udført dag 2-7 bør indgå i den multimodale tilgang til vurdering af patientens prognose hvis øvrige undersøgelser ikke er meget entydige. Der bør foreligge mindst én billeddannende undersøgelse af hjernen før overgang til lindrende behandling.
Biomarkører
Adskillige potentielle biomarkører er undersøgt med henblik på deres anvendelighed i den neurologiske prognosticering af patienter genoplivet efter hjertestop. Den klinisk mest anvendte er neuron specifik enolase (NSE). Da NSE også findes i erytrocytter er det meget vigtigt at hæmolyse udelukkes inden NSE anvendes til neuroprognosticering. To nye markører der er mindre følsom for hæmolyse og ser ud til at have bedre prognostisk værdi er Tau (TAU)138 og Neurofilament light chain (NFL)139. S-100 B140 betragtes i dag som obsolet til prognosticering efter hjertestop.
Neuron specifik enolase (NSE)
Den diagnostiske værdi af serum NSE før implementeringen af TTM er undersøgt i et multicenter studie på 231 patienter fordelt på 32 centre, hvor alle 138 patienter med serum NSE>33 µg/L mellem 24 og 72 timer, efter hjertestop, enten døde eller forblev i en permanent vegetativ tilstand med en FPR 0 % og et 95 % konfidensinterval på (0-3 %)65. Dette studie var baggrunden for American Academy of Neurology´s (AAN) anbefaling fra 2006 om anvendelse af en øvre grænse (cut-off værdi) på NSE>33 µg/L for då rlig prognose40.
Senere undersøgelser138,141 har stadfæstet NSE som en stærk prognostisk værdi, men der er endnu ikke enighed om et cut-off niveau. Tidlige undersøgelser tydede på at TTM behandling påvirkede den prognostiske værdig, men større undersøgelser har ikke kunnet bekræfte dette – i hvert fald ses ens prognostisk værdi ved TTM behandling med 33°C og 36°C98,141. Endelig har mange studier set på forløbet af NSE de første dage som prognostisk markør – men her ser ikke ud til at vindes ret meget i forhold til en enkelt måling ved 48 timer efter ROSC142. Vejledende er en NSE værdi efter 48h over 60 meget alvorlig, og ingen er (i fravær af hæmolyse) overlevet en værdi over 10052. SKAL sikres med egen KBA/assay.
TAU og NFL
Flere andre proteiner fra skadet hjernevæv kan måles i blodet. Specielt TAU og NFL har vist sig lovende. De har en høj specificitet for hjernevæv og de findes ikke i erytrocytter og påvirkes derfor væsentlig mindre af hæmolyse, som mange patienter har efter OHCA. Et enkelt større studie har vist tydeligt bedre prognostisk værdi af både TAU og NFL sammenlignet med NSE138,139. Specielt NFL synes lovende. Disse fund skal naturligvis konfirmeres i andre studier før TAU eller NFL overtager NSEs rolle og egentlige cut-off værdier besluttes.
Sammenfattende biomarkører
Biomarkører spiller i dag en sikker rolle ved prognosticering af OHCA patienten der ikke vågner op spontant, men de kan ikke stå alene. En høj markør > 60 ug/L sammen med en af de andre tegn på dårlig prognose (klinik. Billeddiagnostik eller elektrofysiologi) er et validt ståsted for en prognosevurdering. NSE anvendes i dag flest steder i Danmark. Der er endnu ikke international enighed om et sikkert cut-off niveau; det er derfor vigtigt at man fastsætter dette lokalt sammen med klinisk biokemisk afdeling. Der kan ikke vindes meget ved at se på forløb af markøren – en enkelt måling ved 48-72 timer syntes at være optimal. Det er meget vigtigt at hæmolyse udelukkes, da dette kan give forhøjede værdier i sig selv.
Tidspunkt for prognosticering
Tidligere anbefalinger, fra perioden før TTM-behandling, anså 72 timer efter hjertestop som det optimale tidspunkt for prognosticering bygget på de tilgængelige prognostiske faktorer40,65. Forud for påbegyndelsen af neuroprognosticeringen skal alle confoundere udelukkes herunder ex. restsedation, restrelaksering, manglende normotermi, elektrolytforstyrrelser, nyresvigt, leversvigt, forgiftning, cerebrale katastrofer/infektioner og andre årsager til coma.
Siden indførslen af TTM, og formentlig også grundet et generelt øget fokus på understøttende behandling, er der flere beskrivelser af opvågning med CPC 1-2 outcome også efter dette tidspunkt44,45,48,53,143-145.
Blandt de TTM behandlede patienter som genvinder bevidstheden, sker det hos knap en tredjedel (29 %) mere end 48 timer efter opnåelse af normotermi og stop af sedation. Hos 23 % sker det mere end 7 døgn efter ROSC. Høj alder, shock og påvirket nyrefunktion er associeret med senere opvågning49.
Internationale guidelines anbefaler, at den prognostiske vurdering er multimodal og foretages tidligst 72 timer efter ROSC (ved manglende pupil og cornea-reflekser), hhv. 96 timer efter ROSC (ved bevarede pupil og/eller corneareflekser)31,34,36,38,45,144,146.
Risiko for vegetativ tilstand
Et nyere svensk retrospektivt studie inkluderende 162 komatøse patienter efter hjertestop, fandt at den hyppigste dødsårsag var ophør af aktiv behandling grundet formodet svær hypoksisk hjerneskade147. Undersøgelsen konkluderede videre, at prognosticering på baggrund af en vifte af undersøgelser, som det anbefales i nyere guidelines, forlænger tidspunktet til død, men uden at generere overlevne i en vegetativ tilstand et halvt år efter147. Friberg et al. fandt i et studie af 34 patienter der stadigt var komatøse 72 timer efter normotermi, at seks patienter senere genvandt bevidsthed og at fire stadigt var i live efter 6 måneder hvoraf de 3 var CPC kategori 245.
Rekommandationer
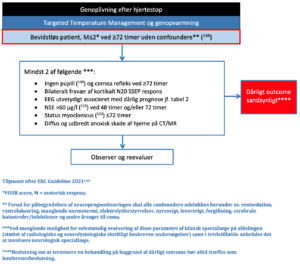
Kombinerede undersøgelsesmodaliteter
Der er ingen undersøgelse der med 100 procent sikkerhed kan forudsige dårligt neurologisk outcome. Derfor er der ofte tale om en multimodal tilgang, hvor man kombinerer flere af de tidligere nævnte undersøgelser for at opnå størst mulig sikkerhed. I den kliniske hverdag er det ofte en kombination af den neurologiske undersøgelse (manglende hjernestammereflekser, tidlig og vedvarende myoklon status, bilateralt fravær kortikalt svar på SSEP, EEG mønster utvetydigt associeret med dårlig prognose, høj biomarkør og MR eller CT med tegn på anoksisk hjerneskade. Samtidig tager man også hensyn til at bestemte tidlige faktorer har betydning for prognosen (bevidnet hjertestop, HLR før ambulance ankomst, kort responstid til ambulance ankomst, ventrikelflimmer, lav alder).
Etiske og juridiske forhold
Hos patienter med manglende opvågning efter hjertestop kan det som beskrevet være vanskeligt at forudsige graden af opvågning og muligheden for at komme tilbage til et ”selvstændigt” liv og beslutningen om at ophøre med eller fortsætte den aktive behandling er yderligere kompliceret af at patienten ikke kan give sin mening til kende, men må repræsenteres af pårørende og eventuelle tidligere tilkendegivelser især via livs- og behandlingstestamente.
For de pårørende er tiden efter genoplivningen og usikkerheden omkring, om patienten vil vågne op og i hvilken tilstand, oftest helt forfærdelig, men lindres en smule ved et velfungerende og imødekommende hospitalsvæsen med ro omkring patientforløbet.
Der er forskellige love og forskellig holdning til hvad der forstås ved et værdigt liv i forskellige dele af verden og indstilling af livsforlængende behandling er ikke praksis i alle lande hvilket det er vigtigt at være opmærksom på i kommunikation med pårørende. (Se evt guideline: ”Etiske overvejelser ved begrænsning eller ophør af intensiv terapi”, DASAIM 2015)
Det er jf de danske love vigtigt at respektere patienternes autonomi og retten til et værdigt liv og samtidig ikke at behandle patienter hvor livsforlængende behandling skønnes udsigtsløs.
Livsforlængende behandling kan indstilles efter patientens ønske hvis patienten er habil eller tidligere har taget stilling til fravalg af livsforlængende behandling i en aktuel sygdomssituation i et livs- eller behandlingstestamente eller af den behandlingsansvarlige læge i følgende situationer150,151
a) patienten er uafvendeligt døende
b) patienten er svært invalideret i en sådan grad, at patienten varigt er ude af stand til at tage vare på sig selv fysisk og mentalt og er afskåret fra enhver form for meningsfuld menneskelig kontakt
c) der er tale om en ikke-uafvendeligt døende patient, hvor behandlingen måske kan føre til overlevelse, men hvor de fysiske konsekvenser af sygdommen eller behandlingen vurderes at være meget alvorlige og lidelsesfulde. (Vejledning om livsforlængende behandling VEJ nr 9935 af 29/10/2019)150
De undersøgelsesmodaliteter som kan udtale sig om prognosen, og hjælpe i beslutningsprocessen vedrørende ophør med livsforlængende behandling ved manglende opvågning efter hjertestop, bør være så specifikke som muligt.
Falsk positive undersøgelsessvar, altså at testen indikerer at tilstanden er udsigtsløs og patienten efterfølgende får bedre neurologisk outcome end forventet, er problematisk da indstilling af livsforlængende behandling i denne patientgruppe oftest medfører patientens død.
Det er derfor nødvendigt at der laves de rigtige undersøgelser og bruges den fornødne tid både til at afsøge patientens ønsker via pårørende og sundhedsregistre og til en sikker vurdering af prognosen.
Algoritme for prognosticering

Den Kliniske neurologiske undersøgelse:

Faktorer, der påvirker undersøgelserne
Kombinerede undersøgelsesmodaliteter

Litteratursøgningsmetode
Medlemmer af arbejdsgruppen har gennemført litteraturgennemgang indenfor respektive emneområder og slutresultatet er formuleret ved konsensus møde.
Hovedvægt ligger på litteratur fra og med 2010, dog er tidligere litteratur af væsentlig betydning medtaget. Revision og opdatering er foretaget i mindre emnegrupper.
Resume for ikke-sundhedsprofessionelle – lægmandsresume
I Danmark er der omkring 5200 pludselige uventede hjertestop om året udenfor hospital. Ca. 16 % af patienterne overlever og udskrives fra hospital. Dette tal er 4-doblet de sidste 20 år. Tidlig erkendelse, alarmering og tidlig behandling med hjerte-lungeredning og efterfølgende avanceret intensiv udredning og behandling er af betydning for prognosen. En del patienter kan ikke genoplives og andre genoplives, men dør efterfølgende på hospitalet trods intensiv behandling.
Dansk Selskab for Intensiv Terapi og Dansk Selskab for Anæstesiologi og Intensiv Medicin har i samarbejde med en række eksperter ønsket at samle den nuværende viden på området. Formålet er at udbrede ny viden på området og dermed forbedre og ensarte udredning og behandling af de patienter, som ikke vågner op umiddelbart efter at være blevet genoplivet efter et hjertestop.
Det er generelt vanskelig at udtale sig om den enkelte patients langtidsprognose og specielt i de første døgn. En lang række faktorer indgår i den konkrete vurdering, herunder tidligere sygdomme, alder, omstændigheder ved hjertestop, hvor tidligt der er givet hjertelungeredning og om der er en såkaldt stødbar rytme, som er behandlet med en hjertestarter (AED). Specielt vigtigt er hvorledes forløbet udvikler sig over de efterfølgende døgn med respiratorbehandling. Hos patienter genoplivet efter hjertestop iværksættes ofte en behandling med nedkøling i 1-2 døgn for at nedsætte hjernens iltbehov. I perioden med nedkøling er det oftest meget vanskelig at vurdere chancerne for overlevelse og specielt at vurdere om overlevelse sker med eller uden mén. Patientens prognose kan typisk først vurderes 2-3 døgn efter patienten er genopvarmet. En enkelt test kan ikke stå alene men flere simple og avancerede undersøgelser kan bidrage til den samlede vurdering af prognosen. Vurderingen af prognosen baseres dog altid på patientens samlede tilstand og er en individuel og konkret vurdering.
Denne guideline giver viden om relevante undersøgelser og test til brug for læger og sygeplejersker på intensiv afdelinger, der behandler patienter efter hjertestop.
Liste over forkortelser
ADC: Apparent Diffusion Coefficient
aEEG: Amplitude integreret EEG
cEEG: Kontinuerlig EEG
CPC: Cerebral Performance Categories Scale
DWI: Diffusion Weighted Images
EEG: ElectroEncephaloGram
ESE: Epileptiform status epilepticus
FLAIR: Fluid Attenuated Inversion Recovery
FOUR score: Full Outline of UnResponsiveness score
FPR: Falsk positiv rate
GCS: Glascow Coma Scale
GPEDs: Generalised periodic epileptiform discharges
N20: Komponent af SSEP der ses med ca 20 msec latens
NSE: Neuron Specifik Enolase
m-ASPECT: Modified-Alberta Stroke Program Early CT Score
ROSC: Return Of Spontaneous Circulation
SSEP: SomatoSensory Evoked Potentials S-100B
S100 calcium binding protein B
Litteratur
1. DANARREST – Registrering af hjertestop på hospital Årsrapport 2019. https://www.sundhed.dk/content/cms/83/70283_danarrest_aarsrapport2019_20200625endelig.pdf.
2. Dansk Raad for Genoplivning. https://genoplivning.dk/wpcontent/uploads/2020/10/Faktaark_Genoplivning_oktober_2020.pdf.
3. Lindhardt, T. B. Hjertestop på hospital. Ugeskr Læger 174, 13.
4. Peberdy, M. A. et al. Survival from in-hospital cardiac arrest during nights and weekends. JAMA : the journal of the American Medical Association 299, 785–792 (2008).
5. Chen, J. et al. The Medical Emergency Team System and not-for-resuscitation orders: results from the MERIT study. Resuscitation 79, 391–397 (2008).
6. Krarup, N. H. V., Løfgren, B., Hansen, T. K. & Johnsen, S. P. Registrering af hjertestop på hospital er en udfordring i den kliniske hverdag. Ugeskr Læger 174, 856–859 (2012).
7. Holzer, M. et al. Hypothermia for neuroprotection after cardiac arrest: systematic review and individual patient data meta-analysis. Critical Care Medicine 33, 414–418 (2005).
8. Wachelder, E. M. et al. Life after survival: long-term daily functioning and quality of life after an out-of-hospital cardiac arrest. Resuscitation 80, 517–522 (2009).
9. Cronberg, T., Lilja, G., Rundgren, M., Friberg, H. & Widner, H. Long-term neurological outcome after cardiac arrest and therapeutic hypothermia. Resuscitation 80, 1119–1123 (2009).
10. Horsted, T. I., Rasmussen, L. S., Meyhoff, C. S. & Nielsen, S. L. Long-term prognosis after outof-hospital cardiac arrest. Resuscitation 72, 214–218 (2007).
11. Holler, N. G., Mantoni, T., Nielsen, S. L., Lippert, F. & Rasmussen, L. S. Long-term survival after out-of-hospital cardiac arrest. Resuscitation 75, 23–28 (2007).
12. Greer, D. M. Mechanisms of injury in hypoxic-ischemic encephalopathy: implications to therapy. Seminars in Neurology 26, 373–379 (2006).
13. Hoesch, R. E., Koenig, M. A. & Geocadin, R. G. Coma after global ischemic brain injury: pathophysiology and emerging therapies. Critical care clinics 24, 25-44-vii–viii (2008).
14. Szydlowska, K. & Tymianski, M. Calcium, ischemia and excitotoxicity. Cell calcium 47, 122– 129 (2010).
15. Sterz, F. et al. Multifocal cerebral blood flow by Xe-CT and global cerebral metabolism after prolonged cardiac arrest in dogs. Reperfusion with open-chest CPR or cardiopulmonary bypass. Resuscitation 24, 27–47 (1992).
16. Wong, C. H. Y. & Crack, P. J. Modulation of neuro-inflammation and vascular response by oxidative stress following cerebral ischemia-reperfusion injury. Current medicinal chemistry 15, 1– 14 (2008).
17. Cerchiari, E. L., Safar, P., Klein, E. & Diven, W. Visceral, hematologic and bacteriologic changes and neurologic outcome after cardiac arrest in dogs. The visceral post-resuscitation syndrome. Resuscitation 25, 119–136 (1993).
18. Adrie, C. et al. Coagulopathy after successful cardiopulmonary resuscitation following cardiac arrest: implication of the protein C anticoagulant pathway. Journal of the American College of Cardiology 46, 21–28 (2005).
19. Granfeldt, A. Organ dysfunction following regional and global ischemia/reperfusion. Intervention with postconditioning and adenocaine. Danish medical journal 59, B4496 (2012).
20. Safar, P. Effects of the postresuscitation syndrome on cerebral recovery from cardiac arrest. Critical Care Medicine 13, 932–935 (1985).
21. Senthil, M. et al. Gut-lymph hypothesis of systemic inflammatory response syndrome/multipleorgan dysfunction syndrome: validating studies in a porcine model. The Journal of trauma 60, 958- 65-discussion 965-7 (2006).
22. Sekhon, M. S., Ainslie, P. N. & Griesdale, D. E. Clinical pathophysiology of hypoxic ischemic brain injury after cardiac arrest: a “two-hit” model. Critical Care 21, 90 (2017).
23. Hosseini, M. et al. Resuscitating the Globally Ischemic Brain: TTM and Beyond. Neurotherapeutics : the journal of the American Society for Experimental NeuroTherapeutics 17, 539–562 (2020).
24. Wassink, G. et al. A working model for hypothermic neuroprotection. The Journal of physiology 596, 5641–5654 (2018).
25. Truettner, J. S., Bramlett, H. M. & Dietrich, W. D. Posttraumatic therapeutic hypothermia alters microglial and macrophage polarization toward a beneficial phenotype. Journal of Cerebral Blood Flow & Metabolism 37, 2952–2962 (2017).
26. Jacobs, I. et al. Cardiac arrest and cardiopulmonary resuscitation outcome reports: update and simplification of the Utstein templates for resuscitation registries: a statement for healthcare professionals from a task force of the International Liaison Committee on Resuscitation (American Heart Association, European Resuscitation Council, Australian Resuscitation Council, New Zealand Resuscitation Council, Heart and Stroke Foundation of Canada, InterAmerican Heart Foundation, Resuscitation Councils of Southern Africa). (2004).
27. Stiell, I. G. et al. Comparison of the Cerebral Performance Category score and the Health Utilities Index for survivors of cardiac arrest. Annals of emergency medicine 53, 241–248 (2009).
28. Raina, K. D., Callaway, C., Rittenberger, J. C. & Holm, M. B. Neurological and functional status following cardiac arrest: method and tool utility. Resuscitation 79, 249–256 (2008).
29. Hanley, J. A. & Lippman-Hand, A. If nothing goes wrong, is everything all right? JAMA : the journal of the American Medical Association 249, 1743–1745 (1983).
30. Herlitz, J. et al. Factors associated with an increased chance of survival among patients suffering from an out-of-hospital cardiac arrest in a national perspective in Sweden. American Heart Journal 149, 61–66 (2005).
31. Blondin, N. A. & Greer, D. M. Neurologic prognosis in cardiac arrest patients treated with therapeutic hypothermia. The Neurologist 17, 241–248 (2011).
32. Samaniego, E. A., Mlynash, M., Caulfield, A. F., Eyngorn, I. & Wijman, C. A. C. Sedation Confounds Outcome Prediction in Cardiac Arrest Survivors Treated with Hypothermia. Neurocritical Care 15, 113–119 (2010).
33. Sandroni, C., Cavallaro, F. & Antonelli, M. Prediction of Neurological Outcome after Cardiac Arrest. Annual Update in Intensive Care … (2011) doi:10.1007/978-3-642-18081-1_57.
34. Friberg, H., Rundgren, M., Westhall, E., Nielsen, N. & Cronberg, T. Continuous evaluation of neurological prognosis after cardiac arrest. Acta Anaesthesiologica Scandinavica 57, 6–15 (2013).
35. Bisschops, L. L. A. L., Alfen, N. N. van, Bons, S. S., Hoeven, J. G. J. van der & Hoedemaekers, C. W. E. C. Predictors of poor neurologic outcome in patients after cardiac arrest treated with hypothermia: A retrospective study. Resuscitation 82, 6–6 (2011).
36. Oddo, M. & Rossetti, A. O. Predicting neurological outcome after cardiac arrest. Current opinion in critical care 17, 254–259 (2011).
37. Chiota, N. A., Freeman, W. D. & Barrett, K. M. Hypoxic-ischemic brain injury and prognosis after cardiac arrest. Continuum (Minneapolis, Minn.) 17, 1094–1118 (2011).
38. Georgia, M. M. D. & Raad, B. B. Prognosis of coma after cardiac arrest in the era of hypothermia. Continuum (Minneapolis, Minn.) 18, 515–531 (2012).
39. Wijdicks, E. F. M., Bamlet, W. R., Maramattom, B. V., Manno, E. M. & McClelland, R. L. Validation of a new coma scale: The FOUR score. Ann Neurol 58, 585–593 (2005).
40. Wijdicks, E. F. M. et al. Practice parameter: prediction of outcome in comatose survivors after cardiopulmonary resuscitation (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 67, 203–210 (2006).
41. Sivaraju, A. et al. Prognostication of post-cardiac arrest coma: early clinical and electroencephalographic predictors of outcome. Intensive Care Medicine 41, 1264–1272 (2015).
42. Huntgeburth, M. et al. Changes in neuron-specific enolase are more suitable than its absolute serum levels for the prediction of neurologic outcome in hypothermia-treated patients with out-ofhospital cardiac arrest. Neurocritical Care 20, 358–366 (2014).
43. Maia, B. et al. Predicting outcome after cardiopulmonary arrest in therapeutic hypothermia patients: clinical, electrophysiological and imaging prognosticators. Acta medica portuguesa 26, 93–97 (2013).
44. Rittenberger, J. C., Sangl, J., Wheeler, M., Guyette, F. X. & Callaway, C. W. Association between clinical examination and outcome after cardiac arrest. Resuscitation 81, 1128–1132 (2010).
45. Cronberg, T. et al. Neuron-specific enolase correlates with other prognostic markers after cardiac arrest. Neurology 77, 623–630 (2011).
46. Fugate, J. E. et al. Predictors of neurologic outcome in hypothermia after cardiac arrest. Annals of neurology 68, 907–914 (2010).
47. Rossetti, A. O., Oddo, M., Logroscino, G. & Kaplan, P. W. Prognostication after cardiac arrest and hypothermia: a prospective study. Annals of neurology 67, 301–307 (2010).
48. Thenayan, E. A., Savard, M., Sharpe, M., Norton, L. & Young, B. Predictors of poor neurologic outcome after induced mild hypothermia following cardiac arrest. Neurology 71, 1535–1537 (2008).
49. Paul, M. et al. Delayed awakening after cardiac arrest: prevalence and risk factors in the Parisian registry. Intens Care Med 42, 1128–1136 (2016).
50. Dragancea, I. et al. Neurological prognostication after cardiac arrest and targeted temperature management 33°C versus 36°C: Results from a randomised controlled clinical trial. Resuscitation 93, 164–170 (2015).
51. Sandroni, C. et al. Prognostication in comatose survivors of cardiac arrest: An advisory statement from the European Resuscitation Council and the European Society of Intensive Care Medicine. Resuscitation 85, 1779–1789 (2014).
52. Sandroni, C. et al. Prediction of poor neurological outcome in comatose survivors of cardiac arrest: a systematic review. Intensive Care Medicine 1–49 (2020) doi:10.1007/s00134-020-06198- w.
53. Rossetti, A. O., Urbano, L. A., Delodder, F., Kaplan, P. W. & Oddo, M. Prognostic value of continuous EEG monitoring during therapeutic hypothermia after cardiac arrest. Critical Care 14, R173 (2010).
54. Oddo, M. et al. Quantitative versus standard pupillary light reflex for early prognostication in comatose cardiac arrest patients: an international prospective multicenter double-blinded study. Intensive Care Medicine 44, 2102–2111 (2018).
55. Zhou, S. E. et al. Distinct predictive values of current neuroprognostic guidelines in postcardiac arrest patients. Resuscitation 139, 343–350 (2019).
56. Deakin, C. D. et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 4. Adult advanced life support. Resuscitation 81, 1305–1352 (2010).
57. Ropper, A. H., Adams, R. D., Victor, M. & Samuels, M. A. Adams and Victor’s Principles of Neurology, Ninth Edition. (McGraw-Hill Professional, 2009).
58. Oddo, M. Prognostication after cardiac arrest: Time to change our approach. Resuscitation 83, 149–150 (2012).
59. Caviness, J. N. & Brown, P. Myoclonus: current concepts and recent advances. Lancet neurology 3, 598–607 (2004).
60. Cassim, F. & Houdayer, E. Neurophysiology of myoclonus. Neurophysiologie clinique = Clinical neurophysiology 36, 281–291 (2006).
61. Venkatesan, A. & Frucht, S. Movement Disorders after Resuscitation from Cardiac Arrest. Neurologic Clinics 24, 123–132 (2006).
62. Dijk, J. M. & Tijssen, M. A. Management of patients with myoclonus: available therapies and the need for an evidence-based approach. The Lancet Neurology 9, 1028–1036 (2010).
63. Thömke, F. et al. Observations on comatose survivors of cardiopulmonary resuscitation with generalized myoclonus. BMC Neurology 5, 14 (2005).
64. Thömke, F. & Weilemann, S. L. Poor prognosis despite successful treatment of postanoxic generalized myoclonus. Neurology 74, 1392–1394 (2010).
65. Zandbergen, E. G. J. et al. Prediction of poor outcome within the first 3 days of postanoxic coma. Neurology 66, 62–68 (2006).
66. Rossetti, A. O. et al. Status epilepticus An independent outcome predictor after cerebral anoxia. Neurology 69, 255–260 (2007).
67. English, W. A., Giffin, N. J. & Nolan, J. P. Myoclonus after cardiac arrest: pitfalls in diagnosis and prognosis. Anaesthesia 64, 908–911 (2009).
68. Young, G. B. Neurologic prognosis after cardiac arrest. New England Journal of Medicine 361, 605–611 (2009).
69. Arnoldus, E. P. & Lammers, G. J. Postanoxic coma: good recovery despite myoclonus status. Annals of neurology 38, 697–698 (1995).
70. Datta, S., Hart, G. K., Opdam, H., Gutteridge, G. & Archer, J. Post-hypoxic myoclonic status: the prognosis is not always hopeless. Critical care and resuscitation : journal of the Australasian Academy of Critical Care Medicine 11, 39–41 (2009).
71. Harper, S. J. & Wilkes, R. G. Posthypoxic myoclonus (the Lance-Adams syndrome) in the intensive care unit. Anaesthesia 46, 199–201 (1991).
72. Krumholz, A., Stern, B. J. & Weiss, H. D. Outcome from coma after cardiopulmonary resuscitation: relation to seizures and myoclonus. Neurology 38, 401–405 (1988).
73. Cloostermans, M. C., Meulen, F. B. van, Eertman, C. J., Hom, H. W. & Putten, M. J. A. M. van. Continuous electroencephalography monitoring for early prediction of neurological outcome in postanoxic patients after cardiac arrest: a prospective cohort study. Critical Care Medicine 40, 2867–2875 (2012).
74. Tortorici, M. A., Kochanek, P. M. & Poloyac, S. M. Effects of hypothermia on drug disposition, metabolism, and response: A focus of hypothermia-mediated alterations on the cytochrome P450 enzyme system. Critical Care Medicine 35, 2196–2204 (2007).
75. Rundgren, M., Rosén, I. & Friberg, H. Amplitude-integrated EEG (aEEG) predicts outcome after cardiac arrest and induced hypothermia. Intensive Care Medicine 32, 836–842 (2006).
76. Ruijter, B. J. et al. Early electroencephalography for outcome prediction of postanoxic coma: A prospective cohort study. Annals of neurology 86, 203–214 (2019).
77. Hofmeijer, J. et al. Early EEG contributes to multimodal outcome prediction of postanoxic coma. Neurology 85, 137–143 (2015).
78. Elmer, J. et al. Sensitivity of Continuous Electroencephalography to Detect Ictal Activity After Cardiac Arrest. JAMA Network Open 3, e203751-13 (2020).
79. Rundgren, M., Westhall, E., Cronberg, T., Rosén, I. & Friberg, H. Continuous amplitudeintegrated electroencephalogram predicts outcome in hypothermia-treated cardiac arrest patients. Critical Care Medicine 38, 1838–1844 (2010).
80. Cloostermans, M. C. T., Hofmeijer, J., Hom, H. W., Bosch, F. H. & Putten, M. J. A. M. van. Predicting Outcome in Postanoxic Coma. Journal of clinical neurophysiology : official publication of the American Electroencephalographic Society 34, 207–212 (2017).
81. Boccagni, C., Bagnato, S., Angelo, A. S., Prestandrea, C. & Galardi, G. Usefulness of standard EEG in predicting the outcome of patients with disorders of consciousness after anoxic coma. Journal of clinical neurophysiology : official publication of the American Electroencephalographic Society 28, 489–492 (2011).
82. Synek, V. M. Prognostically important EEG coma patterns in diffuse anoxic and traumatic encephalopathies in adults. Journal of clinical neurophysiology : official publication of the American Electroencephalographic Society 5, 161–174 (1988).
83. Hirsch, L. J. et al. American Clinical Neurophysiology Society’s Standardized Critical Care EEG Terminology: 2012 version. Journal of clinical neurophysiology : official publication of the American Electroencephalographic Society 30, 1–27 (2013).
84. Westhall, E. et al. Standardized EEG interpretation accurately predicts prognosis after cardiac arrest. Neurology 86, 1482–1490 (2016).
85. Admiraal, M. M. et al. Electroencephalographic reactivity as predictor of neurological outcome in postanoxic coma: A multicenter prospective cohort study. Annals of neurology 86, 17–27 (2019).
86. Duez, C. H. V. et al. Post resuscitation prognostication by EEG in 24 vs 48 h of targeted temperature management. Resuscitation 135, 145–152 (2019).
87. Scarpino, M. et al. Neurophysiology for predicting good and poor neurological outcome at 12 and 72 h after cardiac arrest: The ProNeCA multicentre prospective study. Resuscitation 147, 95– 103 (2020).
88. Monteiro, M. L. et al. The Prognostic Value of 48-h Continuous EEG During Therapeutic Hypothermia After Cardiac Arrest. Neurocritical Care 24, 153–162 (2016).
89. Hofmeijer, J., Cloostermans, M. C. T. & Putten, M. J. A. M. van. Burst-suppression with identical bursts: a distinct EEG pattern with poor outcome in postanoxic coma. Clinical neurophysiology : official journal of the International Federation of Clinical Neurophysiology 125, 947–954 (2014).
90. Backman, S. et al. Highly malignant routine EEG predicts poor prognosis after cardiac arrest in the Target Temperature Management trial. Resuscitation 131, 24–28 (2018).
91. Rossetti, A. O., Carrera, E. & Oddo, M. Early EEG correlates of neuronal injury after brain anoxia. Neurology 78, 796–802 (2012).
92. Rossetti, A. O. et al. Electroencephalography Predicts Poor and Good Outcomes After Cardiac Arrest: A Two-Center Study. Critical Care Medicine 45, e674–e682 (2017).
93. Wennervirta, J. E. et al. Hypothermia-treated cardiac arrest patients with good neurological outcome differ early in quantitative variables of EEG suppression and epileptiform activity*. Critical Care Medicine 37, 2427–2435 (2009).
94. Kawai, M. M., Thapalia, U. U. & Verma, A. A. Outcome from therapeutic hypothermia and EEG. Journal of clinical neurophysiology : official publication of the American Electroencephalographic Society 28, 483–488 (2011).
95. Oh, S. H. et al. Continuous Amplitude-Integrated Electroencephalographic Monitoring Is a Useful Prognostic Tool for Hypothermia-Treated Cardiac Arrest Patients. Circulation 132, 1094– 1103 (2015).
96. Amorim, E. et al. Estimating the False Positive Rate of Absent Somatosensory Evoked Potentials in Cardiac Arrest Prognostication. Critical Care Medicine 46, e1213–e1221 (2018).
97. Admiraal, M. M., Rootselaar, A. F. van & Horn, J. Electroencephalographic reactivity testing in unconscious patients: a systematic review of methods and definitions. European journal of neurology 24, 245–254 (2017).
98. Duez, C. H. V. et al. Large inter-rater variability on EEG-reactivity is improved by a novel quantitative method. Clinical neurophysiology : official journal of the International Federation of Clinical Neurophysiology 129, 724–730 (2018).
99. Admiraal, M. M., Rootselaar, A. F. van & Horn, J. International consensus on EEG reactivity testing after cardiac arrest: Towards standardization. Resuscitation 131, 36–41 (2018).
100. Admiraal, M. M. et al. EEG reactivity testing for prediction of good outcome in patients after cardiac arrest. Neurology 95, e653–e661 (2020).
101. Benarous, L. et al. Sources of interrater variability and prognostic value of standardized EEG features in post-anoxic coma after resuscitated cardiac arrest. Clinical neurophysiology practice 4, 20–26 (2019).
102. Rittenberger, J. C., Popescu, A., Brenner, R. P., Guyette, F. X. & Callaway, C. W. Frequency and timing of nonconvulsive status epilepticus in comatose post-cardiac arrest subjects treated with hypothermia. Neurocritical Care 16, 114–122 (2012).
103. Mani, R., Schmitt, S. E., Mazer, M., Putt, M. E. & Gaieski, D. F. The frequency and timing of epileptiform activity on continuous electroencephalogram in comatose post-cardiac arrest syndrome patients treated with therapeutic hypothermia. Resuscitation 83, 840–847 (2012).
104. Beretta, S. et al. Neurological outcome of postanoxic refractory status epilepticus after aggressive treatment. Epilepsy & behavior : E&B 101, 106374 (2019).
105. Wasterlain, C. G., Fujikawa, D. G., Penix, L. & Sankar, R. Pathophysiological mechanisms of brain damage from status epilepticus. Epilepsia 34 Suppl 1, S37-53 (1993).
106. Hovland, A., Nielsen, E. W., Klüver, J. & Salvesen, R. EEG should be performed during induced hypothermia. Resuscitation 68, 143–146 (2006).
107. Rossetti, A. O., Oddo, M., Liaudet, L. & Kaplan, P. W. Predictors of awakening from postanoxic status epilepticus after therapeutic hypothermia. Neurology 72, 744–749 (2009).
108. Sunde, K. et al. Determination of prognosis after cardiac arrest may be more difficult after introduction of therapeutic hypothermia. Resuscitation 69, 29–32 (2006).
109. Klotz, U. Pharmacokinetics and drug metabolism in the elderly. Drug metabolism reviews 41, 67–76 (2009).
110. San-juan, D., Chiappa, K. H. & Cole, A. J. Propofol and the electroencephalogram. Clinical neurophysiology : official journal of the International Federation of Clinical Neurophysiology 121, 998–1006 (2010).
111. Koht, A., Schütz, W., Schmidt, G., Schramm, J. & Watanabe, E. Effects of etomidate, midazolam, and thiopental on median nerve somatosensory evoked potentials and the additive effects of fentanyl and nitrous oxide. Anesthesia & Analgesia 67, 435–441 (1988).
112. Sloan, T. B., Fugina, M. L. & Toleikis, J. R. Effects of midazolam on median nerve somatosensory evoked potentials. British journal of anaesthesia 64, 590–593 (1990).
113. Scheepstra, G. L., Lange, J. J. de, Booij, L. H. & Ros, H. H. Median nerve evoked potentials during propofol anaesthesia. British journal of anaesthesia 62, 92–94 (1989).
114. Asouhidou, I. et al. Somatosensory Evoked Potentials suppression due to remifentanil during spinal operations; a prospective clinical study. Scoliosis 5, 8 (2010).
115. Bouwes, A. et al. Somatosensory evoked potentials during mild hypothermia after cardiopulmonary resuscitation. Neurology 73, 1457–1461 (2009).
116. Lang, M., Welte, M., Syben, R. & Hansen, D. Effects of hypothermia on median nerve somatosensory evoked potentials during spontaneous circulation. Journal of neurosurgical anesthesiology 14, 141–145 (2002).
117. Russ, W., Sticher, J., Scheld, H. & Hempelmann, G. Effects of hypothermia on somatosensory evoked responses in man. British journal of anaesthesia 59, 1484–1491 (1987).
118. Zandbergen, E. G., Haan, R. J. de, Stoutenbeek, C. P., Koelman, J. H. & Hijdra, A. Systematic review of early prediction of poor outcome in anoxic-ischaemic coma. Lancet 352, 1808–1812 (1998).
119. Robinson, L. R., Micklesen, P. J., Tirschwell, D. L. & Lew, H. L. Predictive value of somatosensory evoked potentials for awakening from coma*. Critical Care Medicine 31, 960–967 (2003).
120. Bouwes, A. et al. Prognosis of coma after therapeutic hypothermia: a prospective cohort study. Annals of neurology 71, 206–212 (2012).
121. Grippo, A. et al. Neurophysiological prediction of neurological good and poor outcome in post-anoxic coma. Acta neurologica Scandinavica 135, 641–648 (2017).
122. Leão, R. N., Ávila, P., Cavaco, R., Germano, N. & Bento, L. Therapeutic hypothermia after cardiac arrest: outcome predictors. Revista Brasileira De Terapia Intensiva 27, 322–332 (2015).
123. Dhakal, L. P. et al. Early Absent Pupillary Light Reflexes After Cardiac Arrest in Patients Treated with Therapeutic Hypothermia. Therapeutic hypothermia and temperature management 6, 116–121 (2016).
124. Glimmerveen, A. B. et al. Association between somatosensory evoked potentials and EEG in comatose patients after cardiac arrest. Clinical neurophysiology : official journal of the International Federation of Clinical Neurophysiology 130, 2026–2031 (2019).
125. Geocadin, R. G. et al. Standards for Studies of Neurological Prognostication in Comatose Survivors of Cardiac Arrest: A Scientific Statement From the American Heart Association. Circulation 140, e517–e542 (2019).
126. Madl, C. et al. Improved outcome prediction in unconscious cardiac arrest survivors with sensory evoked potentials compared with clinical assessment. Critical Care Medicine 28, 721–726 (2000).
127. Zandbergen, E. G. J., Koelman, J. H. T. M., Haan, R. J. de, Hijdra, A. & Group, P. S. SSEPs and prognosis in postanoxic coma: only short or also long latency responses? Neurology 67, 583– 586 (2006).
128. Inamasu, J. et al. Early CT signs in out-of-hospital cardiac arrest survivors: Temporal profile and prognostic significance. Resuscitation 81, 533–537 (2010).
129. Wu, O. et al. Predicting Clinical Outcome in Comatose Cardiac Arrest Patients Using Early Noncontrast Computed Tomography. Stroke 42, 985–992 (2011).
130. Choi, S. P. et al. The density ratio of grey to white matter on computed tomography as an early predictor of vegetative state or death after cardiac arrest. Emergency medicine journal : EMJ 25, 666–669 (2008).
131. Metter, R. B., Rittenberger, J. C., Guyette, F. X. & Callaway, C. W. Association between a quantitative CT scan measure of brain edema and outcome after cardiac arrest. Resuscitation 82, 1180–1185 (2011).
132. Sugimori, H. et al. Early findings on brain computed tomography and the prognosis of postcardiac arrest syndrome: application of the score for stroke patients. Resuscitation 83, 848–854 (2012).
133. Hirsch, K. G. et al. Prognostic value of diffusion-weighted MRI for post-cardiac arrest coma. Neurology 94, e1684–e1692 (2020).
134. Wijman, C. A. C. et al. Prognostic value of brain diffusion-weighted imaging after cardiac arrest. Annals of neurology 65, 394–402 (2009).
135. Heradstveit, B. E. et al. Repeated magnetic resonance imaging and cerebral performance after cardiac arrest–a pilot study. Resuscitation 82, 549–555 (2011).
136. Mlynash, M. et al. Temporal and spatial profile of brain diffusion-weighted MRI after cardiac arrest. Stroke 41, 1665–1672 (2010).
137. Velly, L. et al. Use of Brain Diffusion Tensor Imaging for the Prediction of Long-term Neurological Outcomes in Patients After Cardiac Arrest: a Multicentre, International, Prospective, Observational, Cohort Study. vol. 17 (2018).
138. Mattsson, N. et al. Serum tau and neurological outcome in cardiac arrest. Annals of neurology 82, 665–675 (2017).
139. Moseby-Knappe, M. et al. Serum Neurofilament Light Chain for Prognosis of Outcome After Cardiac Arrest. JAMA neurology 76, 64–71 (2019).
140. Shinozaki, K. et al. S-100B and neuron-specific enolase as predictors of neurological outcome in patients after cardiac arrest and return of spontaneous circulation: a systematic review. Critical Care 13, R121 (2009).
141. Stammet, P. et al. Neuron-Specific Enolase as a Predictor of Death or Poor Neurological Outcome After Out-of-Hospital Cardiac Arrest and Targeted Temperature Management at 33°C and 36°C. Journal of the American College of Cardiology 65, 2104–2114 (2015).
142. Wiberg, S. et al. Single versus Serial Measurements of Neuron-Specific Enolase and Prediction of Poor Neurological Outcome in Persistently Unconscious Patients after Out-OfHospital Cardiac Arrest – A TTM-Trial Substudy. PLoS ONE 12, e0168894 (2017).
143. Fugate, J. E., Wijdicks, E. F. M., White, R. D. & Rabinstein, A. A. Does therapeutic hypothermia affect time to awakening in cardiac arrest survivors? Neurology 77, 1346–1350 (2011).
144. Samaniego, E. A., Persoon, S. & Wijman, C. A. C. Prognosis after cardiac arrest and hypothermia: a new paradigm. Current neurology and neuroscience reports 11, 111–119 (2011).
145. Rothstein, T., Leithner, C., Ploner, C. J., Hasper, D. & Storm, C. Does hypothermia influence the predictive value of bilateral absent N20 after cardiac arrest? Neurology 75, 575-6-author reply 575-6 (2010).
146. Perman, S. M. et al. Timing of neuroprognostication in postcardiac arrest therapeutic hypothermia*. Critical Care Medicine 40, 719–724 (2012).
147. Dragancea, I., Rundgren, M., Englund, E., Friberg, H. & Cronberg, T. The influence of induced hypothermia and delayed prognostication on the mode of death after cardiac arrest. Resuscitation 84, 337–342 (2013).
148. Nolan, J. P. et al. European Resuscitation Council and European Society of Intensive Care Medicine 2015 guidelines for post-resuscitation care. Intensive Care Medicine 41, 2039–2056 (2015).
149. ESICM, E. and. DRAFT GUIDELINES FOR PUBLIC COMMENT. (2021).
150. Vejledning om fravalg og afbrydelse af livsforlængende behandling. https://www.retsinformation.dk/eli/retsinfo/2019/9935 (2019).
151. Det Etiske Råds udtalelse om Undladelse og afbrydelse af livsforlængende behandling (april 2012). https://www.etiskraad.dk/etiske-temaer/aktiv-doedshjaelp-ogdoeende/publikationer/udtalelse-om-undladelse-og-afbrydelse-af-livsforlaengende-behandling2012.
152. Nolan, J. P. et al. Part 1: Executive summary 2015 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations. Resuscitation 95, e1–e31 (2015).
153. Soar, J. et al. 2018 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science With Treatment Recommendations Summary. Resuscitation 133, 194– 206 (2018).
