Anæstesi og amning
En klinisk vejledning
Obstetrisk udvalg og Udvalget for anæstesi og perioperativ medicin, DASAIM
April 2021
INTRODUKTION
FORMÅL
- Formålet med denne vejledning er at give et hurtigt overblik over de mest anvendte stoffer i forbindelse med generel og regional anæstesi til den ammende kvinde. Denne vejledning er til brug perioperativt og postoperativt for anæstesiologer
MÅLGRUPPE
- Læger under uddannelse til anæstesiologer og speciallæger i anæstesiologi med ansættelse på danske anæstesiologiske afdelinger
METODE
- Vejledningen er udarbejdet af en arbejdsgruppe nedsat af DASAIMs obstetriske udvalg og udvalget for Anæstesi og Perioperativ medicin. Vejledningen er en opdatering af “Rekommandation vedrørende anæstesi og amning” fra 2015.
ARBEJDSGRUPPENS MEDLEMMER
- Lotte Marie Vestergaard (LV), afdelingslæge. Anæstesiologisk afdeling, Hvidovre Hospital/pr. 1/1-21 overlæge, Anæstesiologisk afdeling, Sjællands Universitetshospital, Køge (tovholder)
- Patricia Duch (PD), afdelingslæge. Anæstesiologisk afdeling, Nordsjællands Hospital, Hillerød
- Michéle Lefort Sønderskov (ML), afdelingslæge, HovedOrtoCentret, Rigshospitalet
- Christian Melchior Olesen (CO), afdelingslæge, Bedøvelse og Operation 1, Aarhus Universitetshospital
Tak til Professor Per Damkier, Klinisk Farmakologisk afdeling, Odense Universitets Hospital for rådgivning om stoffer hvor gruppen har været i tvivl om fortolkning af litteaturen.
ÆNDRINGER SIDEN SIDST
Afsnittet om human mælkeproduktion er udgået. Af stoffer er desfluran udgået og der er tilføjet afsnit om: tramadol, sugammadex, cefuroxim, dicloxacillin, piperacillin/tazobactam, metronidazol, naloxon, clemastin, cyclizin og clonidin.
UDARBEJDELSE AF DE ENKELTE AFSNIT

INTERESSEKONFLIKTER
Forfatterne har ingen interessekonflikter
FORKORTELSER
FDA – Food and Drug Administration
IFA – i form af N2O – Dinitrogenoxid (lattergas)
PCA – Patient Controlled Analgesia
PONV – Post Operativ Kvalme og Opkastning
RCT – Randomised Controlled Trial TAP blok – Transversus Abdominis Plane blok
WHO – Verdens Sundheds Organisationen
DEFINITIONER
Sikkert at anvende – stoffet er velundersøgt og der er ikke risiko for bivirkninger ved anvendelse til ammende kvinder
Kan anvendes – stoffet anses for at være sikkert, men er ikke velundersøgt til ammende kvinder
Kan om nødvenligt anvendes – kan anvendes, hvis der ikke findes et alternativ. For nogle stoffer anbefales engangsdosering kun i forbindelse med kejsersnit og ikke anden kirurgi Kan ikke anvendes – bør ikke anvendes til ammende kvinder
Er ikke undersøgt – stoffet er ikke undersøgt til ammende kvinder og denne vejledning kan derfor ikke tage stilling til brugen til ammende kvinder
Janusinfo.se – kommercielt uafhængig lægemiddelinformation rettet mod læger og sundhedspersonale
Kolostrum – råmælk der løber til i løbet af de første dage efter fødslen
LactMed® databasen – indeholder information om medicin og andre kemikalier, som ammende kvinder kan udsættes for. Der inkluderes information om indhold i modermælk og spædbarnets blod samt mulige bivirkninger hos det ammende spædbarn
OVERSIGT OVER DE VÆSTENLIGSTE ANBEFALINGER
GENOPTAG AF AMNING EFTER ANÆSTESI
Der anbefales ikke udmalkning efter anæstesi. Amningen kan genoptages så snart kvinden er i stand til at håndtere barnet.
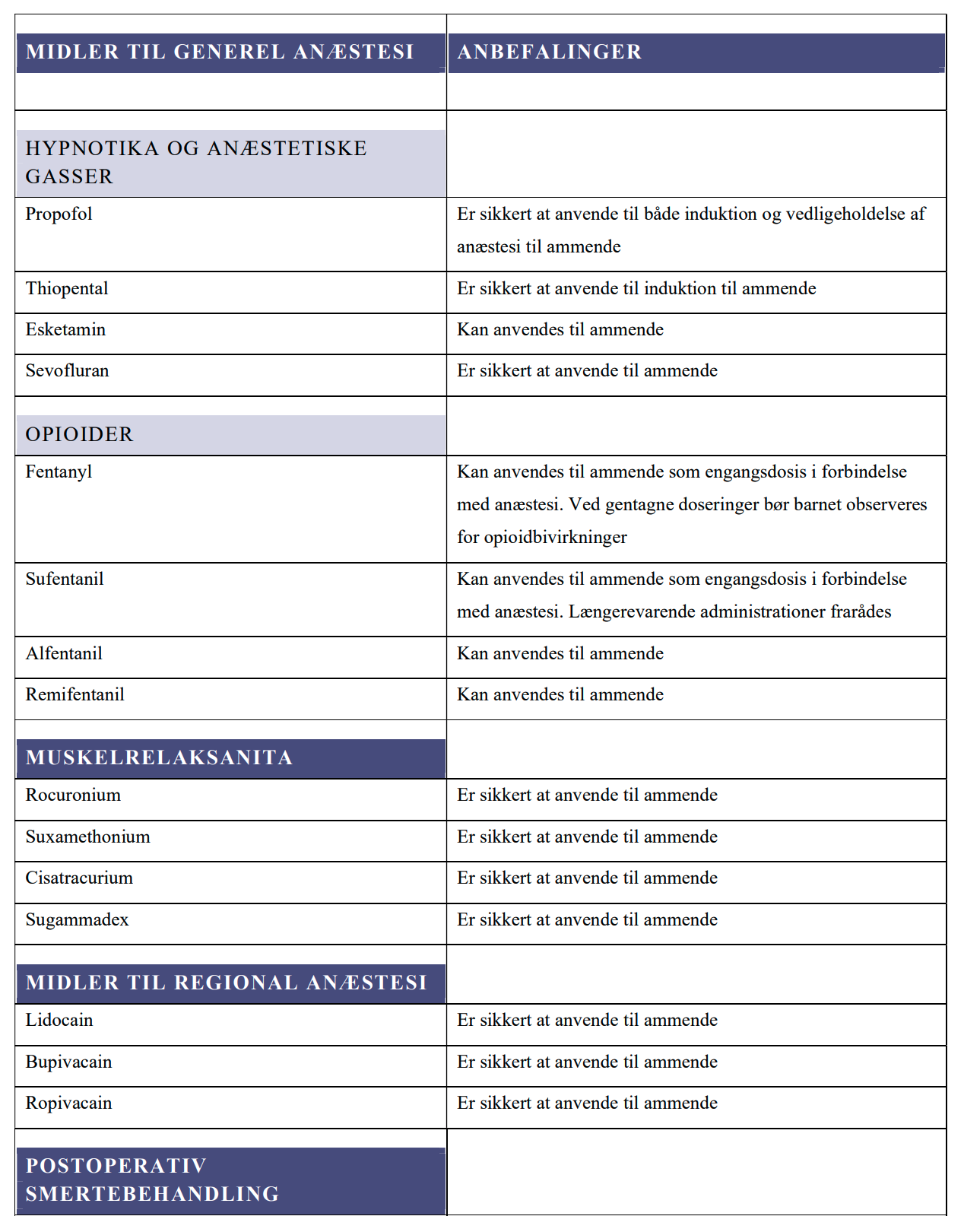
MIDLER TIL GENEREL ANÆSTESI
CO og ML
BAGGRUND FOR REKOMMENDATIONER
PROPOFOL
I et fransk studie fra 1985 målte man koncentrationer i colostrum hos 5 kvinder efter indledning og vedligeholdelse med propofol til kortvarige anæstesier hhv. 15, 30, 60, 120, 240 og 360 minutter efter induktion. Maksimal målte koncentration var 4,9 µg/ml efter 30 minutter(1).
Et senere studie målte propofol-koncentrationer i plasma og colostrum hos 21 kvinder, som fik foretaget elektivt sectio i generel anæstesi ved induktion med propofol 2.5 mg/kg. Kvinderne var delt i 2 grupper, hvor den ene gruppe fik vedligeholdelse med N2O og halotan, og den anden gruppe fik propofol. Studiet var ikke randomiseret. Der findes kun data for colostrum for 7 af patienterne. Colostrum blev udtaget efter 4 og 8 timer. Den højeste målte propofolkoncentration var 0,74 µg/ml. Der blev udtaget umbilicale blodprøver og foretaget neonatale vurderinger, man fandt ingen sammenhæng mellem neonatale propofolkoncentrationer og neonatale APGAR/neurologisk scoring(2).
I et studie undersøgte man koncentrationer af midazolam, propofol og fentanyl i modermælk fra 5 ammende kvinder, der havde været i anæstesi 11 uger postpartum. Alle kvinder modtog midazolam 2 mg som præmedicin. Ved indledning gives 100 µg fentanyl samt 2.5mg/kg propofol. Vedligehold med gas er ikke nærmere beskrevet. Al modermælk blev indsamlet i det 1. postoperative døgn over 5 indsamlinger. Den mediane koncentration af propofol i modermælk efter et døgn var 0,026 mg(3).
Det vurderes, at kun meget små doser propofol overføres via modermælk, og at den gastro-intestinale absorption er lav.
THIOPENTAL
Thiopental er et hypnotikum af barbiturattypen, og bruges til induktion af generel anæstesi.
Udskillelsen af thiopental i colostrum og modermælk er undersøgt i et studie af henholdsvis 8 kvinder i forbindelse med sectio i generel anæstesi og 8 kvinder efter elektiv kirurgia minor mindst 2 uger postpartum. I begge grupper foregik anæstesiindledning med thiopental 3,8-7,0 mg/kg. Prøver af blod og modermælk blev udtaget før indledning og efter 2 (ikke sectio gruppen), 4, 6, 8, 12, 24 og 36 timer. I begge grupper blev den højeste koncentration målt på det første prøvetidspunkt efter induktion, og var gennemsnitlig 3,4 µmol/l efter 2 timer i gruppen med modermælk og gennemsnitlig 1,3 µmol/l efter 4 timer i gruppen med colostrum. Omregnet til vægt/volumen var maksimale koncentrationer 0,09 µg/ml i modermælk og 0,03 µg/ml i colostrum. Børnene født efter sectio havde maksimal apgarscore; der er ikke oplysninger om børnene i den anden gruppe. Forfatterne konkluderer, at koncentrationer af thiopental i colostrum og modermælk er negligable efter induktion med thiopental (4).
Et andet studie har sammenlignet koncentrationer af thiopental og etomidat i maternelt plasma, umbilicalveneblod og i colostrum hos 40 kvinder efter sectio i generel anæstesi, hvor stofferne blev anvendt til induktion. 20 kvinder modtog thiopental, de resterende ethomidat. Gruppefordeling er ikke videre oplyst. Kvinderne modtog thiopental induktionsdosis på 5 mg/kg. I tiopenthal-gruppen blev blodprøver udtaget efter 5 min, 2, 4, 9 og 12 timer og fra colostrum efter 30 min, 4 og 9 timer. I colostrum var den højeste gennemsnitlige koncentration 1,98 µg/ml efter 30 min, og den højeste enkeltmåling var 4,7 µg/ml. Der er ingen oplysninger om effekten på børnene(5).
Samlet set modtager barnet en lille dosis i colostrum og modermælk, hvorfor thiopental kan anvendes til indledning af anæstesi uanset barnets alder.
SEVOFLURAN
Sevofluran er et halogeneret inhalationsanæstetikum.
Der findes ikke studier, der undersøger udskillelsen i modermælk af Sevofluran, så anbefalingerne baserer sig på teoretiske overvejelser. Gassen har kort halveringstid og lav metaboliseringsgrad, så teoretisk overføres der kun begrænsede mængder(6). Der findes ingen oplysninger om oral biotilgængelighed.
Den samlede anbefaling er at sevofluran kan anvendes, og amning kan genoptages, når moderen er vågnet efter anæstesi.
ESKETAMIN
Esketamin er en potent S-isomer af ketamin. Esketamin anvendes overvejende til induktion af generel anæstesi hos hypovolæme og/eller cirkulatorisk ustabile patienter og er kendt for sine hallucinogene bivirkninger. Der findes ingen publikationer om udskillelsen af esketamin eller ketamin i modermælk eller om påvirkninger af børn, der via modermælken har været udsat for esketamin/ketamin.
Ketamin er af WHO vurderet til at være kompatibelt med amning(7). Anbefaling baserer sig på farmakokinetiske karakteristika. På baggrund af esketamins korte halveringstid og ringe orale biotilgængelighed anses udskillelsen af esketamin i modermælk for at være lille. Anvend gerne andre anæstetika til induktion såfremt muligt(8).
Den samlede anbefaling er, at esketamin kan anvendes til anæstesi til ammende kvinder.
FENTANYL
Der er ikke fundet fentanyl i colostrum efter indgift af 100 ug fentanyl epiduralt (9).
Perioperativ engangsadministration af iv fentanyl resulterede i negligeable koncentrationer i colostrum(10,11). Ved undersøgelse af colstrum hos 100 kvinder efter enten iv fentanyl eller epidural fentanyl i forbindelse med kejsersnit er konklusionen, at barnet kun vil udsættes for negligeable koncentrationer(12). Ved gentagne doseringer bør barnet observeres for mulige opioid bivirkninger herunder sedation, respirationsdepression og obstipation(13,14).
SUFENTANIL
Lactmed samt Janusmed(14,15) anfører at sufentanil brugt peripartum, enten epiduralt eller intravenøst, kun vil resultere i et negligeabelt indtag via brystmælk og ikke forventes at have skadelig effekt på barnet. Længerevarende administrationer postpartum frarådes dog(14,16)(17).
Der er ikke fundet sufentanil i colostrum efter epidural administation af sufentanil 50 ug(9).
ALFENTANIL
Både Lactmed databasen og Janusinfo.se kategoriserer alfentanil som sikkert at bruge under amning(18)(14).
REMIFENTANIL
Der findes ingen evidens vedrørende brugen af remifentanil til ammende kvinder. Med baggrund i den meget kortehalveringstid regnes det dog for sikkert at anvende(19)(20).
MIDLER TIL REGIONAL ANÆSTESI
CO og ML
BAGGRUND FOR REKOMMANDATIONER
LIDOCAIN
Lidocain er af The American Association of Pediatrics kategoriseret som forenelig med amning(21). Med baggrund i begrænset udskillelse i brystmælk, den relativt hurtige elimination herfra samt lav peroral biotilgængelighed, er lidocain sikkert at benytte under amning(22,23).
BUPIVACAIN
Brugen af bupivacain til ammende kvinder anses for sikker(20,24). På baggrund af blodprøve målinger efter spinal anæstesi og TAP blok med bupivacain, sammenholdt med bupivacains famakokinetik samt de lave mængder brystmælk en nyfødt indtager, konkluderes det, at bupivacain er sikkert at bruge til ammende(25,26). Med baggrund i begrænset udskillelse i brystmælk, relativ hurtig elimination herfra samt lav peroral biotilgængelighed er bupivacain sikkert at benytte under amning(22). Kontinuerlig infusion af bupivacain intrapleuralt forbindelse med postoperativ smertebehandling resulterer kun i beskedne mængder i brystmælken(27).
ROPIVACAIN
Ropivacain udskilles kun i beskedne mængder i brystmælken som beskrevet ved spinal-epidural anæstesi med ropivacain og fentanyl samt efterfølgende PCA(22,23). Ropivacain anses for sikkert at anvende til ammende kvinder.
MIDLER TIL REGIONAL ANÆSTESI TILSAT ADRENALIN
Perioperative regionale nerveblokader udgør i dag en væstenlig del af patientbehandlingen. I søgen efter optimering med forlænget virkningsvarighed er der tilsat adjuvans til det anvendte lokalanalgetika. Eksempler på adjuvans er Adrenalin. Adrenalins effekt som adjuvans baserer sig på en lokal vasokonstriktion med lavere systemisk optag af de lokalt applicerede medikamenter. Adrenalin er karakteriseret med kort halveringstid og dårlig biotilgængelighed ved oralt indtag. Derfor anses Adrenalin som sikkert at anvende som adjuvans til regionale nerveblokader (14,28).
MUSKELRELAKSANTIA
CO og ML
BAGGRUND FOR REKOMMANDATIONER
ROCURONIUM
Med baggrund i lav oral biotilgængelighed samt lav lipidopløselighed regnes rocuronium for sikkert at anvende til ammende kvinder(20).
SUXAMETHONIUM
Suxamethonium har en hurtig maternel elimination og lav oral biotilgængelighed, og regnes for sikkert at anvende under amning(20).
CISATRACURIUM
Med baggrund i kort virkningsvarighed, høj polarisering, lav lipidopløselighed samt lav oral biotilgængelighed anses cisatracurium for sikkert at anvende til ammende kvinder(20).
SUGAMMADEX
Ifølge producenten viser dyrestudier, at sugammadex udskilles i brystmælk. Den orale eksponering er dog generelt lille, og det forventes ikke at have skadelig effekt for spædbarnet(29).
Lactmed tager udgangspunkt i stoffets meget høje molekylestørrelse, hvorved sugammadex antages for at være sikkert at anvende til ammende kvinder(30). Ligeledes er sugammadex ifølge promedicin.dk sikkert at bruge til den ammende patient(31).
POSTOPERATIV SMERTEBEHANDLING
LV og PD
BAGGRUND FOR REKOMMANDATIONER
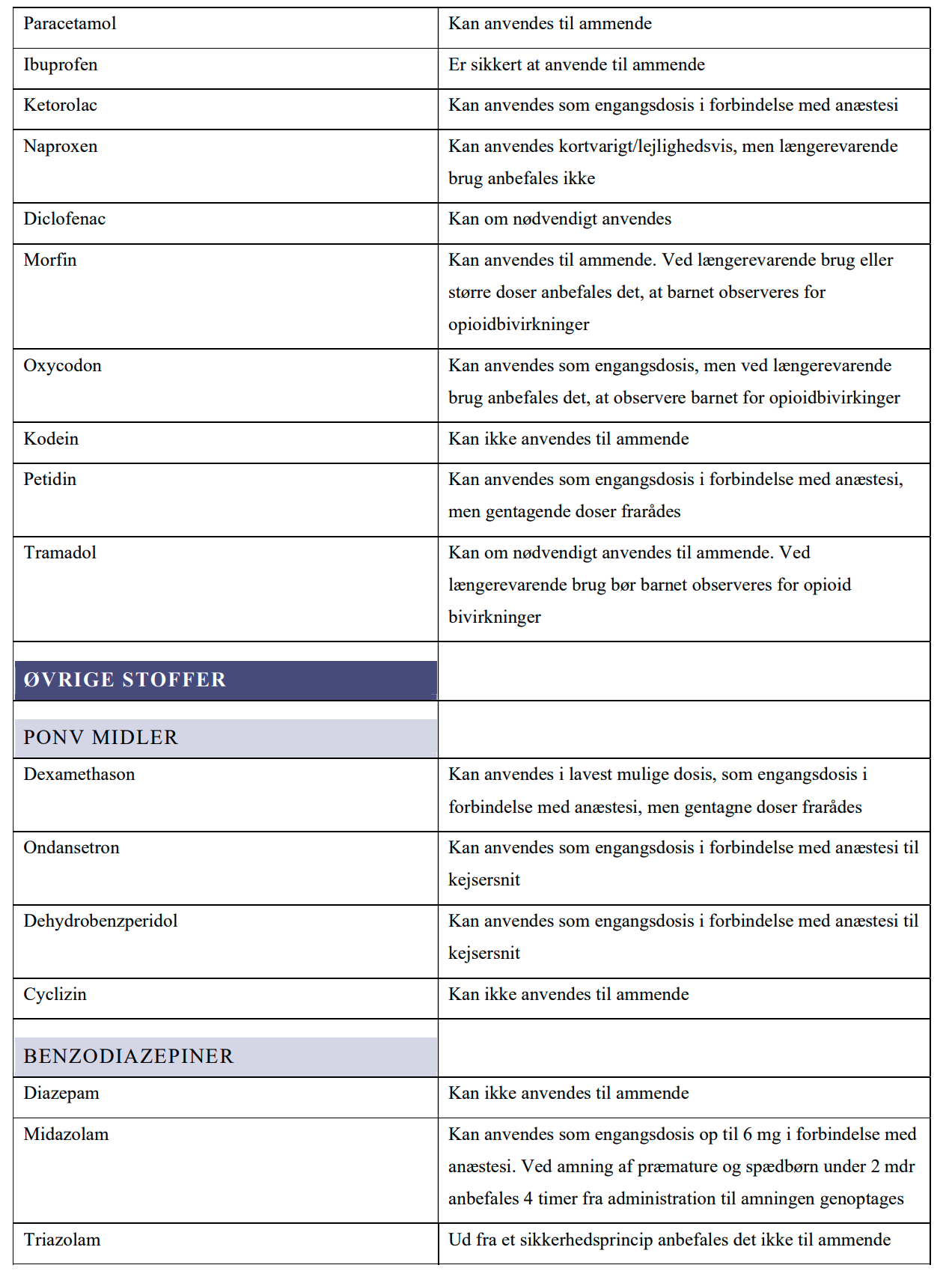
PARACETAMOL
Kan anvendes som analgesi og antipyretika hos ammende mødre (32). Paracetamol udskilles i brystmælk, den relative vægtjusterede dosis er lille (< 5%) (33–35).
Der er beskrevet et enkelt tilfælde af udslæt hos ét barn (36). Der er ikke beskrevet bivirkninger hos 55 spædbørn der ammes (33,37). Spædbørn, der selv får paracetamol i terapeutiske doser, vil få væsentligt højere dosis af stoffet, end der ville passere via modermælken, når moderen er i behandling (35).
IBUPROFEN
Kan anvendes under amning (38). Ibuprofen udskilles kun i meget lav dosis i brystmælk, den relative vægtjusterede dosis er < 0,5% (39–41).
Der er ikke beskrevet bivirkninger hos 23 ammede børn (37,41,42). Ibuprofen har en kort halveringstid og bruges til spædbørn i væsentligt højere doser end de doser, der udskilles i brystmælk (41).
KETOROLAC
Kan om nødvendigt anvendes (43). Anbefales kun som engangsbrug, da risiko ved langtidsbehandling ikke kan bedømmes pga. manglende data. Ketorolac udskilles kun i lav grad i modermælken, den relative vægtjusterede dosis er lav (<0,5%) (44).
Der er ikke beskrevet bivirkninger hos barnet eller nedsat ammeetablering efter brug af en enkelt dosis ketorolac som smertebehandling efter kejsersnit i en RCT med 120 mødre (45), ej heller ved gentagne doser det første døgn efter kejsersnit i en RCT med 118 mødre (46).
Producenten gør opmærksom på, at ketorolac har en stærk antitrombotisk effekt med risiko for gastrointestinal blødning som bivirkning, og anbefaler ikke stoffet til børn under 16 år pga manglende data (47).
NAPROXEN
Må kun anvendes under visse forudsætninger. Kortvarig eller lejlighedsvis anvendelse af naproxen synes foreneligt med amning (48).
Den relative vægtjusterede dosis er lav (< 3,4%) (49). Naproxen har en relativ lang halveringstid på 12-15 timer, hvilket indebærer en teoretisk risiko for akkumulering hos barnet ved vedvarende eksponering gennem modermælken.
Der er kun begrænset information om bivirkninger og brug under amning. En case beskriver blødning og akut anæmi hos et syv dage gammelt barn, hvor moderen blev behandlet med 800 mg naproxen dagligt (50). I et opfølgningssstudie af 20 spædbørn eksponeret for naproxen gennem modermælken blev der af mødrene beskrevet sløvhed hos et barn og opkast hos et barn (37).
DICLOFENAC
Kan om nødvendigt anvendes (51).
Den relative vægtjusterede dosis er lav (< 2%) (52). Halveringstiden er kort, hvilket taler for en lav eksponeringsrisiko. Et RCT med 30 mødre fandt ingen bivirkninger hos børnene (53). Der er begrænset klinisk data i den eksisterende litteratur, men brug af diclofenac under amning vurderes som sikker i flere narrative reviews (54,55).
MORFIN
Epidual morfin som en del af et postoperativt smerteregime resulterer i meget små doser af morfin i modermælk og colostum, og er således sikkert at bruge for både mor og barn(56).
Iv og oral morfin udskilles i modermælk.
Morfin er førstevalg til af behandling af postoperative smerter til ammende kvinder. Morfin er velundersøgt til ammende kvinder. Morfin kan i teorien give CNS symptomer, respirations depression og forstoppelse, særligt ved behandling > 2-3 dage, men sammenlignet med andre opioider, så er morfin at foretrække(57– 63). Morfin metaboliseres til den aktive metabolit mofin-6-glukonorid, der har højere affinitet til µ-receptoren(62). Udskillelsen af morfin i modermælk er undersøgt i flere studier og de finder alle, at mængden af mofin og morfin-6- glukonorid er lille og det er usandsynligt, at det vil give påvirkning af barnet(57,58). Metabolismen af morfin er undersøgt hos nyfødte, spædbørn og ældre børn, og de undersøgelser viser, at nyfødte og spædbørn metaboliserer morfin langsommere end ældre børn(59,64). Sammenlignet med andre opioider, så udskilles morfin i en lavere mængde(60). Da ophobning og farmakokinetik hos barnet ikke kan forudsiges, så anbefales ikke behandling med morfin i mere end 2-3 dage, og ved længere behandling, da skal barnet observeres for bivirkninger inkl. CNS påvirkning, respirations depression og forstoppelse.
OXYCODON
Oxycodon anbefales ikke som førstevalg til behandling af smerter hos ammende kvinder.
Oxycodon udskilles i høj grad i modermælk. Ved en enkelt dosis oxycodon vurderes risikoen for barnet lille, men ved gentagende doser er der risiko for CNS depression, sløvhed og dårlig trivsel hos barnet, og behandling med oxycodon bør ikke overstige 2-3 dage(62,65–67).
Oxycodon metaboliseres via CYP3A til noroxycodon, en svag aktiv metabolit. Oxycodon metaboliseres dog også via CYP2D6, der udviser genetisk variation, til den aktive metabolit oxymorfon. Selvom oxycodon metabolisers til aktive metabolitter, menes disse ikke at have klinisk virkning i forhold til den virkning, der opstår af selve oxycodonen(62). Oxycodon er undersøgt til postoperativ smertebehandling efter kejsersnit, og barnet kan via modermælk indtage > 10 % af en terapeutisk dosis af oxycodon ved amning. Dog indtager barnet umiddelbart efter fødslen små mængder mælk, så det menes ikke at have klinisk betydning(66). Farmakokinetikken for oxycodon varierer meget både individuelt og for forskellige aldersgrupper og et studie fandt, at nyfødte og yngre spædbørn metaboliserer oxydocon langsommere end større spædbørn og børn, og variationen i metaboliseringen varierer mest for nyfødte og yngre spædbørn(67). Der er rapporteret dødsfald som følge af oxycodon og amning(65)(68). I en retrospektiv undersøgelse af opkald til U.S poison control centers fra 2001 til 2017 blev der identificeret 2319 opkald med spædbørn eksponeret for et stof i brystmælk. Af disse blev 7 klassificeret som ”major adverse effect” og af de 7 involverede 3 oxycodon(69).
KODEIN
Kodein anbefales ikke til ammende kvinder.
Der er uenighed blandt eksperter om kodein kan bruges til ammende kvinder. Der er rapporteret et dødsfald hos et 13 dage gammelt spædbarn, hvor mater var ultrahurtig omdanner af kodein(70), så på den baggrund anbefales kodein ikke fra flere sider. En enkelt dosis udgør formentligt ikke en risiko, men flere doser anbefales ikke. Alle de artikler der udfordrer brugen af kodein til ammende kvinder er retrospektive studier, og der er således ikke RCT eller prospektive studier der demonstrerer sikkerheden af kodein til ammende kvinder(70–79). Dog er to studier, der fraråder brugen af kodein på baggrund af den enkle case tidligere refereret nu trukket tilbage(80), så det kan være at anbefalingen om brug af kodein til ammende ændres i fremtiden, men for nuværende fastholdes anbefalingen om at kodein ikke kan anvendes til ammende.
Kodein metabolisers af CYP2D6, der udviser genetisk variation, til bl.a. morfin. At CYP2D6 udviser genetisk variation er vigtige i forhold til om stoffet bør tages af ammende kvinder. Man kan være langsom omdanner, normal omdanner og ultrahurtig omdanner. Hvis man er ultrahurtig omdanner, omdannes kodein hurtigere og i højere grad til morfin(62). Kodein er undersøgt i forhold til paracetamol og CNS påvirkning og mødrene rapporterede en rate af CNS depression på 16,7 % med kodein og 0,5 % med paracetamol(81), hvilket stemmer meget godt overnes et studie(73), mens et andet studie finder en rate af CNS depression på 2,1 %(82), men det var med lave doser og kortvarigt brug. Der er i litteraturen 35 kasuistikker med uforklarlig sløvhed, apnø, bradykardi og cyanose hos børn der ammede og hvis mødre tog kodein(76). Et review har set på brugen af kodein til postoperativ smertebehandling hos børn og der er rapporteret to dødsfald og et tilfælde med respirations depression(75). Det får forfatterne til at anbefale, at kodein ikke bruges til ammende kvinder eller børn under 12 år. Nyfødte har en lavere elimination af kodein/morfin og stoffet akkumuleres ved gentagende doser og risikoen for akkumulation øges ved brug > fire dage(79). Det skal desuden nævnes at et studie har fundet, at kodein + paracetamol giver den samme smertestillende effekt som NSAID(83). FDA (Food and Drug Administration) anbefaler ikke brugen af kodein til ammende kvinder(84).
PETIDIN
Petidin som enkeltdosis i forbindelse med kirurgi kan gives, men gentagende doser anbefales ikke, da petidin metaboliseres til den aktive metabolit norpetidin, der akkumuleres og der er rapporteret CNS påvirkning hos ammede børn.
Petidin metaboliseres til den aktive metabolit norpetidin(71) denne metabolit har en varierende halveringstid(85). Hos voksne har petidin en halveringstid på ca. 3 timer, mens den for nyfødte har en gennemsnitlig halveringstid på 22,7 timer(86). Et studie undersøgte farmakokinetikken for petidin hos nyfødte og spædbørn i alderen fra præmatur til 5 mdr. Median halveringstid var 10,7 timer med et spænd på 3,3 til 59,4 timer. Eliminationen er, som ses af tallene, meget varierende og der er ikke sammenhæng mellem alder og halveringstiden(87). Der er beskrevet neonatal sedation efter amning hvor moren er i petidin behandling(85). Et studie undersøgte brugen af et enkelt dosis petidin 25 mg i forbindelse med generel anæstesi og fandt at petidin kunne måles i op til 24 timer postoperativt, men i lav dosis, ud fra dette konkluderes at petidin som enkeltdosis er sikkert at bruge hos ammende kvinder(88).
TRAMADOL
Tramadol kan om nødvendigt anvendes til ammende. Ved længerevarende brug anbefales det at observere barnet for opioid bivirkninger(89,90). Tramadol metaboliseres af CYP2D6 til en aktiv metabolit og flere inaktive metabolitter. Ca. 30 % udskilles uomdannet gennem nyrerne. Tramadol er i USA ikke godkendt til ammende af FDA, så der er sparsom litteratur om tramadol til ammende. Der er udført et studie omkring tramadol og dets aktive metabolit med 75 kvinder der fik tramadol i forbindelse med kejsersnit. De fandt en vægtjusteret dosis for tramadol på ca. 2 % og ca. 0,06 % for den aktive metabolit(91).
ØVRIGE STOFFER
LV og PD
BAGGRUND FOR REKOMMANDATIONER
PONV MIDLER
DEXAMETHASON
Bør ikke anvendes som gentagende doser under amning, da der er ikke kvantitative data for udskillelse i modermælk(92), dog anses enkeltdoser for sikkert at anvende. Der er ikke fundet publiceret litteratur der beskriver bivirkninger hos spædbørn. Dexamethason kan forårsage et fald i serum prolactin og nedsat produktion af modermælk(93,94).
Anbefalet dosis af enkeltdoser til mater er ikke kvantificeret, men ud fra eksisterende litteratur anbefales at stile efter så lav dosis som muligt i så kort tid som muligt, da den kvantitative udskillelse i modermælk ikke kendes og studier af neonatale eksponeret direkte for dexamethason beskriver risici for multiple bivirkninger(95).
ONDANSETRON
Bør ikke anvendes under amning pga utilstrækkelige data(96). En enkelt dosis ondansetron ifm kejsersnit anses for at være sikkert. Ondansetron har en kort halveringstid (< 3 timer), en kort halveringstid giver teoretisk set en lavere risiko for eksponering.
Ondansetron 4-8 mg iv bruges ofte som kvalmeprofylakse i forbindelse med kejsersnit(97). Doser fra 4 mg til 12 mg er undersøgt i som kvalmeprofylakse i forbindelse med kejsersnit(98). Der er ikke beskrevet bivirkninger hos 40 børn hvor moderen fik ondansetron i forbindelse med fødslen(99).
Der er ikke fundet relevant publiceret data omkring klinisk brug af ondansetron under amning.
DROPERIDOL (DHB)
Bør ikke anvendes under amning, pga. utilstrækkelige data. Et enkelt dosis DHB ifm kejsersnit anses for at være sikkert. Der er ingen data for udskillelse i modermælk(100).
DHB bruges indimellem som kvalmeprofylakse i forbindelse med anæstesi til kejsersnit. DHB har en kort plasmahalveringstid (<2 timer) og effekten af et enkelt dosis i forbindelse med kejsersnit vurderes at være lav for en rask nyfødt til termin(101). Dog er der en risiko for CNS-påvirkning af den nyfødte ved flere administrationer. I et RCT med 40 mødre, der fik droperidol og morfin eller kun morfin, som postoperativ smertelindring efter kejsersnit, havde børnene i gruppen med morfin og droperidol lavere neonatal neurologisk score(102).
CYCLIZIN
Bør ikke anvendes under amning på grund af utilstrækkelige data(103). Enkeltdoser af cyclizin kan formentligt bruges under amning, men flere doser frarådes(104). Der kan forekomme milde bivirkninger i form af irritabilitet og sedation hos barnet og mælkeproduktionen hos mater kan påvirkes. Ud fra et follow-up studie af 85 mødre, der tog antihistamin, rapporterede mødre om irritabilitet og kolik-agtige symptomer hos 10% af spædbørnene og døsighed hos 1,6%. Ingen af bivirkningerne var alvorlige og ingen af spædbørnene var eksponeret for stoffet cyclicin(37). Større doser af antihistamin kan mindske prolactin hos kvinder postpartum(105,106). Den kliniske betydning for amme etablering er ikke undersøgt. Et stort prospektivt studie af kvalmestillende medicin givet under graviditeten fandt ingen tegn på cyclizin var associeret med teratogenicitet(107).
BENZODIAZEPINER
DIAZEPAM
Anbefales ikke til ammende kvinder grundet lang halveringstid af diazapam og dets metabolitter og akkumuleres hos barnet(108).
Stoffet skal særligt undgås når der ammes en nyfødt eller præmatur, og gives stoffet som en enkelt dosis i forbindelse med sedation, så skal der ventes 6 til 8 timer inden amning genoptages, uanset barnets alder(108).
Diazepam metabolisers til nordiazepam (desmethyldiazepam) og temazapam, der igen metaboliseres til oxazapam(108). Både diazapam og dets aktive metabolitter udskilles i modermælk, og man har kunnet finde diazapam 10 dage efter en enkelt administration(109). Diazapam og nordiazapam metaboliseres af CYP2C8, der udviser genvariation. Ca. 3-5 % af kaukasere er langsomme omdannere og er både mor og barn langsomme omdannere, der er stor risiko for bivirkninger hos barnet(110). Nyfødte og spædbørn metaboliserer diazapam endnu langsommere end børn og voksne(109,110).
MIDAZOLAM
Kan som enkelt dosis op til 6 mg iv bruges til ammende kvinder(111,112).
Midazolam udskilles i mindre grad til modermælk og er elimineret efter 4 timer(111–113). Der bør derfor gå 4 timer efter administration til amningen genoptages, særligt hos præmature, nyfødte og spædbørn under 2 mdr. Er barnet over 2 mdr. kan amningen formentligt genoptages med det samme(111).
TRIAZOLAM
Der er ikke lavet undersøgelser omkring triazolam og amning, men triazolam har en kort halveringstid, så det burde ikke give en risiko for bivirkninger hos barnet, men da der ikke er lavet undersøgelser på stoffet, bør man vælge at andet stof(114).
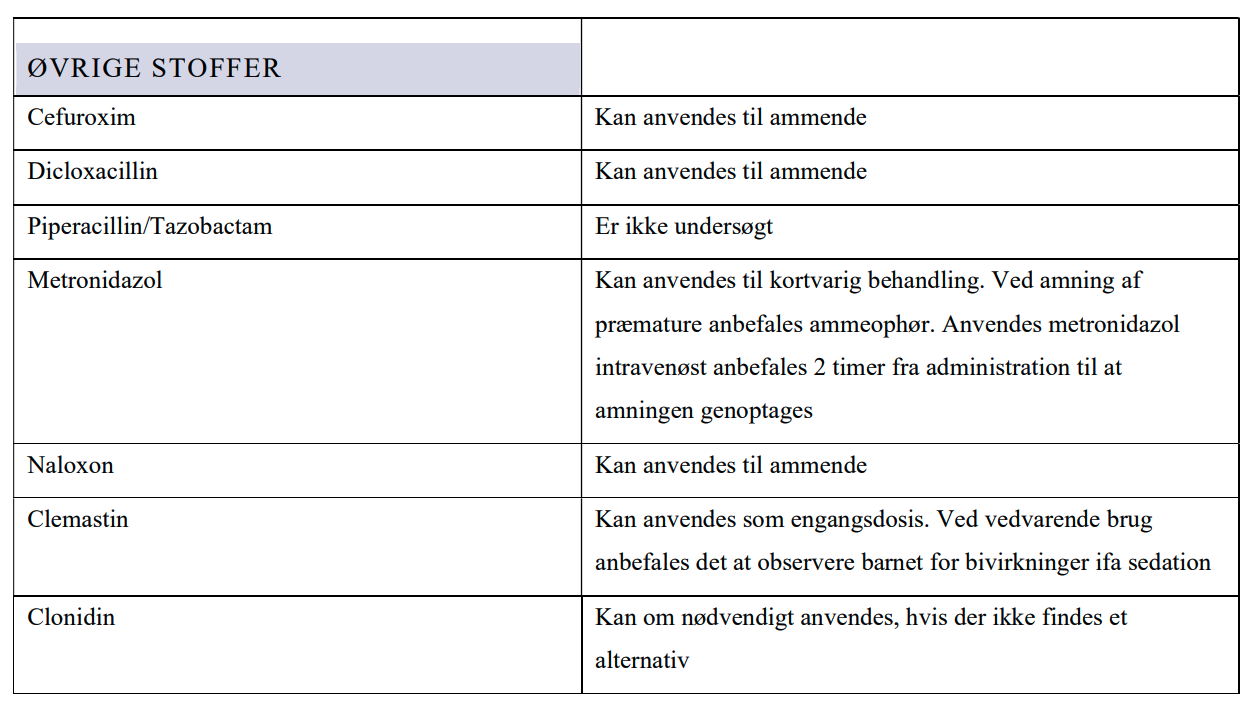
ØVRIGE STOFFER
CEFUROXIM
Kan anvendes(115). Den relative vægtjusterede dosis af Cefuroxim i modermælken er lav (<2 %)(116–118).
Bivirkninger hos børn er undersøgt i et prospektivt kontrolleret studie af ammende mødre n=51 i antibiotisk behandling. Mødrene blev adspurgt om bivirkninger hos deres børn. Der var ikke forskel i rapporterede bivirkninger mellem børnene i kontrolgruppen og i cefuroxim gruppen. Der blev rapporteret om diarre hos et barn i begge grupper(119).
Der er en generel mistanke om at antibiotika kan forstyrre barnets gastrointestinale flora og resultere i diarre eller svamp, men cephalosporiner anses for at være i den sikreste klasse af antibakterielle antibiotia(120)
DICLOXACILLIN
Kan anvendes(121). Transfer til modermælken er lav (< 1,3%)(122,123). Dicloxacillin bruges ofte til behandling af mastitis hos ammende(124,125). Der er ikke fundet publiceret litteratur der beskriver bivirkinger hos børn. Dog er der en generel mistanke om antibiotika kan forstyrre barnets gastrointestinale flora og resultere i diarre eller svamp og det er ikke tilstrækkeligt undersøgt om penicilliner forårsager dette(120).
PIPERACILLIN/TAZOBACTAM
Piperacillin kan bruges til ammende kvinder, men tazobactam er ikke undersøgt til ammende kvinder(126). Kombinationen piperacillin/tazobactam er ikke undersøgt til ammende, så det er ikke muligt at komme med en anbefaling om stoffet(127,128).
METRONIDAZOL
Metronidazol udskilles i høj grad i modermælk, da den vægtjusterede dosis er 12-24 % og det ammende barn får nær den pædiatriske terapeutiske dosis. Der er ikke konsensus om brugen af metronidazol til ammende. En pragmatisk anbefaling er: Anvendes metronidalzol er kortvarig behandling (7-10 dage) forenlig med amning, men længerevarnede behandling anbefales ikke. Amning af præmature anbefales ikke(129).
Lactmed og American Academy of Pediatrics anbefales ammeophør 12-24 timer efter en enkelt dosis(130,131). Hvis der er indikation for længerevarende behandling anbefales ammeophør og at amningen genoptages 2-3 dage efter endt behandling(131–135).
Der er rejst bekymring om brugen af metronidazol til ammende kvinder og eksponering af raske nyfødte og spædbørn, da det er veldokumenteret at metronidazol er genotoksisk og mutagent i bakterier og carcinogent i dyr (mus) og der er rejst mistanke om mutagenicitet i mennesker(132), men relevansen af disse fund er ikke afgjort i større veludførte studier. Producenten af metronidazol til intravenøs brug B.Braun anbefaler ophør af amning under behandling med metronidazol og at amningen først må genoptages 2-3 dage efter behandlingsophør(136). Der er risiko for diarre og candida infektion hos ammende børn hvis mødre får metronidazol(130).
NALOXON
Kan anvendes til ammende kvinder.
Der er ikke lavet undersøgelser på naloxon og udskillelsen i modermælk. Da det ikke er oralt biotilgængeligt er det usandsynligt at det kan påvirke fostret, selvom det udskilles(137). Det skal dog bemærkes, at gives naloxon for en opioidoverdosis, så anbefales amning ikke før, at moderen er helt ude af denne overdosis.
CLEMASTIN
Risikoen, for et barn født til termin, anses for at være lav ved engangsdosis. Ved vedvarende brug anbefales det at observere barnet for bivirkninger ifa sedation. Nonsederende antihistaminer bør bruges som alternativ.
Den relative vægtjusterede dosis for udskillelse i modermælk er 5,2%(138). I et telefon follow-up-studie rapportes der om irritabilitet og kolikagtige symptomer hos 10% af spædbørn og 1,6% rapporterede om sløvhed. Mødrene indtog forskellige antihistaminer, ingen af spædbørnene var eksponeret for clemastin(37). En 10 ugers baby, der blev eksponeret for clemastin, fenytoin og carbamazepin gennem modermælken er i en kasuistik beskrevet irritabel, sløv, nakkestiv og afvisende for føde. Clemastin mistænkes for at være årsagen bag(138).
CLONIDIN
Clonidin kan om nødvendigt anvendes til ammende, hvis der ikke findes et alternativ(139,140). En enkelt dosis intravenøst til behandling af shivering hos kvinder, der får foretaget kejsersnit, er ikke undersøgt, men udgør formentligt ikke en risiko for barnet.
Der er ingen humane studier med clonidin intravenøst og amning. Brugen af clonidin til shivering er undersøgt i et studie, men det har ikke undersøgt amning og evt påvirkning af den nyfødte(141).
Peroral clonidin udskilles i høj grad til modermælk og koncentrationen i modermælk er højere end i blodet(139). I studier er koncentrationen i spædbørns blod fundet at være halvdelen af den maternelle koncentration(139). Der er rapporteret hypotoni, sløvhed, anpø episoder og kramper hos spædbørn hvis mødre tog clonidin, og dette stoppede ved ophør af amning(139).
REFERENCER
- Schmitt JP, Schwoerer D, Diemunsch P, Gauthier-Lafaye J. Passage du propofol dans le colostrum. Données préliminaires. Ann Fr Anesth Reanim. 1987;6(4):267–8.
- Dailland P. Intravenous propofol during cesarean section: placental transfer, concentrations in breast milk, and neonatal effects. Anesthesiology. 1989;71:827–34.
- Nitsun M, Szokol JW, Saleh HJ, Murphy GS, Vender JS, Luong L, et al. Pharmacokinetics of midazolam, propofol, and fentanyl transfer to human breast milk. Clin Pharmacol Ther. 2006;79(6):549–57.
- Andersen LW, Qvist T, Hertz J, Mogensen F. Concentrations of thiopentone in mature breast milk and colostrum following an induction dose. Acta Anaesthesiol Scand. 1987;31(1):30– 2.
- Esener Z, Sarihasan B, Güven H, üstün E. Thiopentone and etomidate concentrations in maternal and umbilical plasma, and in colostrum. Br J Anaesth. 1992;69(6):586–8.
- Sønderskov ML, Albrechtsen CK, Bille AB, Henneberg S, Afshari A. De fleste anæstesimidler kan bruges uden skadelig påvirkning af barnet ved amning. Ugeskr Laeger. 2011;173(38):2332–6.
- WHO | Breastfeeding and maternal medication [Internet]. [cited 2020 Sep 1]. Available from: https://www.who.int/maternal_child_adolescen t/documents/55732/en/
- Mitchell J, Jones W, Winkley E, Kinsella SM. Guideline on anaesthesia and sedation in breastfeeding women 2020: Guideline from the Association of Anaesthetists. Anaesthesia. 2020;1–12.
- MADEJ TH, STRUNIN L. Comparison of epidural fentanyl with sufentanil. Anaesthesia. 1987;42(11):1156–61.
- Steer PL, Pho CJB, Crna WSM, Lantz RK, Sulik PL. Concentration of fentanyl in colostrum after an analgesic dose.
- Nitsun M, Szokol JW, Saleh HJ, Murphy GS, Vender JS, Luong L, et al. Pharmacokinetics of midazolam, propofol, and fentanyl transfer to human breast milk. Clin Pharmacol Ther. 2006 Jun;79(6):549–57.
- Goma HM, Said RN, El-Ela AM. Study of the newborn feeding behaviors and fentanyl concentration in colostrum after an analgesic dose of epidural and intravenous fentanyl in cesarean section. Saudi Med J. 2008;29(5):678–82.
- Kalceks F, Actavis F, Braun FB, Hameln F, Hexal F, Lavipharm F, et al. Fentanyl. 2020;29(5):6–7.
- Söksida | Janusmed [Internet]. [cited 2020 Aug 31]. Available from: https://janusmed.sll.se/#/home/amning
- Drugs and Lactation Database (LactMed) – NCBI Bookshelf [Internet]. [cited 2020 Nov 22]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK5019 22/
- Sufentanil. 2020;46(2):2020.
- Citation NLM, Database L, Library N, Url B. Sufentanil. Nih. 2018;(Md):3–5.
- Citation NLM, Database L, Library N, Url B. Alfentanil. Nih. 2018;(Md):3–5.
- Statement on Resuming Breastfeeding after Anesthesia | American Society of Anesthesiologists (ASA) [Internet]. [cited 2020 Aug 31]. Available from: https://www.asahq.org/standards-andguidelines/statement-on-resumingbreastfeeding-after-anesthesia
- Dalal PG, Bosak J, Berlin C. Safety of the breast-feeding infant after maternal anesthesia. Vol. 24, Paediatric Anaesthesia. Blackwell Publishing Ltd; 2014. p. 359–71.
- AMERICAN ACADEMY OF PEDIATRICS The Transfer of Drugs and Other Chemicals Into Human Milk [Internet]. 2001. Available from: www.aappublications.org/news
- Ortega D, Viviand X, Lorec AM, Gamerre M, Martin C, Bruguerolle B. Excretion of lidocaine and bupivacaine in breast milk following epidural anesthesia for cesarean delivery. Acta Anaesthesiol Scand. 1999;43:394–7.
- Giuliani M, Grossi GB, Pileri M, Lajolo C, Casparrini G. Could local anesthesia while breast-feeding be harmful to infants? J Pediatr Gastroenterol Nutr. 2001;32(2):142–4.
- Citation NLM, Database L, Library N, Url B. Bupivacaine. 2019;(Md):2–5.
- Trabelsi B, Charfi R, Bennasr L, Marzouk S Ben, Eljebari H, Jebabli N, et al. Pharmacokinetics of bupivacaine after bilateral ultrasound-guided transversus abdominis plane block following cesarean delivery under spinal anesthesia. Int J Obstet Anesth [Internet]. 2017;32(2017):17–20. Available from: https://doi.org/10.1016/j.ijoa.2017.04.007
- Junge Joshua. Exploring the transversus abdominis plane block in cesarean sections and the subsequent toxicity to neonates via the breast milk. J Anaesthesiol Clin Pharmacol. 2019;35:153–6.
- Baker PA, Ffaracs C, Schroeder D, Fracs C. Interpleural Bupivacaine for Postoperative Pain during Lactation. Vol. 69, ANESTH ANALG. 1989.
- Citation NLM, Database L, Library N, Url B. Epinephrine. Nih. 2018;(Md):3–5.
- Michailidou A, Trenz H-J, de Wilde P. Annex I: The Internet and European Integration. 2019.
- Citation NLM, Database L, Library N, Url B. Sugammadex. Nih. 2018;(Md):3–5.
- Bridion® – information til sundhedsfaglige – Medicin.dk [Internet]. [cited 2020 Sep 1]. Available from: https://pro.medicin.dk/Medicin/Praeparater/447 3
- Paracetamol – Medicin.dk [Internet]. [cited 2020 Aug 28]. Available from: https://pro.medicin.dk/Medicin/Praeparater/737 2#a010
- Berlin CM, Yaffe SJ, Ragni M. Disposition of acetaminophen in milk, saliva, and plasma of lactating women. Pediatr Pharmacol [Internet]. 1980 Dec 1 [cited 2020 Aug 28];1(2):135–41. Available from: https://pennstate.pure.elsevier.com/en/publicati ons/disposition-of-acetaminophen-in-milksaliva-and-plasma-of-lactati
- Bitzen P-O, Gustafsson B, Jostell KG, Melander A, Wfihlin-Boll E. European Journal of Clinical Pharmacology Excretion of Paracetamol in Human Breast Milk. Eur J Clin Pharmacol. 1981;20:123–5.
- Notarianni L J, Oldham H G, Bennett P N. Passage of paracetamol into breast milk and its subsequent metabolism by the neonate. Vol. 24, J. clin. Pharmac. 1987.
- Matheson I. Lunde P.K.M. NL. Infant Rash Caused by Paracetamol in Breast Milk? Pediatrics. 1985;76(4).
- Ito S, Blajchman A, Stephenson M, Eliopoulos C, Koren G. Prospective follow-up of adverse reactions in breast-fed infants exposed to maternal medication. Am J Obstet Gynecol [Internet]. 1993;168(5):1393–9. Available from: http://dx.doi.org/10.1016/S0002- 9378(11)90771-6
- Ibuprofen – Medicin.dk [Internet]. [cited 2020 Aug 28]. Available from: https://pro.medicin.dk/Medicin/Praeparater/411 #a010
- Rigourd V, Brune De Villepin †, Amirouche A, Bruneau A, Seraissol P, Florent A, et al. Ibuprofen Concentrations in Human Mature Milk-First Data About Pharmacokinetics Study in Breast Milk With AOR-10127 “Antalait” Study. 2014.
- Townsend RJ, Benedetti TJ, Erickson SH, Cengiz C, Gillespie WR, Gschwend J, et al. Excretion of ibuprofen into breast milk. Am J Obstet Gynecol [Internet]. 1984 May 15 [cited 2020 Aug 28];149(2):184–6. Available from: http://www.ajog.org/article/000293788490195 9/fulltext
- Walter K DC. Ibuprofen in human milk. Br J clin Pharmacol, 44, 209-213. 1997;
- Weibert R T et al. Lack of ibuprofen secretion into human milk – PubMed. Clin Pharm SepOct 1982;1(5)457-8 [Internet]. [cited 2020 Aug 30]; Available from: https://pubmed.ncbi.nlm.nih.gov/7184678/
- Toradol® – Medicin.dk [Internet]. [cited 2020 Aug 28]. Available from: https://pro.medicin.dk/Medicin/Praeparater/145 3#a010
- Wischnik A, Manth SM, Lloyd J, Bullingham R, Thompson JS. The excretion of ketorolac tromethamine into breast milk after multiple oral dosing. Vol. 36, Eur J Clin Pharmacol. Springer-Verlag; 1989.
- Hadley EE, Monsivais L, Pacheco L, Babazade R, Chiossi G, Ramirez Y, et al. Multimodal Pain Management for Cesarean Delivery: A Double-Blinded, Placebo-Controlled, Randomized Clinical Trial. Am J Perinatol [Internet]. 2019 Sep 1 [cited 2020 Aug 30];36(11):1097–105. Available from: http://www.thiemeconnect.de/DOI/DOI?10.1055/s-0039-1681096
- Teigen NC, Sahasrabudhe N, Doulaveris G, Xie ; Xianhong, Negassa A, Bernstein J, et al. Enhanced recovery after surgery at cesarean delivery to reduce postoperative length of stay: a randomized controlled trial. Am J Obstet Gynecol [Internet]. 2020 [cited 2020 Aug 28];222:372.e1-372.e10. Available from: https://doi.org/10.1016/j.ajog.2019.10.009
- Lægemiddelstyrelsen. PRODUKTRESUMÉ for Toradol. 2016.
- Bonyl® – Medicin.dk [Internet]. [cited 2020 Aug 28]. Available from: https://pro.medicin.dk/Medicin/Praeparater/113 4#a010
- Jamali F, Stevens DRS. Naproxen excretion in milk and its uptake by the infant [Internet]. Vol. 17, Drug Intelligence and Clinical Pharmacy. Drug Intell Clin Pharm; 1983 [cited 2020 Aug 28]. p. 910–1. Available from: https://pubmed.ncbi.nlm.nih.gov/6653409/
- Fidalgo I et al. Acute anemia, rectorrhagia and hematuria caused by ingestion of naproxen. An Esp Pediatr [Internet]. 1989 [cited 2020 Aug 28];Apr;30(4):317-9. Available from: https://pubmed.ncbi.nlm.nih.gov/2787136/
- Diclofenac – Medicin.dk [Internet]. [cited 2020 Aug 28]. Available from: https://pro.medicin.dk/Medicin/Praeparater/436 3#a010
- Todd PA SE. Diclofenac sodium. A reappraisal of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy – PubMed. Drugs [Internet]. 1988 [cited 2020 Aug 30];Mar;35(3):244-85. Available from: https://pubmed.ncbi.nlm.nih.gov/3286213/
- Hirose M, Hara Y, Hosokawa T, Tanaka Y. The Effect of Postoperative Analgesia with Continuous Epidural Bupivacaine After Cesarean Section on the Amount of Breast Feeding and Infant Weight Gain. Anesth Analg [Internet]. 1996;82:1166–75. Available from: https://journals.lww.com/anesthesia-analgesia
- Janssen NM, Genta MS. The effects of immunosuppressive and anti-inflammatory medications on fertility, pregnancy, and lactation [Internet]. Vol. 160, Archives of Internal Medicine. American Medical Association; 2000 [cited 2020 Aug 30]. p. 610– 9. Available from: https://pubmed.ncbi.nlm.nih.gov/10724046/
- Spigset O HS. Analgesics and Breast-Feeding Safety Considerations. Pediatr Drugs. 2000;2 (3): 223-238.
- ZAKOWSKI MI, RAMANATHAN S, TURNDORF H. A two‐dose epidural morphine regimen in cesarean section patients: pharmacokinetic profile. Acta Anaesthesiol Scand. 1993;37(6):584–9.
- Baka NE, Bayoumeu F, Boutroy MJ, Laxenaire MC. Colostrum morphine concentrations during postcesarean intravenous patientcontrolled analgesia. Anesth Analg. 2002;94(1):184–7.
- Feilberg VL, Rosenborg D, Christensen CB, Mogensen JV. Excretion of morphine in human breast milk. Acta Anaesthesiol Scand. 1989;33(5):426–8.
- Koren G, Butt W, Chinyanga H, Soldin S, Tan YK, Pape K. Postoperative morphine infusion in newborn infants: Assessment of disposition characteristics and safety. J Pediatr. 1985;107(6):963–7.
- Lamvu G, Feranec J, Blanton E. Perioperative pain management: an update for obstetriciangynecologists. Am J Obstet Gynecol [Internet]. 2018;218(2):193–9. Available from: https://doi.org/10.1016/j.ajog.2017.06.021
- Robieux I, Koren G, Vandenbergh H, Schneiderman J. Morphine excretion in breast milk and resultant exposure of a nursing infant. Clin Toxicol. 1990;28(3):365–70.
- Ito S. Opioids in Breast Milk: Pharmacokinetic Principles and Clinical Implications. J Clin Pharmacol. 2018;58(February):S151–63.
- Wittels B, Glosten B, Faure EAM, Moawad AH, Ismail M, Hibbard J, et al. Postcesarean analgesia with both epidural morphine and intravenous patient-controlled analgesia: Neurobehavioral outcomes among nursing neonates. Anesth Analg. 1997;85(3):600–6.
- Olkkola KT, Maunuksela EL, Korpela R, Rosenberg PH. Kinetics and dynamics of postoperative intravenous morphine in children. Clin Pharmacol Ther. 1988;44(2):128–36
- Citation NLM, Database L, Library N, Url B. Oxycodon. 2018;(Md):4–6.
- Seaton S, Reeves M, Mclean S. Oxycodone as a component of multimodal analgesia for lactating mothers after Caesarean section: Relationships between maternal plasma, breast milk and neonatal plasma levels. Aust New Zeal J Obstet Gynaecol. 2007;47(3):181–5.
- Pokela ML, Anttila E, Seppälä T, Olkkola KT. Marked variation in oxycodone pharmacokinetics in infants. Paediatr Anaesth. 2005;15(7):560–5.
- Timm NL. Maternal use of oxycodone resulting in opioid intoxication in her breastfed neonate. J Pediatr [Internet]. 2013;162(2):421– 2. Available from: http://dx.doi.org/10.1016/j.jpeds.2012.08.047
- Beauchamp GA, Hendrickson RG, Horowitz BZ, Spyker DA. Exposures Through Breast Milk: An Analysis of Exposure and Information Calls to U.S. Poison Centers, 2001-2017. Breastfeed Med. 2019;14(7):508– 12.
- Lam J, Matlow JN, Ross CJD, Hayden MR, Carleton BC, Madadi P. Postpartum maternal codeine therapy and the risk of adverse neonatal outcomes: The devil is in the details. Ther Drug Monit. 2012;34(4):378
- Citation NLM, Database L, Library N, Url B. Pethedin. 2018;(Md):4–6.
- Halder S, Russell R, Quinlan J. Codeine and breast-feeding mothers. Int J Obstet Anesth [Internet]. 2015;24(1):5–7. Available from: http://dx.doi.org/10.1016/j.ijoa.2014.12.003
- Lam J, Kelly L, Ciszkowski C, Landsmeer MLA, Nauta M, Carleton BC, et al. Central nervous system depression of neonates breastfed by mothers receiving oxycodone for postpartum analgesia. J Pediatr [Internet]. 2012;160(1):33-37.e2. Available from: http://dx.doi.org/10.1016/j.jpeds.2011.06.050
- Juurlink DN, Gomes T, Guttmann A, Hellings C, Sivilotti MLA, Harvey MA, et al. Postpartum maternal codeine therapy and the risk of adverse neonatal outcomes: A retrospective cohort study. Clin Toxicol. 2012;50(5):390–5.
- Lazaryan M, Shasha-Zigelman C, Dagan Z, Berkovitch M. Codeine should not be prescribed for breastfeeding mothers or children under the age of 12. Acta Paediatr Int J Paediatr. 2015;104(6):550–6.
- Madadi P, Shirazi F, Walter FG, Koren G. Establishing causality of CNS depression in breastfed infants following maternal codeine use. Pediatr Drugs. 2008;10(6):399–404.
- Meny et al kodein.pdf.
- Madadi P, Moretti M, Djokanovic N, Bozzo P, Nulman I, Ito S, et al. Guidelines for maternal codeine use during breastfeeding. Can Fam Physician. 2009;55(11):1077–8.
- Willmann S, Edginton AN, Coboeken K, Ahr G, Lippert J. Risk to the breast-fed neonate from codeine treatment to the mother: A quantitative mechanistic modeling study. Clin Pharmacol Ther [Internet]. 2009;86(6):634–43. Available from: http://dx.doi.org/10.1038/clpt.2009.151
- Pimlott N, Tsuyuki RT. Risks of maternal codeine intake in breastfed infants: a joint statement of retraction from Canadian Family Physician and the Canadian Pharmacists Journal. Can Fam Physician. 2020;66(11):793– 4.
- Donazzolo Y. Poster Session III (PIII 1-85) Displayed 8:00 am – 12:45 pm Attended 8:00 am – 9:30 am. Clin Pharmacol Ther. 2011;89(february):S68–94.
- Kelly LE, Chaudhry SA, Rieder MJ, ’t Jong G, Moretti ME, Lausman A, et al. A Clinical Tool for Reducing Central Nervous System Depression among Neonates Exposed to Codeine through Breast Milk. PLoS One. 2013;8(7):3–8.
- Nauta M, Landsmeer MLA, Koren G. Codeineacetaminophen versus nonsteroidal antiinflammatory drugs in the treatment of postabdominal surgery pain: a systematic review of randomized trials. Am J Surg [Internet]. 2009;198(2):256–61. Available from: http://dx.doi.org/10.1016/j.amjsurg.2008.11.044
- FDA Drug Safety Communication: FDA restricts use of prescription codeine pain and cough medicines and tramadol pain medicines in children; recommends against use in breastfeeding women | FDA [Internet]. [cited 2020 Jun 14]. Available from: https://www.fda.gov/drugs/drug-safety-andavailability/fda-drug-safety-communicationfda-restricts-use-prescription-codeine-painand-cough-medicines-and
- Martin E, Vickers B, Landau R, ReeceStremtan S. ABM Clinical Protocol #28, Peripartum Analgesia and Anesthesia for the Breastfeeding Mother. Breastfeed Med. 2018;13(3):164–71.
- Cadwell. I3ritbsh. 1978;(0).
- Pokela ML. Pharmacokinetics and pharmacodynamics of intravenous meperidine in neonates and infants. 1992;
- Borgatta L, Jenny RW, Gruss L, Ong C, Barad D. Clinical significance of methohexital, meperidine, and diazepam in breast milk. J Clin Pharmacol. 1997;37(3):186–92.
- Citation NLM, Database L, Library N, Url B. Tramadol. 2020;(Md):1–2.
- Janusmed tramadol.pdf.
- Ilett KF, Paech MJ, Page-Sharp M, Sy SK, Kristensen JH, Goy R, et al. Use of a sparse sampling study design to assess transfer of tramadol and its O-desmethyl metabolite into transitional breast milk. Br J Clin Pharmacol. 2008;65(5):661–6.
- Dexametason – Medicin.dk [Internet]. [cited 2020 Aug 28]. Available from: https://pro.medicin.dk/Medicin/Praeparater/725 5#a010
- Hubina E, Nagy GM, Tóth BE, Iván G, Görömbey Z, Szabolcs I, et al. Dexamethasone and Adrenocorticotropin Suppress Prolactin Secretion in Humans. Vol. 18, Endocrine. 2002.
- Henderson JJ, Hartmann PE, Newnham JP, Simmer K. Effect of preterm birth and antenatal corticosteroid treatment on lactogenesis II in women. Pediatrics. 2008 Jan;121(1).
- Doyle LW, Cheong JL, Ehrenkranz RA, Halliday HL. Early (< 8 days) systemic postnatal corticosteroids for prevention of bronchopulmonary dysplasia in preterm infants. Vol. 2017, Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd; 2017.
- Ondansetron – Medicin.dk [Internet]. [cited 2020 Aug 28]. Available from: https://pro.medicin.dk/Medicin/Praeparater/858 2#a010
- Cherian VT, Smith I. Prophylactic ondansetron does not improve patient satisfaction in women using PCA after Caesarean section. Br J Anaesth. 2001;87(3):502–4.
- Griffiths JD, Gml G, Paranjothy S, Hc B, Hk B, Thomas J, et al. Interventions for preventing nausea and vomiting in women undergoing regional anaesthesia for caesarean section (Review). 2021;
- Elkomy MH, Sultan P, Carvalho B, Peltz G, Wu M, Clavijo C, et al. Ondansetron pharmacokinetics in pregnant women and neonates: Towards a new treatment for neonatal abstinence syndrome. Clin Pharmacol Ther. 2015 Feb 1;97(2):167–76.
- Dehydrobenzperidol® – Medicin.dk [Internet]. [cited 2020 Aug 28]. Available from: https://pro.medicin.dk/Medicin/Praeparater/478 5#a010
- Spigset O. Anaesthetic agents and excretion in breast milk. Acta Anaesthesiol Scand [Internet]. 1994 Feb 1 [cited 2020 Aug 30];38(2):94–103. Available from: http://doi.wiley.com/10.1111/j.1399- 6576.1994.tb03848.x
- Bonhomme V et al. M. Droperidol Reduces Nausea after Caesarean Section but Alters the Neurological Status of the Breastfed Infants. Anesthesiology [Internet]. 2002 [cited 2020 Aug 28];96: A1044. Available from: http://www.asaabstracts.com/strands/asaabstrac ts/abstract.htm?year=2002&index=12&absnum =599
- Marzine® – information til sundhedsfaglige – Medicin.dk [Internet]. [cited 2021 Mar 15]. Available from: https://pro.medicin.dk/Medicin/Praeparater/72# a010
- Citation NLM, Database L, Library N, Url B. Cyclizine. 2018;(Md):1–3.
- Messinis IE, Souvatzoglou A, Fais N, Lolis D. Histamine H1 receptor participation in the control of prolactin secretion in postpartum. J Endocrinol Invest [Internet]. 1985;8(2):143–6. Available from: https://doi.org/10.1007/BF03350670
- 106. PONTIROLI AE, SILVA EDECE, MAZZOLENI F, ALBERETTO M, BAIO G, GABRIELE P, et al. The Effect of Histamine and H1 and H2 Receptors on Prolactin and Luteinizing Hormone Release in Humans: Sex Differences and the Role of Stress. J Clin Endocrinol Metab [Internet]. 1981 May 1;52(5):924–8. Available from: https://doi.org/10.1210/jcem-52-5-924
- Milkovich L, van den Berg BJ. An evaluation of the teratogenicity of certain antinauseant drugs. Am J Obstet Gynecol [Internet]. 1976;125(2):244–8. Available from: https://www.sciencedirect.com/science/article/ pii/0002937876906013
- Citation NLM, Database L, Library N, Url B. Stesolid. Nih. 2018;(Md):3–5.
- Cole AP, Hailey DM. Diazepam and active metabolite in breast milk and their transfer to the neonate. Arch Dis Child. 1975;50(9):741– 2.
- SPIGSET O. Anaesthetic agents and excretion in breast milk. Acta Anaesthesiol Scand. 1994;38(2):94–103.
- Citation NLM, Database L, Library N, Url B. Midazolam. Nih. 2018;(Md):3–5.
- Koitabashi T, Satoh N, Takino Y. Intravenous midazolam passage into breast milk. J Anesth. 1997;11(3):242–3.
- Matheson I, Lunde P, Bredesen J. Midazolam and nitrazepam in the maternity ward: milk concentrations and clinical effects. Br J Clin Pharmacol. 1990;30(6):787–93.
- Citation NLM, Database L, Library N, Url B. Triazolam. Nih. 2018;(Md):3–5.
- Cefuroxim – Medicin.dk [Internet]. [cited 2020 Aug 30]. Available from: https://pro.medicin.dk/Medicin/Praeparater/763 0#a010
- Nakamura T et al. Clinical studies on cefuroxime axetil in acute mastitis. Jpn J Antibiot [Internet]. 1987 [cited 2020 Aug 30];Feb;40(2):340-8. Available from: https://pubmed.ncbi.nlm.nih.gov/3599383/
- Takase Z, Shirofuji H, Uchida M. Fundamental and clinical studies of cefuroxime in the field of obstetrics and gynecology. Chemotherapy. 1979 Jul 25;27(Supplement6):600–2.
- Voropaeva SD et al. Effectiveness of using cefuroxime in the obstetrics and gynecology clinic. Antibiot 1982;27(9)697-701 [Internet]. [cited 2020 Aug 30]; Available from: https://pubmed.ncbi.nlm.nih.gov/7149693/
- Benyamini L, Merlob P, Stahl B, Braunstein R, Bortnik O, Bulkowstein M, et al. The Safety of Amoxicillin/Clavulanic Acid and Cefuroxime During Lactation [Internet]. Available from: https://journals.lww.com/drug-monitoring
- Mathew JL. Effect of maternal antibiotics on breast feeding infants [Internet]. Vol. 80, Postgraduate Medical Journal. Postgrad Med J; 2004 [cited 2020 Aug 30]. p. 196–200. Available from: https://pubmed.ncbi.nlm.nih.gov/15082839/
- Dicloxacillin – Medicin.dk [Internet]. [cited 2020 Aug 30]. Available from: https://pro.medicin.dk/Medicin/Praeparater/942 3#a010
- Matsuda S. Transfer of antibiotics into maternal milk. Biol Res Pregnancy Perinatol 1984;5(2)57-60 [Internet]. 1984; Available from: https://pubmed.ncbi.nlm.nih.gov/6743732/
- Muysson M, Datta P, Rewers-Felkins K, Baker T, Hale TW. Transfer of Dicloxacillin into Human Milk. Breastfeed Med [Internet]. 2020 Jul 15 [cited 2020 Aug 30];bfm.2020.0156. Available from: https://www.liebertpub.com/doi/10.1089/bfm.2 020.0156
- Amir LH. ABM clinical protocol #4: Mastitis, revised March 2014. Breastfeed Med. 2014 Jun 1;9(5):239–43.
- Berens PD. Breast Pain: Engorgement, Nipple Pain, and Mastitis [Internet]. 2015. Available from: https://journals.lww.com/clinicalobgyn
- Citation NLM, Database L, Library N, Url B. Pip-tazo. Nih. 2018;(Md):3–5.
- Søg – Produktresuméer [Internet]. [cited 2020 Jun 14]. Available from: http://www.produktresume.dk/AppBuilder/sear ch?utf8=✓&id=&type=&q=piperacillin%2Ftaz obactam&button=Søg
- EMA. CHMP assessment report pursuant to Article 30 of Directive 2001 / 83 / EC , as amended for Tazocin and associated names INN : piperacillin-tazobactam Assessment Report as adopted by the CHMP with all information of a commercially confidential nature. 2011;44(February 2011).
- Metronidazol “B. Braun” – information til sundhedsfaglige – Medicin.dk [Internet]. [cited 2021 Mar 6]. Available from: https://pro.medicin.dk/Medicin/Praeparater/461 1#
- Citation NLM, Database L, Library N, Url B. Metronidazol. 2018;(Md):4–6.
- American Academy of Pediatrics Committee on Drugs: The transfer of drugs and other chemicals into human milk. Pediatrics. 1994;93(1):137–50.
- Chung AM, Reed MD, Blumer JL. Antibiotics and breast-feeding: A critical review of the literature. Pediatr Drugs. 2002;4(12):817–37.
- Mathew JL. Effect of maternal antibiotics on breast feeding infants. Postgrad Med J. 2004;80(942):196–200.
- Heisterberg L, Branebjerg PE. Blood and milk concentrations of metronidazole in mothers and infants. J Perinat Med. 1983;11(2):114–20.
- Dobiáš L, Černá M, Rössner P, Šrám R. Genotoxicity and carcinogenicity of metronidazole. Mutat Res Genet Toxicol. 1994;317(3):177–94.
- Søg – Produktresuméer [Internet]. [cited 2020 Jun 14]. Available from: http://www.produktresume.dk/AppBuilder/sear ch?utf8=✓&id=&type=&q=Metronidazol+B.+ Braun&button=Søg
- Database L. Naloxon. Nih. 2018;(Md):3–5.
- Kok THHG, Taitz LS, Bennett MJ, Holt DW. Drowsiness due to clemastine transmitted in breast milk. Lancet [Internet]. 1982 Apr;319(8277):914–5. Available from: https://linkinghub.elsevier.com/retrieve/pii/S01 40673682921894
- Ornoy A. Pharmacological Treatment of Attention Deficit Hyperactivity Disorder During Pregnancy and Lactation. Pharm Res. 2018;35(3).
- Database L. Clonidin. Nih. 2018;(Md):3–5.
- Capogna G, Celleno D. I.V. CLONIDINE FOR POST-EXTRADURAL SHIVERING IN PARTURIENTS: A PRELIMINARY STUDY. Vol. 71, British Journal of Anaesthesia. 1993.
