DASAIM – Dansk Selskab for Anæstesiologi og Intensiv Medicin
DCO – Dansk Center for Organdonation
DTS – Dansk Transplantationsselskab
Dansk Neurokirurgisk Selskab
Rekommandationen er senest opdateret i 2022 og udarbejdet af:




1. Del
Resumé
Udgangspunktet for denne rekommandation er at vejlede om, hvordan man udfører optimal donorterapi.
Rekommandationen kan downloades via Dansk Center for Organdonations app til IPhone og Android. App’en hedder National Guideline og er gratis at downloade. Rekommandationen inklusiv bilag ligger under punkt 6 i Guidelinen, og kan også tilgås via centrets hjemmeside organdonation.dk under National guideline.
Se i øvrigt actioncard (bilag1) og flowchart (bilag 2).
Indledning
I Danmark har der de seneste 5 år (2016-2020) i gennemsnit været 106 organdonorer årligt (Tal: 2020 – Dansk Center for Organdonation). Det svarer til ca. 30% af de potentielle donorer. Der er flere forskellige årsager til, at ikke alle potentielle donorer rent faktisk bliver donorer, f.eks. lægefaglige eller samtykkebetingede årsager. Potentielle donorer udgør ca 10% af alle dødsfald i Danmark.
De fleste organdonorer er indlagte på neurointensive afdelinger, men et stigende antal af do- norerne kommer fra øvrige intensivafdelinger (Tal: 2020 – Dansk Center for Organdonation).
I det følgende anvendes terminologien ”inkarceration” til beskrivelse af den kliniske hjerne- stammeherniering.
Ikke alle organer er egnet til transplantation. Det kan dels skyldes, at donor inden eller i forbin- delse med det aktuelle sygdomsforløb, har pådraget sig comorbiditet, men også, at organerne har taget skade af den hårde belastning, der ses i forbindelse med en inkarceration. En del af disse skader kan modvirkes eller modificeres ved korrekt behandling. I Danmark er der en ensartet og høj standard for donorterapi, og der udtages 3-4 organer per organdonor.
Når der i afdelingen ligger en patient, hvis tilstand må formodes at føre til hjernedød indenfor kort tid, skal mulighederne for donation altid overvejes jvf. vejledning om samtykke til trans- plantation fra afdøde personer og til transplantationsrelateret forskning.
Loven fastslår, at der skal foreligge tilsagn om organdonation, eller at de nærmeste pårørende skal give tilladelse til anvendelse af organerne (Sundhedsloven, nummer 546, juni 2005, afsnit XIII om ligsyn, obduktion og transplantation: § 53 stk. 2. 1 pkt.).
I retslægelige tilfælde, f.eks. traumepatienter, skal der indhentes tilladelse fra politiet. Retslæ- geligt ligsyn udelukker ikke, at organdonation kan finde sted.
Når patienten er erklæret hjernedød, skifter fokus fra behandling af et cerebralt problem til stabilisering og optimering af organfunktionen hos den potentielle donor.
I ventetiden mellem erkendelsen af, at man har en potentiel donor til samtykke er afklaret, skal nødvendig donorforberedende terapi opretholdes (actioncard, bilag 1), da man har pligt til at afklare donationspotentialet hos alle patienter, der forventes at dø inden for kort tid. Den do- norforberedende behandling sikrer optimal fremtidig funktion for recipienten og kan ses som en ultimativ form for respekt for den potentielle donor og dennes familie, fordi det involverer omhyggelig pleje af den potentielle donors organer.
Denne vejledning handler alene om donation efter hjernedød og hverken om donation fra levende organdonorer eller om donation efter cirkulatorisk død.
Dato for ikrafttrædelse
September 2021. Første udgave 2010, revideret i 2012 og i 2015.
Dato for revidering
3 år (2024)
Baggrund
A. Den potentielle organdonor
Vejledningen handler primært om behandling af voksne potentielle organdonorer. Det korte afsnit om pædiatriske donorer er opdateret (del 4).
Patienter, hvis tilstand må formodes at føre til hjernedød indenfor kort tid, er mulige orgando- norer. De patienter, der hyppigst bliver donorer, er patienter med intrakranielle blødninger, subarachnoidal blødning eller hovedtraumer. Patienter med hypoxiske hjerneskader i forbin- delse med hjertestop, hængning, medicinforgiftning og andet kan også blive organdonorer.
I alle tilfælde hvor der er kliniske tegn til, at patienten kan inkarcerere med fortsat fald i be- vidsthed og aftagende hjernestamme reflekser gælder, at livsforlængende behandling ikke må ophøre før mulighederne for donation er undersøgt. Tilkendegivelser fra patient (Organdonor- register samt anden mundtlig eller skriftlig tilkendegivelse) og pårørende skal undersøges (Sundhedsloven § 53). Derfor skal transplantations-koordinator eller koordinerende transplan- tationskirurg (Tx-koordinator) kontaktes. Tx-koordinator kontaktes altid før samtalen med de pårørende, da den potentielle donor kan være registreret med ja uden ønske om pårørendes accept eller med nej, hvilket i begge tilfælde indbefatter, at pårørende samtykke ikke skal ind- hentes, men pårørende blot informeres. Høj alder, hypertension, malignitet og infektion er ikke kontraindikation for donation.
I retslægelige tilfælde, fx. traumepatienter, skal der indhentes tilladelse fra politiet. Ovenstående er nærmere beskrevet i National Guideline for Organdonation.
B. Hjernedødsundersøgelse og organbevarende behandling
Når positiv tilkendegivelse om donation foreligger, kan undersøgelser påbegyndes.
Inden patienten er erklæret hjernedød, vurderes egnethed som organdonor. Dette foregår ved gennemgang af anamnesen og den aktuelle klinik. Når der er samtykke til organdonation fra patienten selv eller fra patientens pårørende, suppleres med specifikke undersøgelser, herun- der blodprøver, ekkokardiografi (EKKO) og computer tomografi (CT)/radiologi.
På det tidspunkt, hvor det er sandsynligt, at patienten er hjernedød og organdonation kan blive aktuel, må man ofte iværksætte tiltag for at opretholde normal organfunktion.
Der vil efterfølgende blive udført klinisk hjernedødsundersøgelse (1. og 2. hjernedødsunder- søgelse) og evt. foretaget neuroradiologisk vurdering (4 kars digital subtraktions arteriografi (opløbs a-grafi)) med henblik på konstatering af hjernedød. Første hjernedødsundersøgelse udføres mindst 6 timer efter sidste spontane vejrtrækning (1). Anden hjernedødsundersøgelse udføres minimum 1 time efter 1. hjernedødsundersøgelse er slut. Opløbs a-grafi udføres hos patienter, hvor den kliniske hjernedødsundersøgelse ikke kan gennemføres, hos patienten uden strukturel hjerneskade, eller hos børn < 1 år (flowchart, bilag 2).
Uden intensiv terapi vil hjernedød altid medføre kredsløbskollaps, normalt i løbet af 1-3 døgn (2).
Rekommandationen handler om alle tiltag, der kan optimere organfunktionen hos potentielle donorer, se også National Guideline for Organdonation.
C. Outcome
Outcome vurderes som antallet af transplantationsegnede organer på landsplan.
Dette kan dog ikke ses som et isoleret udtryk for effekt eller manglende effekt af aktuelle re- kommandation, men må ses i sammenhæng med øvrige tiltag for at optimere organtilgangen. I stedet finder vi det relevant at anvende kvalitetsmål (kriterier, standarder og indikatorer), f.eks.
- Andelen af donorer, der ikke har haft middel arterielt blodtryk (MAP) < 65 mmHg
- Andelen af donorer med plasma natrium (P-Na +) < 150 mmol/l
- Andelen af donorer, der er behandlet med noradrenalin i en dosis < 0,10 mikro- gram/kg/min i hele donorplejeforløbet
Formål med rekommandationen
At standardisere og fortsat forbedre organdonorterapi i Danmark med henblik på at øge antal- let af organer, der er egnede til transplantation.
Forfattere
Rekommandationen er i 2010 udarbejdet af Neuroanæstesiudvalget under Dansk Selskab for Anæstesi og Intensiv Medicin, revideret i 2012 og i 2015 i samarbejde med Dansk Transplan- tationsselskab og Dansk Neurokirurgisk Selskab.
Nærværende rekommandation 2021 er revideret af:
Overlæge, Ph.D. Karen-Lise Welling og overlæge, Ph.D. Tejs Jansen, Neurointensiv afsnit 6021, Afdeling for Bedøvelse og Intensiv behandling, Neurocentret, Rigshospitalet
Overlæge Pernille Haure, Neuro og Traume Intensivt Afsnit, Klinik Anæstesi, Aalborg Univer- sitetshospital.
Overlæge Mette Juul Koefoed, Intensiv Nord, Aarhus Universitetshospital
Overlæge Nikolaj Preus Hatting og afdelingslæge Kristian Nørholm Jensen, Neurointensiv af- deling, Odense Universitetshospital.
I de forrige udgaver har følgende læger deltaget: Overlæge Karsten Bülow, Odense, overlæge Inge Severinsen, Skejby, afdelingslæge Rikke Helsted, Rigshospitalet, overlæge Niels Juul, Århus.
Rekommandationen henvender sig til
Læger og sygeplejersker på intensivafdelinger, der beskæftiger sig med organdonation samt til anæstesilæger og – sygeplejersker, der deltager i organudtagningen.
2. Del
Informationssøgning
Der er søgt i PubMed, Cochrane og på www.uptodate.com. Søgeord:
Organ donor or organ donation/ organ don* Transpl*
Tissue don* Brain death Donor care
Hemodynamic OR haemodynamic Heart
Dopamine Dobutamine Epinephrine Norepinephrine Lactate OR lactic
Hypernatri* OR Sodium AND Liver Hormon*
Vasopressin Thyroid hormon* Steroid*
Lung
Lung injury Oxygen* PEEP
Mechanical ventilation Pediatric
Begrænsninger:
English Human
Kritisk litteraturgennemgang
Der findes kun få kontrollerede randomiserede studier på området. Evidensniveauet er lavt. Vi har derfor ved udarbejdelsen af rekommandationen støttet os til andre internationale vejled- ninger.
Tværfaglighed
Rekommandationen har oprindelig været i høring hos Dansk Neurokirurgisk Selskab og Dansk Transplantationsselskab.
Den er godkendt af Dansk Selskab for Anæstesiologi og Intensiv Medicin (DASAIM) 22.09.2010.
Revisionen har igen i 2021 været i høring hos Dansk Transplantationsselskab, Dansk Neuro- kirurgisk Selskab og er derefter igen godkendt af DASAIM.
3. Del
Behandling af den potentielle organdonor
Fysiologiske ændringer under inkarcerationsforløbet
Kredsløb
Trods intensiv behandling og pleje vil der efter en kortere periode, hyppigst 1-3 døgn, ske en nedbrydning af organerne som følge af hjernedøden, og hjertet vil standse (3). Der er dog rapporteret om fortsat hjerteaktion op til 8 dage efter hjernedød.
Hjernedød skyldes ophørt cerebral cirkulation som følge af forhøjet intrakranielt tryk. Efterhånden som det intrakranielle tryk stiger, progredierer hjernestammeiskæmien i rostral- caudal retning og blodtrykket stiger i et forsøg på at opretholde cerebralt perfusionstryk.
Midthjerneiskæmi resulterer i parasympatisk aktivering og sinus bradykardi ses hos ca. 20% af patienterne. Efterfølgende pontin iskæmi resulterer i sympatisk stimulation med deraf føl- gende hypertension. Det kliniske billede med bradykardi og hypertension betegnes ofte Cushing refleks.
Yderligere iskæmi i det kardiovaskulære center i medulla oblongata og i vaguskernen resulte- rer i ubalanceret sympatisk stimulation og tab af baroreceptorreflekser, såkaldt ’autonom storm’ eller ’sympatisk storm’. Den autonome storm er donors kompensatoriske respons til øget ICP med truende inkarceration. Blodtryk (BT) og puls stiger voldsomt i denne fase, der oftest varer i 5-15 minutter. Der kan dog ses protraherede forløb af denne fase af op til mange timers varighed. Den vasokonstriktoriske effekt af den autonome storm kan kompromittere or- ganperfusionen væsentligt. Der kan herunder opstå subendocardiel iskæmi og venstresidig inkompensation, hvilket kan medvirke til lungeødem. I forbindelse med inkarcerationen ses endvidere et inflammatorisk respons, som muligvis bidrager til kapillærlækage (4).
Studier tyder på bedre organoverlevelse ved behandling af den autonome storm (5). Den kom- plette herniering med iskæmi ned til medulla spinalis følges af et gradvist tab af al sympatisk aktivitet og deraf følgende vasoplegi, der fører til hypotension og kardiovaskulært kollaps. Di- abetes insipidus bidrager ofte til den hæmodynamiske instabilitet. Hæmodynamisk instabilitet er den helt dominerende udfordring i donorplejen, med hypotension hos omkring 80% af do- norerne.
Lunger
Som ovenfor omtalt ses i forbindelse med inkarcerationen og den øgede sympaticus tonus påvirkning af det pulmonale kredsløb med øget hydrostatisk tryk og risiko for neurogent lun- geødem. Dette kan forstærkes af et inflammatorisk respons med deraf følgende kapillærlæ- kage, ”dobbelt-hit” mekanisme (4,6).
Samtidig kan ses følger efter mekanisk ventilation, aspiration, pneumoni, ARDS, traumer, mul- tiple blodtransfusioner og den væskebehandling, der er givet i det intensive behandlingsforløb med organbevarende formål.
Derfor kan der være behov for øget positivt slutekspiratorisk tryk (PEEP) og ilttilskud i inspira- tionsluften.
I forbindelse med apnøtest kan ses kredsløbsinstabilitet og desaturation, sidstnævnte bl.a. betinget af atelektasedannelse.
Af disse årsager anvendes lungerne i dag fra en mindre del af donorerne, i 2019 var det lige under 30% (Tal: 2020 – Dansk Center for Organdonation).
Der findes i dag mulighed for at evaluere og rekonditionere lungerne efter udtagningen ved hjælp af maskinel ventilation, oxygenering og perfusion (EVLP, ex vivo lung perfusion), hvilket gør en større del af de udtagne lunger anvendelige til transplantation.
Hormonelle forandringer
Under inkarcerationsforløbet indtræder en række hormonelle forandringer, der afspejler mang- lende funktion af hypofysen. Baglappens funktion mistes tidligt i forløbet, mens hypofysens forlapsfunktion er bevaret lidt længere. Residual hypofysær funktion (via arteriel forsyning via gren fra arterie carotis externa) ses hos mange organdonorer.
Antidiuretisk hormon og diabetes insipidus:
Tidligt, undertiden inden inkarcerationen, ses hos op til 80% af donorer diabetes insipidus som følge af manglende arginin-vasopressin (antidiuretisk hormon (ADH)) (7,8). Tilstanden er led- saget af hypovolæmi, hyperosmolalitet og hypernatriæmi og er klinisk karakteriseret af store diureser, lav urin-Na+ og lav urin vægtfylde. Den farmakologiske behandling af manglende vasopressin afhænger af den kliniske status (7). Vasopressin virker ved at bindes til 3 distinkt forskellige G-protein-koblede vasopressin receptorer: V1 receptorer på glat muskulator i kar- rene medierer vasopressin effekten ved at kontrahere blodkarrene; V2-receptorer på basola- terale membran af det distale nefron kontrollerer aquaporiner (vand kanaler) i nyrens samlerør og har en antidiuretisk effekt; V3-receptorer i hypofyseforlappen virker synergistisk med korticotropin-frigørende hormon og regulerer adrenocorticotropin hormon (ACTH)-produktio- nen.
Vasopressin administration er associeret med forbedringer i blodtryk og reducerer behovet for katekolamin vasopressorer og inotropika (8).
Selv donorer, der ikke har tegn til diabetes insipidus ser ud til at have ændret baroreflex-me- dieret sekretion af arginin-vasopressin som respons til hypotension og reduceret cirkulerende volumen. Tidlig behandling med vasopressin eller syntetiske vasopressin analoger (fx synte- tisk argipressin (Empressin R)) kan reetablere hæmodynamisk stabilitet og hindre organskade. Hypernatriæmi (P-Na+ >155 mmol/l) som følge af ubehandlet diabetes insipidus har i visse studier været associeret med postoperativ graft-dysfunktion efter levertransplantation. Hyper- natriæmi er måske blot en markør for suboptimal donorpleje og ikke skadelig i sig selv, da hverken lever eller nyregraft funktion er påvist nedsat hos recipienter der har modtaget organer fra donorer med hypernatriæmi efter 1 år (7). Nær normale P-Na+-værdier (135-155 mmol/l) er dog et rimeligt behandlingsmål (3).
Thyreoidea hormoner
Ændringer i thyreoidea aksen ses hyppigt efter hjernedød. Betydningen heraf er ikke afklaret. Klassisk er lave værdier associeret til nedsat hypofysefunktion. Mange hjernedøde har imid- lertid normale thyreioideahormoner (7). De forandringer, der sker tyder ikke på at årsagen relaterer til thyreoidea, men ligner dem man ser hos almene intensive patienter nemlig en re- duktion i fri triiodthyronin (T3) koncentration, mens thyreoidea stimulerinde hormon (TSH) og tetraiodthyronin (T4) niveauer er variable (9,10). Manglende T3 er associeret med kompromit- teret cellulær metabolisme og lactatacidose. Hypothyreoidisme er associeret med reduceret kardiel energireserve og -funktion. Tilførsel af thyreoideahormon har ikke vist at øge antal transplantationsegnede hjerter. Behandling med thyreoideahormoner er ikke en del af almin- delig intensiv terapi. Tilførsel af thyreoideahormon er baseret på observationelle studier, og der er ikke grundlag for en anbefaling til hæmodynamisk optimering af donor. Fordele og ulem- per ved thyreoidahormon tilførsel er dog i tæt balance (3,11).
Insulin og blodglucose
Der ses et fald i insulinniveauet og insulinfølsomheden efter inkarcerationen (12). Dette fører til intracellulær energidepletering med ledsagende anaerob metabolisme og acidose. Hy- perglycæmi forværres desuden ved stress og brug af glucoseholdige infusioner. Hyperglyk- æmi kan behandles med insulininfusion ligesom hyperosmolalitet og osmotisk diurese fore- bygges. Blodsukker (BS) er aldersafhængigt og afspejler kulhydrat metabolismen. Større BS udsving skal undgås, ligesom kalium holdes i normalområdet. Brug afdelingens sædvanlige retningslinje (3,13).
Binyrebarkhormoner
Endelig ses manglende ACTH. Et signifikant fald i cortisolniveauet, der potentielt kan medføre nedsat stressrespons, har dog ikke kunne påvises (14). Ved hjernedød sker en opregulering af proinflammatoriske og immunologiske mediatorer, og der er tendens til hæmodynamisk in- stabilitet (8). Steroid har potentielt fordelagtige antiinflammatoriske og immunmodulatoriske virkninger. Tilførsel af corticosteroider synes i observationelle studier effektivt i form af bedret organoverlevelse og funktion. Randomiserede studier har dog ikke kunnet genfinde dette (15,16). Der er lav evidens for at anbefale corticosteroider hos donorer, der kræver vasoaktiv behandling. Anvendelsen af lav- versus højdosis steroid gør næppe en forskel hvad angår mængden af anvendte og transplanterede organer (7,17).
Lever og tyndtarm
Der findes ikke humane studier, der omhandler ernæring af donor eller understøtter det ratio- nelle i at fortsætte med enteral ernæring af hensyn til tarmmucosa. Der findes heller ikke stu- dier, der indikerer, at bevarelsen af leverens glycogendepot er af betydning for levergraft funk- tionen under iskæmi i tiden mellem udtagning og transplantation.Tab af vagus tonus efter hjer- nedød forstyrrer sandsynligvis tarm transittiden og absorptionen af næringsstoffer (11). Om- vendt er translokation af bakterier en årsag til bakteriæmi eller sepsis.
Termoregulation
Som en konsekvens af inkarceration ophører også kroppens temperaturregulation, som styres fra hypothalamus. Den manglende regulation kan resultere i hypertermi (2,12), men oftest vil donor være hypotherm, hvilket forværres af manglende evne til at generere temperaturstigning ved shivering og vasokonstriktion. Den kliniske hjernedødsundersøgelse forudsætter en ker- netemperatur på > 35° C. Svær hypotermi er endvidere forbundet med en række systemiske bivirkninger som kardiel dysfunktion, arytmier og koagulopati. Mild hypotermi (34-35 °C) er vist at forbedre nyre graft funktionen (18) og anbefales i nogle guidelines efter hjernedødsdiagno- sticeringen (3), men anbefales i Danmark kun hvis nyrerne anvendes alene, da virkningen på graftfunktionen af de øvrige organer endnu ikke er tilstrækkelig undersøgt.
Koagulation
Koagulationsforstyrrelser ses ofte. Traumatiseret og nekrotisk hjernevæv udskiller trombo- plastin (cortikalt parenchym har et særligt højt indhold af tissuefactor) og kan i værste fald udløse dissemineret intravaskulær koagulation (DIC). Tendensen til koagulopati forværres ved eksisterende blødningstendens, hypotermi og acidose (19). Er donor multitraumatiseret, kan massiv blødning fra andre læsioner medføre transfusionsudløste koagulationsproblemer.
Monitorering
Alle potentielle organdonorer udstyres/monitoreres med:
- Hjerterytme – skopovervågning
- Centralvenøs iltsaturation (ScvO2) – anlæggelse af 3-lumen centralt vene kateter (CVK). Hvis der ikke allerede er anlagt et, skal det anlægges i højre jugularis interna Allerede anlagt CVK bibeholdes
- Minimum 2 gode perifere v.- adgange, hvis muligt
- Perifer iltsaturation (SpO2) – perifer oxygensaturationsmåler
- Invasivt blodtryk – arteriekanyle (beliggenhed underordnet)
- Timediureser – kateter á demeure (KAD)
- Central temperaturmåling
Blod- og urinprøver i donationsforløbet
- Kontrol af arterieblodgas (ABG) med P-Na+, P-K+ og BS hver time.
- Kontrol af nyretal hver time eller efter behov
- Kontrol af koagulationstal efter behov
- Urin-stix – og ved proteinuri udføres albumin/creatinin ratio akut på kateterurin
Behandling
Generelt
Behandlingsprincipperne med en hurtig og målrettet behandlingsindsats gør sig i høj grad gæl- dende hos organdonorer, da deres tilstand kan ændre sig uhyre hurtigt. Derfor er det også altid muligt at få hjælp i donationsforløbet.
Når transplantationscentret har vurderet, at patienten umiddelbart er egnet som donor, herun- der at der ikke er nedlagt forbud mod organdonation, koordinerer de, at en erfaren specialud- dannet intensiv sygeplejerske fra en af de neurointensive afdelinger med særlig kompetence inden for organdonation kommer ud på intensivafdelingen, hvor forløbet foregår, og hjælper i donationsforløbet. Det er målet i alle forløb, at udrykningssygeplejersken sendes ud, når der er sikre inkarcerationstegn. Hjælpen er gratis for intensivafdelingen (Se punkt 4 i National Guideline for Organdonation). Desuden er det også muligt at rådføre sig med transplantations- centrets læger via Tx-koordinator.
Multidisciplinær briefing og checklister med behandlingsmål har vist, at organer kan optime- res under donorplejen, mens terapier hos recipienter har minimal effekt på organets funktion (20).
Kredsløb
Målet for den hæmodynamiske behandling er sikring af normovolæmi samt justering af vaso- aktive stoffer og inotropika med henblik på at sikre normalt afterload og optimalt hjerte minut- volumen. Det skal helst ske uden anvendelse af store doser inotropika, som øger hjertets ilt- forbrug og depleterer hjertet for energireserver. Det kan være en fordel at anvende stoffer, man har i afdelingen, og som man har erfaring med (7,14,21)
Bradykardi
Da donor efter incarcerationen er denerveret, er der ikke effekt af atropin (10), hvorfor bety- dende bradykardi, hvor der indtræder hypotension, skal behandles med isoprenalin (konfere- res med Tx-koordinator).
Hypertension og sympatisk storm
Behandling af hypertension anbefales påbegyndt ved MAP > 90 mmHg eller systolisk BT > 160 mmHg. Den sympatiske storm er som regel kortvarig (minutter til < 1 time) og efterfølges oftest af hypotension. Der er ikke enighed om den optimale behandling af den sympatiske storm, men behandling er væsentlig for at undgå belastning af hjerte og lunger.
Ideelt anvendes en antihypertensiv behandling med så kortvarig virkning som muligt, f.eks.
- Esmolol (betablokker med kort halveringstid 9 min og varighed på 20-30 min (21)): 0,1-0,5 mg/kg/bolus langsomt i.v., efterfulgt af infusion med 50-300 mikrogram/kg/min (se vejledning).
Alternativt, hvis dette ikke forefindes i afdelingen (ikke prioriteret rækkefølge):
- Natriumnitroprussid 0,5-5,0 mikrogram/kg/min. Arteriole T ½ 2 min. Kan med- føre shuntning med deraf følgende pulmonale problemer.
- Remifentanil (opioid). Vil på grund af den korte T ½ på 3-10 min. ikke forsinke den kliniske hjernedødsundersøgelse. Videnskabelig dokumentation mangler, og effekten er ikke altid overbevisende, men Remifentanil er umiddelbart tilgængeligt på alle inten- sive
- Labetolol 5-20 mg/bolus v., givet med 10-20 minutters mellemrum, op til 200 mg. Pro- blemet er lang halveringstid (T ½ 4 timer) og efterfølgende risiko for hypotension og muligvis primært graftsvigt efter hjertetransplantation som følge af bradyarytmier
- Nitroglycerin Venedilatator med T ½ på 1-3 min. Kan medføre hypotension og overhydrering, derfor ikke optimalt hos potentielle lungedonorer – men findes på mange intensive afdelinger og kan være et sidste valg. Ved høje doser (>2 mikro- gram/kg/min) skiftes til natriumnitroprussid.
Hypotension
Der stiles mod MAP > 65 mmHg (og diureser).
Behandlingen af hypotension er vasoaktiv behandling og væsketerapi, oftest simultant, idet en af årsagerne til hypotension er vasoplegi. Normovolæmi, om end dårligt defineret, er målet.
Væskebehandling er en fin balance mellem tilstrækkelig organperfusion og risiko for overload af lungerne. Dette skal opvejes mod behandling med større doser vasopressorer og inotropika, der øger hjertets iltbehov.
Vurdering af effekten af hypotensionsbehandlingen baseres på en kombination af klinik, MAP, laktat, diureser og ændringer i ScvO2, ultralydsbaseret vurdering af hjertets fyldning samt må- ske central venøst tryk (CVP). Det er vores opfattelse, at CVP er en dårlig markør for volu- menstatus (22), men mange referencer angiver stadig CVP som parameter og stiler mod CVP 6-10 mmHg. Måling af hjertets minutvolumen, slagvolumen og andre hæmodynamiske para- metre kan, hvor indiceret, udføres med den metode, afdelingen har rutine i at anvende og et indexeret (dvs per m2 kropsoverflade) hjerteminutvolumen på >2,4 L/min/m2 tilstræbes (21).
Volumenterapi baseres på krystalloid, f.eks. NaCl og/eller Ringer Acetat/Ringer Lactat.
Ved behov for kolloid anbefales human albumin 5-20%, men nyere undersøgelser tyder på, at anvendelsen er kontroversiel. Anvendelse af syntetiske kolloider anbefales ikke. Er syntetisk kolloid tidligere anvendt, diskvalificerer det ikke patienten fra at være donor (8). Hydro- xylethylstivelse er associeret med tidlig dialyse efter transplantation (23).
Udover klinikken kan serielle værdier af ScvO2 være vejledende, om end brugen af ScvO2 ikke er valideret hos donorer og ofte stiger efter inkarcerationen, da hjernen ikke længere perfun- deres (24).
Der gives blod på sædvanlig indikation, jævnfør Sundhedsstyrelsens retningslinjer.
Der er ikke evidens for optimalt hæmoglobinniveau hos donorer. I den nyeste amerikanske konsensusrapport nævnes, at hæmoglobin omkring 4,3 mmol/l (7 g/dl) anbefales til andre pa- tientkategorier (3,8).
Al blod i Danmark er i dag leukocytfiltreret. Men selvom leukocytindholdet er under 1 Mio. celler pr. blodportion, kan disse teoretisk give anledning til falsk positive reaktioner i de meget føl- somme polymerase chain reactions, (PCR)-reaktioner, som anvendes ved vævstypebestem- melsen af donor. Blodprøver til HLA-typebestemmelse bør derfor så vidt muligt udtages inden transfusion af donor og før eventuel indgift af methylprednisolon, der hos ustabile donorer al- lerede gives efter, at samtykke er indhentet. Plasma anvendes ikke som volumen terapi og blodprodukter undlades i fravær af klinisk blødning. Trombocytkoncentrat gives først, når trom- bocytter falder under 10 mia/L (3) eller når koagulationsspecialist anbefaler det på baggrund af clot undersøgelser som fx tromboelastografi (TEG) eller rotational tromboelastometri (RO- TEM).
Hvis donor efter adækvat volumensubstitution samt korrektion af acidose, anæmi, hypoxi og elektrolytter fortsat er hypotensiv overvejes valget af vasopressorbehandling. Donorpatienten vil altid have en grad af vasoplegi på baggrund af tabet af sympaticustonus.
Om vasopressin til behandling af hypotension er mere fordelagtigt end anvendelsen af kate- kolaminer hos donorer vides ikke, men det er et logisk stof at anvende. Dopamin var tidligere førstevalg hos donorer på grund af dets kombinerede inotrope og vasoaktive effekt, men der er ikke sufficiente data til at anbefale dette frem for andre vasopressorer. På baggrund af den udtalte alfa-receptor stimulerende effekt af noradrenalin og metaoxedrin er der risiko for øget lungekapilærpermeabilitet samt vasokonstriktion af tarmarterier og koronararterier. Katekola- miner, især dopamin, har immunmodulerende egenskaber, som muligvis svækker effekten af opreguleringen af den proinflammatoriske cytokinkaskade (21). Behandling med dopamin hos donoren er associeret med hurtigere alveolær væske clearance og reduceret dialysebehov efter transplantation (8,25). Lav dosis dopamin (4 mikrog/kg/min) reducerede signifikant dialy- sebehovet hos recipienten (26). I nyere guideline anbefales, at dopamin slet ikke anvendes (3). Det er kontroversielt, om høj dosering af vasoaktive stoffer giver dårligere graftfunktion ved hjertetransplantation. Der gives lavest mulig dosis af hensyn til hjertets egnethed til trans- plantation.
Oftest anvendes allerede de vasoaktive stoffer, der er rutine i afdelingen. Ved behov for større doser katekolaminer (f.eks. noradrenalindosis > 0,10 mikrogram/kg/min) kan tillægges vasop- ressin, hvis dette er tilgængeligt. Der gives infusion 0,5-4 IE/time (8,21)
Ekkokardiografi (EKKO) kan udføres tidligt i forløbet med henblik på vurdering af hæmodyna- mikken. Lige efter inkarcerationen vil denne med stor sandsynlighed være abnorm, specielt hvis syre-base balance, normalisering af elektrolytter og hæmodynamisk stabilitet endnu ikke er opnået.
Hvis ejection fraction (EF) er < 40%, kan der, når patienten senere er optimeret kredsløbs- mæssigt, laves ny EKKO med henblik på vurdering af hjertets egnethed til organtransplanta- tion. Sidstnævnte vurdering skal foretages af kardiologisk speciallæge.
Såfremt EKKO viser utilfredsstillende pumpefunktion under pågående infusion med esmolol, kan dette evt. pauseres kortvarigt, mens ny EKKO foretages.
Undersøgelser tyder på, at yngre hjerter med venstre ventrikel dysfunktion kan genvinde nor- mal funktion over tid hos donor og efter transplantation også i recipienten.
Hvis ekkokardiografi viser tegn på nedsat myokardiekontraktilitet, startes behandling med inot- ropi. Her kan anvendes dobutamin eller adrenalin efter afdelingens vanlige forskrifter. Også her gives lavest mulige dosis, der medfører MAP > 65 mm Hg og acceptable fysiologiske vær- dier.
Laktatstigning tolkes som tegn på hypoperfusion, som forsøges behandlet. Rutinemæssig måling af kardielle biomarkører anbefales ikke (3).
Ved EF < 40% overvejes cardiac output monitorering efter afdelingens sædvanlige standard (27). Der er ikke evidens for, at pulmonalis kateter er bedre end andre former for cardiac output monitorering af donorer (2) og pulmonalis kateter anbefales ikke (3).
Vedrørende hormonterapi, se under endokrinologisk.
Koronarangiografi kræver transport ud af intensiv, findes ikke i alle centre og er ressourcekræ- vende. Rutinemæssig koronarangiografi anbefales ikke hos yngre patienter, men hos patienter
> 50 år eller ved tilstedeværelse af risikofaktorer vil det ofte blive efterspurgt. Hvis donor på grund af tilstedeværelse af risikofaktorer for koronarsygdom skal have lavet koronar angiografi (KAG) med kontrastindgift, anbefales N-acetylcystein indgift før og efter af hensyn til nyrefunk- tionen ikke længere.
Hjertestop
Det er udvalgets opfattelse, at hjertestopbehandling som udgangspunkt bør initieres ved hjer- testop hos potentielle organdonorer.
Hvis hjertestoppet indtræffer, før hjernedødsdiagnosen er stillet, behandles efter vanlige ret- ningslinjer.
Hvis hjertestoppet indtræffer efter, at hjernedødsdiagnosen er stillet, bør behandlingen påbe- gyndes, men en konkret lægefaglig vurdering vil afgøre varigheden og omfanget af behandlin- gen. En iskæmiperiode med heraf følgende organskade kan forringe chancerne for et vellykket donationsforløb.
Der findes meget lidt litteratur og ingen juridisk regulering på området.
En rapport baseret på interviews med personale på de danske neurointensive afdelinger, har sat fokus på de etiske problemstillinger i forbindelse hermed. Undersøgelsen viser, at der er forskel på, om man finder hjertestopbehandling acceptabel, afhængigt af, hvornår i forløbet, hjertestoppet indtræffer. Et centralt dilemma er på én gang at udvise respekt for den døde krop og samtidig efterkomme den døde og/eller de pårørendes ønsker. Læs undersøgelsen her.
Beslutningen om behandling ved hjertestop bør være diskuteret med de pårørende og med personalet.
Pulmonalt
Generelt anbefales:
- Normoventilation (PaCO2 4,7-5,5 kPa, evt. højere afhængig af donors comorbiditet og pH 7,35-7,45).
- Lavest mulige iltfraktion (FiO2) der giver PaO2 > 9 kPa. PEEP > 8 cm H2 Undgå hy- peroxi (PaO2 >16 kPa). SpO2 kan variere afhængig af pH, men hvis pH er stabil kan den givne SpO2, der giver en PaO2 på 9-12 kPa anvendes som behandlingsmål.
- Inden påbegyndelse af hjernedødsundersøgelsen skal den potentielle donor være
- Respirator associeret pneumoni (VAP)-profylakse med hovedgærde eleveret 30°, suf- ficient cuff-tryk.
- Venderegime, hver 2. time.
- Rekruttering ved behov efter afdelingens
- Efter apnoetest i forbindelse med hjernedødsundersøgelsen anbefales Se tjeklisten til diagnostik af hjernedød her.
- Bronkialt toilette med sugning på indikation, saltvandsinhalationer.
Specielt ved forventet lungedonation
- Lungeprotektivbehandling med lave tidalvolumina 5-7 ml/kg og PEEP > 8 cm H2O eller lavest muligt, samt inspiratiorisk plateau tryk < 25 cm H2O og driving pressure (diffe- rencen mellem in- og ekspiratorisk tryk) < 15 cm H2O er en strategi, der kan øge antallet af lunger, der accepteres til transplantation.
- Efter sugning eller respirator frakobling hos potentielle lungedonorer skal rekrutteres efter afdelingens
- Undgå
- Overvej, om vasopressor-/inotropistøtten skal øges på bekostning af en mulig kardiel påvirkning.
- Antibiotika konfereres med Tx-koordinator. Som hovedregel fortsættes allerede indledt Der gives ofte profylaktisk meropenem, hvis der ikke er igang- værende antibiotikabehandling.
- Anvend ikke inhalations beta-agonist behandling rutinemæssigt, men kun på
- Diagnostisk bronkoskopi anbefales til potentielle lungedonorer (3), men undgå skylning med større
- For ikke at fjerne surfactant anbefales at undgå sugning med mindre, der er større mængder eller obstruerende
Med indførelsen af ex-vivo-lunge-perfusion (EVLP) er der mulighed for at teste og optimere donorlungerne, selv om de umiddelbart ikke opfylder iltningskravene efter konventionelle kri- terier. Det bør drøftes med Tx-koordinator, der rådfører sig med specialister.
Den optimale lungedonor er yngre end 55 år, har normal billeddiagnostik (røntgen af thorax/CT thorax), er AB0 kompatibel, PaO2/FiO2> 300 mm Hg (40 kPa) ved PEEP 5 cm H2O og FiO2 1,0, har mindre end 20 pakkeår i anamnesen, hverken tidligere thoraxtraume, kardiopulmonal kirurgi eller aspiration i anamnesen og intet synligt purulent sekret ved bronchoscopi udført forud for udtagning af lungerne og fravær af bakterier ved mikroskopi af sekretet (8,28). Ho- vedproblemet ved at benytte lunger fra donorer med rygning i anamnesen ud over 20 pakkeår er muligheden for transmission af bronkogen cancer til recipienten.
Ofte udføres en oxygen test for at afgøre, om lungerne er egnede til donation. Den potentielle donor præoxygeneres i 3 min med FiO2 på 1.0 og 5 PEEP, og PaO2 måles. Hvis PaO2 er >300 mm Hg (= PaO2 > 40 kPa), betragtes lungerne i mange centre som egnede til donation.
Kriterierne for den optimale lungedonor er overordentlig restriktive og mere liberale kriterier vil i nogle tilfælde kunne accepteres. Alle potentielle donorer bør drøftes med Tx-koordinator.
Renalt, væske og elektrolytter
Normovolæmi tilstræbes med henblik på:
- MAP > 65 mm Hg
- TD > 1 ml/kg
- Lav vasopressor dosis (f.eks noradrenalin < 0,10 mikrogram/kg/min).
- Albumin:kreatinin ratio ved proteinuri eller for at detektere mikroalbuminuri hos poten- tielle nyre donorer med type 1 eller 2
- Elektrolytter holdes som udgangspunkt indenfor normalområdet, ligeså magnesium, fosfat og calcium (21).
Hypernatriæmi (P-Na+ > 155 mmol/l) ses hyppigt ved hjernedød og skyldes først og fremmest diabetes insipidus og forstærkes af NaCl-indgift. Mange patienter er også blevet behandlet med hyperton NaCl i den sidste periode af aktiv behandling. Ved diabetes insipidus stiger P- Na+ ofte meget hurtigt. Hypernatriæmi har tidligere været opfattet som en risiko for svær lever- graftdysfunktion/grafttab, men dette ser ud til at kunne undgås, hvis hypernatriæmien korrige- res før organdonationen (20).
Til behandling af hypernatriæmi anvendes primært vand i sonden og 5% glukose i.v. evt Rin- gers væske (Natrium indhold 130 mmol/L) og evt. desmopressin (Minirin) (se endokrinologisk). Vær opmærksom på og korrigér plasma kalium (P-K+), -fosfat og -magnesium, der ofte er på- virkede i forbindelse med inkarceration.
Diuretika har normalt ingen plads i donorterapien. Mannitol er kontraindiceret, da det inducerer osmotiske diureser. Vedrørende væsketerapi i øvrigt, se kredsløb.
Gastrointestinalt og lever
- Parenteral ernæring Enteral ernæring fortsættes, men i meget lav dosering (10-20 ml/t).
- Ulcusprofylakse fortsættes, hvis der er en
Potentielle leverdonorer skal have udført CT-abdomen, ligesom der også skal udføres CT- thorax. Der udføres tomskanning samt arteriefase fra diaphragma til under leveren og hos donorer >50 år, venefase i hele abdomen og thorax, hos donorer <50 år venefase i hele ab- domen.
Endokrinologisk
Diabetes insipidus: Ved stigende TD > 4 ml/kg/t, lav urin-Na+ (< 20 mmol/L) (evt kan måles urin-vægtfylde (< 1,005)) samt stigende P-Na+ (op mod eller >150 mmol/l) gives vasopressi- nanalogen desmopressin (Minirin) 0,5-1 mikrogram i.v. ved behov. Titreres til effekt vejledt af TD, urin-Na+ eller urin-vægtfylde og P-Na+. Typisk er behovet 1 mikrogram hver 6 time. Fore- findes desmopressin til i.v.-brug ikke, kan alternativt anvendes nasal spray, 10-20 mikrogram eller smelt tablet 60-120 mikrogram.
Argipressin (Empressin) anvendt til kredsløbsstabilisering har ligeledes en antidiuretisk effekt og desmopressin og vasopressin kan benyttes samtidig hos den kredsløbsustabile patient med hypernatriæmi (8). Hos patienter, der er kredsløbsustabile, anbefales vasopressin til behand- ling af diabetes insipidus. Hos kredsløbsstabile patienter, anbefales desmopressin.
Vejledende BS-niveau: BS 6-10 mmol/l, reguleres efter afdelingens vejledning.
Selv om der ikke med sikkerhed har været effekt af glucocorticoider på graftfunktionen, anbe- fales det hos hæmodynamisk ustabile donorer at give høj dosis glucocorticoider for at optimere den hæmodynamiske stabilitet (3).
Allerede efter indhentet samtykke kan tages blodprøver og derefter gives hos hæmodynamisk ustabile donorer methylprednisolon 15 mg/kg i.v., derefter samme dosis i.v. hver 24. time. Methylprednisolon gives ideelt efter udtagning af blod til typebestemmelse.
Behandling med thyreoideahormon understøttes ikke af litteraturen (11,21,29).
Temperaturregulation
Der tilstræbes en donortemperatur på 36-37,5°C (normotermi) og altid > 35°C indtil 2. hjerne- dødsundersøgelse er afsluttet og pt. erklæret hjernedød. Ved hypertermi køles til normotermi.
Hvis det alene er nyrerne, der skal anvendes til transplantation anbefales mild terapeutisk hy- potermi (34°C < temperatur < 36°C), i modsat fald anvendes normotermi (3,18).
Måltemperaturen opnås enten spontant eller aktivt efter afdelingens rutine, fx ved brug af luft- tæppe eller noninvasivt køleapparatur og kolde væsker. Dette kan kombineres med medicinsk behandling med paracetamol evt. fordelt på 8 doser for at undgå for store fluktuationer i tem- peraturen. Alternativt kan anvendes i.v. paracetamol som kontinuerlig infusion.
På grund af de mange bivirkninger til svær hypotermi er det vigtigt at forebygge temperaturfald under 34°C.
Koagulation
Koagulationsstatus kontrolleres. Ved klinisk blødning tilrådes udvidet monitorering. Overordnet mål er blødningskontrol.
Frisk frosset plasma og trombocytkoncentrat gives i henhold til Sundhedsstyrelsens retnings- linjer, ideelt vejledt af TEG eller ROTEM svar og i samråd med lokale koagulationsspecialister. Lav molekylær heparin behandling seponeres.
Behandlingstiltag i øvrigt
Seponér al unødvendig medicin (f.eks. antiepileptica, smertestillende, laksantia, tarmmotili- tetsfremmende medicin, øjendråber, antihypertensiva, diuretika). Allerede igangsat antibioti- kabehandling beholdes.
Supplerende undersøgelser
I det følgende er anbefalingerne til supplerende undersøgelser for at afklare donors egnethed samlet:
- Kan udføres tidligt i forløbet med henblik på vurdering af hæmodynamikken. Hvis EF er < 40% kan der, når patienten er optimeret kredsløbsmæssigt, laves ny EKKO med henblik på hjertets egnethed til organtransplantation. Såfremt EKKO viser utilfredsstillende pumpefunktion under pågående infusion med esmolol, kan dette evt. pauseres kortvarigt, mens ny EKKO foretages. EKKO skal foretages af kardiologisk speciallæge.
- Rutinemæssig KAG anbefales ikke hos yngre patienter, men hos patienter > 50 år eller ved tilstedeværelse af risikofaktorer, vil det ofte blive efterspurgt. Hvis donor på grund af tilstedeværelse af risikofaktorer for koronarsygdom skal have lavet KAG med kon- trastindgift, anbefales N-acetylcystein indgift før og efter af hensyn til nyrefunktionen ikke længere.
- Diagnostisk bronkoskopi anbefales til potentielle lungedonorer, men undgå skylning med større
- Ofte udføres oxygentest for at afgøre, om lungerne er egnede til donation. Læs mere om fremgangsmåden ved oxygentesten i afsnittet ‘Pulmonalt’ under forventet lungedo-
- Alle donorer skal have udført CT-scanning af thorax og Der udføres tomskanning samt arteriefase fra diaphragma til under leveren og hos donorer > 50 år, venefase i hele abdomen og thorax, hos donorer < 50 år venefase i hele abdomen.
- Albumin:kreatinin ratio ved proteinuri eller for at detektere mikroalbuminuri hos poten- tielle nyre donorer med type 1 eller 2
Spinalreflekser
Nogle donorer kan have ret udtalte spinalreflekser, der kan virke meget foruroligende på på- rørende og personale (30). Forklar de pårørende om mulige reflekser. Donor kan relaxeres efter 2. hjernedødsundersøgelse.
Autotrigning
Påvisning af fravær af spontan respiration ved apnøtesten er en del af den kliniske hjerne- dødsundersøgelse. Hos nogle donorer kan autotrigning forekomme (1,31,32). Autotrigning vil sige, at respiratoren leverer et åndedrag på en assisteret ventilationsform i fravær af spontan respiration. Fænomenet autotrigning kan forvirre og forlænge donationsforløbet. Det er derfor vigtigt at kende til og kunne diagnosticere og afhjælpe problemet.
Potentielle årsager til autotrigning kan være eksterne – f.eks. kondensvand i respiratorslanger, tubelækage, eller patientrelaterede, hyppigst kardielle oscillationer, sjældnere bronchopleurale fistler eller læk via pleuradræn (31). Afhængig af mistanken om årsagen må man checke sy- stemet for lækage, tømme slanger, vurdere røntgen af throrax samt forsøge at justere trigger modus fra flow til tryk-trigger (sat på -2 cmH2O) mv.
Klinisk effektivitet
Se formål + indikatorer.
Cost-effectiveness analyser
Nyretransplantation er den mest effektive behandling, der kan gives patienter med kronisk nyresvigt, og generelt set er der særdeles god økonomi i organtransplantation.
For hver transplanteret nyre sparer sundhedsvæsenet i alt ca. 2 Mio. kr. i dialyseudgifter m.m. over de følgende år, dertil kommer store forbedringer i såvel livskvalitet som overlevelse.
4. Del
Implementering
Vejledningen er godkendt af DASAIM og har været forelagt Dansk Transplantationsselskab og Dansk Neurokirurgisk Selskab. De donationsansvarlige nøglepersoner på intensivafdelingerne implementerer sammen med afdelingsledelserne vejledningen i praksis, ligesom Dansk Cen- ter for Organdonation indarbejder anbefalingerne i National Guideline.
Kvalitetskontrol – indikatorer
Se outcome.
Børn
Fra 2004 til 2021 har der gennemsnitligt været 3 pædiatriske organdonorer årligt (range 1-6) i alderen 0-17 år. De 50 donorer i perioden fordeler de sig således aldersmæssigt: I aldersgrup- pen 0-3 år var der 9 donorer, i aldersgruppen 4-9 år var der 8 donorer og de resterende 33 donorer var 10 år eller derover.
Litteraturen på området er sparsom (uptodate) (8,29,33). Udvalget anbefaler, at man behand- ler den pædiatriske donor efter de samme principper som den voksne organdonor, dog under hensyntagen til aldersrelaterede fysiologiske forhold.
Kun 40% af pædiatriske donorer udvikler klinisk diabetes insipidus (uptodate). Desmopressin kan gives i doser på 0,5 mikrogram/t i.v.som bolus eller infusion til timediureser er justeret ned til 2-4 ml/kg, se tabel 2.
Ved apnoetest hos børn skal man sikre sig, at ekspiration kan foregå uhindret, da der ellers kan opstå pneumothorax. I stedet for placering af et iltkateter i selve tuben, placeres derfor et højt flow af ilt via maske over tuben, eller man kan tilslutte en Beneviniste ventil direkte på tuben med et iltflow på 12-14 L/min. Det medfører CPAP på ca 5 cm og ingen risiko for at overskydende luft ikke kan undslippe.
For at stille hjernedødsdiagnosen hos børn under 1 år kræves, at den kliniske hjernedødsun- dersøgelse suppleres med 4-kars angiografi. De organisatoriske forhold ved organdonation er ens for børn og voksne.
Tabel 1. Pædiatriske donor behandlingsmål
| Alder | Blodtryk systolisk
(mmHg) |
Blodtryk diastolisk
(mmHg) |
| Neonatal | 60-90 | 35-60 |
| Baby (6 mdr.) | 80-95 | 50-65 |
| Småbørn (2 år) | 85-100 | 50-65 |
| Skolealder (7 år) | 90-115 | 60-70 |
| Unge børn (15 år) | 110-130 | 65-80 |
Ref. (8)
Tabel 2. Pædiatrisk hormonel resuscitation
| Stof | Dosis | Adm. | Bemærkning |
| Desmopressin | 0,5 mikrogram/t | i.v. | Halveringstid 75-90 min, titrer til at nedsætte diurese til 3-4 ml/kg/t; kan være gavnlig hos patienter med på-
gående koagulopati |
| Arginin vasopressin | 0,5 millioner IE/kg/t | i.v. | Halveringstid 10-20 min, titrer til at
nedsætte diureser til 3-4 ml/kg/t, hy- pertension kan ses |
| Methylprednisolon | 20-30 mg/kg | i.v. | Væskeretention; glucoseintolerance ses |
| Insulin | 0,05-0,1 IE/kg/t | i.v. | Titrer til at kontrollere blodsukker til 6-10 mmol/L; monitorer for at undgå
hypoglykæmi |
Ref. (8)
Referenceliste
- Arbour RB. Confounding factors in brain death: Cardiogenic ventilator autotriggering and implications for organ transplantation. Intensive Crit Care 2012;28(6):321–8.
- Wood KE, McCartney J. Management of the potential organ donor. Transplant Rev. 2007;21(4):204–18.
- Ball IM, Hornby L, Rochwerg B, Weiss MJ, Gillrie C, Chassé M, et al. Management of the neurologically deceased organ donor: A Canadian clinical practice guideline. Cmaj. 2020;192(14):E361–9.
- Zanden JEV, Jager NM, Daha MR, Erasmus ME, Leuvenink HGD, Seelen Complement therapeutics in the multi-organ donor: Do or don’t? Front Immunol. 2019;10(FEB):1–14.
- Audibert G, Charpentier C, Seguin-Devaux C, Charretier PA, Grégoire H, Devaux Y, et al. Improvement of donor myocardial function after treatment of autonomic storm during brain Transplantation. 2006;82(8):1031–6.
- Meyfroidt G, Baguley IJ, Menon DK. Paroxysmal sympathetic hyperactivity: the storm after acute brain injury. Lancet Neurol [Internet]. 2017;16(9):721– Available from: http://dx.doi.org/10.1016/S1474-4422(17)30259-4
- Opdam HI. Hormonal Therapy in Organ Donors. Crit Care Clin [Internet]. 2019;35(2):389–405. Available from: https://doi.org/10.1016/j.ccc.2018.11.013
- Kotloff RM, Blosser S, Fulda GJ, Malinoski D, Ahya VN, Angel L, et al. Management of the Potential Organ Donor in the ICU: Society of Critical Care Medicine/American College of Chest Physicians/Association of Organ Procurement Organizations Consensus Statement [Internet]. Vol. 43, Critical Care Medicine. 2015 [cited 2019 Dec 8]. 1291–1325 p. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25978154
- Bugge JF. Brain death and its implications for management of the potential organ donor. Acta Anaesthesiol Scand [Internet]. 2009 Nov;53(10):1239–50. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19681785
- Meyfroidt G, Gunst J, Martin-Loeches I, Smith M, Robba C, Taccone FS, et Management of the brain-dead donor in the ICU: general and specific therapy to improve transplantable organ quality. Intensive Care Med [Internet]. 2019 Mar 11;45(3):343–53. Available from: http://link.springer.com/10.1007/s00134-019-05551-y
- Chamorro-Jambrina C, Muñoz-Ramírez MR, Martínez-Melgar JL, Pérez- Cornejo MS. Organ donor management: Eight common recommendations and actions that deserve reflection. Med Intensiva (English Ed. 2017;41(9):559–68.
- Kumar L. Brain death and care of the organ donor. J Anaesthesiol Clin 2016;32(2):146–52.
- Gunst J, Van den Berghe G. Blood glucose control in the intensive care unit: Benefits and Semin Dial. 2010;23(2):157–62.
- Patel MS, Abt PL. Current practices in deceased organ donor management. Curr Opin Organ 2019;24(3):343–50.
- Dupuis S, Amiel JA, Desgroseilliers M, Williamson DR, Thiboutot Z, Serri K, et Corticosteroids in the management of brain-dead potential organdonors: A systematic review. Br J Anaesth. 2014;113(3):346–59.
- Pinsard M, Ragot S, Mertes PM, Bleichner JP, Zitouni S, Cook F, et al. Interest of low-dose hydrocortisone therapy during brain-dead organ donor resuscitation: The CORTICOME Crit Care. 2014;18(4).
- Dhar R, Cotton C, Coleman J, Brockmeier D, Kappel D, Marklin G, et al. Comparison of high- and low-dose corticosteroid regimens for organ donor J Crit Care [Internet]. 2013;28(1):111.e1-111.e7. Available from: http://dx.doi.org/10.1016/j.jcrc.2012.04.015
- Niemann CU, Feiner J, Swain S, Bunting S, Friedman M, Crutchfield M, et Therapeutic Hypothermia in Deceased Organ Donors and Kidney-Graft Function. N Engl J Med. 2015;373(5):405–14.
- Maegele M, Schöchl H, Menovsky T, Maréchal H, Marklund N, Buki A, et al. Coagulopathy and haemorrhagic progression in traumatic brain injury: advances in mechanisms, diagnosis, and management. Lancet Neurol. 2017;16(8):630–47.
- Martin-Loeches I, Sandiumenge A, Charpentier J, Kellum JA, Gaffney AM, Procaccio F, et al. Management of donation after brain death (DBD) in the ICU: the potential donor is identified, what’s next? Vol. 45, Intensive Care 2019.
- Korte C, Garber JL, Descourouez JL, Richards KR, Hardinger K. Pharmacists’ guide to the management of organ donors after brain death. Am J Heal 2016;73(22):1829–39.
- Marik PE, Baram M, Vahid B. Does central venous pressure predict fluid responsiveness? Chest [Internet]. 2008;134(1):172–8. Available from: http://dx.doi.org/10.1378/chest.07-2331
- Patel MS, Niemann CU, Sally MB, De La Cruz S, Zatarain J, Ewing T, et al. The Impact of Hydroxyethyl Starch Use in Deceased Organ Donors on the Development of Delayed Graft Function in Kidney Transplant Recipients: A Propensity-Adjusted Am J Transplant. 2015;15(8):2152–8.
- Powner DJ, Doshi PB. Central venous oxygen saturation monitoring: Role in adult donor care? Prog 2010;20(4):401–6.
- Schnuelle P, Mundt HM, Drüschler F, Schmitt WH, Yard BA, Krämer BK, et Impact of spontaneous donor hypothermia on graft outcomes after kidney transplantation. Am J Transplant. 2018;18(3):704–14.
- Schnuelle P, Benck U, Yard BA. Dopamine in transplantation: Written off or comeback with novel indication? Clin Transplant [Internet]. 2018 Jul [cited 2018 Oct 16];32(7):e13292. Available from: http://www.ncbi.nlm.nih.gov/pubmed/29790212
- Powner DJ, Darby JM, Kellum JA. Proposed treatment guidelines for donor Prog Transplant [Internet]. 2004 Mar;14(1):16–26; quiz 27–8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/15077733
- Shemie SD, Ross H, Pagliarello J, Baker AJ, Greig PO, Brand T, et al. Organ donor management in Canada: Recommendations of the forum on Medical Management to Optimize Donor Organ Potential. Cmaj. 2006;174(6 ):13–30.
- Gupta R, Dhanani S. Endocrine Considerations of the Pediatric Organ J Pediatr Intensive Care. 2016;05(04):205–12.
- Hosseini MS, Ghorbani F, Ghobadi O, Najafizadeh K. Factors affecting the occurrence of spinal reflexes in brain dead cases. Exp Clin Transplant. 2015;13(4):309–12.
- Mojtabaee M, Sadegh Beigee F, Ghorbani F. Deceased Organ Donation From Pediatric Donors: Does the Literature Really Help Us? Implication for More Powerful Guidelines. Transplant Proc [Internet]. 2017 Oct 1 [cited 2018 Oct 16];49(8):1708–11. Available from: https://sciencedirect.com/science/article/pii/S0041134517305651?via% 3Dihub
Actioncard
Se bilag 1
Tidslinje for organdonationsforløbet
Se bilag 2
Blandevejledninger1
Vasopressin – se bilag 3 Esmolol – se bilag 4
1Blandevejledningerne er udarbejdet ved hjælp af Region Hovedstadens Apotek
ACTIONCARD
Donorterapi
| CIRKULATION | |
| Overordnede mål | · MAP > 65 mm Hg (evt. højere, hvis eksisterende hypertension)
· Normovolæmi · Normoxi · Serielle målinger af ScvO2, mål: ScvO2 > 65 og laktat < 2,5 mmol/l |
| Bradykardi | · Hvis betydende bradykardi og påvirket MAP: Isoprenalin |
| Sympatisk storm og systolisk BT > 160 mmHg eller MAP > 90 mmHg | · Esmolol (Brevibloc): 0,1-0,5 mg/kg/ som bolus langsomt i.v., fulgt af in- fusion med 50-300 mikrogram/kg/min. (se vejledning)
Alternativt: · Natriumnitroprussid: 0,5-5,0 mikrogram/kg/min · Remifentanil infusion · Labetalol: 5-20 mg/bolus i.v., givet med 10-20 minutters mellemrum – op til 200 mg · Nitroglycerin infusion – op til 2 mikrogram/kg/min |
| Væsketerapi | · Krystalloider (NaCl og/eller Ringer’s Acetat/ -Lactat). Ved høj P-Na+: Vand i sonden eller 5% glucose i.v.
· Blodprodukter: Efter sædvanlige retningslinjer · Så vidt muligt først transfusion efter udtagelse af blodprøve til HLA-be- stemmelse og kun ved aktiv blødning. |
| Vasopressor be- handling | · Noradrenalin
· Ved Noradrenalin dosis > 0,10 mikrogram/kg/min kan Vasopressin (Empressin) 1 IE i.v. efterfulgt af infusion 0,5-4,0 IE/t tillægges. (se vej- ledning) |
| Inotropi behand- ling | · Dobutamin eller adrenalin
· Evt. EKKO vejledt |
| Nedsat EF | · EF < 0,40: Cardiac output monitorering efter lokale retningslinier over- vejes |
| RESPIRATION | |
| Ventilation Oxygenering | · Normoventilation og pH 7,35-7,45
· PaO2 9-12 kPa og SAT > 95 %. Undgå hyperoxi (PaO2 >16 kPa) |
| Bronchier | · Trachealsugning
· Evt. bronkoskopi og BAL – undgå skylning med større volumina · Vending hver 2. time · Hovedgærdet eleveret 30° · PEEP > 8 cm H2O · Rekruttering efter afdelingens retningslinier og efter apnøtest. |
| Specielt for Lun- gedonorer | · Oxygen test: Præoxygenering 3 min. med FiO2 1.0 og PEEP 5 cm H2O, hvorefter PaO2 måles. Er PaO2 > 300 mm Hg (= PaO2 > 40 kPa) betrag- tes lungerne ofte som egnede til donation.
· Aggressiv indsats med rekruttering efter hver afkobling fra respirator · Tidalvolumen 5-7 ml/kg, PEEP > 8 cm H2O eller lavest muligt · Inspiratorisk plateau pressure < 25 cm H2O · Driving pressure < 15 cm H2O · Diagnostisk bronkoskopi – undgå skylning med større volumina · Antibiotika konfereres med Tx-koordinator · Normohydrering (undgå overhydrering) |
| ENDOKRINOLOGISK | |
| Blodsukker | · BS 6-10 mmol/l
· Actrapidinfusion balanceres med glucoseindgift |
| Steroid | · Til hæmodynamisk ustabile donorer kan gives Methylprednisolon bolus 15 mg/kg efter samtykke og efter, at blodprøver er taget |
| Diabetes Insi- pidus | · Ved stigende TD > 4 ml/kg/t, lav urinvægtfylde < 1,005 eller lav U-Na+ < 20 mmol/L, samt stigende P-Na+ op mod eller > 150 mmol/l, gives Des- mopressin (Minirin) 0,5-1 mikrogram i.v. p.n. Titreres til effekt, ofte be-
hov for indgift ca. hver 6. time. Supplér med vand i sonden / 5% glucose i.v. |
| RENALT | |
| Diureser | · TD > 1 ml/kg |
| Elektrolytter | · 135 mmol/l < P-Na+ < 155 mmol/l
· P-K+ 4-4,5 mmol/l – kaliumindgift efter afdelingens vanlige retningslinier · Ioniseret calcium, se-fosfat og se-magnesium i normalområdet |
| Hypernatriæmi | · Balanceret væsketerapi med brug af vand i sonden og 5% glucose i.v.
· Se ovenfor under ”Endokrinologisk” |
| GASTROINTESTINALT | |
| Ernæring | · Enteral ernæring kan fortsættes, 10-20 ml/t. Parenteral ernæring stop- pes |
| TERMOREGULATION | |
| Temperatur | · Temperatur > 35°C (Mål 36-37,5°C)
· Såfremt det alene er nyrerne, der skal anvendes til transplantation, an- befales mild terapeutisk hypotermi efter hjernedødsdiagnosticeringen (34°C < temperatur < 36°C) |
| Regulering | · Varme/kolde væsker og varme/køletæppe m.m. |
| Hypertermi | · Ved hypertermi: Paracetamol. Aktiv køling efter afdelingens rutine |
| KOAGULATION | |
| Koagulopati | · Korrigeres i samråd med koagulationsspecialister |
| MEDICIN | |
| Medicinliste | · Al unødvendig medicin seponeres |
| Steroid | · Hæmodynamisk ustabile: Methylprednisolon 15 mg/kg, gentages hver
24. time |
| Antibiotika | · Fortsættes. Ved lungedonation konfereres med Tx-koordinator mhp. eventuel Meropenem |
| Tvivl | · Ved tvivl konfereres med Tx- koordinator |
2021 DASAIM, DCO, DTS, DNKS27
Bilag 2
Flowchart – Organdonation
Potentiel donor
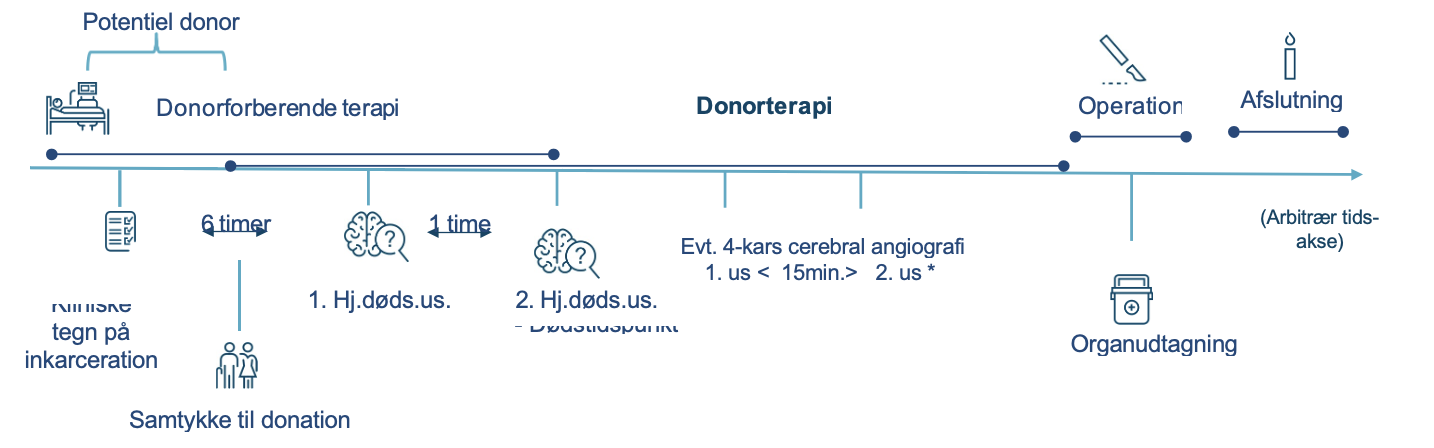
Betingelser
- Hjernelidelsen skal være utilgængelig for be- handling og vurderet som dødelig.
- For at den kliniske hjernedødsundersøgelse kan stå alene, er det en forudsætning, at der er tale om en storhjerne (supratentoriel) læsion.
- Storhjernelæsionen skal være strukturel og rumopfyldende samt påvist CT eller MR
- Er skaden alene infratentoriel, anoksisk eller is- kæmisk, eller er donor et barn < 1 år, skal den kliniske hjernedødsundersøgelse suppleres med 4-kars angiografi
- Hjernedødsundersøgelse
- Der skal være forløbet mindst 6 timer fra tab af bevidsthed og ophør af spontan respira-
- Niveauet af sovemidler/og eller muskelre- lakserende midler i blodet skal skønnes at være på et niveau, hvor det ikke vil kunne påvirke den kliniske undersøgelse.
- Tp > 35 grader, systolisk BT > 90 mmHg
- Andre årsager til bevidstløshed skal være udelukket
* Hvis 4-kars cerebral angiografi udføres, er dødstidspunktet tids- punktet for afslutningen på 2. angiografiske undersøgelse
| Indholdsstof:
Præparatnavn: Lægemiddeltype: Dispenseringsform: Styrke: |
Argipressin (argininvasopressin)
Empressin Antidiuretisk hormon Injektionsvæske 40 IE/2ml ~ 20 IE/ml |
|
| Indikation: (1, 2) | Anvendes til donorpatienter ved mangel på arginin vasopressin som følge af in- carceration og iskæmi af hypofyse/hypothalamus akse.
Anvendes kun til donorpatienter, som trods volumensubstitution og behandling med noradrenalin > 0,10 mikrogram/kg/min eller dopamin > 10 mikro- gram/kg/min fortsat er hypotensive, og hvor genesen formodes primært at være vasodilation.
For donorer med diabetes insipidus kan desmopressin tillægges vasopressin be- handlingen.
Virkningsmekanisme: Vasopressin virker på forskellige receptorer og udøver sin vasokonstriktoriske ef- fekt via V1-receptorerne. Derudover virker vasopressin antidiuretisk via V2-re- ceptorerne i de distale tubuli. Vasopressin virker endvidere i CNS på V3-recepto- rerne, hvor det har en regulerende effekt på adrenocorticotropisk hormon (ACTH). |
|
| Standarddosering: (1, 3) | Voksne:
Doseres individuelt tilpasset respons 0,5-4,0 IE/time. Ved manglende eller lang- somt indsættende effekt kan man forsøge bolus på 1 IE.
Børn: 0,5 mIE/kg/time |
|
| Håndtering: (4) | Opbevares i original emballage for at beskytte produktet mod lys. | |
| Adm. via: (3) | PVK: Ingen oplysninger | CVK: Ja |
| Tilberedning: (1, 3) | I.v. bolus: | Infusion: |
| Voksen:
1 IE kan gives som bolus ved mang- lende eller langsomt indsættende ef- fekt.
Bolusblanding: 0,5 ml arginin vasop- ressin sættes til 9,5 ml infusionsvæske (1 IE/ml). Der indgives 1 ml af bolus- blandingen svarende til 1 IE. |
Voksen:
Infusionsblanding: 2 ml (40 IE) tilsættes 98 ml infusionsvæske til en koncentra- tion på 0,4 IE/ml.
Infusionshastighed: 0,5 – 4 IE/time sva- rende til 1,25 ml/time – 10 ml/time
Maksimal koncentration: 1 IE/ml
Børn: Se nedenstående doseringstabel. |
|
| Kompatibilitet: (3, 4, 5, 6) | Blandes med: | Blandes ikke med: |
| Natriumklorid, isotonisk 9 g/l Glukose, isotonisk 55 g/l*) ref. 5+6 | Opløsninger af andre farmaka samt an- dre infusionsvæsker end de nævnte. | |
Arginin vasopressin IV-vejledning til: Rekommandationen. Behandling af organdonorer. Side 1 af 3
Udarbejdet af Region Hovedstadens Apotek, KFS, Rigshospitalet, november 2022
| Holdbarhed: (4) | Ved køleskabstemperatur: Anvendes straks | Ved stuetemperatur: Ikke relevant, Opbevares altid ved køleskabstempera- tur |
| Nyreinsufficiens: (3, 4) | Der er ingen oplysninger om dosisjustering | |
| Leverinsufficiens: (3, 4) | Der er ingen oplysninger om dosisjustering | |
| Monitorering: (2) | Voksne:
Monitorering af blodtrykket der skal stige til MAP > 60 mm Hg. Der henvises endvidere til vejledningen ”Rekommandation, Behandling af organdonorer”. Vejledningen kan findes på www.organdonation.dk |
|
| Bivirkninger: (4) | Overfølsomhedsreaktioner fra udslæt til urticaria til egentlig anafylaksi. |
| Kontraindikationer: (4) | Kendt allergi over for vasopressin. |
| Afdelingens egne noter | Obs. Maxdosis kan variere afhængig af indikation.
Dosis i denne vejledning er gældende for donorpatienter med manglende vas- opressin produktion grundet inkarceration. |
1: Kotloff et al; Management of the Potential Organ donor in the ICU: Society of Critical Care Medi- cine/American College of Chest Physicians/Association of Organ Procurement Organizations Consensus Statement; Crit Care Med 2015; 43:1291-1325
2: Rekommandation, Behandling af organ donorer; Dansk Center for Organdonation, DASAIM, Dansk Transplantationsselskab, Dansk Neurokirurgisk Selskab.
3: UptoDate.com
4: Produktresume, Empressin
5: Micromedex
6: Lægemiddelinformationen Medicininfo på Bispebjerg SAID-sag: RAP19-2885
Børne doseringstabel:
Der fremstilles en børnestamopløsning: 0,5 ml arginin vasopressin (20 IE/ml) tilsættes 9,5 ml natriumklorid. Stamopløsningen på 1 IE/ml fortyndes yderligere efter nedenstående tabel.
Infusionshastighed: 1 ml/time = 0,5 mIE/kg/time
| Vægt i kg | Antal IE vasopressin | Antal ml arginin vasopressin børnestamopløsning | Antal ml natriumklorid |
| 2 | 0,1 | 0,1 ml | 99,9 ml |
| 4 | 0,2 | 0,2 ml | 99,8 ml |
| 6 | 0,3 | 0,3 ml | 99,7 ml |
| 8 | 0,4 | 0,4 ml | 99,6 ml |
| 10 | 0,5 | 0,5 ml | 99,5 ml |
| 12 | 0,6 | 0,6 ml | 99,4 ml |
| 14 | 0,7 | 0,7 ml | 99,3 ml |
| 16 | 0,8 | 0,8 ml | 99,2 ml |
| 18 | 0,9 | 0,9 ml | 99,1 ml |
| 20 | 1,0 | 1,0 ml | 99,0 ml |
| 25 | 1,3 | 1,3 ml | 98,7 ml |
| 30 | 1,5 | 1,5 ml | 98,5 ml |
| Indholdsstof:
Præparatnavn: Lægemiddeltype: Dispenseringsform: Styrke: |
Esmolol
Brevibloc β-receptorblokerende middel Injektionsvæske og infusionsvæske 10 mg/ml. Injektionsvæske (hætteglas på 10 ml), infusionsvæske (250 ml pose) |
||
| Indikation:(1) | Anvendes til donorer med udtalt hypertension og takykardi (autonom storm eller sympatisk storm).
Da organdonorer i forbindelse med inkarceration ofte får udtalt hy- pertension og takykardi og derefter ofte ganske pludselig udvikler hypotension, kan der være behov for blodtrykssænkende behand- ling. Esmolol synes ideelt i denne sammenhæng, da det er en ultra- kortvirkende B-blokker til i.v. indgift. |
||
| Standarddosering:(1, 3, 5, 7, 8) | Voksne:
Initialdosis (bolus): 0,1-0,5 mg/kg
Vedligeholdelsesdosis: (infusion): 50-300 mikrog/kg/min. |
Børn:
Initialdosis (bolus): 0,1-0,5 mg/kg
Vedligeholdelsesdosis (infusion): 25-100 mikrog/kg/min herefter titreres op med 25-100 mikrog/kg/min til maks. 500 mikrog/kg/min. |
|
| Håndtering:(2,3) | Ingen særlige forholdsregler. | ||
| Adm. Via: (2,3,5,7,9) | PVK: Anbefales ej | CVK: Ja | |
| Tilberedning:(1, 2, 3, 5,
7, 9) |
I.V. bolus: | Infusion: | |
| 0,1-0,5 mg/kg gives som bolusin- jektion over 1 minut. Se dosering- stabel. | Esmolol infusionsvæske leveres klar til brug med en koncentration på 10 mg/ml
Infusionshastighed: Voksne: 50 – 300 µg/kg/min, gives via infusionspumpe, se doseringsta- bel for infusionshastighed.
Børn: 25-500 µg/kg/min, gives via infusionspumpe, se doseringstabel for infusionshastighed. |
||
| Kompatibilitet:(2,3,4) | Blandes med: | Blandes ikke med: | |
| Injektionsvæsken kan blandes med: Natriumklorid isotonisk 9 g/l Glukose isotonisk 55 g/l
Infusionsvæsken leveres klar til brug og bør ikke fortyndes yderli- gere. |
Opløsninger af andre farmaka, andre infusionsvæsker end de nævnte og natriumbikarbonatopløsninger og an- dre basiske opløsninger. | ||
| Holdbarhed:(2,3) | Ved køleskabstemperatur: 24 timer, men bør anvendes umiddelbart efter blanding. | Ved stuetemperatur: Må ikke opbe- vares i åbnet tilstand |
| Nyreinsufficiens: (2,3,5) | Udskilles 73-88% renalt. Plasmahalveringstiden er 9 min.
Ingen dosisjustering nødvendig ved nyreinsufficiens. Fjernes ikke ved dialyse, så supplerende dosis er ikke nødvendig. Halveringstiden for elimination kan forøges til ca. ti gange det normale, og plasmaniveauet kan være væsentlig højere hos patienter med nedsat nyrefunktion. |
|
| Leverinsufficiens: (2,3) | Ingen særlige forholdsregler. | |
| Monitorering: (1,5) | Voksne: Blodtryk og/eller MAP, der stiles efter at nedsætte det systoliske blodtryk til ca, 160 mm Hg eller MAP 90 mm Hg.
Børn: Pædiatriske donor behandlingsmål, se Rekommandation |
|
| Bivirkninger:(6) | Meget almindelige (> 10%): Hypotension.
Ikke almindelige (0,1-1 %): Angina pectoris, AV-blok, Bradykardi Ukendt hyppighed: Hjertestop, angioødem. |
|
| Kontraindikationer: (2,3) | – Overfølsomhed over for det aktive stof, et eller flere af hjælpestofferne el- ler andre betablokkere (der kan forekomme krydsoverfølsomhed mellem betablokkere) | |
| Afdelingens egne
noter |
Plasmahalveringstiden er 9 min. | |
1: Rekommandation, Behandling af organ donorer; Dansk Center for Organdonation, DA- SAIM, Dansk Transplantationsselskab, Dansk Neurokirugisk Selskab.
2: Produktresume for injektionsvæske 3: Produktresume for infusionsvæske
4: Handbook on Injectable Drugs, Trissel 5: uptodate.com
6: Pro.medicin
7: BNF for children, 2020-2021
8: The Teddy Bear Book (Pediatric injectable drugs), 10. Udgave 9: Legemidlertilbarn.no
Doseringstabeller: Se nedenfor
Doseringstabeller:
Bolus Esmolol dosis i mg og ml:
|
Vægt (kg) |
Dosis esmolol i mg |
Mængde esmolol i ml |
||
| 0,1 mg/kg | 0,5 mg/kg | 0,1 mg/kg | 0,5 mg/kg | |
| 4 kg | 0,4 | 2,0 | 0,04 | 0,2 |
| 5 kg | 0,5 | 2,5 | 0,05 | 0,25 |
| 6 kg | 0,6 | 3,0 | 0,06 | 0,3 |
| 7 kg | 0,7 | 3,5 | 0,07 | 0,35 |
| 8 g | 0,8 | 4,0 | 0,08 | 0,4 |
| 9 kg | 0,9 | 4,5 | 0,09 | 0,45 |
| 10 kg | 1,0 | 5,0 | 0,1 | 0,5 |
| 11 kg | 1,1 | 5,5 | 0,11 | 0,55 |
| 12 kg | 1,2 | 6,0 | 0,12 | 0,6 |
| 13 kg | 1,3 | 6,5 | 0,13 | 0,65 |
| 14 kg | 1,4 | 7,0 | 0,14 | 0,7 |
| 15 kg | 1,5 | 7,5 | 0,15 | 0,75 |
| 16 kg | 1,6 | 8,0 | 0,16 | 0,8 |
| 17 kg | 1,7 | 8,5 | 0,17 | 0,85 |
| 18 kg | 1,8 | 9,0 | 0,18 | 0,9 |
| 19 kg | 1,9 | 9,5 | 0,19 | 0,95 |
| 20 kg | 2,0 | 10,0 | 0,2 | 1,0 |
| 25 kg | 2,5 | 12,5 | 0,25 | 1,25 |
| 30 kg | 3,0 | 15,0 | 0,3 | 1,5 |
| 35 kg | 3,5 | 17,5 | 0,35 | 1,75 |
| 40 kg | 4,0 | 20,0 | 0,4 | 2,0 |
| 50 kg | 5,0 | 25,0 | 0,5 | 2,5 |
| 60 kg | 6,0 | 30,0 | 0,6 | 3,0 |
| 70 kg | 7,0 | 35,0 | 0,7 | 3,5 |
| 80 kg | 8,0 | 40,0 | 0,8 | 4,0 |
| 90 kg | 9,0 | 45,0 | 0,9 | 4,5 |
| 100 kg | 10,0 | 50,0 | 1,0 | 5,0 |
| 110 kg | 11,0 | 55,0 | 1,1 | 5,5 |
| 120 kg | 12,0 | 60,0 | 1,2 | 6,0 |
| 130 kg | 13,0 | 65,0 | 1,3 | 6,5 |
Infusionshastigheden af efterfølgende infusion af Esmolol infusionsvæske, 10 mg/ml (250 ml):
|
Vægt (kg) |
Infusionshastighed | ||||
|
25 µg/kg/min |
50 µg/kg/min |
75 µg/kg/min |
100 µg/kg/min |
300 µg/kg/min |
|
| 4 kg | 0,6 ml/time | 1,2 ml/time | 1,8 ml/time | 2,4 ml/time | 7,2 ml/time |
| 5 kg | 0,75 ml/time | 1,5 ml/time | 2,25 ml/time | 3,0 ml/time | 9,0 ml/time |
| 6 kg | 0,9 ml/time | 1,8 ml/time | 2,7 ml/time | 3,6 ml/time | 10,8 ml/time |
| 7 kg | 1,05 ml/time | 2,1 ml/time | 3,15 ml/time | 4,2 ml/time | 12,6 ml/time |
| 8 kg | 1,2 ml/time | 2,4 ml/time | 3,6 ml/time | 4,8 ml/time | 14,4 ml/time |
| 9 kg | 1,35 ml/time | 2,7 ml/time | 4,05 ml/time | 5,4 ml/time | 16,2 ml/time |
| 10 kg | 1,5 ml/time | 3,0 ml/time | 4,5 ml/time | 6,0 ml/time | 18,0 ml/time |
| 11 kg | 1,65 ml/time | 3,3 ml/time | 4,95 ml/time | 6,6 ml/time | 19,8 ml/time |
| 12 kg | 1,8 ml/time | 3,6 ml/time | 5,4 ml/time | 7,2 ml/time | 21,6 ml/time |
| 13 kg | 1,95 ml/time | 3,9 ml/time | 5,85 ml/time | 7,8 ml/time | 23,4 ml/time |
| 14 kg | 2,1 ml/time | 4,2 ml/time | 6,3 ml/time | 8,4 ml/time | 25,2 ml/time |
| 15 kg | 2,25 ml/time | 4,5 ml/time | 6,75 ml/time | 9,0 ml/time | 27,0 ml/time |
| 16 kg | 2,4 ml/time | 4,8 ml/time | 7,2 ml/time | 9,6 ml/time | 28,8 ml/time |
| 17 kg | 2,55 ml/time | 5,1 ml/time | 7,65 ml/time | 10,2 ml/time | 30,6 ml/time |
| 18 kg | 2,7 ml/time | 5,4 ml/time | 8,1 ml/time | 10,8 ml/time | 32,4 ml/time |
| 19 kg | 2,85 ml/time | 5,7 ml/time | 8,55 ml/time | 11,4 ml/time | 34,2 ml/time |
| 20 kg | 3,0 ml/time | 6,0 ml/time | 9,0 ml/time | 12,0 ml/time | 36,0 ml/time |
| 25 kg | 3,75 ml/time | 7,5 ml/time | 11,25 ml/time | 15,0 ml/time | 45,0 ml/time |
| 30 kg | 4,5 ml/time | 9,0 ml/time | 13,5 ml/time | 18,0 ml/time | 54,0 ml/time |
| 35 kg | 5,25 ml/time | 10,5 ml/time | 15,75 ml/time | 21,0 ml/time | 63,0 ml/time |
| 40 kg | 6,0 ml/time | 12,0 ml/time | 18,0 ml/time | 24,0 ml/time | 72,0 ml/time |
| 50 kg | 7,5 ml/time | 15,0 ml/time | 22,5 ml/time | 30,0 ml/time | 90,0 ml/time |
| 60 kg | 9,0 ml/time | 18,0 ml/time | 27,0 ml/time | 36,0 ml/time | 108,0 ml/time |
| 70 kg | 10,5 ml/time | 21,0 ml/time | 31,5 ml/time | 42,0 ml/time | 126,0 ml/time |
| 80 kg | 12,0 ml/time | 24,0 ml/time | 36,0 ml/time | 48,0 ml/time | 144,0 ml/time |
| 90 kg | 13,5 ml/time | 27,0 ml/time | 40,5 ml/time | 54,0 ml/time | 162,0 ml/time |
| 100 kg | 15,0 ml/time | 30,0 ml/time | 45,0 ml/time | 60,0 ml/time | 180,0 ml/time |
| 110 kg | 16,5 ml/time | 33,0 ml/time | 49,5 ml/time | 66,0 ml/time | 198,0 ml/time |
| 120 kg | 18,0 ml/time | 36,0 ml/time | 54,0 ml/time | 72,0 ml/time | 216,0 ml/time |
| 130 kg | 19,5 ml/time | 39,0 ml/time | 58,5 ml/time | 78,0 ml/time | 234,0 ml/time |
DASAIM – Dansk Selskab for Anæstesiologi og Intensiv Medicin DCO – Dansk Center for Organdonation
DTS – Dansk Transplantationsselskab DNKS – Dansk Neurokirurgisk Selskab
