Komfortstrategi
Målrettet behandling af gener forbundet med kritisk sygdom. 4. udgave 2023.
Godkendt Guideline møde januar 2024 og DASAIM maj 2024
Arbejdsgruppen har haft følgende sammensætning med repræsentation fra alle regioner:
Christina Ankjær Pedersen
Afdelingslæge, Klinisk Anæstesi
Aalborg Universitetshospital. Region Nord
Therese Simonsen Straarup
Overlæge, Operation og Intensiv
Regionshospitalet Viborg, Hospitalsenhed Midt. Region Midt
Helle Lykkeskov Nibro
Overlæge, Intensiv Nord.
Aarhus Universitetshospital. Region Midt
Susanne Iversen
Ledende Overlæge, Intensiv afsnit
Slagelse Sygehus, Region Sjælland
Hans Christian Toft Boesen
Overlæge, Anæstesiologisk Afdeling.
Sjællands Universitetshospital, Køge. Region Sjælland.
Stine Estrup Damby
Afdelingslæge. Intensiv terapi klinik 4131.
Rigshospitalet. Region Hovedstaden.
Lise Fonsmark
Overlæge, Intensiv terapi klinik 4131.
Rigshospitalet. Region Hovedstaden.
Helene Korvenius Nedergaard
Afdelingslæge. Bedøvelse og Intensiv.
Sygehus Lillebælt Kolding. Region Syddanmark.
Thomas Strøm
Professor. Bedøvelse og Intensiv.
Sygehus Sønderjylland.
Overlæge. Anæstesiologisk Intensiv afdeling V
Odense Universitetshospital. Region Syddanmark.
Introduktion
Med denne 4. udgave af ” Komfortstrategi – Målrettet behandling af gener forbundet med kritisk sygdom”, Dansk Selskab for Anæstesi og Intensiv Medicin (DASAIM), tilstræbes en samlet national vejledning i at behandle gener hos kritisk syge patienter. Vejledningen er ikke strikt bygget på GRADE. Evidens og baggrund herfor er omtalt i de enkelte kapitler. Vejledningen bør betragtes som et holdningspapir.
Samlet anbefaler arbejdsgruppen:
Anvendelse af sedativa til kritisk syge mekanisk ventilerede patienter bør minimeres eller helt undgås, hvor det er muligt, og i de øvrige tilfælde begrænses mest muligt mht. mængde og varighed af behandlingen.
Målet er en vågen, kommunikerende, relevant interagerende samt tidligt mobiliseret patient uden unødige gener.
Dette anbefales faciliteret gennem øget opmærksomhed på reversible årsager til stress og nedsat tolerance for given behandling og målrettet behandling af disse.
Denne målsætning vil være gældende for størstedelen af de patienter, som indlægges på intensivafdelinger i Danmark. Anvendelse af dybere sedation vil fortsat være indiceret til udvalgte patienter.
Beskrivelse
Der er evidens for, at sedation af kritisk syge patienter i respirator forlænger respiratortiden, indlæggelsestiden på intensiv afdeling og den samlede hospitalsindlæggelsestid. Angst, smerter og delirium er almindeligt forekommende, underrapporterede, indbyrdes forbundne og multifaktorielle tilstande, der hver for sig eller i kombination kan føre til nedsat tolerance/evne til at medvirke til mekanisk ventilation eller anden livsvigtig terapi. Imidlertid er disse tilstande helt eller delvist reversible og kan i mange tilfælde undgås ved målrettet behandling eller tidlig opmærksomhed på- og elimination af udløsende faktorer. Vi anbefaler en 7-trinsstrategi omfattende 6 områder for systematisk og struktureret screening, som bør gå forud for anvendelse af sedativa (7. trin).
Trin 1: Identifikation og behandling af smerter
Trin 2: Identifikation og behandling af angst
Trin 3: Identifikation og behandling af delirium
Trin 4: Identifikation og behandling af dyspnø
Trin 5: Identifikation og behandling af abstinens
Trin 6: Identifikation og facilitering af søvn
Trin 7: Sedation
Formål
- Sikre en ensartet dansk praksis af høj kvalitet vedrørende brug af sedativa hos kritisk syge patienter (i respirator) på danske intensivafdelinger.
- Lindre smerte, angst og ubehag med færrest mulige bivirkninger.
- Minimere det samlede forbrug af sedativa i forbindelse med kritisk sygdom.
- Minimere antallet af respiratordage og indlæggelsesvarighed i forbindelse med kritisk sygdom.
I det følgende beskrives de 7 trin i en hurtig gennemgang med henblik på et hurtigt overblik. Emnerne uddybes og nuanceres i de efterfølgende hovedkapitler.
Trin 1: Smerter
Smerter er hyppigt forekommende og underrapporterede blandt kritisk syge patienter på intensiv afdeling.
Screening
Bør ske dagligt og med validerede scoringsværktøjer.
Behandlingsmål
- Opnå tilpas smertelindring i hvile.
- Procedurerelaterede smerter bør behandles i et p.n.-regime med opioider.
- Undgå overdosering.
Valg af analgetika
Anbefalede analgetika omfatter primært opioider og perifert virkende non-opioide analgetika. Ved forekomst af neuropatiske smerter anbefales behandling med tricycliske antidepressiva eller antikonvulsiva, clonidin, perifer nerveblokade og/eller lav-dosis ketamin kan anvendes som adjuvans.
Fast, regelmæssig i.v. eller p.o. administration af opioider, suppleret med p.n. behandling af gennembrudssmerter, anbefales frem for kontinuerlig administration.
Abstinensprofylakse/opioidaftrapning.
I forbindelse med seponering af pågående opioidbehandling bør risikoen for udvikling af abstinens vurderes, og der bør tages stilling til observation og forebyggende foranstaltninger i form af gradvis aftrapning og evt. omlægning til p.o. terapi (Se afsnit ”opioid-abstinenser” i kap. ”Abstinenstilstande”)
(En mere detaljeret beskrivelse findes i kapitlet ”Smertebehandling”.)
Trin 2: Angst
Beskrivelse
Angst er en subjektiv oplevelse og beskrives bedst af patienten selv. Symptombilledet er varierende, med eller uden objektive fund og kan optræde alene eller som ledsagefænomen til smerter, abstinens, delir, dyspnø m.m.
Forekomst
Angst er hyppigt forekommende i forbindelse med kritisk sygdom. Tilstanden øger risikoen for nedsat tolerance for/accept af livsvigtig behandling, herunder respiratorterapi og ubehandlet risikeres øget brug af sedativa.
Forebyggelse
Forebyggelse bør ske ved at skabe informative, imødekommende, professionelle og rolige omgivelser, samt ved elimination eller behandling af potentielt udløsende faktorer (smerter, abstinens, delir, dyspnø m.m.)
Behandling
Behandlingen er primært non-farmakologisk i form af tryghedsskabende tiltag som verbalt og fysisk nærvær og elimination eller behandling af evt. udløsende faktorer. Ved akut behandlingsbehov anbefales benzodiazepin. Antipsykotika har alle angstdæmpende effekt og kan anvendes. I de tilfælde hvor angst optræder som ledsagefænomen til smerter, delirium, abstinenser, dyspnø m.m., målrettes behandlingen disse tilstande.
Patienter i kronisk benzodiazepinbehandling bør fortsætte denne.
(En mere detaljeret beskrivelse findes i kapitlet ”Angst”.)
Trin 3: Delirium
Beskrivelse
Intensivdelirium er en akut opstået, svingende ændring i bevidsthed og kognition under indlæggelse på intensiv afdeling. Der skelnes mellem hyperaktivt, hypoaktivt og blandet delirium. Tilstanden er særdeles ubehagelig for patienten men også meget vanskelig og udfordrende for personalet. Tilstanden medfører ofte nedsat kompliance til nødvendig behandling, er hyppigt forekommende, ofte vanskelig at erkende og formentlig underdiagnosticeret.
Disposition
En lang række disponerende faktorer er påvist. Nogle er præ-eksisterende (alder, alkohol, demens samt hypertension) og andre relateret til den kritiske sygdom (høj APACHE II-score, angst, koma, infektioner, metaboliske forstyrrelser, sedativa, opioider samt antal invasive adgange).
Screening og diagnose
Screening og diagnostik bør ske med validerede screeningsværktøjer, f.eks. ”CAM-ICU”.
Forebyggelse
Forebyggende non-farmakologiske foranstaltninger bør iværksættes hos disponerede individer.
Behandling
- Tilstanden er reversibel og afhænger af behandling af grundsygdommen.
- Non-farmakologisk behandling omfatter brug af audiovisuelle hjælpemidler, konkret og kortfattet kommunikation med kort tidshorisont, ro med fokus på døgnrytme, søvn og tidlig mobilisering.
- Farmakologisk behandling kan omfatte antipsykotika, evt. anxiolytika og ultimativt kortvarig sedation som en sidste udvej.
- Såvel non-farmakologisk som farmakologisk behandling er symptomatisk og har til formål at dæmpe frustration, angst og ledsagende agitation for dermed at bane vej for anden livsvigtig terapi.
(En detaljeret beskrivelse inklusive medicinske behandlingsforslag kan findes i kap. 3 ”Delirium”.)
Trin 4: Dyspnø
Dyspnø er en oplevelse af anstrengt vejrtrækning, lufthunger eller kvælning og er ofte associeret med en følelse af angst eller panik med nedsat accept af mekanisk ventilation til følge. Tilstanden er hyppigt forekommende blandt kritisk syge patienter. Dyspnø kan have organisk såvel som ikke-organisk grundlag. PaO2 og PaCO2 i blod kan være indenfor normalområdet.
Forebyggelse
Bør ske ved information, sikring af smertefrihed og tryghedsskabende foranstaltninger samt sikring af sufficient ilttilbud og kuldioxid udluftning, herunder løbende optimering af respiratorindstillinger.
Monitorering
Bør ske ved patientens selvrapportering og klinisk observation, herunder monitorering af syre-base status.
Behandling
Skal rettes mod udløsende årsager, herunder optimering af respiratorindstillinger. Opioider i små doser kan foruden analgetisk effekt også have lindrende effekt mod lufthunger.
(En mere detaljeret beskrivelse findes i kapitlet ”Dyspnø”, kapitel 4)
Trin 5: Abstinenser
Baggrund
Alkohol-, benzodiazepin- og opioidabstinenser er almindeligt forekommende på danske hospitaler.
Symptomerne er generelt uspecifikke og nærmere beskrevet i de respektive afsnit i hovedkapitlet.
Alkohol-abstinenser
Optræder tidligt efter fald i alkoholpromillen og er en potentielt livstruende tilstand. Tilstanden varer i de fleste tilfælde 1-3 døgn. Der skelnes mellem simpel abstinens (grad 1), truende delirium med hallucinationer på syn og hørelse (grad 2) samt delirium tremens med bevidsthedspåvirkning i form af konfusion (grad 3).
Abstinenskramper kan optræde samtidigt med øvrige abstinenssymptomer og optræder oftest indenfor 48 timers abstinens.
Monitorering og behandling
Screening og monitorering bør ske ved anvendelse af en valideret abstinensscore med regelmæssige intervaller. Brug af standardiserede behandlingsprotokoller og stram titrering af benzodiazepin eller barbiturat på baggrund af abstinensscoren reducerer behovet for respiratorterapi som følge af overdosering. Benzodiazepin anbefales som 1.valg grundet eksistensen af specifik antidot. Propofol kan anvendes i refraktære tilfælde, men kræver oftest intubation. Clonidin kan anvendes som adjuverende terapi, men har ikke dokumenteret effekt på abstinenskramper.
(En mere detaljeret beskrivelse findes i kapitlet ”abstinenstilstande”).
(Alkohol abstinens scorings-skema findes i ”værktøjskassen”).
Opioid-abstinenser
Opioid-abstinenssymptomer er uspecifikke, ubehagelige, men almindeligvis ufarlige.
Behandlingsstrategi
- Patienter i kronisk smertebehandling bør i forbindelse med indlæggelse fortsætte igangværende behandling eller overgå til andet opioid i ækvipotent dosering.
- For opioidnaive patienter som har været i højdosis behandling i mere end en uge aftrappes infusionen med max 10 % per dag.
- Alternativt skift til peroral behandling med opioid med lang halveringstid (f.eks. methadon).
- Clonidin kan bruges som adjuverende abstinensprofylakse i tillæg til opioid.
(En mere detaljeret beskrivelse findes i kapitlet ”Abstinenstilstande”).
Benzodiazepin-abstinenser
Forekommer blandt intensivpatienter efter ophør af kronisk behandling med benzodiazepin og efter brat seponering af benzodiazepin baseret sedation. Risikoen er størst efter længerevarende indgift (> 7 dage) i høj dosering. Symptomerne er som ved øvrige abstinenstilstande uspecifikke. Alvorligste symptomer er generaliserede krampeanfald og delirium.
Forebyggelse og behandling
Patienter i langtidsbehandling med benzodiazepin kræver gradvis og langsom dosisreduktion, ofte over flere måneder. Under indlæggelse bør vanlig benzodiazepin-behandling derfor fortsættes i ækvipotent dosering.
Efter langvarig sedation med midazolam til patienter i højrisiko gruppe foretages langsom aftrapning ved hjælp af peroral benzodiazepin med lang halveringstid (f.eks. lorazepam).
(En mere detaljeret beskrivelse findes i kapitlet ”Abstinenstilstande”)
Nikotin-abstinenser
Symptomerne er ufarlige og oftest milde. Rutinemæssig anvendelse af nikotinsubstitution kan ikke anbefales.
(En mere detaljeret beskrivelse findes i kapitlet ”Abstinenstilstande”)
Trin 6: Søvn- og døgnrytme-forstyrrelser
Søvn hos kritisk syge er en kompleks størrelse. Endvidere er søvn hos kritisk syge patienter vanskelig at monitorere. Der er dårlig korrelation mellem observeret søvn og egentlig søvn målt med polysomnografi.
Vanlige GABAA-receptor agonister som propofol og midazolam giver ikke en egentlig søvn, men hæmmer restituerende søvn. De bør undgås ud fra et søvnfremmende synspunkt. Dexmedetomidin kan muligvis fremme en naturlig søvn hos kritisk syge patienter.
En række farmaka, der fremmer søvn hos raske, kan anvendes hos intensivpatienter, men der mangler kliniske studier på denne patientgruppe.
Non-farmakologiske tiltag som ørepropper og ro omkring patienten bør tilstræbes. Forstyrrelser som følge af observations- eller plejemæssige opgaver på stuen bør begrænses mest muligt.
(En mere detaljeret beskrivelse findes i kapitlet ” Søvn”).
Trin 7: Sedation
Kritisk syge, mekanisk ventilerede patienter bør ikke sederes rutinemæssigt. Ukritisk brug af sedativa forlænger indlæggelsestiden på intensiv afdeling og tiden i respirator. Dyb sedation er kun sjældent absolut indiceret. Undtagelserne kan være tilstande med øget intrakranielt tryk, hypotermi behandling, kramper eller svær respirationsinsufficiens, særligt i tilfælde af brug af neuromuskulær blokade og bugleje-ventilation.
Terapimålet er derfor at patienten er vågen, komfortabel og kognitivt intakt med brug af mindst mulig sedativa. Dette opnås ved rutinemæssig screening for reversible årsager (smerter, angst, delir, hypoxi m.m.), og målrettet behandling af disse, hvis de er til stede. Hvis dette vurderes utilstrækkeligt, bør sedation overvejes.
Brugen af sedation bør være vejledt af specifikke mål for sedationsdybde ved brug af en valideret sedationsscore, og der bør udføres daglig standardiseret vækning ved en såkaldt ”Wake-up test” med revurdering af det fortsatte sedationsbehov.
Strategi
- Reversible årsager til stress og manglende komfort identificeres ved gennemgang af de ”6 trin” og målrettet terapi iværksættes.
- Ved utilstrækkelig effekt heraf påbegyndes sedation i mindst mulig dosering. Behandlingen bør være vejledt af journalført mål for sedationsdybde og løbende monitorering ved brug af valideret sedationsscore.
- Med mindre kontraindikationer foreligger bør iværksat sedation afbrydes dagligt med henblik på revurdering af fortsat sedationsbehov, ønsket sedationsdybde og dosisjustering.
Valg af sedativa: Lægemidler anvendt til sedation af kritisk syge patienter i respirator omfatter: Propofol, benzodiazepiner, opioid baseret analgosedation samt dexmedetomedin.
(En mere detaljeret beskrivelse findes i kapitlet. ” Sedation”).
Smertebehandling
Definition
Smerte defineres ifølge The International Association for the Study of Pain (IASP) som ”en ubehagelig sensorisk og emotionel oplevelse forbundet med aktuel eller potentiel vævsskade”. Definitionen indebærer således, at smerter kan optræde uden påviselig vævsskade, og understreger smerters subjektive natur, hvor oplevelsen ud over det sensoriske ligeledes rummer følelsesmæssige og kognitive komponenter1.
Forekomst og betydning
Smerter optræder hyppigt hos kritisk syge patienter indlagt på en intensiv afdeling. Der er registreret smerter hos mere end 70 % af hjertekirurgiske patienter under indlæggelse på intensiv afdeling. Smerterne optrådte især i forbindelse med vendinger og blev beskrevet som svære hos 41 % af disse2. I blandede populationer af medicinske og kirurgiske intensivpatienter er forekomsten af smerter opgjort til omkring 40 %. Udover smerter i hvile oplever mange patienter smerter relateret til diverse procedurer3. Smerter beskrives som et af de mest stressende og pinefulde symptomer under indlæggelse på en intensiv afdeling4,3. Angst, frygt, søvndeprivation, træthed og følelsen af tab af kontrol kan yderligere påvirke smertetærsklen og øge smerteopfattelsen.
Utilstrækkeligt behandlede smerter kan have negative følgevirkninger for patienterne, primært som følge af et accentueret stressrespons medførende bl.a. øget myokardielt iltforbrug, respiratorisk distress, nedsat vævsoxygenering, øget muskel-katabolisme og svækket immunrespons. Desuden kan ubehandlede smerter have alvorlige emotionelle og neuropsykologiske konsekvenser for kritisk syge patienter, herunder angst, depression, forringet søvn og øget risiko for PTSD4. Derudover kan kroniske smerter, defineret som smerter der ikke synes at have biologisk baggrund og som varer i mere end 3-6 måneder, forekomme efterfølgende5.
På den baggrund er det vigtigt, at forekomsten af smerter vurderes hos alle patienter med jævne mellemrum og at en passende behandling iværksættes.
Diagnosticering og monitorering
Den optimale vurdering af smerter opnås ved samtale med den vågne patient, men mange patienter på ITA er ikke i stand til at kommunikere deres oplevelse af smerter som følge af endotracheal intubation, sedation, ændret mental status, eller andre sygdomsrelaterede forhold. Det kan således være meget vanskeligt at vurdere smerteintensiteten, og det er vist, at observatør-baseret vurdering ofte vil underestimere problemet.
Systematisk og protokol-baseret smertevurdering og -behandling kan formentligt reducere brugen af sedativa, varighed af mekanisk ventilation, indlæggelsestid på ITA og smerteintensitet6.
Det anbefales derfor i internationale kliniske guidelines, at tilstedeværelsen og sværhedsgraden af smerter samt effekten af iværksat smertebehandling vurderes regelmæssigt vha. standardiserede smertescoringssystemer7.
Der findes forskellige metoder til vurdering af smerter hos ”vågne” patienter:
- Patientens egne oplysninger er den mest troværdige og valide metode.
- Numeric Rating Scale (NRS), 0-10 punkts skala, hvor 10 repræsenterer værst tænkelige smerter.
- Visual Analogue Scale (VAS), deskriptiv skala fra ”ingen smerte” til ”værst tænkelige smerter”.
Hos bevidsthedspåvirkede patienter, der ikke kan medvirke til en scoring, anbefales:
Critical-Care Pain Observation Tool (CPOT), et adfærdsscoringsredskab, der tager udgangspunkt i patientens ansigtsudtryk, bevægelser, compliance med respirator (intuberet) eller vokalisering (ekstuberet) og muskelspænding. Den højeste score er 8. En score på 3 eller derover er tegn på betydende smerte og bør som udgangspunkt lede til en form for intervention8,9.
Inddeling af smerter
Af hensyn til den bedst mulige smertebehandling kan det være hensigtsmæssigt at skelne mellem akutte vs. kroniske smerter og baggrunds- vs. procedurerelaterede smerter. Det er ligeledes vigtigt at være opmærksom på de forskellige smertetyper, nociceptive og neuropatiske, for at kunne vælge den bedst mulige behandling.
Akutte smerter kan være udløst af
- Den tilgrundliggende sygdom eller det traume, der har ført til indlæggelsen.
- Følge af invasive procedurer og kirurgi.
- Ubehag fra monitorerings- og behandlingsudstyr (katetre, dræn, NIV-maske, endotrachealtube mv.).
- Diverse plejeprocedurer (sugning, fysioterapi, sårskift, vending og mobilisation mv.).
- Længerevarende immobilitet.
Kroniske smerter i form af eksisterende smertevoldende sygdomme eller kronisk smertetilstand.
Baggrundssmerter defineres som en persisterende akut eller kronisk smertetilstand.
Gennembrudssmerter er en pludselig smerteforværring, som optræder hos patienter med baggrundssmerter på trods af smertebehandling. De kan opstå spontant, i relation til aktivitet, eller hvis virkningen af den medicin, som patienten får til behandling af baggrundssmerterne, ophører inden næste dosis, som udtryk for at doseringsintervallet er for langt.
Procedurerelaterede smerter
Der foretages mange smertevoldende procedurer under indlæggelse på en intensiv afdeling såsom anlæggelse af a-kanyle, fjernelse af pleuradræn og øvrige dræn, vending/lejring/mobilisering, trachealsugning, fysioterapi, sårskift mv.
Somatiske, nociceptive smerter udgår fra kroppens bevægeapparat. Smerterne optræder ofte i hvile, men kan også være relateret til belastning eller aktivitet. De er som regel konstant til stede, vellokaliserede og karakteriseret som trykkende, murrende, borende og undertiden stikkende.
Viscerale smerter er nociceptive smerter, der udgår fra de indre organer. De er mere diffuse og vanskeligere at lokalisere. Kan beskrives som trykkende, murrende og krampagtige. De kan ligeledes være konstant til stede, men er ofte periodiske og eventuelt kolikagtige. Er hyppigt ledsaget af autonome symptomer i form af kvalme, opkastninger, ventrikelaspirater, svedudbrud, blodtryks- og pulsfald og kan være ledsaget af reflektorisk muskelkontraktion i det smertende område. Viscerale smerter kan udløses af distension af hulorganer, kapselspænding (f.eks. leverkapsel), spasmer i glat muskulatur (kolikker, tenesmi), iskæmi og inflammation.
Neuropatiske smerter er defineret som smerter forårsaget af en læsion eller en sygdom i det somato-sensoriske nervesystem. Smerterne er spontane smerter med anfaldsvise smertejag. Beskrives som brændende, stikkende, sviende og jagende – som elektrisk stød – men kan også være dybe og murrende. Smerterne kan fremprovokeres ved berøring, og der kan være øget sensibilitet i form af dysæstesi (ubehagelig, ikke smertefuld følelse ved berøring), hyperalgesi (øget smerteoplevelse ved smertefuld stimulus) og allodyni (smerter fremkaldt af et normalt ikke-smertefuldt stimulus). Neuropatiske smerter ses typisk efter amputationer (fantomsmerter), ved herpes zoster både i den akutte fase og som postherpetisk neuralgi, ved forskellige former for polyneuropati (DM, alkoholisme, efter stråle- og kemoterapi, Guillan Barré og ICU-acquired weakness).
Farmakologisk behandling
Opioider
Virkningsmekanisme
Opioider virker via opioidreceptorer, my (μ-), kappa (қ-) og delta (δ-)receptorer, der findes både i CNS i stor koncentration og i de perifere væv, bl.a. i gastrointestinalkanalen og i plasma, hvorfra receptorerne kan rekrutteres til områder med inflammatoriske processer. Den farmakologiske virkning opstår ved binding af opioid til en eller flere opioidreceptorer og deres undertyper. Den analgetiske effekt er resultat af binding til især μ-receptorerne i CNS.
Indikationer
Anvendes på intensiv afdeling
- Som led i sedation.
- Til behandling af opioid følsomme smerter.
- Dyspnø, reducerer effektivt den subjektive følelse af lufthunger.
Da de enkelte præparater er forskellige med hensyn til anslagstider, virkningsvarigheder og muligvis bivirkningsprofiler, afhænger valget af præparat af stoffets farmakologiske egenskaber og potentielle bivirkninger (se ækvipotenstabel).
Hyppigst forekommende bivirkninger
- CNS-påvirkning: Sedation, delirium, hallucinationer, eufori og konfusion. Ofte udtryk for overdosering. Problemet kan reduceres ved omhyggelig dosisjustering. Mindsker dyb søvn og REM-søvn.
- Respirationsinsufficiens: Alle opioider giver dosisafhængig respirationsinsufficiens, omend der hurtigt udvikles tolerance for denne bivirkning. Vil ofte være forudgået af øvrige CNS-bivirkninger.
- Arytmier: Ses især i forbindelse med methadon, der kan give QTc-forlængelse.
- Hypotension: Ses specielt hos volumendepleterede.
- Kvalme og opkastninger/forsinket ventrikeltømning: Kan udløses af alle opioider og kan være såvel centralt som perifert udløst. Behandles med antiemetika om nødvendigt kombinationsbehandling med præparater med forskellige angrebspunkter. Dosisjustering er vigtig. Eventuelt skift til andet opioid.
- Obstipation: Opstår hos næsten alle patienter og toleransudvikling kan ikke forventes. Behandling med laksantia bør derfor altid iværksættes hos patienter med forventet længerevarende behandling. Der skal anvendes præparater med såvel blødgørende som peristaltikfremmende effekt. Derudover er perifert virkende opioidantagonister effektive:
- Methylnaltrexon, Relistor er en perifert virkende selektiv opioidantagonist, der bindes til μ-receptorer i mave-tarmkanalen og er uden hæmning af den opioid-medierede analgetiske effekt i CNS. Stoffet administreres som s.c. injektion i en dosis på 12 mg s.c. hver 2. dag justeret efter nyrefunktion. Stoffet er kontraindiceret ved mistanke om gastrointestinal obstruktion eller perforationsrisiko.
- Naloxegol, Moventig er ligeledes en perifert virkende μ-opioid receptor antagonist. Administreres som tabletter i en dosis på 12,5-25 mg x 1 justeret efter nyrefunktion. Stoffet er kontraindiceret ved mistanke om gastrointestinal obstruktion eller perforationsrisiko.
- Urinretention: Sjældent et problem hos intensivpatienter, da de oftest har KAD.
- Kløe: Specielt for morfin ses histaminfrigørelse med kløe og bronkospasmer. Antihistamin er som regel ineffektivt. Dosisjustering eller skift af opioid kan undertiden afhjælpe problemet.
- Abstinenser: Længerevarende behandling med opioider kan medføre fysisk afhængighed og dermed risiko for abstinenssymptomer ved brat seponering. Symptomdebut afhænger af de enkelte opioiders halveringstid. Kan forebygges ved gradvis aftrapning med ca. 10 % dagligt efter længerevarende opioidinfusion (>7 dage) (American Pain Association). Alternativt skift til stof med længerevarende virkningsvarighed (eks. methadon) (se afsnittet om abstinenstilstande).
- Toleransudvikling: Opioidtolerance er et fænomen, hvor en gradvis dosisøgning over tid er nødvendig for at opretholde en uændret farmakologisk effekt. Når en patient har behov for stigende doser opioid, kan det skyldes, at smertetilstanden er forværret, at der er udviklet tolerans eller at smerterne ikke er opioidfølsomme.
Principper for dosering af opioider
Dosering af opioider titreres individuelt til optimal smertebehandling med minimal forekomst af bivirkninger. Skift af et opioid til et andet er en mulighed hos patienter, der oplever opioid relaterede bivirkninger eller toleransudvikling. Der er ingen evidens for forskel i analgetisk effekt mellem de forskellige opioider, når der anvendes ækvianalgetiske doser.
Der skal ved doseringen tages højde for, om patienten er opioidtilvænnet, idet disse patienter generelt har brug for større doser.
Baggrundssmerter skal som udgangspunkt behandles med præparater med længere virkningsvarighed (morfin, oxycodon, methadon) i passende doseringsintervaller i.v. eller om muligt i mave-tarmkanalen) eller som kontinuerlig infusion af præparater med kortere virkningsvarighed (remifentanil, fentanyl, sufentanil). Der tilstræbes døgndækkende smertefrihed i hvile. En p.n. ordination til behandling af eventuelle gennembrudssmerter i relevant dosis sv.t. 15-20 % af døgnopioid dosis per p.n. dosis skal være til rådighed. Ved vedvarende behov for supplerende doser, skal det overvejes at øge den faste dosering.
Derudover vil langt de fleste intensivpatienter have behov for behandling af procedurerelaterede smerter, hvor valg af præparat skal tilgodese varigheden og arten af proceduren, hvilket som oftest vil indebære brug af præparater med kort anslagstid og virkningsvarighed (fentanyl, sufentanil, alfentanil eller remifentanil).
Effekten af smertebehandlingen skal vurderes løbende og justeres ved behov.
Opioidrotation
Ved opioidrotation forstås skift fra et opioid til et andet. Kan anvendes, hvis der er utilstrækkelig effekt af det anvendte opioid, hvis der er uacceptable bivirkninger ved nødvendige doser af det pågældende opioid eller ved uhensigtsmæssig stor toleransudvikling overfor det anvendte præparat.
Præparater
Her omtales de hyppigst anvendte opioider på intensivafdeling.
Alfentanil
Syntetisk ren opioidagonist. Fentanylderivat.
Administration
Parenteralt.
Anvendelsesområder
Velegnet til korte procedurerelaterede smerter.
Dosering
Start dosis til ikke opioidtilvænnede
- Voksne 0,5 til 1 mg i.v. Kan gentages.
- Ældre – dosis nedsættes.
Bivirkninger
Stærkt respirationsdeprimerende. Se i øvrigt under ”Hyppigst forekommende bivirkninger”.
Væsentlige interaktioner
Metaboliseres via CYP3A4. Samtidig indgift af hæmmere af CYP3A4 kan øge plasmakoncentrationen, mens induktorer kan reducere virkningen (for nærmere se under methadon/interaktioner).
Samtidig behandling med MAO-hæmmere og behandling med irreversible MAO-hæmmere inden for 14 dage bør undgås.
Samtidig brug af serotonerge midler giver risiko for udvikling af serotoninsyndrom.
Farmakodynamik
Efter i.v. indgift af enkeltdosis opnås maksimal effekt indenfor 2 minutter. Virkningsvarighed 6-15 minutter.
Virkningsvarighed længere efter længerevarende infusion. Virker 25 gange stærkere end morfin.
Farmakokinetik
Metaboliseres i leveren til inaktive metabolitter.
Velegnet til nyreinsufficiente patienter. Mindre end 1 % udskilles uomdannet gennem nyrerne.
Fentanyl
Semisyntetisk µ-receptorselektiv opioidagonist.
Administration
Kan administreres såvel parenteralt som transdermalt. Transdermal administration kan som hovedregel ikke anbefales til kritisk syge patienter pga. usikker absorption fra huden og langsomme ækvilibreringstider.
Anvendelsesområder
Velegnet til behandling af akutte smerter i en kortere periode, til korte procedurerelaterede smerter eller som supplement til sedation som kontinuerlig i.v.-infusion.
Dosering
Til procedurerelaterede smerter gives som initial dosis til ikke tidligere opioidtilvænnede patienter:
- Voksne 1-2 µg/kg i.v. – kan gentages.
- Ældre – dosis bør nedsættes.
Supplement til sedation som kontinuerlig i.v.-infusion startdosis:
- Voksne 0,5-2 µg/kg/t evt. højere.
- Ældre – dosis bør nedsættes.
Akkumuleres efter længerevarende kontinuerlig infusion, idet halveringstiden stiger med varigheden af administration, hvorfor dosis skal justeres løbende efter effekt.
Bivirkninger
Stærkt respirationsdeprimerende. Se i øvrigt under ”Hyppigst forekommende bivirkninger”.
Væsentlige interaktioner
Se under alfentanil.
Farmakodynamik
Efter i.v.-indgift er der maksimal effekt i løbet af få minutter. Virkningsvarighed af enkeltdosis ca. 30 minutter.
Virker ca. 100 x stærkere end morfin.
Farmakokinetik
Metaboliseres i leveren via CYP3A4 til inaktive metabolitter.
Velegnet til nyreinsufficiente patienter. Ca. 10 % udskilles uomdannet via nyrerne.
Methadon
Syntetisk fremstillet langtidsvirkende μ-receptoragonist og NMDA-receptorantagonist.
Administration
Kan administreres enteralt og parenteralt.
Anvendelsesområder
- Anvendes til behandling af blandet smertetilstand med nociceptiv og neuropatisk smertemekanisme, ved opioidinduceret hyperalgesi eller ved toleransudvikling for andre opioider.
- Velegnet som abstinensprofylakse i forbindelse med aftrapning af længerevarende infusion af opioider med kort virkningsvarighed pga. meget lille misbrugspotentiale.
- Uegnet til behandling af procedurerelaterede smerter.
Dosering
Doseringsintervallet er kortere ved anvendelse til smertebehandling sammenlignet med vedligeholdelses-behandling af opioid misbrugere.
Oral startdosis til behandling af baggrundssmerter til ikke tidligere opioidbehandlede patienter:
- Voksne 2,5 mg x 3 p.o.
- Ældre – dosis bør nedsættes.
Ved skift fra andet opioid skal man være opmærksom på
- At methadon er 5-10 gange så potent som morfin.
- At dosis kun øges med 3-4 dages mellemrum pga risiko for akkumulation.
- At ordinere et korttidsvirkende opioid f.eks. morfin til p.n.-anvendelse i tilfælde af gennembrudssmerter.
Bivirkninger
Udover vanlige opioidbivirkninger kan bl.a. ses QTc-forlængelse og torsade de pointes. Ses især ved behandling med høje doser (> 200 mg daglig). Derfor skal methadon administreres med forsigtighed til patienter med QTc-forlængelse og/eller ved behandling med andre præparater med potentiale for QTc-forlængelse eksempelvis amiodaron, haloperidol, propofol, azoler, fluorquinoloner, erythromycin, ondansetron og tricycliske antidepressiva. Ekg bør kontrolleres hos alle patienter ved doser over 150 mg dagligt samt ved samtidige risikofaktorer for QTc-forlængelse.
Væsentlige interaktioner
Methadon metaboliseres via CYP3A4 (P450-enzymer) i leveren. Andre hyppigt anvendte lægemidler kan påvirke metabolismen ved enten induktion eller hæmning af dette enzym og dermed påvirke effekten af methadon. Eksempelvis kan fenytoin nedsætte effekten, mens bl.a. amiodaron, erythromycin, fluconazol og voriconazol kan øge virkningen.
Der kan forekomme serotoninsyndrom ved samtidig administration af methadon, MAO-hæmmere, SSRI, SNRI og tricycliske antidepressiva.
Symptomerne på serotoninsyndrom kan omfatte ændringer i mental tilstand, autonom instabilitet, neuromuskulære abnormaliteter og/eller gastrointestinale symptomer.
Farmakodynamik
Efter oral administration af en enkeltdosis opnås effekt efter 30-60 minutter. Virkningsvarigheden for en enkeltdosis er ca. 4 timer.
Efter i.v.-administration er der begyndende effekt efter 10-20 minutter og virkningsvarighed 6-8 timer.
Ved gentagen administration ses en forlængelse af virkningsvarigheden på grund af akkumulering. Gennemsnitlig virkningsvarighed ved gentagen indgift 8-12 timer.
Farmakokinetik
Methadon har en kompleks farmakokinetik og behandling bør derfor kun påbegyndes af læger med erfaring med anvendelse af lægemidlet.
Stoffet absorberes hurtigt ved peroral indgift med en biotilgængelighed på ca. 85 % efter oral indgift.
Pga. høj fedtopløselighed og affinitet til væv akkumuleres methadon i kroppen, hvilket betyder, at såvel virkning som bivirkninger kan manifestere sig flere dage efter påbegyndt behandling, hvorfor dosisjusteringer bør foretages med dages mellemrum.
Ca. 20 % udskilles uomdannet gennem nyrerne. Ved svært nedsat nyrefunktion (creatininclearance < 10 ml/min) kan det overvejes at øge doseringsintervallet til 8-12 timer.
Metaboliseres i leveren til inaktive metabolitter. Hos patienter med levercirrhose hæmmes metaboliseringen af methadon og first pass-effekten reduceres, hvilket kan resultere i højere methadon plasmaniveauer, hvorfor lavere doser anbefales.
Morfin
Ren opioidagonist med overvejende effekt på µ-receptorer.
Administration
Kan administreres parenteralt, peroralt og rektalt. Biotilgængelighed efter rektal administration svarer til peroral administration.
Anvendelsesområder
Velegnet til behandling af opioidfølsomme baggrundssmerter. Er derimod mindre velegnet til behandling af procedurerelaterede smerter pga. lang virkningsvarighed.
Dosering
Parenteral startdosis til ikke tidligere opioidbehandlede
- Voksne patienter. 5-10 mg i.v. hver 4. time.
- Ældre. Dosis reduceres til 2,5-5 mg i.v. hver 4. time.
Oral startdosis til ikke tidligere opioidbehandlede
- Voksne patienter. 10-30 mg hver 4. time.
- Ældre. Dosis skal reduceres.
Titreres efterfølgende til optimal dosis, jf. ”Principper for dosering af opioider”
Bivirkninger
Se under ”Hyppigst forekommende bivirkninger”
Væsentlige interaktioner
Samtidig behandling med MAO-hæmmere og behandling med irreversible MAO-hæmmere indenfor 14 dage bør undgås.
Farmakodynamik
Maksimal virkning efter enkeltdosis 45-60 minutter og virkningsvarighed 3-5 timer.
Farmakokinetik
- Absorberes let efter peroral indgift hovedsagelig i duodenum.
- Biotilgængelighed er 20-60 % pga udtalt first pass-metabolisme i leveren.
- Morfin metaboliseres i leveren til det inaktive stof morfin-3-glukoroinid (M3G) (80 %) og til den biologisk aktive metabolit morfin-6-glukoronid (M6G) (20 %), der er ca. 2-4 gange så aktiv som morfin.
- 90 % af indgivet morfin udskilles via nyrerne både i form af metabolitter og uomdannet morfin, mens 10 % udskilles via fæces. Der er på den baggrund risiko for akkumulation og dermed toksicitet ved nyreinsufficiens.
- Tåles godt af leverinsufficiente patienter, da glukuronideringsprocessen sjældent er påvirket ved nedsat leverfunktion.
Oxycodon
Semisyntetisk µ- og muligvis κ-receptor agonist opioidagonist.
Administration
Findes i en korttids-virkende form til peroral og parenteral anvendelse og som depottablet.
Anvendelsesområder
Anvendes til behandling af opioidfølsomme baggrundssmerter, såfremt morfin ikke tåles. Er ikke egnet til behandling af procedurerelaterede smerter pga. lang virkningsvarighed.
Dosering
Parenteral startdosis til ikke tidligere opioidbehandlede
- Voksne patienter 1-10 mg i.v. hver 4. time.
- Ældre. Dosis bør nedsættes.
- Ved parenteral indgift svarer 10 mg oxycodon til ca. 10 mg morfin.
Oral startdosis til ikke tidligere opioidbehandlede
- Voksne patienter 5 mg x 4 p.o.
- Ældre. Dosis bør nedsættes.
- Er ved peroral behandling 1,5-2 gange så potent som morfin.
- Depotformulering anvendes som hovedregel ikke til intensivpatienter.
Titreres efterfølgende til optimal dosis, jf. ”Principper for dosering af opioider”
Bivirkninger
Særligt bør fremhæves stoffets eufori-fremkaldende virkning, som kan være medvirkende til mulig udvikling af afhængighed. Bør derfor primært anvendes til patienter med svære bivirkninger ved morfinbehandling og til nyreinsufficiente patienter.
Se i øvrigt under ”Hyppigst forekommende bivirkninger”.
Væsentlige interaktioner
Samtidig behandling med MAO-hæmmere og behandling med irreversible MAO-hæmmere inden for 14 dage bør undgås.
Samtidig brug af serotonerge midler giver risiko for udvikling af serotoninsyndrom.
Farmakodynamik
Maksimal effekt efter enkeltdosis 45-60 minutter og virkningsvarighed ca. 3 timer.
Farmakokinetik
- Har sammenlignet med morfin en høj biotilgængelighed på 60-80 %.
- Metaboliseres i tarmen og leveren til aktive metabolitter, som udskilles renalt.
- 8 % udskilles uomdannet gennem nyrerne.
- Ved nyreinsufficiens er dosisreduktion nødvendig ved en estimeret glomerulær filtrationsrate (eGFR) < 50 ml/min. Ved eGFR < 20 ml/min tilrådes brug af oxycodon frem for morfin.
- Bør kun undtagelsesvist anvendes hos nyreraske patienter pga stort misbrugspotentiale10.
Remifentanil
Syntetisk ultrakorttidsvirkende ren opioidagonist.
Administration
Udelukkende i.v.-infusion.
Anvendelsesområder
- Kan anvendes som supplement til sedation hos respiratorbehandlede intensivpatienter. Er i den forbindelse særlig velegnet til patienter, hvor hyppig neurologisk vurdering er nødvendig.
- Stoffet er velegnet til korterevarende smertevoldende procedurer, eksempelvis skiftninger.
- hurtig toleransudvikling bør det ikke anvendes til længerevarende smertebehandling.
- Da virkningen af remifentanil ophører meget hurtigt, vil der ikke være nogen opioidaktivitet tilbage 5-10 minutter efter seponeringen. Til de patienter, der forventes fortsat at have behov for smertebehandling, skal anden behandling iværksættes og effekt være opnået inden seponering.
- Da der hurtigt udvikles tilvænning ved infusion med remifentanil, kan abstinenssymptomer forekomme efter meget kort tids behandling. For at undgå dette kan infusionen gradvist aftrappes over timer afhængig af behandlingsvarighed og den givne dosis.
Dosering
Til voksne anbefales, at remifentanil startes med en infusionshastighed på mellem 0,1 µg/kg/min og 0,15 µg/kg/min. Dosis kan justeres hvert 5. minut med ændringer på 0,025 µg/kg/min vejledt af effekten. Dosis reduceres til ældre.
Bolusdoser anvendes som hovedregel ikke.
Bivirkninger
Stærkt respirationsdeprimerende. Se i øvrigt under ” Hyppigst forekommende bivirkninger”.
Væsentlige interaktioner
Se under oxycodon.
Farmakodynamik
Maksimal virkning efter 2 minutter (i.v. bolus). Virkningsvarighed 5-10 minutter uden tendens til akkumulation efter adskillige timers infusion.
Farmakokinetik
Metaboliseres af uspecifikke esteraser på røde blodlegemer og i vævene til inaktive metabolitter. Er således uafhængig af nyre- og leverfunktion.
Sufentanil
Syntetisk morfinlignende analgetikum. Fentanylanalog.
Administration
Kan administreres parenteralt og epiduralt som supplement til bupivacain.
Anvendelsesområder
Velegnet til korte procedurerelaterede smerter og som supplement til epidural smertebehandling.
Dosering
Til procedurerelaterede smerter gives som initial dosis til ikke tidligere opioidtilvænnede patienter:
- Voksne 0,5 til 5 µg/kg iv.
Bivirkninger
Stærkt respirationsdeprimerende. Bradycardi kan forekomme. Se i øvrigt under ”Hyppigst forekommende bivirkninger”.
Væsentlige interaktioner
Se under alfentanil.
Farmakodynamik
Sufentanil er et kraftigt virkende opioid og har 7-10 gange større affinitet for µ-receptorerne end fentanyl. Efter Iv. administration opnås den maksimale virkning inden for få minutter. Analgetisk virkningsvarighed efter enkeltdosis er mindre end 30 minutter.
Farmakokinetik
Metaboliseres i leveren til bl.a. en farmakologisk aktiv metabolit (ca. 10 % så aktiv som moderstoffet).
Hos patienter med levercirrhose ses en signifikant forlængelse af halveringstiden med omkring 30 % pga. forøget fordelingsvolumen og lidt lavere clearance.
Kan anvendes til patienter med nyreinsufficiens. Ca. 2 % udskilles uforandret gennem nyrer og fæces.
Non-opioide analgetika
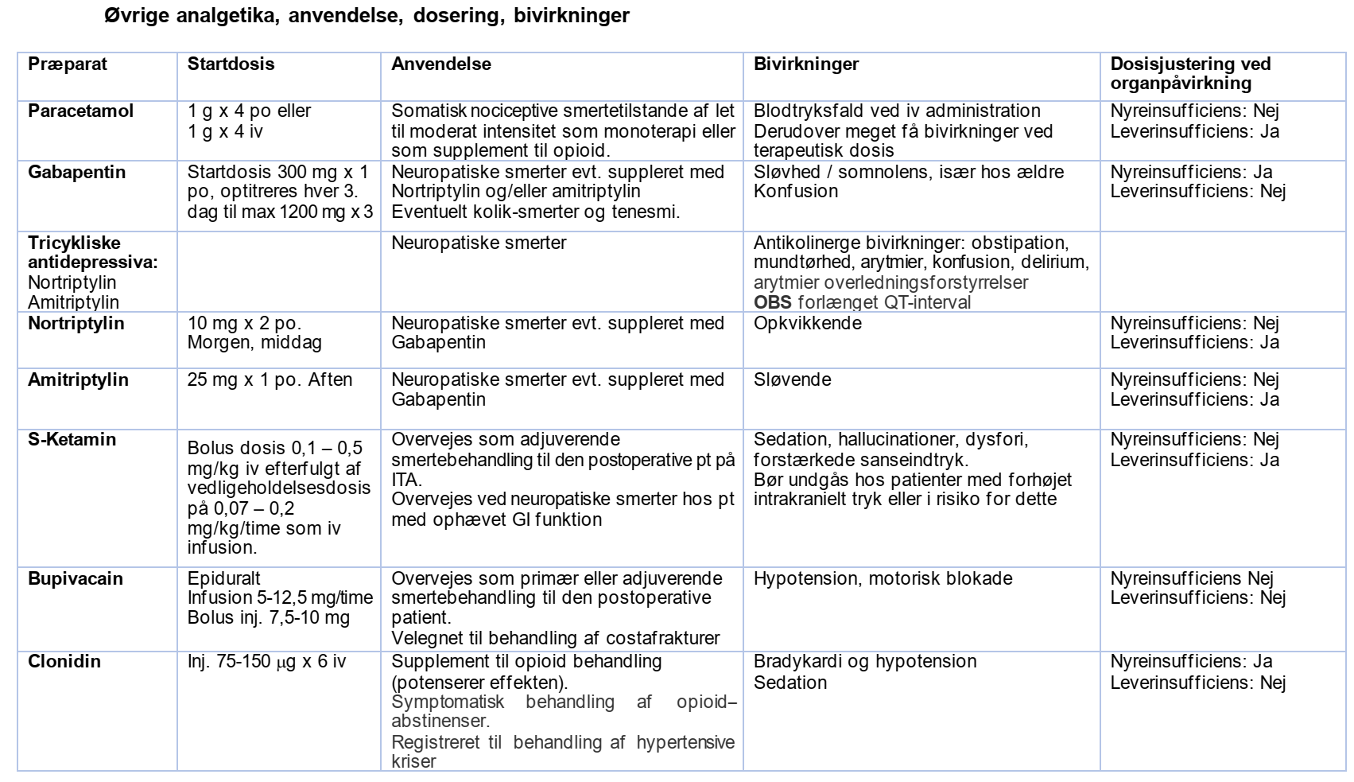
Paracetamol
Har analgetisk og antipyretisk effekt.
Administration
Kan administreres enteralt og parenteralt.
Anvendelsesområder
Anvendes til somatisk nociceptive smertetilstande af let til moderat intensitet som monoterapi eller som supplement til opioid.
Dosering
- Voksne 1 g x 3-4
Bivirkninger
Blodtryksfald kan ses ved intravenøs indgift. Derudover er bivirkninger sjældne ved terapeutisk dosering.
Interaktioner
Ingen væsentlige.
Farmakodynamik
Sandsynligvis både central og perifer analgetisk effekt.
Farmakokinetik
Absorberes næsten 100 % efter peroral/sonde administration. Ved rektal administration er biotilgængeligheden 30-40 %.
NSAID
- Brugen begrænset hos kritisk syge patienter pga. bivirkninger i form af gastrointestinal blødning, blødningstendens pga. trombocytinhibition og nyreinsufficiens.
- Kan overvejes til korterevarende behandling af drænsmerter.
Tricycliske antidepressiva, Nortriptylin og Amitriptylin
Administration
Kan kun administreres enteralt.
Anvendelsesområder
Anvendes til behandling af neurogene smertetilstande (dysæstesi, brændende, sviende, stikkende smerter) ved betydelig lavere dosering end antidepressiv dosis.
Dosering
- Nortriptylin har let opkvikkende virkning. Dosis 10 mg x 2 i dagtid.
- Amitriptylin har sederende effekt og gives derfor bedst om aftenen. Dosis 25 mg x 1.
Bivirkninger
- Antikolinerge bivirkninger såsom obstipation, mundtørhed, arytmier, konfusion, delirium, overledningsforstyrrelser, arytmier og ortostatisk hypotension.
- Inden behandlingsstart bør foreligge ekg for at udelukke forlænget QT-interval, hvilket kan øge risikoen for medicinsk induceret arytmi.
Interaktioner
- Skal anvendes med forsigtighed til ældre og til patienter i behandling med QTc-forlængende lægemidler.
- Bør ikke gives sammen med andre serotonerge lægemidler.
Farmakodynamik
Smertelindrende effekt kan forventes indenfor 3-8 døgn.
Farmakokinetik
- Kan gives i sædvanlig dosis ved nedsat nyrefunktion.
- Forsigtig dosering ved leverinsufficiens.
Antikonvulsiva
Gabapentin
Administration
Kan kun administreres enteralt.
Anvendelsesområder
- Anvendes til behandling af neuropatiske smertetilstande.
- Eventuelt kolik-smerter og tenesmi.
- Der kan undertiden opnås bedre behandlingsrespons, når det kombineres med tricycliske antidepressiva.
Dosering:
Startdosis 300 mg, som gradvist øges afhængig af nyrefunktion som skitseret i skema nedenfor; langsommere ved nedsat nyrefunktion og lav legemsvægt.
Ved ophør af behandling skal denne aftrappes over 1-2 uger for undgå seponeringssymptomer i form af bl.a. angst, søvnløshed, kvalme, svedtendens og utilpashed
| Kreatinin-clearance (ml/min) | Total døgndosis (mg/dg) | Dosering (mg) |
| > 60 30-60 15-30 < 15 |
1.200 600 300 150 |
400 mg x 3 300 mg x 2 300 mg x 1 300 mg hver 2. dag |
Bivirkninger
Svimmelhed og – især hos ældre patienter – somnolens er hyppigst forekommende.
Væsentlige interaktioner
Øget risiko for svimmelhed, respirationsdepression og sedation ved samtidig behandling med opioider.
Farmakodynamik
Effekten indtræder i løbet af 1-3 uger.
Farmakokinetik
Biotilgængeligheden er ca. 60 %. Udskilles uomdannet via nyrerne.
Adjuverende behandling
Nerveblokader
Ved udvalgte smertetilstande kan anvendes perifere og centrale nerveblokader. Thorakal epidural anæstesi/analgesi kan være en effektiv smertebehandling efter større abdominal og thorakal kirurgi, der udover smertelindring kan forbedre mave-tarmfunktionen og respirationen og dæmpe det kirurgiske stress-respons og dermed potentielt reducere organdysfunktion. Det anbefales derudover til behandling af smerter udløst af costafrakturer og ved vanskeligt traktable smerter i forbindelse med akut pancreatitis. Ved forventet længere tids anvendelse, bør kateteret tunneleres. Der er ikke evidens for anvendelse af epidural analgesi til medicinske intensivpatienter7.
Clonidin
Centralt virkende α-2 agonist.
Administration
Er aktuelt kun registreret til parenteral brug, men findes i tabletform som tilladelsespræparat.
Anvendelsesområder
- Potenserer effekten af opioider og kan derfor anvendes som adjuvans til opioidbehandling.
- Anvendes derudover som symptomatisk behandling af opioidabstinenser.
- Registreret til behandling af hypertensive kriser.
Dosering
- Voksne 75-150 μg x 4-6 p.o. eller i.v.
- Brat ophør af behandlingen kan medføre rebound hypertension, hvorfor en gradvis nedtrapning over en periode på nogle dage anbefales.
Bivirkninger
Sinusbradycardi, AV-blok, hypotension, sedation, vrangforestillinger, hallucinationer, søvnforstyrrelser og mareridt, mundtørhed og kløe.
Væsentlige interaktioner
Kan muligvis øge det arytmogene potentiale (QTc-forlængelse, ventrikelflimmer) af høje intravenøse haloperidoldoser.
Farmakodynamik
- Den analgetiske effekt skyldes binding til α2-receptorer på såvel spinalt som på centralt niveau.
- Anslagstid efter i.v.-indgift er typisk 5-10 minutter, men op til 60 minutter efter p.o.-indgift.
- Virkningsvarigheden er 6-12 timer og halveringstiden 6-24 timer, men kan være væsentlig længere ved nedsat nyrefunktion.
Farmakokinetik
- Har høj biotilgængelighed.
- 70 % udskilles renalt; hvorfor dosis bør reduceres ved svær nyreinsufficiens. Der er ingen aktive metabolitter.
S-ketamin
Selektiv NMDA-receptor antagonist. Virker analgetisk i subanæstetiske doser.
Administration
Kan administreres som i.v. eller s.c.-infusion.
Anvendelsesområder
- Kan anvendes til behandling af neuropatiske, iskæmiske og viscerale smerter.
- Kan overvejes som supplement ved stort opioidbehov, toleransudvikling og til postoperativ smertebehandling7 11-13.
- Forsigtighed ved hjerteinsufficiens, ubehandlet hypertension, ustabil angina pectoris, sygdomme i centralnervesystemet, psykiske sygdomme og ubehandlet glaucom.
Dosering
- Bolus dosis 0,1-0,5 mg/kg i.v. efterfulgt af vedligeholdelsesdosis på 0,07 – 0,2 mg/kg/time som i.v. infusion.
Bivirkninger
Bivirkninger optræder især ved højere infusionshastigheder/anæstesidoser i form af:
- Hallucinationer, delirium og levende drømme, risiko for forhøjet intrakranielt og intraokulært tryk, hypersalivation, kvalme og opkastninger, bevægeforstyrrelser og arytmier.
- Bivirkningerne kan dæmpes ved dosisreduktion og ved indgift af benzodiazepin.
- Ved lave infusionsrater har ketamin ingen eller ringe sedativ virkning.
Væsentlige interaktioner
- Kombination med sympatomimetika, thyreoideahormoner og vasopressin kan medføre stigning i blodtryk og puls.
Farmakodynamik
- Virkningen af enkeltdosis indtræder i løbet af 30-40 sekunder og varer op til 10 minutter.
- Eliminationshalveringstiden er 2-3 timer.
Farmakokinetik
- Metaboliseres af cytochrom P450 enzymer i leveren, hvorved den aktive metabolit norketamin dannes.
- Det er ikke nødvendigt at justere dosis ved nyreinsufficiens.
- Dosering usikker ved leversvigt.
Praktisk smertebehandling
Der foreligger meget sparsom videnskabelig evidens vedrørende principper for smertebehandling og valg af lægemidler til kritisk syge patienter. Behandlingsstrategien baseres derfor på kendte fysiske/kemiske, farmakokinetiske og farmakodynamiske egenskaber for lægemidlerne kombineret med ekstrapolation af evidens fra andre patientpopulationer.
Da smerter er hyppigt forekommende hos kritisk syge patienter og pga. kommunikationsvanskeligheder er det vigtigt, at forekomsten af smerter vurderes jævnligt hos alle patienter, at en målrettet behandling iværksættes og revurderes løbende. Det kan være hensigtsmæssigt at anvende en multimodal smertebehandlingsstrategi, hvor der anvendes en kombination af forskellige analgetika og teknikker, hver især med forskellige virkningsmekanismer i det perifere og centrale nervesystem. Herved kan der opnås en synergistisk eller additiv effekt af de enkelte midler.
Har patienten smerter
Baggrunds- og gennembrudssmerter
For alle patienter med smerter skal der lægges en smerteplan, hvor følgende forhold bør overvejes:
- Et mål for analgesien skal defineres. I de fleste tilfælde er det hensigtsmæssigt at tilstræbe smertefrihed i hvile for at undgå opioidoverdosering og deraf følgende bivirkninger.
- Ordination af analgetika, der tager højde for smertetype/-kvalitet.
- Ved somatisk nociceptive smerter og/eller viscerale smerter er en kombination af opioider og non-opioide analgetika ofte en fordel, da der opnås en større analgetisk effekt end højere doser opioid alene kan give.
- Neuropatiske smerter behandles med antikonvulsiva, tricykliske antidepressiva, methadon eller lav-dosis ketamin.
- Døgndækkende dosering skal tilstræbes, idet forebyggelse af smerter er mere effektivt end behandling af eksisterende smerter.
- Kontinuerlig opioid infusion bør minimeres både mht. dosis og infusionsperiode, da lang infusionsperiode og høj dosis kan medføre toleransudvikling, akkumulation og dermed risiko for overdosering og efterfølgende udvikling af abstinenser.
- Depotpræparater er ikke hensigtsmæssige til patienter med akutte smerter
- Der skal foreligge p.n. ordinationer til behandling af gennembrudssmerter (15-20 % af opioid døgndosis).
- Da smerter er en dynamisk tilstand, skal smerteplanen som minimum dagligt vurderes og justeres ved behov.
- Husk at ikke alle intensivpatienter har behov for opioidbehandling.
Procedurerelaterede smerter
- Der bør foreligge en plan for behandling af diverse smertevoldende procedurer.
- Planen skal tage højde for procedurens art og varighed og valget af opioid skal foretages med udgangspunkt i stoffets anslagstid og virkningsvarighed. Effekten af denne behandling skal om muligt afventes, inden proceduren udføres.
Patienter med præeksisterende kroniske smerter
- Som hovedregel bør igangværende behandling af kroniske smerter fortsættes.
- Hvis det ikke er muligt at fortsætte en igangværende behandling med opioid (f.eks. depotformulering), skal der gives anden opioidbehandling i ækvianalgetiske doser.
- Derudover skal akutte smerter behandles under hensyntagen til, at patienter i langtidsbehandling med opioid pga. tilvænning har behov for større opioiddoser end ikke tilvænnede patienter. Gælder både fast og p.n. dosering.
Patient-kontrolleret analgesi (PCA)
Denne behandlingsform resulterer i stabile koncentrationer, god kvalitet af smertebehandlingen, mindre sedation, mindre opioidforbrug og potentielt færre bivirkninger hos ikke-kritisk syge patienter14,15. Denne administrationsform er sjældent indiceret til kritisk syge patienter, men kan anvendes i udvalgte tilfælde8,9.
Konklusion
Smerter er hyppigt forekommende blandt kritisk syge patienter indlagt på en intensiv afdeling.
En systematisk og omhyggelig evaluering af smerter bør derfor gennemføres minimum en gang dagligt hos alle patienter og derudfra lægges en plan for smertebehandling. Denne skal om muligt tilgodese forskellige smertekvaliteter og evt. omfatte en multimodal behandlingsstrategi. Behandlingen skal tage højde for såvel hvilesmerter som procedurerelaterede smerter. Opioidbehandling reduceres mest muligt pga. mange bivirkninger. Effekten af den iværksatte terapi bør kontrolleres med jævne mellemrum ved anvendelse af et relevant scoringssystem og justeres ved behov, afhængig af det terapeutiske respons.
- Raja SN, Carr DB, Cohen M, et al. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain 2020;161(9):1976-1982. DOI: 10.1097/j.pain.0000000000001939.
- Gelinas C. Management of pain in cardiac surgery ICU patients: have we improved over time? Intensive & critical care nursing : the official journal of the British Association of Critical Care Nurses 2007;23(5):298-303. DOI: 10.1016/j.iccn.2007.03.002.
- Barr J, Fraser GL, Puntillo K, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med 2013;41(1):263-306. DOI: 10.1097/CCM.0b013e3182783b72.
- Puntillo KA, Arai S, Cohen NH, et al. Symptoms experienced by intensive care unit patients at high risk of dying. Crit Care Med 2010;38(11):2155-60. DOI: 10.1097/CCM.0b013e3181f267ee.
- Puntillo KA, Naidu R. Chronic pain disorders after critical illness and ICU-acquired opioid dependence: two clinical conundra. Current opinion in critical care 2016;22(5):506-12. DOI: 10.1097/MCC.0000000000000343.
- Chanques G, Jaber S, Barbotte E, et al. Impact of systematic evaluation of pain and agitation in an intensive care unit. Crit Care Med 2006;34(6):1691-9. DOI: 10.1097/01.CCM.0000218416.62457.56.
- Devlin JW, Skrobik Y, Gelinas C, et al. Clinical Practice Guidelines for the Prevention and Management of Pain, Agitation/Sedation, Delirium, Immobility, and Sleep Disruption in Adult Patients in the ICU. Crit Care Med 2018;46(9):e825-e873. (In eng). DOI: 10.1097/ccm.0000000000003299.
- Ahlers SJ, van Gulik L, van der Veen AM, et al. Comparison of different pain scoring systems in critically ill patients in a general ICU. Crit Care 2008;12(1):R15. DOI: 10.1186/cc6789.
- Gelinas C, Johnston C. Pain assessment in the critically ill ventilated adult: validation of the Critical-Care Pain Observation Tool and physiologic indicators. The Clinical journal of pain 2007;23(6):497-505. DOI: 10.1097/AJP.0b013e31806a23fb.
- Nielsen AVA, Aædder EA, Uhrbrand PG, Runge C, Breining P. Differences and similarities of morphine and oxycodone. Ugeskrift for laeger 2023;185(37):V02230103-V02230103.
- Subramaniam K, Subramaniam B, Steinbrook RA. Ketamine as adjuvant analgesic to opioids: a quantitative and qualitative systematic review. Anesthesia and analgesia 2004;99(2):482-95, table of contents. DOI: 10.1213/01.ANE.0000118109.12855.07.
- Bell RF, Dahl JB, Moore RA, Kalso E. Perioperative ketamine for acute postoperative pain. The Cochrane database of systematic reviews 2006(1):CD004603. DOI: 10.1002/14651858.CD004603.pub2.
- Bell RF, Eccleston C, Kalso EA. Ketamine as an adjuvant to opioids for cancer pain. The Cochrane database of systematic reviews 2012;11:CD003351. DOI: 10.1002/14651858.CD003351.pub2.
- Gust R, Pecher S, Gust A, Hoffmann V, Bohrer H, Martin E. Effect of patient-controlled analgesia on pulmonary complications after coronary artery bypass grafting. Crit Care Med 1999;27(10):2218-23. (http://www.ncbi.nlm.nih.gov/pubmed/10548210).
- Boldt J, Thaler E, Lehmann A, Papsdorf M, Isgro F. Pain management in cardiac surgery patients: comparison between standard therapy and patient-controlled analgesia regimen. Journal of cardiothoracic and vascular anesthesia 1998;12(6):654-8. (http://www.ncbi.nlm.nih.gov/pubmed/9854662).
Angst
Baggrund
Angst er et normalt adaptivt biologisk respons til en potentiel trussel. Angst opstår, når patienten føler sig hjælpeløs eller ængstelig omkring en given situation, eksempelvis kritisk sygdom, og når patienten oplever sig hjælpeløs eller ude af stand til at kontrollere eller forudsige situationen. Tilstanden bliver patologisk, når tilstanden er vedvarende og ”løber løbsk”.
Indlæggelse på en intensiv afdeling eksponerer patienten for mange stressfaktorer såsom smerte, kommunikationsvanskeligheder, søvnforstyrrelser, isolation, respiratorterapi, kvælningsfornemmelse, og invasive procedurer. Larm og lys fra monitorer, maskiner og alarmer er yderligere stressfaktorer1,2.
Angst i mild eller moderat grad kan ses hos op til 50 % af intensivpatienter3.
Symptomer
Angst aktiverer det sympatiske ”fight and flight” respons. Symptomerne ses derfor som:
Fysiske: Takykardi, takypnø, hypertension, svedtendens, tremor.
Affektive: Nervøsitet, uro, frygt, panik, rædsel.
Adfærdsmæssige: Agitation, rastløshed, undgåelsesadfærd og manglende compliance i forhold til procedurer og behandling.
Kognitive: Ængstelse, bekymring, benægtelse, besættelse, tanker om døden.
Angst er en subjektiv følelse, som ikke altid er forbundet med objektive fund. Angst kan komplicere det kliniske billede og symptomerne ligner til forveksling dem der ses ved delir, smerter eller abstinenstilstande4. Det er vist, at dyspnø er stærkt associeret med angst hos mekanisk ventilerede patienter5.
Angst er således et komplekst fænomen, som kan give alvorlig påvirkning af patientens psykiske såvel som fysiske stabilitet og ubehandlet medfører øget morbiditet og mortalitet6.
Strategi
Forebyggelse
At skabe imødekommende, professionelle og rolige omgivelser. Information om sygdom og behandling skal gives under hensyntagen til patientens ønsker og behov såvel ved indlæggelsen som løbende under indlæggelsen.
Behandling
Identifikation og erkendelse af at en patient er angst, eller har udviklet angst uden objektive symptomer, kan være vanskelig. Såvel den intuberede som den ikke-intuberede patient kan have svært ved at beskrive denne følelse. Derfor bør den professionelle være specielt opmærksom på tilstanden og vide, at angst af patienten også ofte beskrives som frustration, frygt eller panik6.
Det er vigtigt at sikre, at angsten ikke er et ledsagesymptom til eksisterende smerter, delirium, abstinens eller dyspnø. Såfremt dette er tilfældet, målrettes behandlingen disse tilstande.
Nonfarmakologisk behandling
En nonfarmakologisk tilgang til behandling af angst er altid at foretrække, hvis det er praktisk muligt. Nonfarmakologiske tiltag kan være: Verbalt og fysisk nærvær af personale og familie, etablering af en nonverbal entydig kommunikation (blik, hovedrysten, håndtryk etc.), lejringsændring, musik og musikterapi, højtlæsning, rolige omgivelser, bevægeøvelser, massage, m.m. 2,7,8.
Klinisk psykologisk intervention under intensiv-indlæggelsen kan i svære tilfælde overvejes, idet dette udover at reducere frekvensen af angst hos den enkelte patient under indlæggelsen også ser ud til at reducere forekomsten af psykiske sequelae 12 måneder efter udskrivelse fra intensiv afdeling9.
Farmakologisk behandling
Farmakologisk behandling kan være påkrævet, men nonfarmakologiske tiltag skal altid supplere den farmakologiske behandling.
Patienter, der er i behandling for angst inden indlæggelsen, bør fortsætte denne behandling.
Benzodiazepiner
Har anxiolytisk effekt og er førstevalgspræparat til behandling af angst.
Har endvidere anamnestisk, sedativ/hypnotisk, antikonvulsiv og muskelafslappende effekt.
Nogle patienter, især ældre, kan have en paradoks virkning med agitation, trods skaleret dosering.
Præparater med kort halveringstid anbefales.
Ved behov for længerevarende behandling er peroral administration i fast døgndækkende dosering at foretrække.
I forbindelse med akut behandling kan intravenøs administration af enkelt doser anvendes.
Antipsykotika
I små doser har disse præparater nogen anxiolytisk effekt overfor ikke psykotisk angst.
Konklusion
Angst er en hyppigt forekommende tilstand hos intensiv-patienter. Tilstanden kan være uden objektive fund, men kan forårsage en lang række symptomer sv.t. overaktivering af det sympatiske nervesystem, eks. puls- og blodtryksstigning, svær uro og aggressiv adfærd samt dårlig compliance til given behandling eks. respiratorterapi.
Angst forebygges ved at skabe informative, imødekommende, professionelle og rolige omgivelser. Behandlingen er primært nonfarmakologisk med tryghedsskabende tiltag som verbalt og fysisk nærvær. Ved akut farmakologisk behandlingsbehov gives benzodiazepin.
I de tilfælde hvor angst optræder som ledsagefænomen til smerter, delirium, abstinenser eller dyspnø, målrettes behandlingen disse tilstande.
- Kress JP, Hall JB. Sedation in the mechanically ventilated patient. Crit Care Med 2006;34(10):2541-6. DOI: 10.1097/01.CCM.0000239117.39890.E3.
- Brush DR, Kress JP. Sedation and analgesia for the mechanically ventilated patient. Clinics in chest medicine 2009;30(1):131-41, ix. DOI: 10.1016/j.ccm.2008.09.001.
- Shdaifat SA, Al Qadire M. Anxiety and depression among patients admitted to intensive care. Nurs Crit Care 2022;27(1):106-112. DOI: 10.1111/nicc.12536.
- Pun BT, Dunn J. The sedation of critically ill adults: Part 1: Assessment. The first in a two-part series focuses on assessing sedated patients in the ICU. The American journal of nursing 2007;107(7):40-8; quiz 49. DOI: 10.1097/01.NAJ.0000279265.66906.2f.
- Schmidt M, Demoule A, Polito A, et al. Dyspnea in mechanically ventilated critically ill patients. Crit Care Med 2011;39(9):2059-65. DOI: 10.1097/CCM.0b013e31821e8779.
- Tate JA, Devito Dabbs A, Hoffman LA, Milbrandt E, Happ MB. Anxiety and agitation in mechanically ventilated patients. Qualitative health research 2012;22(2):157-73. DOI: 10.1177/1049732311421616.
- Chlan LL, Weinert CR, Heiderscheit A, et al. Effects of patient-directed music intervention on anxiety and sedative exposure in critically ill patients receiving mechanical ventilatory support: a randomized clinical trial. JAMA 2013;309(22):2335-44. DOI: 10.1001/jama.2013.5670.
- Pun BT, Dunn J. The sedation of critically ill adults: part 2: management. The American journal of nursing 2007;107(8):40-9; quiz 50. DOI: 10.1097/01.NAJ.0000282293.72946.1f.
- Peris A, Bonizzoli M, Iozzelli D, et al. Early intra-intensive care unit psychological intervention promotes recovery from post traumatic stress disorders, anxiety and depression symptoms in critically ill patients. Critical Care 2011;15(1):R41. (http://ccforum.com/content/15/1/R41).
Delirium
Delirium er hyppigt hos den kritisk syge intensivpatient. Tilstanden ses hos op mod 30-80 % af patienterne på intensiv1-6. Det er en akut opstået og alvorlig tilstand, der er associeret med en øget mortalitet, flere dages respiratorbehandling, længere indlæggelse på intensiv og på sygehuset og en højere risiko for kognitive symptomer 3 og 12 måneder efter udskrivelse fra sygehus2,4,5. Hvert døgn med delirium er associeret med 20 % øget risiko for forlænget hospitalsindlæggelse6.
Et studie har vist, at for hver dag patienterne har delirium, øges ét-års mortaliteten med 10 %7. Der er ikke påvist en kausal sammenhæng. Sedations-relateret delirium, der forsvinder kort tid efter seponering af sedationen, har ikke samme dårlige prognose som delirium generelt8.
Delirium kan i særdeleshed være ubehageligt for patienten og de pårørende, men det udgør også en betydelig udfordring for personalet omkring patienten.
Delirium kan være vanskeligt at erkende, og tilstanden er formentlig underdiagnosticeret. Udvikling af delirium på intensiv bør opfattes som et organsvigt på niveau med svigt af andre organer.
Symptombillede
Delirium er kendetegnet ved en ofte fluktuerende tilstand med ændringer i bevidsthedsniveau og kognition. Der skelnes mellem hyperaktivt, hypoaktivt og blandet delirium, der fordeler sig med hhv. ca. 23 %, 50 % og 28 %9. Patienten med delirium har nedsat evne til at fokusere, opretholde eller ændre fokus.
Der er ændret kognition eller opfattelse. Der kan være hukommelsestab, desorientering, taleforstyrrelser og en ændret opfattelsesevne, der ikke skyldes eksisterende demens. Søvnforstyrrelser er hyppige. Der kan ligeledes være hallucinationer, vrangforestillinger og illusioner, men det behøver ikke være til stede.
Tilstanden udvikles oftest over timer til få dage, og vil typisk svinge i løbet af døgnet10.
Patienter med hyperaktivt delirium er ofte agiterede, rastløse, psykomotorisk hyperaktive og seponerer ofte tuber, katetre mv. De kan være aggressive, udadreagerende og emotionelt labile.
Patienter med hypoaktivt delirium er typisk tilbagetrukne, apatiske, sløve og psykomotorisk hypoaktive. De kan udvise tegn på depression og har forlænget reaktionstid.
Tilstand med blandet delirium ses også ofte.
Patogenese
Patogenesen bag delirium kendes ikke, den er formentlig multifaktoriel. Der findes forskellige kendte disponerende faktorer. Vægtningen af de forskellige faktorer er uafklaret, og det er ligeledes uafklaret, hvilke der har betydning for den intensive patient11.
Faktorerne kan opdeles i de ikke-korrigerbare og de potentielt korrigerbare12-14.
Ikke-korrigerbare faktorer (ikke-prioriteret rækkefølge):
- Tidligere delirøse episoder
- Alder (stigende)
- Tobaks- og alkoholforbrug
- Misbrug
- Komorbiditet:
- Demens, kognitiv påvirkning
- Tidligere apopleksi
- Tidligere traumatisk hjerneskade
- Psykisk sygdom
- Neurodegenerativ lidelse
- Hypertension
Potentielt korrigerbare faktorer:
- Sygdommens sværhedsgrad (APACHE/SAPS-score)
- Akut kirurgi før indlæggelse på intensiv
- Indlæggelsestiden på intensiv
- Medicin, særligt benzodiazepiner, opioider og steroid
- Abstinenser
- Infektioner, feber
- Smerter
- Anæmi
- Sedation
- Hypoxi, acidose, elektrolytforstyrrelser
- Hæmodynamisk instabilitet
- Respiratordyssynkroni
- Immobilisation
- Sonder og katetre
- Stress, frustrationer
- Manglende/forstyrret søvn
- Høre- og synsnedsættelse
- Støj/uro/alarmer
- Manglende dagslys
- Isolation
Diagnosticering
Delirium er en klinisk diagnose og patienter på intensiv bør screenes systematisk, da tilstanden, især den hypoaktive form, kan være svær at opdage. Det skærper desuden opmærksomheden hos personalet, så potentielt korrigerbare risikofaktorer kan forebygges og non-farmakologiske tiltag hurtigere kan iværksættes.
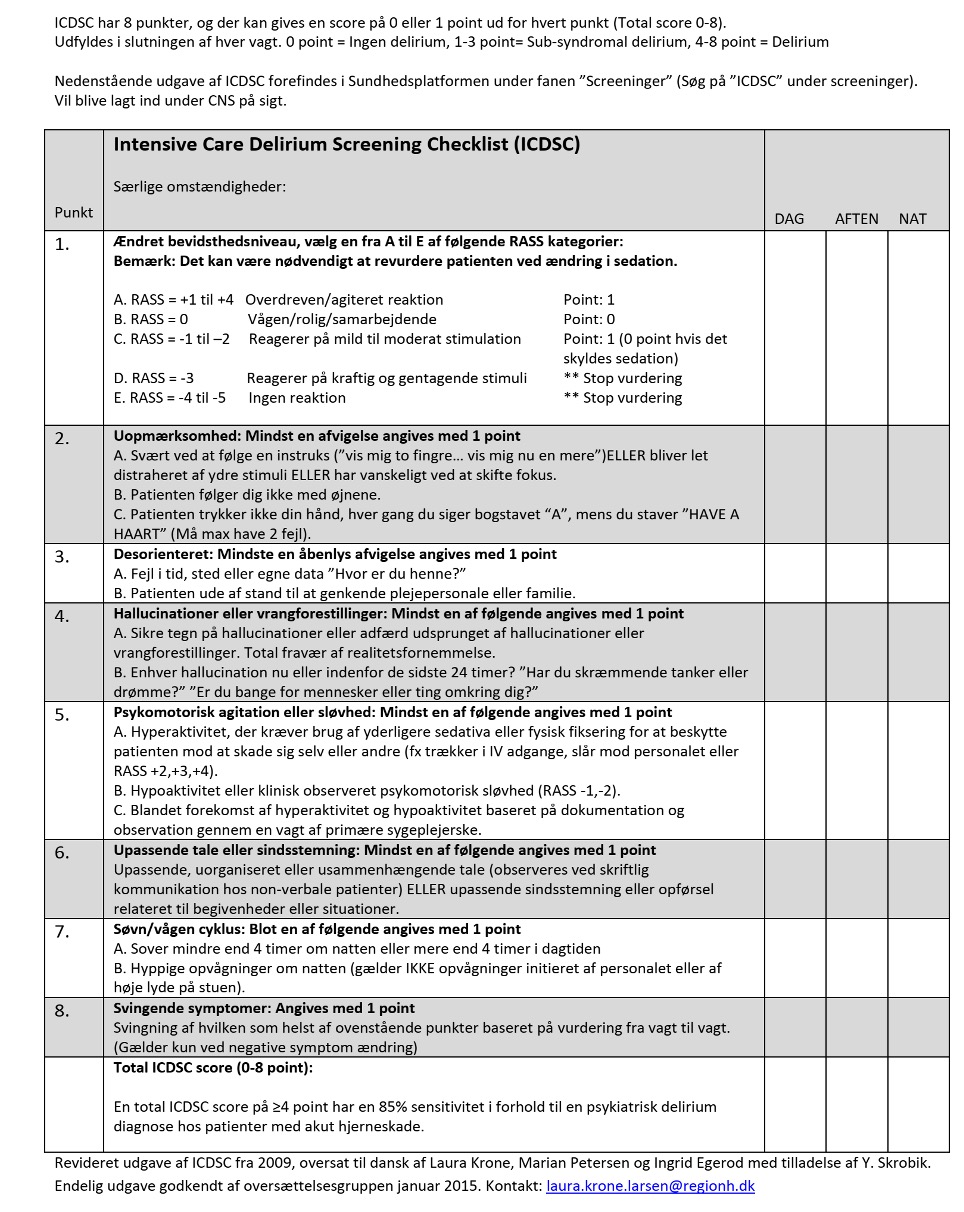
Der findes flere validerede screeningsmetoder, hyppigst anvendes CAM-ICU (Confusion Assessment Method of the Intensive Care Unit) eller ICDSC (Intensive Care Delirium Screening Checklist).
Med CAM-ICU kan man på få minutter screene for delirium15. Den er ikke valideret til patienter med akutte hjerneskader (traumer, SAH, apopleksi mfl.). ICDSC er også velvalideret, og kan anvendes. Både sensitivitet og specificitet er høj for begge tests16.
Det er ikke vist, at screening for delir ændrer på mortalitet, indlæggelsestid eller risiko for udvikling af langvarige kognitive symptomer11. Det er muligt at man ved screening og behandling kan mildne og afkorte de delirøse episoder17.
Forebyggelse og behandling
Forebyggende non-farmakologiske tiltag bør tidligt iværksættes, særligt til udsatte patienter (ældre, komorbiditet, tidligere delir.) Disponerende faktorer bør så vidt muligt behandles og elimineres, særligt anbefales at undgå polyfarmaci med cerebralt aktive stoffer, eksempelvis sedativa og opioider18,19.
Der er ikke evidens for, at delirium kan forebygges med farmakologisk behandling16.
Hvis farmakologisk behandling findes indiceret, anbefales lavest mulige dosis i kortest mulige tid.
Behandlingen af delirium er symptomatisk og bør rettes mod følgende:
- Den sygdom, der har ført patienten på intensiv.
- De komplikationer, der evt. måtte tilstøde.
- De korrigerbare faktorer der måtte være, f.eks. smerter eller abstinenser.
- Daglig grundig medicingennemgang.
Målet for behandlingen er ikke nødvendigvis at gøre patienterne deliriumfrie, da det ofte ikke er muligt, så længe patienten er indlagt på intensiv. Målet er, at patienterne skal lindres og bringes i en tilstand, hvor de kan modtage intensiv pleje og behandling.
Non-farmakologiske tiltag: Sigter mod at mindske og, om muligt, eliminere de disponerende faktorer16,17.
Man bør forsøge at:
- Mobilisere tidligt.
- Optimere syn og hørelse – sikre at pt har egne briller og høreapparater.
- Kommunikere i korte sætninger, med konkret indhold og kort tidshorisont.
- Hyppigt orientere om tid og sted.
- Reducere stimuli fra alarmer, TV og personale.
- En døgnrytmeplan er ofte en fordel, og man kan forsøge at forebygge delir ved at fastholde en døgnrytme. Det bør forsøges at sikre patienten en god søvn. Er patienten først blevet delirøs, bør man kun af uopsættelige årsager vække patienten, når denne sover.
- Nærvær, men uden at overskride patientens intimsfære unødigt, beroligelse, evt. fast vagt.
Det er vist, at tidlig, aktiv fysio- og ergoterapi i forbindelse med daglig vækning af respiratorpatienter reducerer antallet af dage med delirium20.
Farmakologisk behandling:
Der er ikke evidens for effekt af farmakologisk behandling af delirium, og derfor anbefales ikke rutinemæssig brug, hverken af haloperidol, 2. generations antipsykotika eller dexmedetomidin16,21-26.
Hvis patienterne er forpinte, udadreagerende, selvskadende eller i en tilstand hvor de ikke er i stand til at modtage relevant pleje og behandling, kan det efter en lægelig individuel vurdering være relevant at forsøge at behandle farmakologisk. Effekten af behandlingen bør følges og dokumenteres. Desuden bør man være opmærksom på, at behandlingen seponeres, når patienten udskrives fra intensiv, eller at der laves en kortvarig udtrapningsplan for at hindre unødig, længerevarende medicinering af patienterne27,28. Medicinsk behandling er som anført symptomatisk og rettet mod natlig uro, seponerende adfærd, angst og mistroiskhed, manglende evne til at udtrappe respiratorbehandlingen mv. og bør betragtes som et tiltag, der kan bringe patienterne i en tilstand, hvor de kan modtage behandling for deres primære sygdom.
Et ældre studie har vist ligeværdig effekt af Haloperidol og Olanzapin, men patienter, der fik Olanzapin havde ikke ekstrapyramidale bivirkninger. Lette ekstrapyramidale bivirkninger sås i haloperidolgruppen29. Haloperidol er ikke vist at reducere forekomsten eller varigheden af delirium. Dog må haloperidol på baggrund af et dansk initieret multicenterstudie betragtes som et relativt sikkert valg i behandlingen af delirium hos kritisk syge patienter23,30,31.
Det er muligt, at dexmedetomidin forkorter varigheden af delirium og tid i respirator hos patienter med agiteret delirium26,32-34.
Generelt gælder for antipsykotika, at de fremkalder en såkaldt specifik dæmpning, så patienten bliver mere indifferent over for ydre stresspåvirkninger og indre ubehagelige impulser uden nødvendigvis at blive sederet. Det antages, at denne symptomdæmpning er medvirkende til den antipsykotiske virkning. Samtidig vil der ofte også indtræde en dæmpning af emotionalitet og af spontan aktivitet og initiativ. Den antipsykotiske virkning indtræder først efter ugers behandling.
Overordnet er der ikke evidens for at foretrække det ene præparat frem for det andet, og det vil derfor altid bero på en lægefaglig vurdering, hvilket præparat, der foretrækkes.
Medikamenter:
- Haloperidol: 1. Generations lavdosis antipsykotikum med ringe sedativ og antikolinerg effekt (dosisafhængigt).
- Kan administreres p.o./i.v./(i.m.)
- Elektrolytforstyrrelser bør korrigeres før behandling med haloperidol påbegyndes, grundet risiko for udvikling af ventrikulære arytmier.
- QTc-forlængelse kan ses, arytmi i form af torsade de pointes ses yderst sjældent. Der bør udvises forsigtighed ved samtidig behandling med andre stoffer, der kan give QTc-forlængelse f.eks. erythromycin35.
- Ekg bør foreligge før eller hurtigst muligt efter at behandling påbegyndes. Hvis patienterne udskrives til stamafdeling med haloperidol, bør der ligeledes foreligge et nyt ekg til dokumentation for normalt QTc-interval.
- Forsigtighed bør udvises hos ældre og hos patienter med leverinsufficiens.
- Hurtig intravenøs indgift kan give hypotension og bradykardi.
- Bør undgås ved nyligt AMI.
- generations antipsykotika: Olanzapin, Risperidon og Quetiapin
- Administreres PO/i sonde. Olanzapin findes også til i.m./i.v. injektion, men erfaring hos intensivpatienter savnes36.
- Nogen sedativ effekt (Olanzapin og Quetiapin mere end Risperidon), nogen antikolinerg effekt (Olanzapin og Quetiapin mere end Risperidon), færre ekstrapyramidale bivirkninger end Haloperidol
- Har umiddelbar angstdæmpende effekt og bør således være 1.valg ved angst i forbindelse med delirium.
- Forsigtighed bør udvises hos ældre og patienter med leverinsufficiens, nyreinsufficiens samt ved strukturel hjerneskade. Her foretrækkes Risperidon som 1. valg.
- Hvis præparaterne anvendes mod natlig uro, skal de administreres nogle timer før ønsket effekt.
- Risiko for forlænget QT er lavere ved Olanzapin37.
- Benzodiazepiner:
- Er en potentiel risikofaktor for udvikling af delirium og er derfor ikke primære valg ved behov for medicinsk behandling af intensivdelirium.
- Ved seponerende/udadreagerende adfærd kan små doser benzodiazepin (f.eks. Midazolam) anvendes som escape.
- Oxapax foretrækkes i øvrigt ved angst og uro.
- Forsigtighed bør udvises hos ældre og patienter med leverinsufficiens.
- Dexmedetomidin:
- α2-receptoragonist
- Kan anvendes til at sikre bedre døgnrytme hos patienter præget af natlig uro.
- Forkorter muligvis varigheden af delirium.
- Reducerer tid i respirator for patienter med agiteret delir.
- Forsigtighed bør udvises hos patienter med leverinsufficiens.
- Risiko for udvikling af AV-blok, bradycardi, hypotention og stigende temperatur.
Medicinsk behandling af hypoaktivt delirium:
Ved angst og søvnproblemer kan et 1. eller 2. generations antipsykotikum forsøges.:
- Olanzapin 5-10 mg vesp., dosis kan øges til maksimalt 20 mg, i korte perioder op til 40 mg.
- Lavdosis inj. Haloperidol 1-5 mg iv vesp. evt. med øgning til 1-5 mg x 2-3.
- Til ældre og patienter med hjerneskade foretrækkes tabl. Risperidon 0,5-2 mg vesp, da det er mindre sederende.
Medicinsk behandling af hyperaktivt/blandet delirium:
- Olanzapin 5-10 mg vesp., dosis kan øges til maksimalt 20 mg og evt. deles i to, hvis der er behov for den sedative effekt i løbet af dagtid.
- Quetiapin 50-100 mg vesp., dosis kan øges til 200 mg og evt. deles i to, hvis der er behov for den sedative effekt i løbet af dagtid.
- Risperidon 0,5-2 mg vesp., dosis kan øges til 2-4 mg
- Lavdosis inj. Haloperidol 1-5 mg i.v. vesp. evt. med øgning til 1-5 mg x 2-3.
- Dexmedetomidin, initial dosis 0,7 µg/kg/t, dosis justeres til 0,2-1,4 µg/kg/t
Behandlingsresistent hyperaktivt delirium:
- Quetiapin 50-100 mg vesp. Dosis kan øges med 50-100 mg/dag til 800 mg, der er dog kun sjældent behov for doser > 100 mg x 2
- Maksimal dosis Haloperidol er 20 mg.
- Sedation af patienten kan i disse tilfælde være nødvendigt.
Opmærksomhed på, at antipsykotika i sjældne tilfælde kan være medvirkende årsag til delirium.
Der er ikke evidens for anvendelse af ECT til behandling af delirium, men det kan overvejes til patienter med behandlingsrefraktært delirium, hvor øvrige behandlingsmuligheder er udtømte19,38.
- Rudolph JL, Jones RN, Levkoff SE, et al. Derivation and validation of a preoperative prediction rule for delirium after cardiac surgery. Circulation 2009;119(2):229-36. DOI: 10.1161/CIRCULATIONAHA.108.795260.
- Salluh JI, Wang H, Schneider EB, et al. Outcome of delirium in critically ill patients: systematic review and meta-analysis. BMJ 2015;350:h2538. DOI: 10.1136/bmj.h2538.
- Brummel NE, Jackson JC, Pandharipande PP, et al. Delirium in the ICU and subsequent long-term disability among survivors of mechanical ventilation. Crit Care Med 2014;42(2):369-77. DOI: 10.1097/CCM.0b013e3182a645bd.
- Ely EW, Shintani A, Truman B, et al. Delirium as a predictor of mortality in mechanically ventilated patients in the intensive care unit. JAMA 2004;291(14):1753-1762. (http://www.ncbi.nlm.nih.gov/pubmed/15082703).
- Pandharipande PP, Girard TD, Ely EW. Long-term cognitive impairment after critical illness. The New England journal of medicine 2014;370(2):185-6. DOI: 10.1056/NEJMc1313886.
- Ely EW, Gautam S, Margolin R, et al. The impact of delirium in the intensive care unit on hospital length of stay. Intensive Care Med 2001;27(12):1892-900. DOI: 10.1007/s00134-001-1132-2.
- Pisani MA, Kong SY, Kasl SV, Murphy TE, Araujo KL, Van Ness PH. Days of delirium are associated with 1-year mortality in an older intensive care unit population. American journal of respiratory and critical care medicine 2009;180(11):1092-7. DOI: 10.1164/rccm.200904-0537OC.
- Patel SB, Poston JT, Pohlman A, Hall JB, Kress JP. Rapidly reversible, sedation-related delirium versus persistent delirium in the intensive care unit. American journal of respiratory and critical care medicine 2014;189(6):658-65. DOI: 10.1164/rccm.201310-1815OC.
- la Cour KN, Andersen-Ranberg NC, Weihe S, et al. Distribution of delirium motor subtypes in the intensive care unit: a systematic scoping review. Crit Care 2022;26(1):53. DOI: 10.1186/s13054-022-03931-3.
- Sorrell JM. Diagnostic and Statistical Manual of Mental Disorders-5: implications for older adults and their families. Journal of psychosocial nursing and mental health services 2013;51(3):19-22.
- Devlin JW, Skrobik Y, Gelinas C, et al. Clinical Practice Guidelines for the Prevention and Management of Pain, Agitation/Sedation, Delirium, Immobility, and Sleep Disruption in Adult Patients in the ICU. Crit Care Med 2018;46(9):e825-e873. (In eng). DOI: 10.1097/ccm.0000000000003299.
- Van Rompaey B, Elseviers MM, Schuurmans MJ, Shortridge-Baggett LM, Truijen S, Bossaert L. Risk factors for delirium in intensive care patients: a prospective cohort study. Crit Care 2009;13(3):R77. DOI: 10.1186/cc7892.
- Ouimet S, Kavanagh BP, Gottfried SB, Skrobik Y. Incidence, risk factors and consequences of ICU delirium. Intensive Care Med 2007;33(1):66-73. DOI: 10.1007/s00134-006-0399-8.
- Zaal IJ, Devlin JW, Peelen LM, Slooter AJ. A systematic review of risk factors for delirium in the ICU. Crit Care Med 2015;43(1):40-7. DOI: 10.1097/CCM.0000000000000625.
- Ely EW, Inouye SK, Bernard GR, et al. Delirium in mechanically ventilated patients: validity and reliability of the confusion assessment method for the intensive care unit (CAM-ICU). JAMA 2001;286(21):2703-10. DOI: 10.1001/jama.286.21.2703.
- Bergeron N, Dubois MJ, Dumont M, Dial S, Skrobik Y. Intensive Care Delirium Screening Checklist: evaluation of a new screening tool. Intensive Care Med 2001;27(5):859-64. DOI: 10.1007/s001340100909.
- van den Boogaard M, Pickkers P, van der Hoeven H, Roodbol G, van Achterberg T, Schoonhoven L. Implementation of a delirium assessment tool in the ICU can influence haloperidol use. Crit Care 2009;13(4):R131. DOI: 10.1186/cc7991.
- Palakshappa JA, Hough CL. How We Prevent and Treat Delirium in the ICU. Chest 2021;160(4):1326-1334. DOI: 10.1016/j.chest.2021.06.002.
- Pedersen TA. Forebyggelse og behandling af organisk delirium: National klinisk retningslinje. 2021.
- Schweickert WD, Pohlman MC, Pohlman AS, et al. Early physical and occupational therapy in mechanically ventilated, critically ill patients: a randomised controlled trial. Lancet 2009;373(9678):1874-1882. DOI: S0140-6736(09)60658-9 [pii];10.1016/S0140-6736(09)60658-9 [doi].
- Devlin JW, Al-Qadhee NS, Skrobik Y. Pharmacologic prevention and treatment of delirium in critically ill and non-critically ill hospitalised patients: a review of data from prospective, randomised studies. Best Pract Res Clin Anaesthesiol 2012;26(3):289-309. DOI: 10.1016/j.bpa.2012.07.005.
- Andersen CU, Høimark L, Dabrowski K, Hansen KB, Sædder E. Sparsom evidens for antipsykotika til behandling af organisk delirium. Ugeskrift for laeger 2013;176:V11130658.
- Andersen-Ranberg NC, Poulsen LM, Perner A, et al. Haloperidol for the Treatment of Delirium in ICU Patients. The New England journal of medicine 2022;387(26):2425-2435. DOI: 10.1056/NEJMoa2211868.
- Girard TD, Exline MC, Carson SS, et al. Haloperidol and Ziprasidone for Treatment of Delirium in Critical Illness. The New England journal of medicine 2018;379(26):2506-2516. DOI: 10.1056/NEJMoa1808217.
- Liu SB, Liu S, Gao K, Wu GZ, Zu G, Jie Liu J. Olanzapine for the treatment of ICU delirium: a systematic review and meta-analysis. Ther Adv Psychopharmacol 2023;13:20451253231152113. DOI: 10.1177/20451253231152113.
- Shehabi Y, Howe BD, Bellomo R, et al. Early Sedation with Dexmedetomidine in Critically Ill Patients. The New England journal of medicine 2019;380(26):2506-2517. (In eng). DOI: 10.1056/NEJMoa1904710.
- Tomichek JE, Stollings JL, Pandharipande PP, Chandrasekhar R, Ely EW, Girard TD. Antipsychotic prescribing patterns during and after critical illness: a prospective cohort study. Crit Care 2016;20(1):378. DOI: 10.1186/s13054-016-1557-1.
- Marshall J, Herzig SJ, Howell MD, et al. Antipsychotic utilization in the intensive care unit and in transitions of care. J Crit Care 2016;33:119-24. DOI: 10.1016/j.jcrc.2015.12.017.
- Skrobik YK, Bergeron N, Dumont M, Gottfried SB. Olanzapine vs haloperidol: treating delirium in a critical care setting. Intensive Care Med 2004;30(3):444-9. DOI: 10.1007/s00134-003-2117-0.
- Marra A, Vargas M, Buonanno P, Iacovazzo C, Kotfis K, Servillo G. Haloperidol for preventing delirium in ICU patients: a systematic review and meta-analysis. Eur Rev Med Pharmacol Sci 2021;25(3):1582-1591. DOI: 10.26355/eurrev_202102_24868.
- Andersen-Ranberg NC, Barbateskovic M, Perner A, et al. Haloperidol for the treatment of delirium in critically ill patients: an updated systematic review with meta-analysis and trial sequential analysis. Crit Care 2023;27(1):329. DOI: 10.1186/s13054-023-04621-4.
- Reade MC, Eastwood GM, Bellomo R, et al. Effect of Dexmedetomidine Added to Standard Care on Ventilator-Free Time in Patients With Agitated Delirium: A Randomized Clinical Trial. Jama 2016;315(14):1460-8. (In eng). DOI: 10.1001/jama.2016.2707.
- Burry L, Hutton B, Williamson DR, et al. Pharmacological interventions for the treatment of delirium in critically ill adults. The Cochrane database of systematic reviews 2019;9(9):CD011749. DOI: 10.1002/14651858.CD011749.pub2.
- Burry LD, Cheng W, Williamson DR, et al. Pharmacological and non-pharmacological interventions to prevent delirium in critically ill patients: a systematic review and network meta-analysis. Intensive Care Med 2021;47(9):943-960. DOI: 10.1007/s00134-021-06490-3.
- Haloperidol. Promedicin.dk. (https://pro.medicin.dk/Medicin/Praeparater/68#a140).
- Khorassani F, Saad M. Intravenous Olanzapine for the Management of Agitation: Review of the Literature. Ann Pharmacother 2019;53(8):853-859. DOI: 10.1177/1060028019831634.
- (https://www.cardio.dk/arytmi-risiko-ved-anvendelse-af-psykofarmaka-2022).
- Nielsen RM, Olsen KS, Lauritsen AO, Boesen HC. Electroconvulsive therapy as a treatment for protracted refractory delirium in the intensive care unit–five cases and a review. J Crit Care 2014;29(5):881 e1-6. DOI: 10.1016/j.jcrc.2014.05.012.
Dyspnø
Definition
Dyspnø defineres som en subjektiv fornemmelse af ubehag/anstrengelse ved vejrtrækning, lufthunger eller kvælning1,2. Det er et komplekst og ubehageligt symptom, som kan opleves af patienter med respiratorisk svigt og som kan vedligeholdes eller forværres af mekanisk ventilation3.
Introduktion
Trods det faktum at dyspnø er et af de hyppigst forekommende og svært belastende symptomer hos kritisk syge patienter med lige så mange psykiske og kliniske konsekvenser som smerte, har det kun fået lidt opmærksomhed, og forekomsten monitoreres ikke regelmæssigt på intensiv afdelinger 4-6. På den baggrund er forekomsten formodentlig underdiagnosticeret og tilstanden ofte ubehandlet7. I et studie fra 2022 med 612 respiratorbehandlede patienter rapporterede 34 % dyspnø, 71 % brugte termen ”lufthunger”, mens 25 % oplevede meget anstrengende vejrtrækning (excessive respiratory effort) 6.
Dyspnø kan optræde trods objektivt upåfaldende respirationsmønster og er lige så hyppigt forekommende hos respiratorbehandlede som ikke respiratorbehandlede patienter 4. Kompleksiteten af symptomet kan blandt andet forklares ved, at dyspnø afledes af interaktioner mellem multiple fysiologiske, psykologiske, sociale og miljøbestemte faktorer, men dyspnø har oftest organisk oprindelse. Hos mekanisk ventilerede patienter med ARDS kan lungeprotektiv ventilation og permissiv hypercapni medføre en oplevelse af lufthunger opstået som følge af øget respiratorisk drive projiceret til cortex cerebri6. Fornemmelsen er uafhængigt associeret med angst, og den oftest følgende panik/agitation kan vanskeliggøre patientens accept af nødvendig terapi, herunder respiratorbehandling2,3,8,9. Dyspnø er associeret med post-ICU depression og PTSD6,10. Behandlingen bør rettes mod udløsende årsager, men kan ved utilstrækkelig effekt heraf nødvendiggøre medikamentel behandling10.
Beskrivelse
Symptomer
Identifikation må, på basis af dyspnøens subjektive karakter, primært bero på en opfordret eller spontan selvrapportering. Systematisk evaluering og score ved hjælp af VAS-score kan øge opmærksomheden på problemet13.
Kan objektivt være ledsaget af uro, takypnø, overfladisk vejrtrækning, øget svedtendens, takykardi, og/eller brug af accessoriske respirationsmuskler med udvikling af hypoksi og/eller hyperkapni. Dyspnø kan forekomme trods en acceptabel blodgasanalyse også hos den respiratorbehandlede patient 2,11. En sederet patient ude af stand til at kommunikere kan opleve lufthunger trods indtryk af en komfortabel patient.
Årsager
Respiratoriske: Bronkospasme, pneumothorax, infektion, luftvejsobstruktion (ødem, sekret, aspiration, fremmedlegeme), lungeemboli og atelektase.
Non respiratoriske: Akut myokardieinfarkt, akut blødning/anæmi/hypovolæmi, hjertesvigt, hjertetamponade, feber/sepsis, acidose 2.
Angst og smerte kan udløse dyspnø, men kan også være et resultat af dyspnø 3,9.
Ikke-optimal respiratorindstilling11 skal overvejes, hvis patienten angiver dyspnø, også selvom patienten umiddelbart har respirationsbevægelser synkront med respiratoren og en normal syre-base status 12. Udover ukoordinerede thorakoabdominale bevægelser, kan tegn på respirator-patient-asynkroni være angst, agitation, takypnø, brug af accessoriske respirationsmuskler, takykardi, hypotension og arytmier. Ventilation på tynd tube, eller delvis okklusion af tuben, vil ofte give dyspnø, og skal altid overvejes som udløsende årsag.
Lungeprotektiv ventilation med små tidalvolumina: Ved nedsat gas udveksling kan neurale input fra chemoreceptorer samt receptorer fra lunge og thoraxvæg øge det respiratorisk drive og medføre en reflektorisk øgning i tidalvolumina. Intuberede og mekanisk ventilerede patienter kan have en oplevelse af ikke at få luft nok.
Strategi
Forebyggelse
Sikre at patienten er rolig og tryg (smertefri, angstfri, velinformeret og accepterer behandling).
Rutinemæssig monitorering af patienten, inklusiv kontrol af syre-basestatus, således at vejrtrækningsbesvær erkendes og behandles så tidligt som muligt.
Sufficient ilttilbud og kuldioxidudluftning herunder optimal respiratorindstilling og optimering af hæmodynamik.
Sedation ved kritisk hypoxi/hyperkapni. OBS: En sederet patient kan ikke give udtryk for lufthunger og propofol menes ikke at lindre dyspnø10.
Udredning
Følgende undersøgelser kan anvendes til vurdering af årsagen1:
Wake up-call hvis muligt, vil give patienten mulighed for at kommunikere med personalet10.
Inspektion af tuben: Kompression, kinkning, tegn på okklusion eller sekret.
Inspektion af thorax-/abdominal bevægelser, lungestetoskopi, respirationsfrekvens, BT.
Blodgasanalyse, pulsoxymetri, end-tidal CO2.
Respirator-værdier: Tidalvolumen, compliance, evt. forekomst af auto-PEEP, luftvejstryk.
Insufficient trigning af respirator, eller auto-trigning.
Røntgen af thorax, endoskopi af øvre luftveje, ultralyd af thorax, ekg.
Behandling
Nonfarmakologisk behandling
Terapien rettes mod udløsende årsager, som søges korrigeret.
Optimering af respiratorindstillinger. En undersøgelse har vist, at 35 % af patienter med dyspnø responderede på ændrede respiratorindstillinger og den intervention, som hyppigst lindrede patientens dyspnø var øgning i inspiratorisk flow3. Når muligt, spontan respiration, som tillader patienten at lindre symptomer på dyspnø10.
Hos trakeotomerede patienter, som habituelt er mundrespirerende, kan dyspnø eventuelt afhjælpes ved 1-3 liters ilttilskud per os.
Evt. lejringsændring 13.
Farmakologisk behandling
Opioider kan foruden analgetisk effekt også have en lindrende effekt på lufthunger.
Bronkodilaterende medikaminae ved bronkospasme. Anxiolytica. Eventuelt kan dexmedetomidin forsøges.
Såfremt disse tiltag ikke bedrer tilstanden kan patienten kortvarigt sederes, men det er vigtigt at være opmærksom på at det ikke nødvendigvis fjerner patientens symptomer.
Konklusion
Dyspnø er en subjektiv oplevelse af lufthunger, som kan forekomme såvel hos den uintuberede som hos den respiratorbehandlede patient. Hos den respiratorbehandlede patient er det hyppigt og intenst. Dyspnø kan optræde trods objektivt ukompliceret vejrtrækning og normal blodgasanalyse. Dyspnø er stærkt associeret med angst og smerter og bør monitoreres systematisk. Kan udløse symptomer som agitation, panik og dødsangst. PTSD ses hyppigere hos patienter, som har oplevet dyspnø under indlæggelsen på intensiv. Andre symptomer kan være takypnø, brug af accessoriske respirationsmuskler, takykardi, hypotension og arytmier. Hos den respiratorbehandlede patient kan ukoordinerede thorax- og abdominal bevægelser ses i forbindelse med dyspnø.
Forebygges ved information af patienten, analgesi, tryghedsskabende foranstaltninger samt observation og monitorering af såvel respiration, cirkulation som respiratorindstilling. Behandlingen rettes om muligt mod den udløsende årsag.
- Hansen-Flaschen J. Improving patient tolerance of mechanical ventilation. Challenges ahead. Critical care clinics 1994;10(4):659-71. (http://www.ncbi.nlm.nih.gov/pubmed/8000919).
- Dyspnea. Mechanisms, assessment, and management: a consensus statement. American Thoracic Society. American journal of respiratory and critical care medicine 1999;159(1):321-40. DOI: 10.1164/ajrccm.159.1.ats898.
- Schmidt M, Demoule A, Polito A, et al. Dyspnea in mechanically ventilated critically ill patients. Crit Care Med 2011;39(9):2059-65. DOI: 10.1097/CCM.0b013e31821e8779.
- Puntillo KA, Arai S, Cohen NH, et al. Symptoms experienced by intensive care unit patients at high risk of dying. Crit Care Med 2010;38(11):2155-60. DOI: 10.1097/CCM.0b013e3181f267ee.
- Haugdahl HS, Storli SL, Meland B, Dybwik K, Romild U, Klepstad P. Underestimation of Patient Breathlessness by Nurses and Physicians during a Spontaneous Breathing Trial. American journal of respiratory and critical care medicine 2015;192(12):1440-8. (In eng). DOI: 10.1164/rccm.201503-0419OC.
- Demoule A, Hajage D, Messika J, et al. Prevalence, Intensity, and Clinical Impact of Dyspnea in Critically Ill Patients Receiving Invasive Ventilation. American journal of respiratory and critical care medicine 2022;205(8):917-926. DOI: 10.1164/rccm.202108-1857OC.
- Gentzler ER, Derry H, Ouyang DJ, et al. Underdetection and Undertreatment of Dyspnea in Critically Ill Patients. American journal of respiratory and critical care medicine 2019;199(11):1377-1384. (In eng). DOI: 10.1164/rccm.201805-0996OC.
- Parshall MB, Schwartzstein RM, Adams L, et al. An official American Thoracic Society statement: update on the mechanisms, assessment, and management of dyspnea. American journal of respiratory and critical care medicine 2012;185(4):435-52. DOI: 10.1164/rccm.201111-2042ST.
- Schmidt M, Banzett RB, Raux M, et al. Unrecognized suffering in the ICU: addressing dyspnea in mechanically ventilated patients. Intensive Care Med 2014;40(1):1-10. DOI: 10.1007/s00134-013-3117-3.
- Worsham CM, Banzett RB, Schwartzstein RM. Dyspnea, Acute Respiratory Failure, Psychological Trauma, and Post-ICU Mental Health: A Caution and a Call for Research. Chest 2021;159(2):749-756. DOI: 10.1016/j.chest.2020.09.251.
- Keith RL, Pierson DJ. Complications of mechanical ventilation. A bedside approach. Clinics in chest medicine 1996;17(3):439-51. (http://www.ncbi.nlm.nih.gov/pubmed/8875006).
- Tobin MJ. What should a clinician do when a patient “fights the ventilator”? Respir Care 1991;36:395-406.
- Puntillo K, Nelson JE, Weissman D, et al. Palliative care in the ICU: relief of pain, dyspnea, and thirst–a report from the IPAL-ICU Advisory Board. Intensive Care Med 2014;40(2):235-48. (In eng). DOI: 10.1007/s00134-013-3153-z.
Abstinenstilstande
Definition
Abstinens betyder afholdenhed, og abstinenssymptomer optræder efter en reduktion af, eller ophør med anvendelse/indtagelse af et stof, som forud for dette har været anvendt regelmæssigt.
Abstinenssymptomer er resultatet af fysisk afhængighed.
Introduktion
Abstinenssymptomer, der undertiden kan være livstruende, optræder ikke sjældent blandt kritisk syge patienter som følge af abrupt afbrydelse af et kronisk alkoholoverforbrug, kronisk benzodiazepinforbrug, kronisk opioidforbrug eller rygning.
Derudover ses iatrogent påførte abstinenssymptomer jævnligt efter indlæggelse på intensiv og brug af analgetika og sedativa.
Symptomerne afhænger til dels af det anvendte stof, men er som hovedregel relativt ukarakteristiske. Efter indgift/anvendelse af stoffer med kort halveringstid (alkohol og visse opioider) ses abstinenssymptomerne kort tid efter afbrydelse af indgiften, mens der kan gå dage efter seponering af stoffer med lang halveringstid. Forsinket clearance af det aktive stof/aktive metabolitter og dermed senere udvikling af abstinenssymptomer kan ses ved påvirket nyre- og leverfunktion.
Oplysninger om afhængighedsskabende forbrug/misbrug bør om muligt søges tilvejebragt ved indlæggelse på intensivafdeling. Patienter med risiko for udvikling af abstinenser skal observeres omhyggeligt for udvikling af abstinenssymptomer. Derudover bør patienter, der har været behandlet længere tid under indlæggelsen med analgetika/sedativa, monitoreres nøje efter ophør af, eller reduktion af disse.
Alkohol-abstinenser
Baggrund
Alkoholabstinenstilstand er et symptomkompleks, der opstår hos alkoholafhængige individer efter nedgang i eller ophør af et forudgående konstant stort forbrug af alkohol. Den udløses i forbindelse med et fald i koncentrationen af alkohol i CNS.
Symptomerne opstår fordi alkohol er et CNS-dæmpende stof. Alkohol øger den inhibitoriske virkning af GABA og hæmmer den excitatoriske effekt af bl.a. glutamat på NMDA-receptorerne 1 2. Et abrupt fald i alkoholkoncentrationen medfører derfor en manglende inhibition og derved en ureguleret excitation, og symptomerne er derfor karakteriseret ved overaktivitet af det sympatiske nervesystem.
Symptomer
Symptomkomplekset varierer fra milde abstinenssymptomer til svære symptomer tydende på delirium tremens (DT).
| Syndrom | Symptomer | Tid siden sidste alkoholindtag |
| Abstinenssymptomer | Tremor, sved, rastløshed, søvnløshed, hovedpine, koncentrationsbesvær, psykomotorisk uro, kvalme, opkastninger, palpitationer,
let hypertension, let feber |
6 – 36 t |
| Alkoholabstinenskramper | Enkelte eller kortvarige generaliserede tonisk-kloniske kramper, kort post-iktal periode.
Meget sjældent status epilepticus |
6 – 48 t |
| Alkohol hallucinationer | Syns- eller hørehallucinationer | 12 – 48 t |
| Delirium tremens | Ændret bevidsthedsniveau og opmærksomhed,
Kognitive forstyrrelser inkl. desorientering, Psykomotorisk uro, forstyrret søvnrytme, øget angst Forværring af autonome funktioner (sved, kvalme, tremor, hypertension, takykardi)
|
48 – 96 t |
Typisk udvikles de første abstinenssymptomer inden for 6-36 timer efter sidste alkoholindtagelse og varer i de fleste tilfælde 1-3 døgn. Skulle der optræde abstinenslignende symptomer senere i forløbet, bør andre årsager til symptomerne søges.
Alkoholabstinens kramper
Optræder hyppigst indenfor 48 timer efter ophør af alkohol indtagelse. Der ses ofte samtidig andre symptomer på alkoholabstinenstilstand. Risikofaktorer for kramper er en anamnese med tidligere abstinenskramper, stort alkoholforbrug og mange tidligere afrusninger. Kramper kan også ses ved akut alkoholintoxikation.
Kramperne er oftest enkle eller kortvarige. Ved langvarige kramper eller status epilepticus bør anden årsag straks udelukkes. Herunder strukturel eller infektiøs årsag. Ved mindste mistanke bør der foretages supplerende undersøgelser med eksempelvis CT af cerebrum eller lumbalpunktur 3.
Alkoholhallucinationer
Alkoholhallucinationer opstår tidsmæssigt før delirium tremens og er derfor ikke synonymt hermed. Hallucinationerne er oftest visuelle og opstår hos en ellers vågen patient.
Delirium tremens
Er resultatet af manglende behandling eller underbehandling af en alkoholabstinenstilstand og er den mest alvorlige manifestation af alkoholabstinens. Tilstanden udvikles typisk 2-4 døgn efter sidste alkoholindtagelse, men der kan gå helt op til en uge.
Klinisk ligner delirium tremens øvrige delirøse tilstande, men karakteristisk er de udtalte autonome forstyrrelser og visuelle hallucinationer ofte i form af diminutive dyrevisioner.
Ubehandlet er delirium tremens livstruende med en dødelighed på op til 20 %, mens sufficient behandlede tilfælde har en dødelighed på cirka 1 %3.
Alvorlig alkoholabstinenstilstand kan også være associeret med alvorlige forstyrrelser i væske- og elektrolytbalancen;
- Respiratorisk alkalose pga. hyperventilation. Dette kan resultere i nedsat cerebralt blodflow.
- Hypovolæmi pga. svedtendens, opkast, takypnø og nedsat oralt indtag.
- Metabolisk acidose pga. hypoperfusion, alkoholisk ketoacidose eller thiamin-mangel.
- Hypokaliæmi pga. renalt og ekstrarenalt kaliumtab, ændringer i aldosteron koncentration samt ændringer i kaliumdistributionen over cellemembranen.
- Hypomagnesiæmi er hyppigt og øger risikoen arytmier og kramper.
- Hypofosfatæmi pga. malnutrituion. Dette kan i svære tilfælde medvirke til hjertesvigt og rhabdomyolyse.
Behandling
Alkoholabstinenssyndrom er en klinisk diagnose og symptomerne kan maskere andre alvorlige tilstande, som altid skal udelukkes.
Understøttende behandling af respiration, kredsløb, volumendeficit og elektrolytderangering skal behandles. Thiamin og B-combin administreres mhp. at undgå Wernickes encephalopati.
Patienten bør skærmes mod uvedkommende sanseindtryk.
Farmakologisk behandling
- Benzodiazepin er førstevalg i behandlingen af alkoholabstinenssymptomer. Benzodiazepin virker på GABA-receptorerne og har derfor både en forebyggende og behandlende effekt.
- Det er hensigtsmæssigt at vælge et benzodiazepin med så lille misbrugspotentiale som muligt og en lang halveringstid, som f. eks chlordiazepoxid4.
- v.-administration i svære tilfælde. Ellers anbefales oral indgift i øvrige tilfælde.
- Barbiturater (Phenobarbital) kan anvendes til patienter, der ikke har tilstrækkelig effekt af benzodiazepinbehandling. Eventuelt som supplement, da det har en synergistisk additiv effekt4.
- Propofol som kontinuerlig infusion kan anvendes til mekanisk ventilerede patienter, men effekten er mindre veldokumenteret.
- Clonidin og dexmedetomidin kan anvendes som supplement til benzodiazepin, men der er ikke dokumentation for en forebyggende effekt på hverken delirium eller abstinensrelaterede kramper11,12.
Behandlingsstrategi
Der anbefales en standardiseret behandlingsprotokol med anvendelse af et abstinensscoresystem både til vurdering af symptomerne og deraf sværhedsgraden af tilstanden. Endvidere til monitorering af behandlingseffekten.
Abstinensscore – se bilag.
Ved en abstinensscore på 2 eller derover påbegyndes behandling.
Patienten scores som udgangspunkt 1 gang i timen. Ved score 6 eller derover scores hver ½ time.
Behandlingsstrategi
Startdosis ved score 2 eller derover
Tabl. chlordiazepoxid (Klopoxid, Risolid) 50 – 100 mg per os per dosering.
Hvis patienten har svære abstinenssymptomer begyndes med 200 mg per os
Vedligeholdelsesbehandling
Ved score 2-6 gives tabl. chlordiazepoxid 100 mg hver 2. time.
Ved score > 6 gives tabl. chlordiazepoxid 100 mg hver time
Svære abstinenstilstande/delirium tremens
Inj. diazepam i.v. i refrakte doser 5-10 mg hver 10.-15. minut. Gentages til søvn opnås. Patienten skal sove dybt og ikke vågne ved lette stimuli.
Ved indgift > 1000 mg diazepam uden søvn opnås, skal overvejes præparatskift.
Alkoholabstinenskramper
Behandles som udgangspunkt med benzodiazepin.
Kan ved manglende effekt suppleres med carbamazepin 200-(400) mg x 3 dagligt.
Chlordiazepoxid og diazepam metaboliseres i leveren til aktive metabolitter, hvorfor dosering bør justeres, når terapeutisk effekt er opnået hos patienter med betydende nyre- og leverpåvirkning3.
Konklusion
Alkoholabstinenser optræder tidligt efter et fald i alkoholpromillen og kan udvikles til en potentielt livstruende tilstand. Førstevalgsbehandling er benzodiazepin.
Tilstanden monitoreres ved hjælp af et alkoholabstinensscoringsskema og behandlingen titreres efter symptomer.
Opioid-abstinenser
Baggrund
Opioidabstinenser er forbundet med udtalt subjektivt ubehag, men er almindeligvis ufarlige hos i øvrigt somatisk raske personer. Der ses ingen krampeanfald eller udvikling af psykotiske symptomer, som det kan ses ved alkohol- og benzodiazepin-abstinenser.
Patienter behandlet med høj dosis opioid gennem længere tid kan udvikle fysisk afhængighed og dermed abstinenssymptomer ved brat seponering13. Forekomsten af iatrogent induceret opioidafhængighed og efterfølgende abstinenser ved seponering hos voksne intensivpatienter er meget dårligt belyst i litteraturen, men enkelte studier viser en hyppighed på op til 44 %14. Risiko for abstinensudvikling er associeret med dosis og varighed af behandling. Størst risiko for udvikling af abstinenser ses efter kontinuerlig indgift af opioid i mere end 7 dage eller ved døgndosis fentanyl > 5 mg/dag15.
Symptomer
Indre uro, dilaterede pupiller, rastløshed, irritabilitet, øget følsomhed for smerter, kramper,
muskelsmerter, angst, gaben, smasken, tåre- og næseflåd, svedudbrud, gåsehud, kulderystelser, mavekramper, opkastninger, diarre, påskyndet hjerteaktion, feber, BT-stigning og takypnø.
Behandling
Der findes ingen klinisk kontrollerede undersøgelser til belysning af valget af behandlingsstrategi, ligesom der ikke er konsensus for den bedste strategi.
Patienter med kroniske smerter i langtidsbehandling med opioid
Denne patientgruppe bør som hovedregel fortsætte den igangværende behandling. Hvis det ikke er muligt at fortsætte behandlingen med opioid (f.eks. depotformulering), skal der gives et andet opioid i ekvipotente doser for at undgå abstinens-udvikling.
Forebyggelse af abstinenser efter kortvarig opioid behandling hos tidligere opioid-naive patienter
Ved behandling med kontinuerlig højdosis-opioidinfusion i mindre end 7 dage aftrappes infusionen ved en reduktion af dosis med 10-15 % hver 6.- 8. time.
Forebyggelse af abstinenser efter langvarig opioid behandling hos opioid-naive patienter
Ved behandling med kontinuerlig højdosis opioidinfusion i mere end 7 dage anbefales aftrapning med max. 10 % per dag.
Alternativt kan det være hensigtsmæssigt at skifte til peroral behandling med opioid med lang halveringstid (f.eks. methadon).
Fordelen ved methadon frem for andre opioid-agonister er dels en langsom absorption (maksimal plasmakoncentration 2-6 timer), som bevirker, at der ikke initialt kommer nogen udtalt euforiserende effekt, dels en lang halveringstid (15-50 timer), hvilket mindsker risikoen for abstinenssymptomer og samtidig indebærer, at man kan nøjes med at give få doser dagligt.
Behandlingsstrategi
Forslag til omstilling fra kontinuerlig infusion med fentanyl til peroral methadonbehandling
Opioidabstinenser er mere veldokumenterede indenfor pædiatrien end hos voksne. Nedenstående forslag til omlægning fra kontinuerlig infusion fentanyl til peroral methadonbehandling er inspireret af Tobias, Critical Care Medicine, 2010 og derfor ekstrapoleret fra pædiatriske patienter 17.
- Beregn seneste døgndosis fentanyl.
- Såfremt der ikke er sikker GI-funktion, kan det være en fordel at give methadon i.v., indtil der er sikker absorption fra GI-kanalen.
- Startdosis peroral methadon svarer til døgndosis fentanyl x 5-10 fordelt på 2-3 doser.
- Efter 2. perorale methadondosis reduceres fentanyl infusion med 50 %.
- Efter 3. perorale methadondosis reduceres fentanyl med yderligere 50 %.
- Efter 4. perorale methadondosis seponeres fentanyl.
- Opioidabstinenssymptomer kan behandles med morfin 0,1 mg/kg/dosis.
- Den totale mængde morfin indgivet i løbet af 24 timer pga. opioid abstinenser omregnes og lægges til næste dags methadondosis.
- Ved fortsatte abstinenssymptomer de næste 72 timer gives morfin i ovennævnte dosering, men methadondosis ændres ikke indenfor denne periode.
- Hvis patienten bliver for sederet, holdes én methadon dosis tilbage og dosis reduceres med 10-20 %.
- Når en passende dosis er opnået, påbegyndes aftrapningen med 20-25 % af dosis 1 gang om ugen, således at methadon aftrappes over i alt 3-6 uger.
- Patienten bør først flyttes fra intensiv afdeling, når stabil peroral dosering er opnået.
Adjuverende behandling
Clonidin kan nedsætte de metaboliske, respiratoriske og hæmodynamiske påvirkninger, der kan ses i forbindelse med abstinenser og med fordel anvendes som supplement til opioidbehandlingen18.
- Dosis 150 µg x 3 daglig i.v. Eventuelt 75 µg x 6 daglig i.v. ved for kraftig effekt af enkeltdosis.
- Peroral dosering 100-200 µg x 2-4 dagligt p.o.
- Skal aftrappes gradvist over 2-4 dage for at undgå reboundhypertension.
Husk altid at ordinere p.n. medicin, hvis der skulle opstå abstinenssymptomer. Ved hyppigt behov for supplerende doser, kan det være nødvendigt at justere dosis af den faste behandling.
Konklusion
Opioidabstinenser er forbundet med udtalt subjektivt ubehag, men er almindeligvis ufarlige hos i øvrigt somatisk raske personer.
For patienter i kronisk opioidbehandling og opioid-naive patienter, der har været i højdosisbehandling i mere end 1 uge, tilrettelægges en aftrapningsplan under hensyntagen til dosis og varighed af opioid-indgift.
Overgang til peroral behandling med præparat med lang halveringstid (f.eks. methadon) kan være hensigtsmæssig.
Clonidin kan anvendes som adjuverende terapi.
Benzodiazepin-abstinenser
Baggrund
Forekomst af abstinenssymptomer er udover over hos patienter med kronisk benzodiazepinforbrug også beskrevet blandt intensivpatienter behandlet med benzodiazepin som sedativum13. Risikoen for abstinensudvikling ved ophør af indgift er størst efter længerevarende indgift (> 7 dage) af høj dosis benzodiazepin15.
Symptomer
Angst, søvnløshed, rastløshed, tremor, hovedpine, konfusion, psykose, træthed, agitation, øget følsomhed for lys og lyde, paræstesier, muskelkramper, myoklonier, søvnforstyrrelser, svedudbrud, appetitløshed, BT-fald og feber. Alvorligste symptomer er generaliserede krampeanfald og delirium.
Behandling
Patienter i langtidsbehandling med benzodiazepin
Aftrapning efter længerevarende benzodiazepinforbrug/-misbrug er vanskelig og kræver en gradvis og langsom dosisreduktion, ofte over flere måneder. Der er derfor vigtigt i forbindelse med indlæggelse at fortsætte en igangværende behandling med benzodiazepin med det vanlige præparat. Hvis dette ikke kan gennemføres pga. manglende GI-funktion, må der gives ækvivalente doser parenteralt.
Forebyggelse af abstinenser efter langvarig sedation med midazolam til patient i højrisikogruppe
Der tilstræbes langsom aftrapning ved hjælp af peroral benzodiazepin med lang halveringstid. Lorazepam (Temesta) foretrækkes for diazepam, idet sidstnævnte har aktive metabolitter med variabel halveringstid og virkningsvarighed.
Behandlingsstrategi
Forslag til omstilling fra intravenøs midazolam til oral lorazepam
Ligesom ved opioidabstinensbehandling er der begrænset evidens for behandling af voksne hvorfor der igen henvises til pædiatrisk inspireret omstillingsmodel fra Tobias, Critical Care Medicine, 2010 14
- Beregn seneste døgndosis midazolam.
- Såfremt der ikke er sikker GI-funktion, kan det være en fordel at give lorazepam i.v. indtil der er sikker absorption fra GI-kanalen.
- Ækvivalent lorazepamdosis er døgndosis midazolam divideret med 12.
- Startdosis lorazepam gives fordelt på 4 doser peroralt/i sonde.
- Efter 2. dosis lorazepam reduceres midazolaminfusion med 50 %.
- Efter 3. dosis lorazepam reduceres midazolaminfusion med yderligere 50 %.
- Efter 4. dosis lorazepam seponeres midazolaminfusion.
- Benzodiazepinsabstinenser behandles med bolus doser midazolam 0,05-0,1 mg/kg.
- Den totale mængde midazolam indgivet i løbet af 24 timer pga. benzodiazepinabstinenser omregnes og lægges til næste dags lorazepamdosis.
- Når en passende dosis er opnået påbegyndes aftrapningen med 20-25 % af dosis 1 gang om ugen.
- Patienten bør først flytte fra intensivafdeling, når stabil peroral dosering er opnået.
Forebyggelse af abstinenser efter langvarig sedation med både opioid og benzodiazepin til patient i højrisikogruppe
Har patienten både været i behandling med benzodiazepin og opioid gennem længere tid og det vurderes, at der kan optræde abstinenssymptomer efter begge stoffer, bør aftrapningen af benzodiazepin gå forud for opioid, for at undgå at patienten vågner med smerter.
Konklusion
Aftrapning af et kronisk benzodiazepinforbrug/-misbrug er vanskelig og kræver en gradvis og langsom dosisreduktion, ofte over flere måneder. Det anbefales derfor, at disse patienter fortsætter den vanlige behandling.
Efter længerevarende sedation med midazolam i høj dosering bør foretages langsom aftrapning ved hjælp af peroral benzodiazepin med lang halveringstid f.eks. lorazepam. Lorazepam (Temesta ) foretrækkes frem for diazepam.
Nikotinabstinenser
Baggrund
Nikotinabstinenser er beskrevet i The International Classification of Diseases (WHO), 11th revision (ICD-11) 19. Ifølge beskrivelsen er nikotinabstinenser “a clinically significant cluster of symptoms, behaviours and/or physiological features, varying in degree of severity and duration, that occurs upon cessation or reduction of use of nicotine (typically used as a constituent of tobacco) in individuals who have developed Nicotine dependence or have used nicotine for a prolonged period or in large amounts”. På trods af at antallet af aktive rygere også er højt blandt kritisk syge patienter, er litteraturen vedrørende tegn på nikotin-abstinenser samt forebyggelse og behandlingsmuligheder kun sparsom for denne patientpopulation.
Symptomer
Symptomerne på nikotinabstinenser er generelt ufarlige og omfatter irritabilitet, frustration, vrede, angst, sænket stemningsleje, rastløshed, koncentrationsbesvær, søvnløshed og nedsat hjertefrekvens. Symptomerne starter typisk 1-2 dage efter ophør, vil være mest udtalte indenfor den første uge og i de fleste tilfælde forsvinde i løbet 2-4 uger3.
En egentlig symptombeskrivelse blandt intensivpatienter findes ikke, men aktiv rygning er vist at være en uafhængig risikofaktor for agitation og delirium20,21.
Behandling
I et systematisk review fra 2014 gennemgås 7 studier, der omhandler resultaterne af nikotinsubstitutionsbehandling i intensive populationer med det formål at evaluere evidensen for anvendelse af denne behandling. De konkluderer på baggrund af analysen, at substitutionsbehandling ikke bør anvendes rutinemæssigt, men begrænses til patienter, hvor gevinsten ved behandling vejer tungere end risikoen, da evidens for effektivitet er usikker og der er en tendens til øget toxicitet blandt behandlede patienter22.
I et nyere systematisk review fra 2016 gennemgås 6 studier med det formål at vurdere om behandling med nikotinsubstitution reducerer forekomsten af agitation og delirium blandt kritisk syge patienter. Forfatterne konkluderer, at der er utilstrækkelig evidens for at anvende profylaktisk nikotinsubstitution til behandling af agitation og delirium hos rygere indlagt på intensivafdeling23 21.
Konklusion
Da abstinenssymptomer ved rygeophør er ufarlige og behandling med nikotinsubstitution kan være forbundet med bivirkninger, kan det ikke anbefales at anvende det rutinemæssigt. Såfremt en patient med kendt større nikotinforbrug udvikler svær agitation, der ikke kan forklares ud fra andre udløsende årsager, kan nikotinsubstitution overvejes.
- Morrow AL, Suzdak PD, Karanian JW, Paul SM. Chronic ethanol administration alters gamma-aminobutyric acid, pentobarbital and ethanol-mediated 36Cl- uptake in cerebral cortical synaptoneurosomes. J Pharmacol Exp Ther 1988;246(1):158-64. (https://www.ncbi.nlm.nih.gov/pubmed/2839659).
- Hoffman PL, Grant KA, Snell LD, Reinlib L, Iorio K, Tabakoff B. NMDA receptors: role in ethanol withdrawal seizures. Ann N Y Acad Sci 1992;654:52-60. DOI: 10.1111/j.1749-6632.1992.tb25955.x.
- Awissi DK, Lebrun G, Fagnan M, Skrobik Y, Regroupement de Soins Critiques RdSRQ. Alcohol, nicotine, and iatrogenic withdrawals in the ICU. Crit Care Med 2013;41(9 Suppl 1):S57-68. DOI: 10.1097/CCM.0b013e3182a16919.
- Nielsen AS, Becker U, Højgaard B, et al. Alkoholbehandling: en medicinsk teknologivurdering: Sundhedsstyrelsen, Center for medicinsk teknologivurdering København, 2006.
- Hoey LL, Nahum A, Vance-Bryan K. A prospective evaluation of benzodiazepine guidelines in the management of patients hospitalized for alcohol withdrawal. Pharmacotherapy 1994;14(5):579-85. (http://www.ncbi.nlm.nih.gov/pubmed/7997391).
- Daeppen JB, Gache P, Landry U, et al. Symptom-triggered vs fixed-schedule doses of benzodiazepine for alcohol withdrawal: a randomized treatment trial. Arch Intern Med 2002;162(10):1117-21. DOI: 10.1001/archinte.162.10.1117.
- DeCarolis DD, Rice KL, Ho L, Willenbring ML, Cassaro S. Symptom-driven lorazepam protocol for treatment of severe alcohol withdrawal delirium in the intensive care unit. Pharmacotherapy 2007;27(4):510-8. DOI: 10.1592/phco.27.4.510.
- Gold JA, Rimal B, Nolan A, Nelson LS. A strategy of escalating doses of benzodiazepines and phenobarbital administration reduces the need for mechanical ventilation in delirium tremens. Crit Care Med 2007;35(3):724-30. DOI: 10.1097/01.CCM.0000256841.28351.80.
- Heavner JJ, Akgun KM, Heavner MS, et al. Implementation of an ICU-Specific Alcohol Withdrawal Syndrome Management Protocol Reduces the Need for Mechanical Ventilation. Pharmacotherapy 2018;38(7):701-713. DOI: 10.1002/phar.2127.
- Umar Z, Haseeb Ul Rasool M, Muhammad S, et al. Phenobarbital and Alcohol Withdrawal Syndrome: A Systematic Review and Meta-Analysis. Cureus 2023;15(1):e33695. DOI: 10.7759/cureus.33695.
- McKeon A, Frye MA, Delanty N. The alcohol withdrawal syndrome. Journal of neurology, neurosurgery, and psychiatry 2008;79(8):854-62. DOI: 10.1136/jnnp.2007.128322.
- Schmidt KJ, Doshi MR, Holzhausen JM, Natavio A, Cadiz M, Winegardner JE. Treatment of Severe Alcohol Withdrawal. Ann Pharmacother 2016;50(5):389-401. DOI: 10.1177/1060028016629161.
- Barr J, Fraser GL, Puntillo K, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med 2013;41(1):263-306. DOI: 10.1097/CCM.0b013e3182783b72.
- Fox MA, Carothers C, Dircksen KK, Birrer KL, Choi MJ, Mukkera SR. Prevalence and Risk Factors for Iatrogenic Opioid Withdrawal in Medical Critical Care Patients. Crit Care Explor 2023;5(5):e0904. DOI: 10.1097/CCE.0000000000000904.
- Cammarano WB, Pittet JF, Weitz S, Schlobohm RM, Marks JD. Acute withdrawal syndrome related to the administration of analgesic and sedative medications in adult intensive care unit patients. Crit Care Med 1998;26(4):676-84. (http://www.ncbi.nlm.nih.gov/pubmed/9559604).
- Chiu AW, Contreras S, Mehta S, et al. Iatrogenic Opioid Withdrawal in Critically Ill Patients: A Review of Assessment Tools and Management. Ann Pharmacother 2017;51(12):1099-1111. DOI: 10.1177/1060028017724538.
- Tobias JD. Tolerance, withdrawal, and physical dependency after long-term sedation and analgesia of children in the pediatric intensive care unit. Crit Care Med 2000;28(6):2122-32. (http://www.ncbi.nlm.nih.gov/pubmed/10890677).
- Liatsi D, Tsapas B, Pampori S, Tsagourias M, Pneumatikos I, Matamis D. Respiratory, metabolic and hemodynamic effects of clonidine in ventilated patients presenting with withdrawal syndrome. Intensive Care Med 2009;35(2):275-81. DOI: 10.1007/s00134-008-1251-0.
- World Health Organization. The ICD-10 classification of mental and behavioural disorders: clinical descriptions and diagnostic guidelines. 1992.
- Dubois MJ, Bergeron N, Dumont M, Dial S, Skrobik Y. Delirium in an intensive care unit: a study of risk factors. Intensive Care Med 2001;27(8):1297-304. (http://www.ncbi.nlm.nih.gov/pubmed/11511942).
- Lucidarme O, Seguin A, Daubin C, et al. Nicotine withdrawal and agitation in ventilated critically ill patients. Crit Care 2010;14(2):R58. DOI: 10.1186/cc8954.
- Wilby KJ, Harder CK. Nicotine replacement therapy in the intensive care unit: a systematic review. Journal of intensive care medicine 2014;29(1):22-30. DOI: 10.1177/0885066612442053.
- Kowalski M, Udy AA, McRobbie HJ, Dooley MJ. Nicotine replacement therapy for agitation and delirium management in the intensive care unit: a systematic review of the literature. J Intensive Care 2016;4:69. DOI: 10.1186/s40560-016-0184-x.
Søvn hos kritisk syge patienter
Søvn er livsvigtig, og søvndeprivation har en lang række negative konsekvenser bl.a. negativ nitrogenbalance, nedsat immunforsvar, nedsat hukommelse og kognition, øget iltforbrug og CO2-produktion og nedsat udholdenhed af respirationsmusklerne1.
Ny forskning viser, at en af søvnens afgørende biologiske funktioner er at fjerne metaboliske spildprodukter fra CNS. Denne funktion varetages af det “glymphatiske system”. Systemet er primært aktivt under søvn2.
Neurofysiologisk søvn
Polysomnografi (PSG) er guldstandarden for beskrivelse af søvn. Ud fra mønstrene i PSG kategoriseres søvnen i 4 stadier: N1, N2, N3 og REM-søvn. N3 søvn kaldes også dyb søvn eller SlowWaveSleep (SWS). SWS og REM-søvn menes at være de “restituerende” søvnstadier3.
Medicin og søvn
REM-søvn kan forsinkes eller undertrykkes af alkohol, hypnotika, barbiturater og andre antiepileptika, beta-blokkere, MAO-hæmmere, SSRI og stimulanser (amfetamin, dextroamfetamin, methylphenidat, modafinil). Medicin med fremtrædende antikolinerg effekt (f.eks. tricykliske antidepressiva) kan også undertrykke REM-søvn. Den kliniske betydning af disse ændringer i REM-søvn er uklar. På den anden side kan REM-søvn øges ved seponering af alkohol, benzodiazepiner, TCA og MAO-hæmmere.
Medicinsk inducerede ændringer i søvnkvalitet eller søvnarkitektur, er ikke ensbetydende med søvnforstyrrelser: I nogle tilfælde er ændringerne terapeutiske (som hos antidepressiva), i andre kan de være benigne eller dårligt forståede4.
Sedativa (propofol, midazolam, lorazepam) og opioider vides at hæmme SWS og REM-søvn4.
Effekten af glucocorticoider er sparsomt undersøgt, men de giver mindre REM-søvn, mindre søvntid og flere opvågninger.
Søvn på intensivafdeling
Søvndeprivation er en af de største rapporterede belastninger for intensivpatienter – kun overgået af smerter5.
PSG-studier på ITA-patienter har vist, at PSG kun giver anvendelige resultater hos de mindst syge og mindst medicinerede patienter. I denne gruppe finder man ekstrem søvn-fragmentering, talrige opvågninger (20 pr. time) nedsat SWS og REM-søvn samt tab af døgnrytme. Patienterne er kvalitativt, men ikke nødvendigvis kvantitativt søvndepriverede. De vigtigste årsager til dette findes i medicin, pleje, alarmer, samtaler, støj, sygdommen i sig selv og respiratorbehandling5.
Hos de ikke-sederede intensivpatienter, der er moderat syge eller i delir, forsvinder vågenhedstegnene i EEG’et, så man ikke kan måle søvnvarigheden eller søvnarkitekturen med PSG. PSG’en bliver “atypisk” og viser “encephalopati” både under søvn og vågenhed, og jo sygere patienterne er, desto mere patologisk er EEG’et6,7.
En patologisk PSG, som beskrevet ovenfor, er associeret med en øget mortalitet8.
Måling af søvn på intensivafdeling:
I et nyligt dansk studie finder man, at der er ringe overensstemmelse mellem subjektiv søvnvurdering og PSG. Patientvurderet søvn kan kun bruges hos helt vågne, ikke-delirøse intensivpatienter. Man overestimerer også søvn, når den vurderes klinisk9. Ikke desto mindre er den kliniske søvnvurdering stadig den eneste vurderingsmetode, vi har til rådighed.
Søvnfremmende behandling under intensiv terapi
Non-farmakologiske tiltag:
Forstyrrelser, støj og lys bør begrænses mest muligt. Ørepropper og sovemasker giver mere SWS og færre opvågninger i et randomiseret PSG-studie på ITA-patienter10. Dette bør tilbydes som standard, såfremt patienten er indforstået med det. Respiratoren bør indstilles, så alarmer og respiratordyssynkroni så vidt muligt undgås. Centrale apnøer, der opstår når patienten falder i søvn, vil ofte udløse en alarm eller back-up-modus. Begge dele vil vække patienten. Alarmindstillinger kan tage højde for dette, eller man kan vælge et kontrolleret modus5. Søvnapnø hos ikke-intuberede patienter er et problem, der erfaringsmæssigt ofte overses. Lejring eller nasal airway vil ofte kunne løse problemet.
Medicinsk behandling
Følgende anbefalinger bygger på den hypotese, at farmaka, der forbedrer søvn-arkitekturen hos raske og andre forsøgspersoner, også kan understøtte restituerende søvn hos ITA-patienter.
𝛂2-agonister: dexmedetomidin og clonidin:
Dexmedetomidin er det bedst dokumenterede farmakon til at opnå søvn hos intensivpatienter. Et dansk PSG-studie rapporterede længere søvntid med dexmedetomidin sammenlignet med placebo9.
Hos NIV-patienter afkorter dexmedetomidin ITA-forløbet og mindsker risiko for intubation og delirium11.
I seneste systematiske review er dexmedetomidin dog ikke vist at reducere risiko for delirium signifikant 12.
Klinisk effekt: Søvnighed og søvn med bevaret søvnarkitektur. Øget SWS, mindsket REM-søvn. Mindsket sympaticus-drive, potensering af opioider, dæmpning af abstinenssymptomer.
Bivirkninger: Feber, AV-blok, bradykardi, BT-fald.
Clonidin giver hos raske forsøgspersoner uændret søvntid, mindre REM og N1, men mere SWS og N2 søvn. Sammenlignet med dexmedetomidin har clonidin en ceiling-effekt og mindre specificitet for 𝛂2-receptoren og længere halveringstid. Dvs. at man ikke kan opnå samme maksimal-effekt med clonidin, som med dexmedetomidin og man får erfaringsmæssigt maksimal effekt ved enkeltdoser på 300 µg.
Bivirkninger: Risiko for AV-blok, bradykardi og hypotension. Ortostatisk hypotension.
GABAA-receptoragonister: propofol og midazolam
Midazolam og propofol er hyppigt anvendte sedativa, som begge er GABAA-receptoragonister, og de inducerer begge en søvnlignende tilstand ved at hæmme neuroner i locus coeruleus. Men sedation med GABAA-agonister giver ikke “restituerende” søvn, som er nødvendig for at undgå komplikationer til søvndeprivation. Disse sedativa undertrykker arousal, men undertrykker også SWS og REM-søvn, hvilket yderligere forværrer den allerede forstyrrede søvn. GABAA-agonister maskerer symptomerne på søvndeprivation, som efterlades underbehandlet. Dette forklarer måske, hvorfor GABAA-agonister er fundet at forårsage delirium, forlænge intensiv-ophold og forlænge respiratoraftrapning.
Ud fra et søvnperspektiv bør dyb sedation med propofol og benzodiazepiner undgås9.
Zopiclon og zolpidem
Zopiclon og Zolpidem er GABAA-specifikke. Hos raske opnås en søvn med bevaret søvnarkitektur, men hos kroniske brugere er søvnen ikke bedre end hos medicinfri patienter med søvnproblemer14. Desuden er der øget risiko for søvnapnø, som rapporteres hos kroniske brugere19. Zolpidem har kortere virkningsvarighed end zopiclon, og kan overvejes ved problemer med dagtidstræthed.
Opioider
Opioider har en negativ effekt på søvnarkitekturen, idet de mindsker SWS og i højere doser mindsker REM-søvn. Der er dog en anderledes effekt hos kroniske brugere. Desuden øger opioid risikoen for central søvnapnø, som er til stede hos 70 % i første nat efter ekstubation4.
Melatonin
Der er ikke evidens for gavnlig effekt af at anvende melatonin til intensivpatienter jf. Cochranereview fra 201815.
Antiepileptika
Gabapentin øger SWS hos raske voksne og kan overvejes ved samtidige smerter. Den sederende effekt optræder ved første dosis4.
Antidepressiva
De sederende antidepressiva, der kan overvejes som søvnfremmende behandling, er amitriptylin og mirtazapin16. Disses effekt på histaminerge receptorer synes relateret til søvn, og den søvnfremmende effekt opnås ved første dosis. Deres virkning på søvnarkitekturen er positiv, men de giver dagtidstræthed. Der er ingen undersøgelser på intensiv- eller delirpatienter, at støtte sig til.
Ikke-sederende antidepressiva (Fx sertralin, citalopram, venlafaxin, og duloxetin), som mange patienter får hjemmefra, mindsker søvntiden og forsinker REM-søvn. Dette er paradoksalt nok en del af behandlingseffekten, men en del patienter oplever medicin-inducerede søvnproblemer. Seponering skal imidlertid ske med langsom nedtrapning over uger, for at undgå seponeringssymptomer som angst og depression.
Neuroleptika
AID-ICU-studiet rapporterede, at haloperidol er sikkert at benytte hos patienter med delirium og gav en bedre overlevelse sammenlignet med placebo. Dermed vurderes det rationelt at anbefale haloperidol ved delirium og søvnproblemer20. Olanzapin er teoretisk et bedre alternativ, vurderet ud fra søvndata, men der er ingen evidens for kortere delirium eller bedre overlevelse. Haloperidols effekt på søvn er kun sparsomt undersøgt, men det giver stort set uændret søvnarkitektur.
Haloperidol
Søvn efter haloperidol er kun undersøgt i ét studie21. Her gav en morgendosis på 3 mg en lille reduktion i SWS og øgning af REM søvn sammenlignet med placebo.
Hos skizofrene patienter giver haloperidol mere søvntid, men samme eller mindre SWS.
Bivirkninger: QTc-forlængelse.
Olanzapin
Olanzapin giver mindre søvnlatens, og signifikant øget søvntid og SWS hos normale forsøgspersoner og hos patienter med skizofreni22. Olanzapin synes at bevare den normale søvnarkitektur, og øge mængden af SWS, hvilket kan være en ekstra fordel i behandlingen af skizofreni. Den effektive kliniske dosis er muligvis lavere for kvinder end for mænd23.
Quetiapin
Quetiapin er undersøgt hos raske mænd, i ro, og under støj. Sammenlignet med placebo giver quetiapin signifikant mindsket søvnlatens, øget søvntid og færre opvågninger både i ro og under støj. Der var ingen effekt på søvnarkitekturen i øvrigt22,24.
Antihistaminer
Promethazin (Phenergan) har været bredt anvendt som hypnotikum, specielt til KOL-patienter, da det ikke har respirationsdeprimerende effekt. Det er blevet brugt mindre de senere år pga. bekymring for den antikolinerge effekt og mulig risiko for delirium. Phenergan giver mere søvntid, uændret SWS, men mindre REM-søvn 25.
Konklusion
Udfordringerne hos intensivpatienter er at behandle søvndeprivation, undgå søvnforstyrrelser, og give en medicinsk behandling, der understøtter søvn bedst muligt, uden at give for meget dagtidstræthed, udvikling af delirium eller – for de ikke-intuberede patienter – øge risikoen for aspiration eller søvnapnø.
Samtidig må vi forsøge at reducere eller undgå medicinsk behandling, der vides at hæmme den restituerende søvn: propofol, midazolam og opioider.
Vurdering af søvn må ske ud fra klinisk observation, da der på nuværende tidspunkt ikke findes andre muligheder.
En strategi for søvn er ønskelig, men der er ikke evidens for én samlet anbefaling.
- Bourne RS, Mills GH. Sleep disruption in critically ill patients–pharmacological considerations. Anaesthesia 2004;59(4):374-84. DOI: 10.1111/j.1365-2044.2004.03664.x.
- Jessen NA, Munk AS, Lundgaard I, Nedergaard M. The Glymphatic System: A Beginner’s Guide. Neurochem Res 2015;40(12):2583-99. DOI: 10.1007/s11064-015-1581-6.
- Stages and architecture of normal sleep. (UpToDate)
- The effects of medications on sleep quality and sleep architecture. (Up-to-date)
- Andersen JH, Boesen HC, Skovgaard Olsen K. Sleep in the Intensive Care Unit measured by polysomnography. Minerva Anestesiol 2013;79(7):804-15. (https://www.ncbi.nlm.nih.gov/pubmed/23449243).
- Boesen HC, Andersen JH, Bendtsen AO, Jennum PJ. Sleep and delirium in unsedated patients in the intensive care unit. Acta Anaesthesiol Scand 2016;60(1):59-68. DOI: 10.1111/aas.12582.
- Cooper AB, Thornley KS, Young GB, Slutsky AS, Stewart TE, Hanly PJ. Sleep in critically ill patients requiring mechanical ventilation. Chest 2000;117(3):809-18. (http://www.ncbi.nlm.nih.gov/pubmed/10713011).
- Boyko Y, Toft P, Ording H, Lauridsen JT, Nikolic M, Jennum P. Atypical sleep in critically ill patients on mechanical ventilation is associated with increased mortality. Sleep Breath 2019;23(1):379-388. DOI: 10.1007/s11325-018-1718-3.
- Oxlund J, Knudsen T, Sorberg M, Strom T, Toft P, Jennum PJ. Sleep quality and quantity determined by polysomnography in mechanically ventilated critically ill patients randomized to dexmedetomidine or placebo. Acta Anaesthesiol Scand 2022. DOI: 10.1111/aas.14154.
- Demoule A, Carreira S, Lavault S, et al. Impact of earplugs and eye mask on sleep in critically ill patients: a prospective randomized study. Crit Care 2017;21(1):284. DOI: 10.1186/s13054-017-1865-0.
- Lewis K, Piticaru J, Chaudhuri D, et al. Safety and Efficacy of Dexmedetomidine in Acutely Ill Adults Requiring Noninvasive Ventilation: A Systematic Review and Meta-analysis of Randomized Trials. Chest 2021;159(6):2274-2288. DOI: 10.1016/j.chest.2020.12.052.
- Maagaard M, Barbateskovic M, Andersen-Ranberg NC, et al. Dexmedetomidine for the prevention of delirium in adults admitted to the intensive care unit or post-operative care unit: A systematic review of randomised clinical trials with meta-analysis and Trial Sequential Analysis. Acta Anaesthesiol Scand 2023;67(4):382-411. DOI: 10.1111/aas.14208.
- Mitchell HA, Weinshenker D. Good night and good luck: norepinephrine in sleep pharmacology. Biochem Pharmacol 2010;79(6):801-9. DOI: 10.1016/j.bcp.2009.10.004.
- Yamadera H, Kato M, Tsukahara Y, Kajimura N, Okuma T. Relationship between the effects of a hypnotic drug, zopiclone, on polysomnography and on daytime EEGs. Neuropsychobiology 1997;35(3):152-5. DOI: 10.1159/000119337.
- Lewis SR, Pritchard MW, Schofield-Robinson OJ, Alderson P, Smith AF. Melatonin for the promotion of sleep in adults in the intensive care unit. The Cochrane database of systematic reviews 2018;5(5):CD012455. DOI: 10.1002/14651858.CD012455.pub2.
- Wichniak A, Wierzbicka A, Walecka M, Jernajczyk W. Effects of Antidepressants on Sleep. Curr Psychiatry Rep 2017;19(9):63. DOI: 10.1007/s11920-017-0816-4.
- Karsten J, Hagenauw LA, Kamphuis J, Lancel M. Low doses of mirtazapine or quetiapine for transient insomnia: A randomised, double-blind, cross-over, placebo-controlled trial. J Psychopharmacol 2017;31(3):327-337. DOI: 10.1177/0269881116681399.
- Aslan S, Isik E, Cosar B. The effects of mirtazapine on sleep: a placebo controlled, double-blind study in young healthy volunteers. Sleep 2002;25(6):677-9. (https://www.ncbi.nlm.nih.gov/pubmed/12224847).
- Sivertsen B, Omvik S, Pallesen S, Nordhus IH, Bjorvatn B. Sleep and sleep disorders in chronic users of zopiclone and drug-free insomniacs. J Clin Sleep Med 2009;5(4):349-54. (https://www.ncbi.nlm.nih.gov/pubmed/19968013).
- Andersen-Ranberg NC, Barbateskovic M, Perner A, et al. Haloperidol for the treatment of delirium in critically ill patients: an updated systematic review with meta-analysis and trial sequential analysis. Crit Care 2023;27(1):329. DOI: 10.1186/s13054-023-04621-4.
- Gimenez S, Clos S, Romero S, Grasa E, Morte A, Barbanoj MJ. Effects of olanzapine, risperidone and haloperidol on sleep after a single oral morning dose in healthy volunteers. Psychopharmacology (Berl) 2007;190(4):507-16. DOI: 10.1007/s00213-006-0633-7.
- Monti JM, Torterolo P, Pandi Perumal SR. The effects of second generation antipsychotic drugs on sleep variables in healthy subjects and patients with schizophrenia. Sleep Med Rev 2017;33:51-57. DOI: 10.1016/j.smrv.2016.05.002.
- Lindberg N, Virkkunen M, Tani P, et al. Effect of a single-dose of olanzapine on sleep in healthy females and males. Int Clin Psychopharmacol 2002;17(4):177-84. DOI: 10.1097/00004850-200207000-00004.
- Cohrs S, Rodenbeck A, Guan Z, et al. Sleep-promoting properties of quetiapine in healthy subjects. Psychopharmacology (Berl) 2004;174(3):421-9. DOI: 10.1007/s00213-003-1759-5.
- Adam K, Oswald I. The hypnotic effects of an antihistamine: promethazine. Br J Clin Pharmacol 1986;22(6):715-7. DOI: 10.1111/j.1365-2125.1986.tb02962.x.
Sedation
Indledning
Selvom der er mange andre strategier til at opnå komfort, kan det stadig være nødvendigt at sedere patienter. Det kan både være pga. den kliniske tilstand, men også fordi man ikke kan opnå komfort ad andre veje. For nogle patientgrupper er sedation en del af behandlingen i kortere eller længere tid. Både denne og internationale guidelines anbefaler at undgå og minimere sedation1. Det anbefales også at anvende en systematisk tilgang og dagligt vurdere og minimere sedativa, gerne ved en daglig pause i sedationen. Dette er afprøvet i flere store studier og har vist at kunne nedsætte tid i respirator og også indlæggelsestiden på intensiv. Enkelte har også påvist reduceret samlet indlæggelsestid og endda mindsket mortalitet2-4. Brug af boli frem for infusion har også vist at kunne nedsætte tiden i respirator og indlæggelsen på intensiv4,5. Disse studier er alle udført i sundhedssystemer, som har en del til fælles med det danske, men som dog alligevel adskiller sig ved blandt andet bemanding, visitation og balance mellem offentlige og private sygehuse.
Resultaterne af det første danske studie om non-sedation viste, at ingen sedation er bedre end sedation med daglig vækning med hensyn til respiratortid og indlæggelsestid på både intensiv og hospital6. Resultaterne med non-sedation-protokollen i et større multicenterstudie kunne ikke vise forskel i disse parametre, men patienterne, som ikke blev sederet, havde flere dage uden coma og delirium7.
Studier har sammenlignet de forskellige sedativa direkte, men selvom randomiserede undersøgelser viser, at propofol og dexmedetomidin fører til kortere respiratortid end benzodiazepiner og at dexmedetomidin er forbundet med lavere risiko og varighed af delir end andre sedativa, er det en for simpel tilgang ved valg af lægemiddel til den enkelte patient8-11. Valget bør træffes ud fra patientens behov med de forskelle, der er mellem de forskellige præparater som skitseret nedenfor.
Lægemidler
Propofol
Anvendelsesområder og virkning
Binder til GABAA-receptorerne. Kan anvendes til både kontinuerlig infusion og boli. Anvendes både til procedurerelateret og kontinuerlig sedation. Har ingen anxiolytisk eller analgetisk effekt og giver ikke amnesi. Propofol er ikke egnet til let sedation hos patienter uden en sikker luftvej, da det påvirker svælgmuskulatur og respiration.
Dosering
Kort anslags- og halveringstid (ofte anslag på under et minut). En infusionshastighed på 0,3-4 mg/kg/t er passende hos de fleste patienter.
Bivirkninger
Propofol giver vasodilatation og kan bidrage til hypotension. Anvendelse kan derfor være relativt kontraindiceret ved shock.
Propofol er suspenderet i olie. Det giver 1 kcal/ml som skal medregnes i kalorieregnskabet. Kan medvirke til hypertriglyceridæmi.
Propofolinfusionssyndrom er en sjælden, men alvorlig tilstand, der ses hyppigst hos børn12. Risikoen er dosisafhængig og stiger med højere dosis og længere infusionsvarighed (over 4-5 mg/kg/t). Se i øvrigt separat guideline om sedation hos børn.
Symptomerne er lipidæmi, acidose, nyresvigt, rhabdomyolyse, EKG-forandringer og ultimativt kardielle arytmier førende til hjertestop.
Grønfarvning af urin ses jævnligt ved længerevarende infusion af propofol og kan optræde uden at være et symptom på propofolinfusionssyndrom.
Farmakokinetik
Metaboliseres i leveren til inaktive metabolitter og udskilles gennem nyrerne, hvorfor dosis bør justeres ved leverinsufficiens.
Midazolam
Anvendelsesområder og virkning
Et lægemiddel af benzodiazepintypen som virker ved at binde til GABAA-receptorerne. Kan bruges både som bolus og infusion.
Dosering
Til sedation af voksne på intensivafdelinger anbefales bolusdoser på 0,03-0,3 mg/kg legemsvægt i.v. Vedligeholdelsesdosis på 0,03-0,2 mg/kg legemsvægt pr. time i.v.
Foretrækkes frem for andre benzodiazepiner pga. den kortere halveringstid. Halveringstiden er 1,5-2,5 timer efter indgift af enkeltdosis, men betydelig længere ved kontinuerlig indgift. Da stoffet derudover metaboliseres til en aktiv metabolit, kan det betyde, at opvågning efter midazolam-sedation kan tage mange timer til flere dage, særligt efter langvarig infusion. Ved langvarig sedation skal man ligeledes være opmærksom på, at der kan ses abstinenser efter seponering. Man skal derfor enten trappe ned eller lægge en abstinensplan med for eksempel benzodiazepin som tablet (se afsnit om abstinenser).
Midazolam virker anxiolytisk og giver antegrad amnesi, men har ingen analgetiske egenskaber.
Bivirkninger
Få, kan anvendes til cirkulatorisk ustabile patienter.
Farmakokinetik
Nedbrydes til den aktive metabolit α-hydroxy-midazolam, som kan akkumuleres ved nyreinsufficiens. Der kan også ses akkumulering ved adipositas og lav albumin.
Omsættes i leveren og virkningen kan potenseres af andre hæmmere af cytokrom P450 som claritromycin, erytromycin, amiodaron, fluconazol, voriconazol og verapamil. Induktorer af cytokrom P450 som carbamezepin, rifampicin, dexamethason, phenytoin og prednisolon kan nedsætte virkningen.
Dexmedetomidin
Anvendelsesområder og virkning
Selektiv α2-agonist. Kan bruges som infusion, men ikke i refrakte doser. Anvendes til let, men ikke dyb sedation. Virker ikke respirationsdeprimerende og kan derfor anvendes til patienter uden en sikker luftvej. Har både analgetisk og sederende virkning. Denne analgetiske effekt opnås via α2-receptorer i rygmarven og betyder at dexmedetomidin også potenserer effekten af opioider.
Dosering
En dosis på 0,2-1,4 µg/kg/t vil være nok til at opnå sedation – i de fleste tilfælde uden bivirkninger. Hvis det anvendes for at understøtte nattesøvn, bør det kun infunderes i nattetimerne. Pausering bør ske tidligt om morgenen for at undgå hangover og sikre mulighed for mobilisering.
Bivirkninger
Bivirkninger inkluderer bradykardi og hypotension via en sympatikusdeprimerende effekt. Temperaturstigning.
Farmakokinetik
Metaboliseres i leveren til inaktive metabolitter. Eliminationen er bifasisk med distributionshalveringstid på 6 minutter og eliminationshalveringstid på 2-2,5 time.
Inhalationssedativa
Anvendelsesområder og virkning
Inhalationssedativa anvendes oftest hos børn i forbindelse med sedationsrotation og kan anvendes til patienter med svært traktabel bronkospasme, for eksempel ved status astmaticus. Det hyppigst anvendte stof i Danmark er Sevofluran.
Dosering
Sevofluran kan tilføres respiratorsystemet via en sprøjtepumpe gennem en fordamper, som kobles direkte til slangerne. End-tidal sevofluran og MAC-værdi monitoreres via tilkoblet monitor. Stoffet er meget styrbart med hurtig ind- og udvaskning.
Bivirkninger
Der skal ved brug af sevofluran være fokus på tætte slanger og et effektivt udsugningssystem.
Farmakokinetik
Optages fra lungerne og redistribueres. Udskilles overvejende gennem lungerne, dog 5% via leveren.
Sedationsscore
Sedationsscoring er blevet en vigtig del af den intensive observation når sedation benyttes.
Flere scoringssystemer har været benyttet. Ramsay Sedation Scale er en ældre ikke valideret score13. En ulempe er at den ikke kan score den agiterede patient. Andre validerede sedationsscorer er Motor Activity Assessment Scale (MAAS) og Riker Sedation-Agitation Scale (SAS), som begge også tager højde for den agiterede patient 14,15. Den mest udbredte score er Richmond Agitation and Sedation Scale (RASS) 16. Denne benyttes som led i deliriumscoringen CAM-ICU (se afsnit om delirium).
Det væsentlige ved sedationsscoren er sammenhængen med sedationspraksis. Det er ikke i sig selv afgørende blot at udføre scoringen. Den skal anvendes som et mål i en behandlingsprotokol, helt på linje med for eksempel daglig vækning.
Når sedation til en kritisk syg patient benyttes, bør der være et objektivt mål for sedationen. Ikke blot ”sedation til tubeaccept”.
Strategi
Når årsager til uro er systematisk gennemgået og målrettet behandling iværksat (de 6 trin), og patienten trods dette ikke er komfortabel, kan man overveje sedation. Hvilket lægemiddel man anvender, beror på en individuel vurdering og den kliniske situation, men det anbefales at vælge bolusadministration frem for infusion og at starte med et lægemiddel med kort virkningsvarighed. Der bør lægges en plan for det ønskede sedationsniveau ud fra en sedationsscore.
Sederede patienter bør vækkes dagligt. Dette har til formål at se om patienten er smertedækket, at vurdere den cerebrale status og at vurdere, om der kan opnås sufficient spontan vejrtrækning. Efter vækningsforsøget foretages fornyet systematisk gennemgang af eventuelle årsager til uro (de 6 trin) og målrettet behandling iværksættes. Såfremt komfort ikke opnås, kan sedation genoptages i lavest mulig dosis.
- Devlin JW, Skrobik Y, Gelinas C, et al. Clinical Practice Guidelines for the Prevention and Management of Pain, Agitation/Sedation, Delirium, Immobility, and Sleep Disruption in Adult Patients in the ICU. Crit Care Med 2018;46(9):e825-e873. (In eng). DOI: 10.1097/ccm.0000000000003299.
- Marra A, Ely EW, Pandharipande PP, Patel MB. The ABCDEF Bundle in Critical Care. Critical care clinics 2017;33(2):225-243. (In eng). DOI: 10.1016/j.ccc.2016.12.005.
- Girard TD, Kress JP, Fuchs BD, et al. Efficacy and safety of a paired sedation and ventilator weaning protocol for mechanically ventilated patients in intensive care (Awakening and Breathing Controlled trial): a randomised controlled trial. Lancet 2008;371(9607):126-134. DOI: S0140-6736(08)60105-1 [pii];10.1016/S0140-6736(08)60105-1 [doi].
- Kress JP, Pohlman AS, O’Connor MF, Hall JB. Daily interruption of sedative infusions in critically ill patients undergoing mechanical ventilation. NEnglJMed 2000;342(20):1471-1477. (http://www.ncbi.nlm.nih.gov/pubmed/10816184).
- Schweickert WD, Gehlbach BK, Pohlman AS, Hall JB, Kress JP. Daily interruption of sedative infusions and complications of critical illness in mechanically ventilated patients. Crit Care Med 2004;32(6):1272-1276. (http://www.ncbi.nlm.nih.gov/pubmed/15187505).
- Strom T, Martinussen T, Toft P. A protocol of no sedation for critically ill patients receiving mechanical ventilation: a randomised trial. Lancet 2010;375(9713):475-480. DOI: S0140-6736(09)62072-9 [pii];10.1016/S0140-6736(09)62072-9 [doi].
- Olsen HT, Nedergaard HK, Toft P. Nonsedation or Light Sedation in Critically Ill, Mechanically Ventilated Patients. Reply. The New England journal of medicine 2020;382(26):e107. (In eng). DOI: 10.1056/NEJMc2011055.
- Garcia R, Salluh JIF, Andrade TR, et al. A systematic review and meta-analysis of propofol versus midazolam sedation in adult intensive care (ICU) patients. J Crit Care 2021;64:91-99. DOI: 10.1016/j.jcrc.2021.04.001.
- Zhang Z, Chen K, Ni H, Zhang X, Fan H. Sedation of mechanically ventilated adults in intensive care unit: a network meta-analysis. Sci Rep 2017;7:44979. DOI: 10.1038/srep44979.
- Heybati K, Zhou F, Ali S, et al. Outcomes of dexmedetomidine versus propofol sedation in critically ill adults requiring mechanical ventilation: a systematic review and meta-analysis of randomised controlled trials. Br J Anaesth 2022;129(4):515-526. DOI: 10.1016/j.bja.2022.06.020.
- Constantin JM, Momon A, Mantz J, et al. Efficacy and safety of sedation with dexmedetomidine in critical care patients: a meta-analysis of randomized controlled trials. Anaesth Crit Care Pain Med 2016;35(1):7-15. DOI: 10.1016/j.accpm.2015.06.012.
- Hemphill S, McMenamin L, Bellamy MC, Hopkins PM. Propofol infusion syndrome: a structured literature review and analysis of published case reports. Br J Anaesth 2019;122(4):448-459. (In eng). DOI: 10.1016/j.bja.2018.12.025.
- Ramsay MA, Savege TM, Simpson BR, Goodwin R. Controlled sedation with alphaxalone-alphadolone. BrMedJ 1974;2(5920):656-659. (http://www.ncbi.nlm.nih.gov/pubmed/4835444).
- Devlin JW, Boleski G, Mlynarek M, et al. Motor Activity Assessment Scale: A valid and reliable sedation scale for use with mechanically ventilated patients in an adult surgical intensive care unit. Critical Care Medicine 1999;27(7):1271-1275. (https://journals.lww.com/ccmjournal/Fulltext/1999/07000/Motor_Activity_Assessment_Scale__A_valid_and.8.aspx).
- Riker RR, Picard JT, Fraser GL. Prospective evaluation of the Sedation-Agitation Scale for adult critically ill patients. Crit Care Med 1999;27(7):1325-9. (In eng). DOI: 10.1097/00003246-199907000-00022.
- Sessler CN, Gosnell MS, Grap MJ, et al. The Richmond Agitation-Sedation Scale: validity and reliability in adult intensive care unit patients. American journal of respiratory and critical care medicine 2002;166(10):1338-44. DOI: 10.1164/rccm.2107138.
Værktøjskasse
Figur 1: Obervation og score af alkohol-abstinenssymptomer
Figur 2: Deliriumscreening
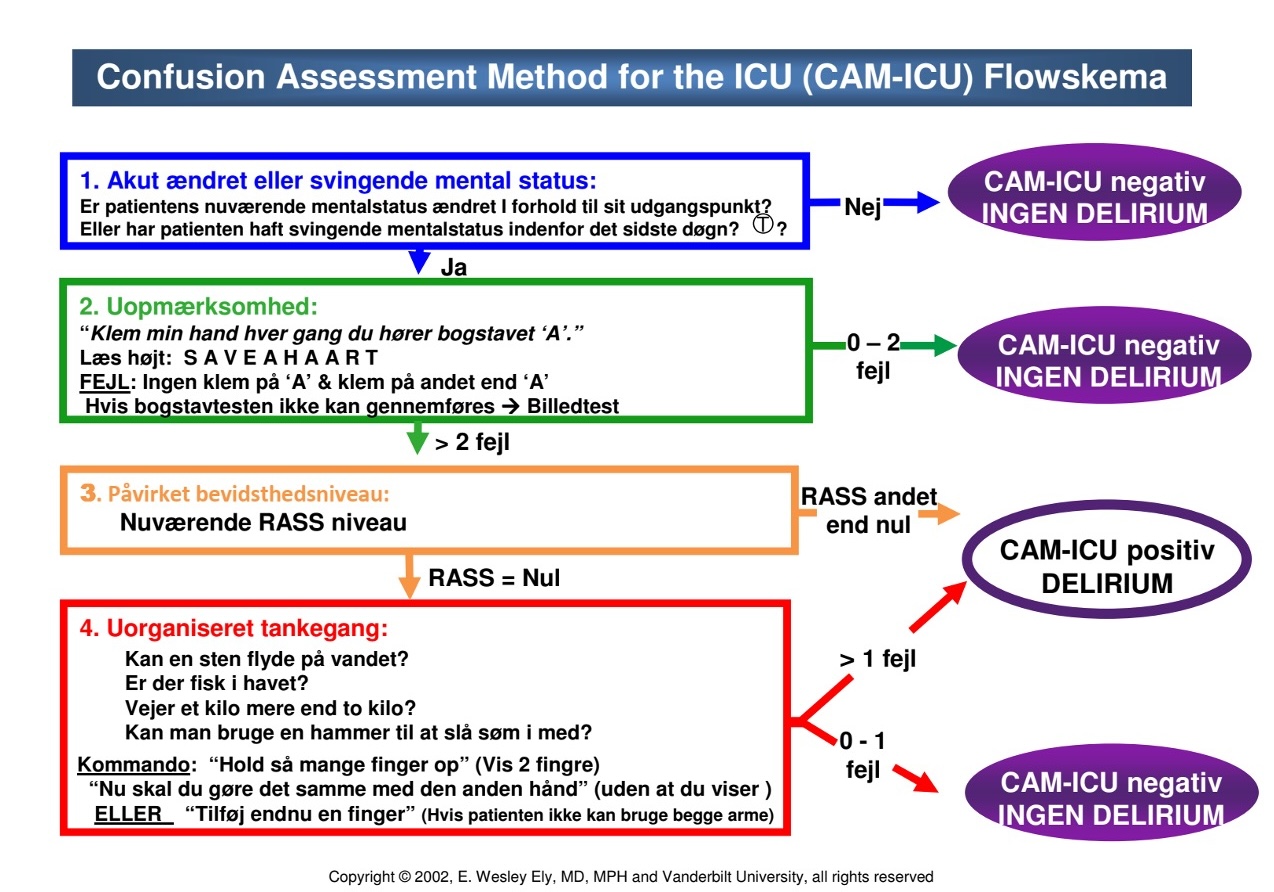
Figur 3: Intensiv Care Delirium Screening Checklist (ICDSC)
Figur 4: Richmond Agitation Sedation Scale (RASS)
Smertescoringsværktøjer
Numerisk Rang Skala (NRS)

Visuel Analog Skala (VAS)
En numerisk rang skala i form af en 100 mm lang streg på et stykke papir. Patienten angiver sin smerte ved at sætte et mærke på stegen, VAS scores ved at måle længden i mm fra ingen smerte til patioentens mærke.
Verbal Rang Skala (VRS)
En fempunkts VRS kan se således ud:
- Ingen smerter
- Lette smerter
- Moderate smerter
- Svære smerter
- Uudholdelige smerter
Smerteskalaer baseret på observation/adfærd
Denne type smerteskalaer anvendes til den sederede, ikke kommunikerende patient
Behavioral Pain Scale (BPS)
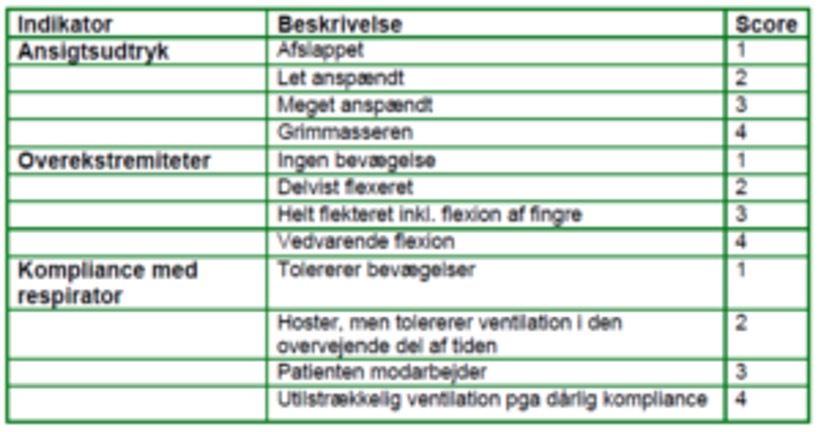
Critical-care Pain Observation Tool (CPOT)
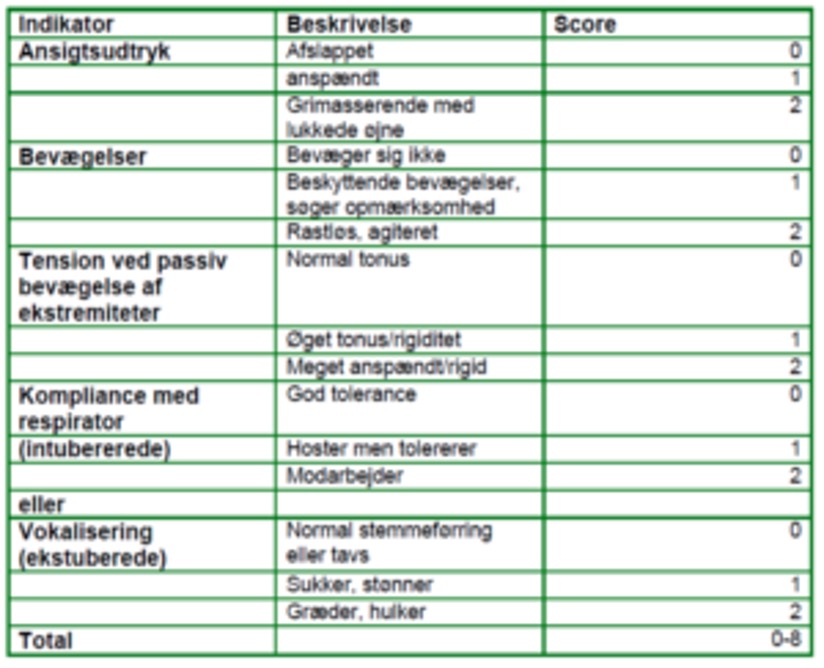
Opioider:
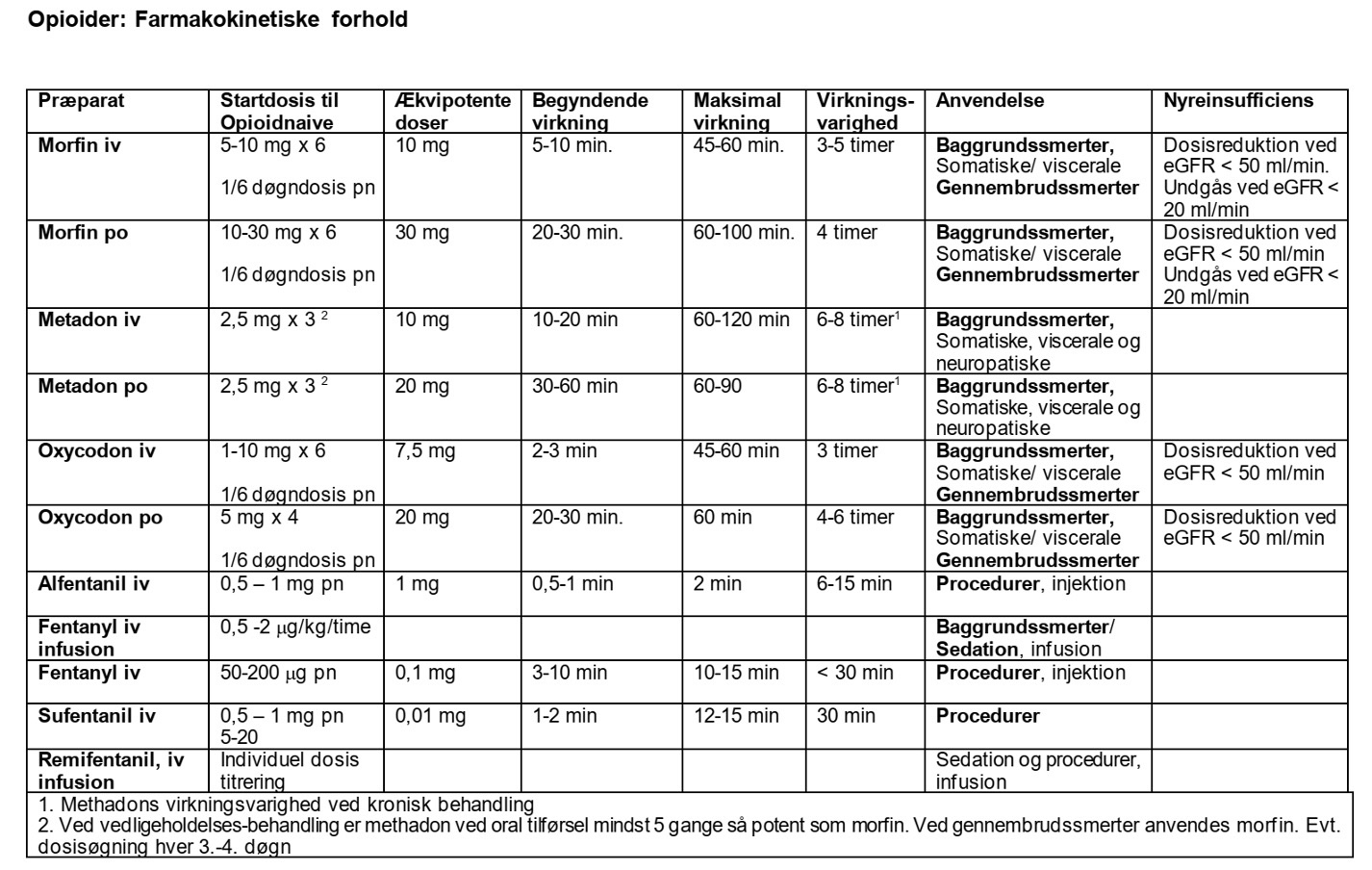
Øvrige Analgetika: