KLINISK VEJLEDNING
OBSTETRISK ANÆSTESIUDVALG, DASAIM V
ERSION 2019
Erstatter ”Anæstesi til kejsersnit, en klinisk guideline”, Obstetrisk Anæstesiudvalg, DASAIM, 2014
INTRODUKTION
FORMÅL
PRIMÆR
- Formålet med denne guideline er at højne kvaliteten af anæstesi til kejsersnit ved at reducere forekomsten og alvorligheden af anæstesirelaterede komplikationer samt at øge patienttilfredsheden
SEKUNDÆRE
- Danne basis for udarbejdelsen af lokale instrukser for anæstesi til kejsersnit
- Danne basis for undervisningen i obstetrisk anæstesi ved speciallægeuddannelsen i anæstesiologi
- Tjene som vejledning for daglig klinisk praksis ved anæstesi til kejsersnit
MÅLGRUPPE
- Læger under uddannelse til anæstesiologer og speciallæger i anæstesiologi med ansættelse på danske anæstesiologiske afdelinger
METODE
- Vejledning er udarbejdet af en arbejdsgruppe nedsat af DASAIMs Obstetrisk Anæstesiudvalg. Vejledningen er en opdatering af ”Anæstesi til kejsersnit, en klinisk guideline” fra 2014
ARBEJDSGRUPPENS MEDLEMMER
Afdelingslæge Mette Legaard Andersson (MLA), Anæstesiologisk-Intensiv Afdeling, Odense Universitetshospital (tovholder/redaktør)
Afdelingslæge Deepti Jain (DJ), Anæstesiologisk Afdeling, Aarhus Universitetshospital
Overlæge Eva Weitling (EW), Anæstesiologisk Afdeling, Kolding Sygehus Afdelingslæge, Greta Skou (GS), Anæstesiologisk Afdeling, Aalborg Universitetshospital Nord
Overlæge Kim Ekelund (KE), Anæstesiologisk Afdeling, JMC, Rigshospitalet
Afdelingslæge Kim Lindelof (KL), Anæstesiologisk Afdeling, JMC, Rigshospitalet
Afdelingslæge Kim Wildgaard (KW), Anæstesiologisk Afdeling, Herlev Hospital
Overlæge Lars Møller Pedersen (LMP), Anæstesiologisk Afdeling, Hvidovre Hospital
Overlæge Lone Fuhrmann (LF), Anæstesiologisk Afdeling, Herlev Hospital
Afdelingslæge Lotte Vestergaard (LV), Anæstesiologisk Afdeling, Hvidovre Hospital
Overlæge Omar Rian (OR), Anæstesiologisk Afdeling, Hospitalsenheden Horsens
UDARBEJDELSE AF DE ENKELTE AFSNIT
Udarbejdelse af de enkelte afsnit blev uddelegeret til to medlemmer af arbejdsgruppen:

INTERESSEKONFLIKTER
Forfatterne har ingen interessekonflikter
FORKORTELSER
ACOG American College of Obstetricians and Gynecologists
ADP Accidental Dural Puncture
ASA American Society of Anesthesiologists
BMI Body Mass Index (BMI = vægt(kg) / højde(m)2 )
CSE Combined Spinal Epidural
CSF CerebroSpinal Fluid
DASAIM Dansk Selskab for Anæstesiologi og Intensiv Medicin
DSOG Dansk Selskab for Obstetrik og Gynækologi
EBP Epidural Blood Patch ED90 Effective Dose (dosis krævet for at opnå effekt i 90% af populationen)
ESA European Society of Anaesthesiology
ESRA The European Society of Regional Anaesthesia and pain therapy
ETCO2 End-Tidal CO2
ETO2 End-Tidal O2
HELLP Hemolysis, Elevated Liverenzymes, Low Platelets
IBW Ideal Body Weight (kvinder: IBW (kg) = højde i cm – 105; mænd:
IBW (kg) = højde i cm – 100)
IE Internationale Enheder
IM Intramuskulær
IV Intravenøs
LOR Loss Of Resistance
MAC Minimum Alveolar Concentration
MR Magnetisk Resonans
NICE National Institute for health and Care Excellence
NSAID Non-Steroidal Anti-Inflammatory Drug
PCA Patient-Controlled Analgesia
PDPH Post-Dural Puncture Headache
PONV PostOperativ Nausea and Vomiting
PPH PostPartum Hemorrhage
PPI Proton Pump Inhibitors
QL Quadratum Lumborum
RCOG Royal College of Obstetricians and Gynaecologists
RCT Randomized Controlled Trial
RSI Rapid Sequence Induction
SSAI Scandinavian Society of Anaesthesiology and Intensive Care Medicine
TAP Transversus Abdominis Plane
TBW Total Body Weight
TIVA Total IntraVenøs Anæstesi
TQL Transmuskulær Quadratum Lumborum
ORGANISATION, KLASSIFIKATION, MELDING OG ANSVARSFORDELING
LMP og OR
REKOMMANDATION
ORGANISATION, KLASSIFIKATION, MELDING OG ANSVARSFORDELING
- Det anbefales at følge eksisterende DSOG/DASAIM-guideline ”Akut sectio – klassifikation, melding og organisation” på www.dasaim.dk
ANÆSTESITEAM
- Det anbefales, at anæstesiteam ved kejsersnit består af mindst 2 anæstetister
- Det anbefales, at ikke-speciallæge eller ikke-specialuddannet sygeplejerske superviseres af hhv. speciallæge i anæstesi eller uddannet anæstesisygeplejerske
BAGGRUND
ORGANISATION, KLASSIFIKATION, MELDING OG ANSVARSFORDELING
Organisation, klassifikation, melding og ansvarsfordeling er adresseret i DSOG/DASAIM-guideline ”Akut sectio – klassifikation, melding og organisation”: www.dasaim.dk
ANÆSTESITEAM
Ved anæstesi til akutte obstetriske patienter har anæstesiologen flere samtidige opgaver og arbejder desuden ofte under tidspres. Obstetrisk anæstesi er fortsat forbundet med en betydelig mortalitetsrisiko, og uerfarenhed hos anæstesiologen er en betydende risikofaktor (1). I erkendelse heraf har flere videnskabelige selskaber fremført rekommandationer for anæstesibemandingen. Således anbefaler The Royal College of Anaesthetists i Storbritannien, at obstetrisk anæstesi varetages af speciallæge uden andre opgaver, evt. superviserende ikke-speciallæge (www.aagbi.org).
Rekommandation for anæstesi ifølge DASAIM 2017 er: Anæstesiologisk tilsyn og revurdering samt indledning, vedligeholdelse og afslutning af anæstesi varetages af speciallæge i anæstesi. Opgaven kan uddelegeres til anæstesisygeplejerske eller yngre anæstesilæge, men speciallægen skal i disse situationer være umiddelbart tilgængelig (2)
ANÆSTESIVALG OG MONITORERING
KE og LMP
REKOMMANDATIONER
ANÆSTESIVALG: GENEREL, SPINAL, EPIDURAL OG KOMBINERET SPINAL OG EPIDURAL ANÆSTESI
- Valget af anæstesimetode bør være individualiseret og byggende på anæstesiologiske, obstetriske og føtale risikofaktorer (f.eks. elektiv vs. akut), patient-præference samt anæstesiologens vurdering i situationen
- Aflastning af aortocaval kompression bør opretholdes indtil barnets fødsel, som regel med uterus 15 grader tiltet mod venstre side
- Ved de fleste kejsersnit bør man vælge neuroaksial teknik frem for generel anæstesi
- Ved spinal anæstesi anbefales stumpe (pencil point) spinalnåle fremfor skærende spinalnåle
- Ved akut kejsersnit kan et eksisterende epiduralkateter anvendes som alternativ til spinal eller generel anæstesi
- Generel anæstesi kan være det rigtige valg i nogle situationer – f.eks. ved svær føtal bradykardi, uterusruptur, alvorlig blødning, alvorlig placentaløsning, navlesnorsfremfald og præterm fodpræsentation
MONITORERING, UDSTYR, FACILITETER OG PERSONALE
- Per- og postoperativ monitorering skal foregå i overensstemmelse med DASAIMs rekommandationer
- På fødestue og evt. kejsersnitstue skal udstyr, faciliteter og personale svarende til operationsgangen være muligt at tilvejebringe mhp. at kunne håndtere komplikationer som mislykket intubation, insufficient analgesi/anæstesi, hypotension, respirationsdepression, systemisk toxicitet af lokalanalgetika, kløe og opkast. I praksis betyder dette mobilt anæstesihold i beredskab
- Tilsvarende udstyr og personale skal være tilgængeligt ved varetagelse af obstetriske patienter efter neuroaksial eller generel anæstesi
BAGGRUND FOR REKOMMANDATIONER
Rekommandationer stammer fra ASAs Practice Guidelines for Obstetric Anesthesia (3), DASAIMs Rekommandation for anæstesi og DASAIMs Rekommandation for overvågning efter anæstesi (www.dasaim.dk).
REGIONAL ANÆSTESI
LF og MLA
REKOMMANDATIONER
SPINAL ANÆSTESI
- Det anbefales at anvende stump spinalnål (pencil point) 25-27 G
- Det anbefales at foretage indstik under L3
- Det anbefales at anvende bupivacain tung minimum 10 mg (koncentration 5 mg/ml) tilsat fentanyl 10 mikrog eller sufentanil 2,5 mikrog, således at der opnås et samlet volumen på omkring 2,5 ml
- Hvis intrathekal morfin tilsættes for postoperativ smertebehandling, anbefales 50 mikrog, se også afsnit 12. Postoperativ smertebehandling efter kejsersnit
- Der anbefales ikke justering af intrathekal dosis efter patienten højde og vægt
TOP-UP FØDEEPIDURAL
- Det anbefales at anvende top-up fødeepidural til kejsersnit, når fødeepiduralen er velfungerende
- Det anbefales at anvende lidokain 2% med adrenalin 15-20 ml. I fravær af tidspres kan ropivacain 0,75% 15- 20 ml anvendes
- Det anbefales at anvende lokalanalgetika, som har kropstemperatur for at opnå hurtigere anslag
- Det anbefales at tilsætte opioider (fentanyl 100 mikrog eller sufentanil 10 mikrog) for at opnå bedre intraoperativ analgesi og lavere dosis lokalanalgetika
- Det anbefales at tilsætte natriumbikarbonat 8,4% 1 ml pr. 10 ml lidokain 2% med adrenalin for at opnår kortere anslagstid
DE NOVO EPIDURAL ANÆSTESI
- Anbefaling af indikationer for at vælge de novo epidural til kejsersnit:
- Forsigtig optitrering af anæstesien ønskes, f.eks. 5 ml lidokain 2% med adrenalin hver 5. min. indtil sufficient analgesi og/eller max. dosis
- Mulighed for supplering af anæstesien intraoperativt, herunder som plan B ved risiko for insufficient spinal eller forventet lang operation
- Epidural postoperativ smertebehandling ønskes
- Det anbefales at anvende lidokain 2% med adrenalin 15-20 ml eller ropivacain 0,75% 15-20 ml
- Det anbefales at tilsætte opioid, fentanyl eller sufentanil, for at opnå bedre intraoperativ analgesi
KOMBINERET SPINAL OG EPIDURAL ANÆSTESI
- Anbefaling af indikation for at vælge CSE til kejsersnit:
- Lette teknikken ved neuroaksial anæstesi hos overvægtige, hvor spinal teknik har været umulig
- Ønske om hurtigt anslag af anæstesien samtidig med muligheden for at forlænge anæstesien gennem epiduralkateter
- Det anbefales at anvende enten A) eller B):
- A) Fuld spinal anæstesi og først administration af lokalanalgetika i epiduralkateteret, når spinalanæstesien er under T4 niveau
- B) Reduceret spinal anæstesi og langsom optitrering af epidural til sufficient analgesiniveau som under de novo epidural
TEST AF NEUROAKSIAL ANÆSTESI
- Det anbefales at teste udbredelsen af neuroaksial anæstesi ved kulde/varme og/eller let berøring, som ved sufficient anslag bør være til niveau T4
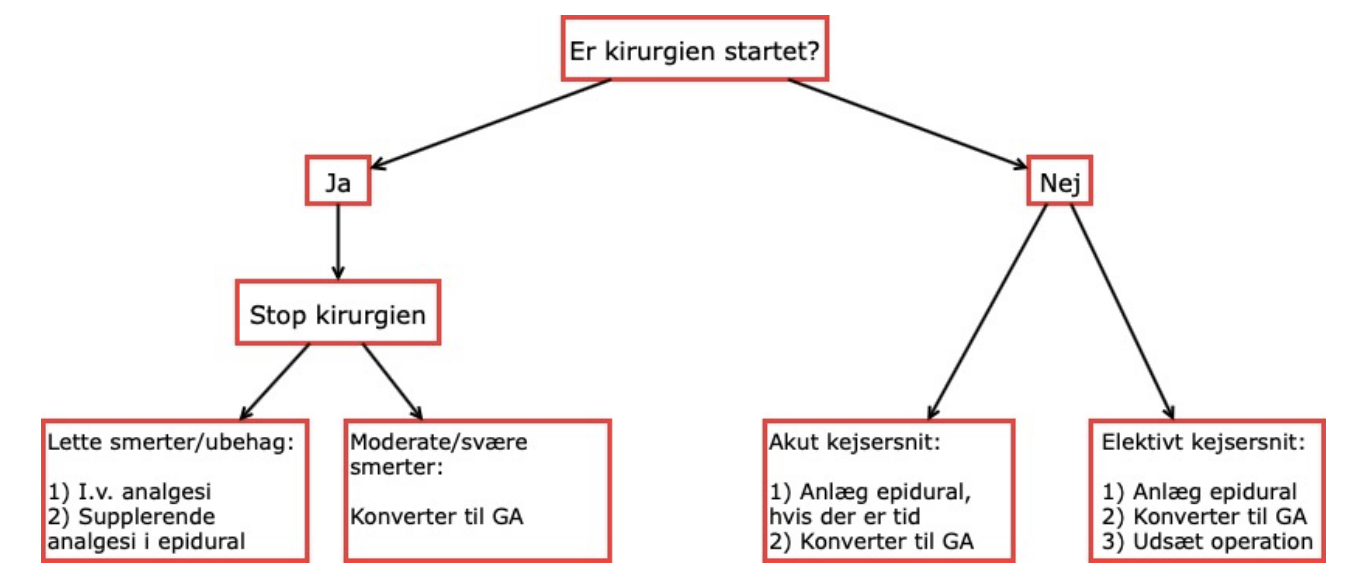
INSUFFICIENT NEUROAKSIAL ANÆSTESI
- Ved insufficient neuroaksial anæstesi anbefales anvendelse af følgende flow chart:
KOAGULATIONSFORSTYRRELSER
- Det anbefales at anvende retningslinjerne i PRAB-rapporten fra Dansk Selskab for Trombose og Hæmostase på www.dsth.dk
- Grænseværdier for trombocytter ved spinal anæstesi er: Comfort > 100 x 109 , morbidity > 50 x 109 og mortality > 30 x 109
- Grænseværdier for trombocytter ved epidural anæstesi er: Comfort > 100 x 109 , morbidity > 80 x 109 og mortlity > 50 x 109 Side 10 af 58 DASAIM, Obstetrisk Anæstesiudvalg. Version: 2019
- Det anbefales, at måling af trombocytter max. er 3 timer gamle ved anlæggelse af neuroaksial anæstesi hos patienter med præeklampsi, eklampsi og HELLP
ASEPTIK
- Det anbefales at anvende aseptisk teknik ved neuroaksial anæstesi. Dette inkluderer hue, mundbind, hånddesinfektion, sterile handsker, huddesinfektion med chlorhexidinsprit 0,5% og steril afdækning med hulstykke, samt steril forbinding over indstikssted ved epiduralkateter
- Det anbefales at undgå kontaminering af utensilier med chlorhexidinsprit, inklusiv lade chlorhexidinsprit tørre på huden før indstik, for at undgå risikoen for adhesiv arachnoidit
LEJRING
- Mht. udbredelse af neuroaksial anæstesi har lejring under anlæggelse (siddende eller liggende) ingen betydning
INTRAOPERATIVT ILTTILSKUD
- Det anbefales ikke at anvende intraoperativt ilttilskud til elektivt kejsersnit medmindre patientens saturation falder
- Det anbefales at anvende intraoperativt ilttilskud til akut kejsersnit mhp. intrauterin resuscitation
BAGGRUND FOR REKOMMANDATIONER
SPINAL ANÆSTESI
NÅLETYPE
Stump spinalnål (pencil point) reducerer risikoen for PDPH sammenlignet med skærende spinalnål (3–5). Der er ikke fundet evidens for forskel i risikoen for paræstesier eller rygsmerter mellem skærende og stumpe nåle (4,5). Der er ikke fundet evidens for forskel i frekvensen af PDPH, paræstesier eller rygsmerter mellem stump spinalnål 25G og stump spinalnål 27G (4,5).
NIVEAU FOR INDSTIK
Spinal anæstesi indebærer risiko for skade på conus medullaris med svære neurologiske følgevirkninger. Hos de fleste patienter slutter conus medullaris over L2-L3 niveau, men en undersøgelse viser, at anæstesiologer ofte bedømmer mellemrummet mellem vertebrae for lavt og derfor foretager indstikket på et højere niveau end intenderet (6,7). Cristatransversalen krydser ved L3 eller L3-L4 mellemrummet, men ved palpation er der betydelig variation (8,9). Anvendelse af ultralyd giver en mere sikker bestemmelse af interspinalrummet (10). Hvis cristatransversalen palpatorisk krydser et mellemrum skal indstikket foretages i mellemrummet caudalt herfor. Hvis cristatransversalen krydser over en processus spinosus skal indstikket foretages i mellemrummet caudalt herfor (11).
MEDICIN OG DOSERING
Lokalanalgetika: Bupivacain tung er hyppigst anvendt til spinal anæstesi (12). Bupivacain tung giver hurtigere anslagstid sammenlignet med bupivacain plain (12,13). Der er ikke signifikant forskel på bupivacain tung og bupivacain plain mht. frekvensen af konvertering til generel anæstesi og behov for supplerende analgetika intraoperativt (14). Både Side 11 af 58 DASAIM, Obstetrisk Anæstesiudvalg. Version: 2019 ropivacain og levobupivacain giver kortere anæstesivarighed sammenlignet med bupivacain (12). Ropivacain giver kortere varighed af motorisk blokade sammenlignet med bupivacain (15). Et regimen med bupivacain < 8 mg øger behovet for supplerende analgetika sammenlignet med et regimen med bupivacain > 8 mg, men giver færre bivirkninger i form af hypotension og kvalme/opkastninger (16).
Sammenlignes et regime med bupivacain < 10 mg tilsat opioid med et regime med bupivacain ≥10 mg uden opioid eller et regime med bupivacain <10 mg uden opioid ses ikke alene reduceret intraoperativ hypotension men også sufficient analgesi (17).
I Danmark er klinisk praksis at anvende bupivacain tung minimum 10 mg tilsat opioid, for at opnå en sikkerhedsmargin i forhold til anæstesivarighed, og samtidig anvendes infusion phenylephrin som standard for at reducere risikoen for hypotension.
Intrathekal opioid: Intrathekal opioid kan anvendes for at bedre intra- og postoperativ analgesi samt for at kunne reducere mængden af lokalanalgetika (12). Især intraoperativ ubehag som følge af visceral manipulation hæmmes af intrathekal opioid (12). Intrathekal opioid giver bedre postoperativ smertelindring sammenlignet med NaCl, IV opioid og IM opioid (3,18).
Morfin, som er et hydrofilt opioid, givet intrathekalt er vist at reducere postoperativ smerte og postoperativt forbrug af analgetika (12). Postoperativ kløe og PONV tiltager dosisafhængigt af morfindosis intrathekalt (12,18,19). Den anbefalede intrathekale morfindosis er 50 mikrog, hvilket giver samme postoperative analgesi som 100 mikrog og 150 mikrog morfin intrathekalt og med færre bivirkninger (19).
Lipidopløselige opioider som fentanyl og sufentanil bedrer den intraoperative analgesi, men har minimal postoperativ analgetisk effekt (12,20,21). Typiske intrathekale doser er fentanyl 10-25 mikrog og sufentanil 2,5-10 mikrog (12). Kløe er en kendt og dosisafhængig bivirkning ved intrathekal fentanyl og sufentanil (12,20,21). Kombinationen af bupivacain og sufentanil giver færre tilfælde af smertegennembrud, kortere anslagstid og forlænger tiden til første analgetikaadministration sammenlignet med bupivacain alene (20).
Patientens højde og vægt: Der er ikke fundet international guidelines, reviews eller metaanalyser, som adresserer dosis af spinal lokalanalgetika og opioid i forhold til patientens højde, vægt og BMI. To observationelle studier har ikke fundet, at højde, vægt eller BMI har betydning for udbredelsen af spinal anæstesi med bupivacain tung i doser 12-15 mg, dette gældende for højde på 146-178 cm og vægt på 55-136 kg (22,23). Ét prospektivt kontrolleret studier fandt ingen forskel mellem høje og lave kvinder i forhold til respons på intrathekal ropivacain ved spinal anæstesi til kejsersnit (24).
TOP-UP FØDEEPIDURAL
TOP-UP FØDEEPIDURAL SAMMENLIGNET MED SPINAL ANÆSTESI
Risikoen for insufficient anæstesi ved top-up af en fødeepidural øges 1) i takt med antal boli i fødeepiduralen under vearbejdet, 2) når top-up varetages af en ikke-obstetrisk anæstesiolog, 3) i takt med hastegraden af kejsersnit (25).
MEDICIN OG DOSERING
Lokalanalgetika: Lidokain 2% med adrenalin er hyppigst anvendt ved top-up af fødeepidural, og anslagstiden kan forkortes ved tilsætning af natriumbikarbonat og fentanyl (12). Sammenligning af lidokain 2% med adrenalin, bupivacain 0,5% samt blanding af bupivacain 0,5% og lidokain 2% med adrenalin er ét sted angivet uden forskel i anslagstid (18), mens anslagstiden af epiduralt bupivacain og ropivacain et andet sted er angivet som længere end lidokain 2% med adrenalin (12). Der er større behov for supplerende lokalanalgetika intraoperativt ved anvendelse af bupivacain og levobupivacain sammenlignet med lidokain 2% med adrenalin og ropivacain 0,75% (26).
Temperaturen på lokalanalgetika har betydning for anslagstiden, idet lokalanalgetika med kropstemperatur har signifikant hurtigere anslagstid end lokalanalgetika med rumtemperatur. Dette skyldes, at pH øges ved højere temperature (27–29). Kropstemperatur kan opnås ved f.eks. at opvarme ampullen med lokalanalgetika i hånden inden administration.
Opioid: Ligesom for intrathekale opioider giver epiduralt administrerede lipofile opioider (fentanyl og sufentanil) intraoperativ analgesi, mens hydrofile opioider (morfin) giver postoperativ analgesi (12). Anbefalede doser af opioid er f.eks. fentanyl 100 mikrog eller sufentanil 10 mikrog.
Tilsætning af opioid i top-up efter fødeepiduralinfusion med opioid har ikke vist signifikant forskel i intraoperativ analgesi sammenlignet med top-up uden opioid (30,31), men tilsætning af opioid kan reducere dosis af lokalanalgetika (32,33).
Natriumbikarbonat: Tilsætning af natriumbikarbonat 8,4% i doseringen 1ml pr. 10ml lidokain 2% med adrenalin i epidural top-up reducerer anslagstiden, fordi pH af lokalanalgetika øges (18).
DE NOVO EPIDURAL
DE NOVO EPIDURAL SAMMENLIGNET MED SPINAL ANÆSTESI
Sammenligning af epidural og spinal anæstesi er inkonklusiv mht. tiden fra induktion til forløsning, maternel hypotension, navlesnors-pH og Apgar score (3). Et Cochrane review fandt kortere tid fra start af anæstesi til start af operation ved spinal anæstesi sammenlignet med epidural anæstesi (34).
MEDICIN OG DOSERING
Lokalanalgetika: Det mest anvendte lokalanalgetika til epidural anæstesi ved kejsersnit er lidokain 2% med adrenalin i doser 15-25 ml (35). Ropivacain og bupivacain kan administreres epiduralt, men studier taler for, at ropivacain 0,75% er det bedste alternativ til lidokain 2% med adrenalin frem for bupivacain, idet bupivacain formentlig har en mindre sikkerhedsmargin i forhold til kardiovaskulære komplikationer ved accidentiel intravaskulær injektion (36).
Opioid: Der henvises til afsnittet om opioider under top-up fødeepidural.
KOMBINERET SPINAL OG EPIDURAL ANÆSTESI
CSE SAMMENLIGNET MED SPINAL ANÆSTESI
Sammenligning af CSE med spinal anæstesi er inkonklusiv mht. varighed af operation, maternel hypotension og Apgar score (3). Der er ikke signifikant evidens for forskel i sensorisk blok udbredelse og brug af vasopressorer, når CSE sammenlignes med spinal anæstesi, dog er tiden fra start af anæstesi til start af operation signifikant længere med CSE sammenlignet med spinal anæstesi (37).
CSE kan være at foretrække frem for spinal anæstesi til overvægtige, da det kan være teknisk lettere og giver mulighed for at forlænge anæstesien, hvis der kirurgisk er behov for dette (38).
CSE SAMMENLIGNET MED EPIDURAL ANÆSTESI
Sammenligning af CSE med epidural anæstesi er inkonklusiv mht. maternel hypotension og Apgar score (3).
MEDICIN OG DOSERING
Anvendte lokalanalgetika og opioider er de samme som for spinal og epidural anæstesi (12). To tilgange til CSE kan vælges afhængig af indikationen for valget af denne neuroaksiale teknik: A) Fuld dosis spinal anæstesi og administration af lokalanalgetika i epiduralkateteret, når spinal anæstesien aftager under niveau T4. B) Reduceret dosis spinal anæstesi kombineret med langsom optitreting af epidural til sufficient analgesiniveau. Valg af teknik vil afhængig af tidshorisont for kejsersnittet og maternel komorbiditet (12).
TEST AF NEUROAKSIAL ANÆSTESI
Anslaget af den spinale blokade kan vurderes ved let berøring, varme/kulde og smerte. Der er ikke konsensus om, hvilken metode der er bedst. Sufficient anslag defineres som anæstetisk niveau til T4 (39).
INSUFFICIENT NEUROAKSIAL ANÆSTESI
Ved elektivt kejsersnit bør udbredelsen af den neuroaksiale anæstesi testes før kirurgisk afspritning og afdækning, så muligheden for gentagelse af neuroaksial anæstesi eller anvendelse af anden neuroaksial teknik foreligger (12). Ved akut kejsersnit med truet mor og/eller barn bør insufficient neuroaksial anæstesi konverteres til generel anæstesi (12).
Insufficient spinal anæstesi: Hvis der er tid, bør man vente 20 min., før man konkluderer, at spinal anæstesien er insufficient, da enkelte slår langsomt an (12). Partiel spinal anæstesi kan suppleres med anlæggelse af epiduralkateter og langsom optitrering til sufficient analgesiniveau, alternativ til elektivt kejsersnit kan spinal anæstesi gentages, når den partielle spinal er helt forsvundet (12). Ved intet spinalanslag efter 20 min., kan spinal anæstesi gentages med normal dosis (12).
Insufficient anæstesi ved top-up fødeepidural: Jo flere boli, der er behov for under fødselsanalgesi i en fødeepidural, jo større er risikoen for insufficient anslag af anæstesi til kejsersnit via samme fødeepidural (12). Ved insufficient topup epidural, kan der, hvis der er tid hertil, anlægges en ny epidural og anæstesien kan optitreres (12). Anlæggelse af spinal anæstesi oveni insufficient top-up epidural anbefales ikke (12).
Ubehag eller smerter under kejsersnit: Niveauet af neuroaksial anæstesi skal vurderes (12). Lokalanalgetika og/eller opioid kan gives i epiduralkateter, hvis patienter har dette, eller mindre doser IV smertestillende og/eller kvælstofforilte (N2O), hvis tilgængeligt, kan forsøges ved lettere ubehag, men er den neuroaksiale anæstesi klart insufficient, bør generel anæstesi induceres (12).
KOAGULATIONSFORSTYRRELSER
Patienter i behandling med antikoagulantia og patienter med trombocyt- og koagulationsdefekter er i øget risiko for neuroaksial hæmatom ved neuroaksial anæstesi (12). I forhold til vaginal fødsel er risikoen for venøse tromboembolier op til 4-doblet efter kejsersnit (40). Selv om risikoen for tromboembolier forekommer at være mindre ved operation i neuroaksial anæstesi end ved operation i generel anæstesi ved almenkirurgiske patienter, findes der ingen tilsvarende evidens for kejsersnitpatienter (41,42).
Der henvises til PRAB-rapporten (43) og retningslinjen ” Tromboembolisk sygdom under graviditet og post partum” fra Dansk Selskab for Trombose og Hæmostase (44) på www.dsth.dk. Anbefalinger i disse rapporter er ens, fraset tidsgrænser for anlæggelse af neuroaksial blokader efter terapeutisk dosis lavmolekylært heparin (i PRAB-rapporten angives 24 timer og i retningslinjen for tromboembolisk sygdom under graviditet og post partum angives 20 timer). Da PRAB-rapporten er nyest bør anbefalinger heri følges.
Der henvises til SSAIs nordiske guideline ang. neuroaksial anæstesi ved forstyrrelse hæmostase for grænseværdier for trombocytter ved spinal og epidural (45).
For patienter med præeklampsi, eklampsi og HELLP kan trombocytniveauet falde, hvorfor DSOG anbefaler, at måling af trombocytter max. er 3 timer gamle ved anlæggelse af neuroaksial anæstesi (46).
ASEPTIK
Adhesiv arachnoidit er en meget alvorlig omend sjælden komplikation til neuroaksial blokade. Komplikationen er beskrevet ved accidentiel injektion af chlorhexidinsprit epiduralt. Kontaminering af utensilier med chlorhexidinsprit skal undgås (47,48).
Internationale guidelines anbefaler aseptisk teknik ved anlæggelse af neuroaksial anæstesi. Aseptisk teknik omfatter hue, mundbind, hånddesinfektion, sterile handsker, huddesinfektion med chlorhexidinsprit 0,5% og steril afdækning med hulstykke, samt at epiduralkateter og indstikssted dækkes med steril forbinding (49,50).
LEJRING UNDER ANLÆGGELSE AF BLOKADE
Studier har ikke kunne vise forskel på udbredelse af blokaden på baggrund af patientens lejring under anlæggelse af spinal anæstesi (siddende versus liggende på venstre henholdsvis højre side) (51–53). Ved lejring på skråkile (hævet overkrop) efter anlæggelse af spinal anæstesi ses et signifikant lavere blok efter 10 min. (54).
INTRAOPERATIVT ILTTILSKUD
Ilttilskud til kvinder, der får udført elektivt kejsersnit, er hverken gavnlig eller skadelig for mor eller barn. Der findes selvfølgelig højere ilttension i både maternel og neonatal blodgasser hos kvinder, der får intraoperativt ilttilskud (55).
FØDSELSOPLEVELSE, FORÆLDRE-BARN KONTAKT OG AMNING
Neuroaksial anæstesi tillader forældrenes fælles oplevelse af fødslen, tidlig forældre-barn og hud-til-hud kontakt, hvilke er væsentlige prædiktorer for en positiv oplevelse af fødslen (56). Ikke-randomiserede studier viser højere frekvens af ammende mødre efter kejsersnit i neuroaksial anæstesi end i generel anæstesi (57,58). Den postoperative smertebehandling har derudover stor betydning for fødselsoplevelsen, kontakt til barnet og opstart af amning (59).
HYPOTENSION: PROFYLAKSE OG BEHANDLING VED NEUROAKSIAL ANÆSTESI
KW og LV
REKOMMANDATIONER
DEFINITIONER
- Hypotension: Systolisk blodtryk < 90% af udgangsblodtrykket
- Hypertension: Systolisk blodtryk > 120% af udgangsblodtrykket
- Maternel bradykardi: puls < 60 slag/min.
- Føtal acidose: Navlearterie-pH < 7,10
- Ovenstående definitioner er ikke gældende for præeklampsi, jf. afsnittet ”Særligt for præeklampsi”
GENERELT
- Det anbefales at lejre den gravide i rygeleje, 15 grader mod venstre indtil barnet er forløst, såfremt der er sidestøtter på operationslejet. Ellers lejres i venstre sideleje minimum 10 grader
- Ved maternel kollaps eller svær hypotension, der ikke responderer på vasopressorbehandling, anbefales det at lejre den gravide i fuldt venstre sideleje
- Krystalloider 10 ml/kg anbefales til co-loading
- Der anbefales phenylephrin som førstevalg til profylakse og phenylephrin eller efedrin til behandling af hypotension
- Det anbefales at holde systolisk blodtryk over 90% af udgangsblodtrykket
- Det anbefales at måle maters blodtryk hvert min. fra spinal eller epidural anæstesi er anlagt/opsprøjtet, indtil barnet er forløst
PROFYLAKSE
- Det anbefales at opstarte infusion phenylephrin 25-50 mikrog/min. til elektivt kejsersnit og til akut kejsersnit grad 2 og 3 i spinal anæstesi
- Ved grad 1 sectio er rutinemæssig opstart af infusion phenylephrin næppe nødvendigt, og hypotension kan behandles med bolus af phenylephrin eller efedrin. Hvis tiden tillader det, kan infusion phenylephrin opstartes
BEHANDLING
- Til behandling af hypotension anbefales phenylephrin 100 mikrog/dosis ved maternel hjertefrekvens > 60 slag/min. og efedrin 10 mg/dosis ved maternel hjertefrekvens < 60 slag/min.
ANTIKOLINERGIKA OG ANDRE LÆGEMIDLER
- Antikolinergika bør ikke benyttes rutinemæssigt
- Atropin 0,5 mg eller glycopyrroniumbromid 0,2 – 0,4 mg kan benyttes til behandling af bradykardi med samtidig betydende hypotension
- IV Ondansetron 4 mg anbefales som profylakse mod hypotension, kvalme og opkast i forbindelse med kejsersnit i spinal anæstesi
SÆRLIGT FOR PRÆEKLAMPSI
- Det tilstræbes, at tilstanden er stabil inden bedøvelse til kejsersnit. Et overordnet mål for blodtrykket er, at det skal være mindre end 150/100 mmHg
- Det anbefales, at blodtrykket holdes over 90% af udgangsblodtrykket
- Præeklamptikere har øget kartonus, og derfor kan præ- og/eller co-load undlades
- Ved præeklampsi anbefales lavere doser af både phenylephrin og efedrin til behandling af hypotension, f.eks. phenylephrin 50 mikrog eller efedrin 5 mg under nøje observation af hæmodynamisk respons
- Det anbefales at starte med lavere doser af infusion phenylephrin, hvis denne opstartes til kejsersnit
ANDRE SÆRLIGE FORHOLD
- Særlig høj tilbageholdenhed med præ- og co-load bør finde sted ved manifest hjerteinsufficiens
BAGGRUND FOR REKOMMANDATIONER
DEFINITION AF HYPOTENSION
Der er ikke nogen klar definition af hypotension ved spinal anæstesi. De to hyppigste definitioner er blodtryk under 80% af udgangsblodtrykket og under 100 mmHg med henholdsvis 25,4% og 20,6% (60). Alt efter definition er incidensen af hypotension 7,4-74,1% (60). I et internationalt konsensusstatement anbefales det, at systoliske blodtryk holdes over 90% af udgangsblodtrykket (61), hvor udgangsblodtrykket er defineret som et præcist målt blodtryk inden neuroaksial anæstesi (61). Der er en langt lavere incidens af hypotensive episoder, kvalme og opkastninger, når blodtrykket holdes over 90% af udgangsblodtrykket (62). Komplikationer ved hypotension hos mater er kvalme, opkastninger, dyspnø og i særlige tilfælde cirkulatorisk kollaps. Hos fostret er det reduceret placentaperfusion med føtal bradykardi og acidose til følge (63,64).
Hypotension er hyppigere ved spinal anæstesi end ved epidural anæstesi (63).
LEJRING
Det anbefales at lejre den gravide kvinde i rygleje, 15 grader tilt mod venstre, såfremt der er sidestøtter på operationslejet. Hvis det ikke er tilfældes, så lejres patienten i det antal grader venstre sideleje, der kan opnås uden, at man risikerer, at patienten falder af lejet, og operationen samtidig kan gennemføres. Evidensen bag disse anbefalinger er sparsomme og bygger på undersøgelser lavet i 1970’erne (18). Både NICE og ASA anbefaler 15 grader venstre tilt trods sparsom evidens (3,18). Cochrane lavede i 2017 et review, hvor evidensen for tilt blev undersøgt, og der konkluderer man, at der er sparsom evidens, men at venstre tilt er bedre end højre tilt (65).
VÆSKEBEHANDLING, PRÆ- OG CO-LOAD
Et studie fandt, at spinal anæstesi inducerede hypotension i 25 af 27 gravide kvinder, som ikke var i aktiv fødsel. I dette studie blev der ikke givet præ-load, og uterus blev ikke venstreforskudt (66).
PRÆ-OG CO-LOAD MED KRYSTALLOIDER
Krystalloider er bedre til at forebygge hypotension end ingen behandling. Lav volumen præ-load med krystalloid (<10ml/kg) gav ikke mere hypotension end høj volumen præ-load (15-20ml/kg) (65).
Ved sammenligning af præ- og co-load med krystalloid (15ml/kg) er ingen af regimerne fundet sufficiente til at undgå hypotension eller interventionskrævende hypotension, og behandling med vasopressor var nødvendig trods præ-/co-load (67).
Præ-load med krystalloid bør kun benyttes sammen med vasopressorbehandling og må ikke forsinke anæstesi hos den cirkulatoriske stabile kejsersnitpatient (3,68).
PRÆ OG CO-LOAD MED KOLLOIDER
Kolloider er bedre end ingen behandling til at forebygge hypotension (65). Færre kvinder fik hypotension i kolloidgruppen ved sammenligning med krystalloid. For interventionskrævende hypotension var der ingen forskel på kolloid- og krystalloidgruppen (65).
Hvis kolloider benyttes, er 10ml/kg bedre end 5 ml/kg til at forebygge hypotension (69).
Det er uklart hvilken vægt (absolut eller ideal), som er udgangspunkt for væskeberegningen i de analyserede studier. Dette reflekteres i anbefalingerne fra en international konsensusgruppe, som trods den tvivlsomme evidens finder, at både præ- og co-load er acceptable teknikker til at forbedre hæmodynamisk stabilitet ved samtidig profylakse med vasopressor (61).
NICE anbefaler brug af præ-load med enten krystalloid eller kolloid, men man bør være opmærksom på, at de britiske tidskriterier fra indikation til forløsning ved kejsersnit, er længere end i Danmark, hvorfor præ-load til grad 1 og 2 kejsersnit kan være vanskeligt at overføre til danske forhold (70).
Andre guidelines fraråder brug af kolloider til gravide, eftersom der ikke findes nødvendig viden om overførelse til fosteret af syntetiske eller naturlige kolloider. Dermed kan en teoretisk ukendt risiko for fosteret ikke udelukkes (71).
PRESSORSTOFFER – LÆGEMIDLER
Phenylephrin anbefales som førstevalg til at forebygge hypotension ved kejsersnit (3,62,72–74). Både efedrin og phenylephrin er effektive til at behandle hypotension (3,18,61). Der er tendens til lavere navlearterie-pH efter efedrin (74), men dette har ikke klinisk betydning, ej heller ved akutte kejsersnit eller i forvejen påvirket foster (75–78).
PRESSORSTOFFER – ADMINISTRATION
Både efedrin og phenylephrin behandler effektivt hypotension ved kejsersnit i spinal anæstesi. Effektive doser er efedrin 10 mg og phenylephrin 100 mikrog (3,18,61,72). Som profylakse er der sparsom evidens, men den, der findes, støtter infusion phenylephrin 25- 50 mikrog/min. Infusion phenylephrin 25 mikrog/min. forebygger hypotension, men 25% oplever kvalme og opkastninger, mens 50 mikrog/min. forbygger hypotension og har en incidens af kvalme og opkastninger på 4%. Infusion phenylephrin 100 mikrog/min. giver en incidens af kvalme på 0%, men en øget incidens af hypertension og bradykardi (62).
ANTIKOLINERGIKA – LÆGEMIDLER
Antikolinergika bør kun benyttes ved mistanke om nedsat cardiac output med samtidig bradykardi og hypotension (61).
Glycopyrroniumbromid er ikke bedre end kontrolgruppen til at forhindre interventionskrævende hypotension (65) og bør ikke benyttes til at forebygge hypotension (79).
Atropin virker hurtigere end glycopyrroniumbromid (2-6 vs. 3-7 min.), omend glycopyrroniumbromid teoretisk set er mere sikker for fosteret, da glycopyrroniumbromid dårligt passerer placenta på hunde (79,80).
ONDANSETRON
Ondansetron (typisk 4 mg IV ca. 5 min. før induktion) er bedre end placebo til forebyggelse af hypotension induceret af spinal anæstesi (65,81).
Den anti-hypotensive effekt af ondansetron antages at skyldes, at ondansetron forebygger den serotonin-inducerede Bezold-Jarisch refleks, modvirker venodilatation og dermed øger det venøse tilbageløb (82). Denne effekt virker til at være mest udtalt for den obstetriske population (83).
SÆRLIGT FOR PRÆEKLAMPSI
Det er veletableret, at der er en lavere incidens af hypotension ved spinal anæstesi ved præeklampsi (84–87), og at gravide med præeklampsi har behov for lavere doser efedrin og phenylephrin for at korrigere hypotension (85,86). Efedrin er sikkert at bruge, men sammenligner man efedrin med phenylephrin, så korrigerer phenylephrin 50 mikrog hypotension mere effektivt end efedrin 15 mg (86).
TEMPERATURREGULERING
KL og LV
REKOMMANDATIONER
IV INFUSIONER
- Det anbefales ved infusion af mere end 1 liter krystalloid at bruge væsker fra varmeskab eller opvarmede væsker
- Det anbefales ved blodtransfusion at opvarme blodprodukter og/eller patient
SHIVERING
FOREBYGGELSE
- Det anbefales at tilsætte opioid til spinal og epidural anæstesi, da det nedsætter forekomsten af shivering
- Såfremt der skønnes højere risiko for shivering, kan man forsøge at forebygge det ved aktiv opvarmning af patient og/eller IV væsker
BEHANDLING
- Det anbefales at varme patienten med et varmt tæppe eller varmluftstæppe
- IV opioid anbefales, f.eks. fentanyl 50-100 mikrog, sufenta 5-10 mikrog eller pethidin 12,5-25 mg (max. 25 mg ialt)
- IV clonidin 30 mikrog anbefales og må gentages op til 90 mikrog
- Opioid og clonidin til behandling af shivering skal først administreres efter barnet er født og afnavlet
BAGGRUND FOR REKOMMENDATIONER
TEMPERATURREGULERING
Neuroaksial anæstesi resulterer i ophævet termoregulation i de blokerede områder. Der sker en vasodilatation, som giver en omdistribuering af varmen i kroppen (88). Spinal anæstesi giver en mindre grad af shivering end epidural anæstesi (88). Shivering giver øget fysiologisk stress med et følgende øget iltforbrug og øget produktion af CO2 (88).
OPVARMNING AF PATIENTEN
En metaanalyse finder, at aktiv opvarming reducerer temperaturændringen signifikant, reducerer shivering og øger maternel komfort. Desuden er navlesnors-pH højere i den opvarmede gruppe (89). Aktiv opvarmning giver et mindre temperaturfald end opvarmede væsker, men ikke et signifikant fald i maternel hypotermi (89).
OPVARMNING AF VÆSKER
Opvarmning af IV væsker er tilstrækkeligt til at forhindre hypotermi (90) og opvarmede væsker reducerer temperaturændringen og shivering (89).
SHIVERING
FOREBYGGELSE
Forebyggelsen af shivering er undersøgt i talrige studier. Generelt findes, at tilsætning af et opioid til neuroaksiale anæstesi forbygger shivering i højere grad end uden (91–97), men øger forekomsten af PONV. De mest undersøgte stoffer er fentanyl, tramadol og pethidin. Ondansetron er også undersøgt til forebyggelse af shivering, og nogle studier finder, at ondansetron forebygger shivering (98,99), men ikke bedre end pethidin, mens andre studier ikke finder dette (100,101). Derfor kan ondansetron ikke anbefales til forbyggelse af shivering på rutinemæssig basis.
BEHANDLING
Behandling af shivering ved kejsersnit er kun undersøgt i to små ældre studier med hver 40 patienter. Det første studie undersøger pethidin sammenlignet med NaCl og finder, at pethidin er bedre til at behandle shiverning end NaCl (102). Et andet studie undersøger clonidin sammenlignet med NaCl, og finder at clonidin op til 90 mikrog behandler shivering bedre end NaCl (103).
POSTDURAL PUNKTUR HOVEDPINE: PROFYLAKSE, RISIKOFAKTORER OG BEHANDLING
GS og KW
REKOMMANDATIONER
PROFYLAKSE
- Til spinal analgesi anbefales en stump nål (pencil point)
- Tynde spinal nåle (G25-27) reducerer incidensen af PDPH
- For epidural teknik bør ikke anvendes tykkere end G18 touhy nåle
- Det frarådes at anlægge profylaktisk EBP efter ADP
BEHANDLING
- Det anbefales at behandle let PDPH konservativt, med normohydrering og perorale analgetika
- Det anbefales at behandle moderat til svær PDPH varende > 48 timer med EBP. Tidligere intervention kan være indiceret efter individuel vurdering. EBP er mest effektiv når det sker > 48 timer efter durapunktur
- Ved EBP anbefales langsom injektion af 20 ml af autolog blod. Injektion skal afbrydes ved betydelig smerte eller tryk
- Det anbefales, at EBP foretages i samme niveau som ADP eller caudalt herfor
- Det anbefales, at patienten lejres horisontalt de første 2 timer efter EBP
- Det anbefales at gentage behandling med EBP ved recidiv af PDPH, forudsat at der har været klar effekt af den første EBP
- Det anbefales at foretage neurologisk vurdering ved mistanke om intrakraniel patologi, hvis hovedpinens karakter ændres, ved recidiv efter 2. EBP eller hvis der ikke har været klar effekt af EBP
BAGGRUND FOR REKOMMANDATIONER
PDPH er en velkendt bivirkning til neuroaksiale procedurer (104–106). Mekanismen ved PDPH er ikke fuldt afdækket, og der findes to dominerende teorier: 1. Udsivning af CSF leder til mindre intrakraniel CSF. Dette betyder mindre opdrift af cerebrum resulterende i træk på strukturer i hjernen, som leder til smerter (104,105). 2. Manglende CSF leder til intrakraniel kompensatorisk arterio- og venodilatation, og hovedpinen skyldes i så fald øget intrakraniel tryk (104,105).
RISIKOFAKTORER
ALDER
20-30-årige har, efter spinal anæstesi, en 3-5 gange øget risiko for at udvikle PDPH i forhold til > 60-årige (107).
KØN
Kvinders risiko for at udvikle PDPH er dobbelt så stor som mænds (107).
ANAMNESE
Tidligere PDPH og kronisk hovedpine disponerer til udvikling af PDPH (107). BMI Højt BMI beskytter mod PDPH via en ikke kendt mekanisme (107).
DIAGNOSTICERING
DEFINITION
PDPH er lavtrykshovedpine forårsaget af læk af CSF efter neuroaksial instrumentering (spinal eller epidural anæstesi) (108).
KRITERIER
De diagnostiske kriterier for lavtrykshovedpine forårsaget af durapunktur er (107,108):

Det Internationale Hovedpine Selskab beskriver ikke antal af kriterier, der er nødvendige for diagnosen, eller skelner mellem sværhedsgrader af PDPH (108).
Ved svære symptomer (nedsat eller manglende evne til at varetage den nyfødte) bør man tidligere tilbyde invasiv behandling end ved lette symptomer.
BILLEDDIAGNOSTISKE TESTS
Der er muligt at vise diskrete forandringer med MR ved PDPH. Men MR kan være normal trods symptomatisk PDPH.
DIFFERENTIALDIAGNOSER

PROFYLAKSE FØR INDSTIK
SPINAL NÅLETYPE
Valg af spinal nåletype har betydning for risiko for at udvikle PDPH efter ADP. Skærende spinalnåle giver øget risiko for PDPH sammenlignet med stumpe spinalnåle (4). En Cochrane analyse af nålestørrelser (alle med gauge over 22G) fandt ikke sikker forskel i incidens af PDPH baseret på nåletykkelse (4). Dette er i kontrast til klinisk opfattelse og i kontrast til en ældre metaanalyse af obstetriske patienter (109,110). Resultatet af Cochrane analysen kan skyldes, at der ofte kun var én størrelsesforskel mellem de nåle, der blev sammenlignet.
LOR MED NACL VERSUS LUFT VED EPIDURAL ANALGESI
En nylig Cochrane analyse fandt ikke forskel i ADP uanset brug af luft eller NaCl (111). Anbefaling af NaCl til brug for LOR-teknik er alene baseret på en teoretisk risiko for pneumocephalus ved ADP og brug af luft.
ULTRALYDSGUIDED SPINAL OG EPIDURAL TEKNIK
Standardiseret ultralydsteknik til neuroaksiale procedurer vinder frem (112). Med standardiseret teknik kan afvigelse mellem ultralydsmåling og nåleafstand til LOR reduceres til ca. 3 mm (113). En metaanalyse af ultralydsvejledt spinal og epidural anlæggelse viste, at neuroaksial ultralyd øgede effektiviteten ved anlæggelse af lumbal spinal og epidural anæstesi ved korrekt at identificere indstiksniveau, reducere antallet af opgivne epiduraler og antal indstik i patienter med både normale og vanskelige anatomiske kendetegn (113). Der foreligger endnu ikke studier, der viser reduktion af ADP og PDPH ved brug af neuroaksial ultralyd, men muligheden for at afstandsbedømme det posteriore kompleks giver viden, som kan hindre unødig lang nåleindføring.
PROFYLAKSE EFTER INDSTIK
PROFYLAKTISK EPIDURAL BLOOD PATCH
Profylaktisk EBP anbefales ikke rutinemæssigt, da effekten er uklar. Litteraturgennemgang relateret til profylaktisk EBP inden for obstetrisk anæstesi viser, at det ikke reducerer forekomsten af PDPH, men kan reducere intensitet og/eller varighed af symptomer (114).
SPINALKATETER VED ADP
Effekt af spinalkateterplacering efter ADP er ikke vist i RCT’er, og de fleste undersøgelser har ikke rapporteret nogen fordel af anlæggelse af spinalkateter. Metaanalyse af ikke-randomiserede studier fra 2013 har vist, at anlæggelse af spinalkateter efter ADP, som fjernes igen efter 24 timer, reducerer behovet for EBP men ikke forekomsten af PDPH (115). Spinalkatetre efter ADP kan have en højere grad af mislykket fødselsanalgesi sammenlignet med gentagne epiduralkatetre (116). Af disse årsager anbefales rutinemæssig anlæggelse af spinalkateter efter ADP ikke. Dog kan det anlægges selektivt (f.eks. efter en vanskelig epidural procedure). Tilstedeværelse af et spinalkateter indebærer dog i sig selv en risiko for infektion og fejladministration. Derfor skal spinalkateter markeres tydeligt, og medicin bør kun administreres af anæstesilæge.
MEDICINSK PROFYLAKSE
Pga. begrænsede tilgængelige data anbefales ikke administration af profylaktiske lægemidler efter ADP for at forhindre PDPH. Studier med få deltagere har vist, at epiduralt morfin (117) og cosyntropin (118) kan reducere risikoen for PDPH efter ADP. Epiduralt morfin er forbundet med høj risiko for PONV (44%) og usikkerhed med hensyn til hvor meget morfin, der transporteres spinalt gennem perforationen i dura (119). Peroral koffein forhindrer ikke PDPH efter ADP (120). SENGELEJE OG VÆSKE Sengeleje eller ekstra væsketilførsel, ud over normohydrering, reducerer ikke risikoen for PDPH efter ADP (105).
BEHANDLING AF PDPH
Behandlingsstrategien ved PDPH afhænger af sværhedsgraden og dens indvirkning på patientens evne til at fungere.
MEDICINSK BEHANDLING
Flere typer medicin er blevet undersøgt til behandling af PDPH i små undersøgelser, men ingen har vist sig at være gavnlige.
Koffein: Der er begrænset evidens til at understøtte brugen af koffein i behandlingen af obstetrisk PDPH. Hvis det anvendes, bør behandlingen med koffein ikke vare længere end 24 timer. Oral behandling er foretrukket, og doserne må ikke overstige 300 mg, med maksimalt 900 mg pr. 24 timer. En lavere maksimal dosis på 200 mg pr. 24 timer bør overvejes hos kvinder, der ammer. Dette især for mødre til børn med lav fødselsvægt eller for tidligt fødte spædbørn. Kvinder, der får koffeinbehandling, skal have koffeinindtaget monitoreret, og den anbefalede daglige dosis bør ikke overskrides (106).
Analgetika: Nogle eksperter foretrækker oral analgetika til symptomatisk behandling af PDPH, typisk paracetamol eller NSAID. Der er manglende evidens for dette, specielt til PDPH (106).
Opioider: Opioider kan tilbydes kvinder med PDPH, indtil EBP kan tilbydes, hvis simpel oral analgesi er ineffektiv, men langtidsbehandling anbefales ikke (106).
Andre lægemidler: Effekten af gabapentin, hydrocortison og theophyllin er minimal til PDPH. Ved behandling med sumatriptan og adrenokortikotropt hormon er der ikke evidens for positiv effekt på PDPH (106).
Væske: Effekten af IV væsker er uklar (4) og anbefales kun til patienter, som ikke kan indtage tilstrækkelig væske peroralt (106).
Tromboseprofylakse: Hvis patienten er sengeligende mere end 24 timer på grund af PDPH, bør thromboprofylakse overvejes og diskuteres med det obstetriske hold. Hvis der anvendes farmakologisk tromboseprofylakse, og en EBP skal udføres, skal passende tid mellem den sidste dosis af antikoagulant og EBP være udløbet for at reducere risikoen for vaskulære komplikationer (106).
EPIDURAL BLOOD PATCH
Succesrate: EBP er en effektiv behandling af PDPH (121–123). Den initiale succesrate er ca. 90% uafhængig af, om PDPH er opstået efter spinal, epidural eller CSE anæstesi. Risikoen for tilbagefald er 5% efter spinal, 31% efter epidural og 7% efter CSE anæstesi (124).
Volumen: Det optimale volumen er ukendt, de fleste anbefalinger er 10-20 ml. Det seneste studie sammenlignede 15, 20 og 30 ml autologt blod og fandt ingen signifikant forskel. Anbefalingen blev injektion af 20 ml autologt blod og afbrydelse af proceduren, hvis patienten oplevede smerter i ryg eller ben under injektionen (125).
Niveau: EBP skal foretages på niveau med durapunkturen eller caudalt herfor, idet MR efter EBP viser, at blodet hovedsagelig spreder sig kranielt for indstiksstedet (126,127).
Timing: Retrospektive studier viser højere succesrate, når EBP foretages mere end 48 timer efter debut af PDPH. Dette kan dog skyldes, at svær PDPH foranlediger tidligere EBP. En international konsensusgruppe anbefaler, at kvinder med PDPH informeres om reduceret effekt og øget risiko for endnu en EBP ved anlæggelse < 48 timer efter durapunktur (128). Immobilisering > 24 timer resulterer i administration af tromboseprofylakse, som kan påvirke anlæggelsestidspunktet.
Lejring: Et studie fandt bedre effekt af EBP ved horisontal lejring i 2 timer sammenlignet med horisontal lejring i 30 min. efter anlæggelse af EBP (129).
Komplikationer: Rygsmerter er den hyppigst forekommende komplikation ved EBP. Rygsmerter forekommer hos 25- 35% af patienterne. Rygsmerter forsvinder som regel spontant inden for 48 timer (130). Sjældne komplikationer omfatter: Hæmatom (epiduralt, subduralt og subarachnoidalt), infektion, subdural absces, lammelse af n. facialis, rodaffektion og spastisk paraparese (131).
ANDRE BEHANDLINGER
Bilateralt transnasalt sphenopalatint ganglion blok (SPGB): SPGB menes at virke ved at blokere parasympatisk flow til cerebral vaskulatur, hvilket reducerer cerebral vasodilatation (106). Der er i øjeblikket utilstrækkelig evidens til at anbefale brugen af SPGB som standard til behandling af obstetrisk PDPH.
Greater n. occipitalis blok (GONB): Et RCT, der sammenlignede GONB med sengeleje, hydrering og svage analgesi ved PDPH efter spinalanæstesi (både fødselsrelateret og ikke-obstetrisk) med en 27G skærende spinalnål, viste en statistisk signifikant reduktion i smertescore på 1.-6. dag. Det er i øjeblikket ikke anbefalet at behandle obstetrisk PDPH med GONB som standard pga. manglende evidens (106).
GENEREL ANÆSTESI
DJ og EW
REKOMMANDATIONER
GENERELT
- Generel anæstesi til kejsersnit er en specialistopgave, som bør reserveres til de situationer, hvor neuroaksial anæstesi ikke er mulig, er kontraindiceret eller har svigtet
- Før indledning af anæstesi bør der foretages en luftvejsvurdering og formuleres en plan for håndtering af evt. vanskelig luftvej, jf. DAS guidelines for håndtering af obstetrisk luftvej (www.das.uk.com)
ASPIRATIONSPROFYLAKSE
- Der anbefales natriumcitrat 0,3M 30ml peroralt før præoxygenering
- RSI anvendes pga. aspirationsrisiko
- Se i øvrigt afsnit 10. Faste og aspirationsprofylakse
LEJRING
- Det anbefales at lejre den gravide i rygeleje tiltet 15 grader mod venstre, indtil barnet er forløst, såfremt der er sidestøtter på operationslejet. Ellers lejres i venstre sideleje gerne minimum 10 grader
- Det anbefales at optimere intubationsforholdene ved lejring i sniffing eller ramped position (skråkile med løftet overkrop)
MONITORERING
- Se afsnit 4. Anæstesivalg og monitorering
PRÆOXYGENERING
- Skal altid foretages
- Det anbefales at præoxygenere med 100% i 3-5 min. med tætsluttende maske til ETO2 ≥ 0,9
- 8 dybe vejrtrækninger med ilt flow 10L/min. i løbet af 60 sek. med tætsluttende maske kan anvendes som alternativ
- Overveje passiv apnø oxygenering med nasal ilt
INDUKTION
- Hypnotikum gives, når patient er afdækket, og operatøren er klar til at starte
- Følgende hypnotika kan anvendes:
- Propofol IV 2,5-2,8 mg/kg
- Thiopental IV 5-7 mg/kg
- Ved hæmodynamisk påvirkning (f.eks. blødningsshock): S-ketamin IV 0,5-1 mg/kg
- Opioid anvendes ikke rutinemæssigt, før barnet er født og afnavlet
- Opioid anvendes, når refleks-hypertension under intubation kan indebære en risiko, f.eks. ved præeklampsi, øget intrakranielt tryk og hjertesygdom
- Følgende opioider kan anvendes som bolus:
- Remifentanil IV 1 mikrog/kg
- Alfentanil IV 15-30 mikrog/kg
- Pædiater orienteres, hvis der gives opioid, før barnet er afnavlet
- Muskelrelaksantia gives umiddelbart efter hypnotika
- Følgende muskelrelaksantia kan anvendes:
- Suxamethon IV 1-1,5 mg/kg TBW
- Rocuronium IV 0,9-1,2 mg/kg IBW. Sugammadex IV (16 mg/kg) haves klar ved behov for hurtig revertering af rocuronium
- Der anvendes RSI og som udgangspunkt maskeventileres ikke
INTUBATION
- Intubation foretages af mest erfarne intubatør og med bedst mulig velkendt udstyr (laryngoskop eller videolaryngoskop)
- Intubation med 6,0-6,5 mm cuffed endotrakeal tube
- Tubens placering sikres ved kapnografi og stetoskopi
- Ved intubationsvanskeligheder følges DAS guidelines for håndtering af obstetrisk vanskelig luftvej (www.das.uk.com)
VEDLIGEHOLDELSE
- Før barnet er født:
- Ventilation med 50-100% ilt (100% ilt ved tegn på asfyksi hos fostret)
- Normoventilation (ETCO2 ≈ 4,0 kPa)
- Inhalationsanæstesi med sevofluran 1,0-1,5 MAC
- TIVA når inhalationsanæstesi er kontraindiceret (se nedenfor)
- Efter barnet er født og afnavlet:
- Opioid: Fentanyl IV 4-5 mikrog/kg eller sufentanil IV 0,25-0,5 mikrog/kg
- Inhalationsanæstesi reduceres til sevofluran 0,5 – 1,0 MAC eller
- Skift til TIVA ved uterin atoni
- Iltkoncentration kan reduceres til 30-50%
- Muskelrelaksantia er normalt ikke nødvendig, men kan bruges ved behov
- PONV-profylakse med ondansetron IV 4 mg
- Plan for postoperativ smertebehandling, jf. afsnit 12. Postoperativ smertebehandling efter kejsersnit
EKSTUBATION
- Ventrikeltømning anbefales før ekstubation ved mistanke om fyldt ventrikel
- Det anbefales at ekstubere, når patienten er vågen og ude af neuromuskulært blok
TIVA
- Indikation:
- Hvor inhalationsanæstesi er kontraindiceret (eks. malign hypertermi)
- Uterin atoni
- Medicin:
- Propofol/Remifentanil
- S-ketamin (fordel i tilfælde af blødningsshock)
- Induktionsdosis IV 0,5-1 mg/kg
- Vedligeholdelsesdosis IV 25-75 mikrog/kg/min.
- Anvendes S-ketamin, bør der gives benzodiazepin (f.eks. midazolam IV 1-2 mg) efter barnet er født og afnavlet
ADIPØSE KEJSERSNITSPATIENTER
- Det anbefales at gravide med prægravid BMI ≥ 40 kg/m2 ses af en anæstesilæge i graviditeten mhp. anæstesiologisk vurdering og journalføring af dette. Det anbefales, at patienten samtidig informeres om risici og anbefales anlæggelse af epiduralkateter tidligt i fødsel mhp. evt. senere smertelindring og bedøvelse til evt. kejsersnit.
- Generel anæstesi bør reserveres til de situationer, hvor neuroaksial anæstesi ikke er mulig, er kontraindiceret eller har svigtet
- Før indledning af anæstesi bør der foretages en luftvejsvurdering og formuleres en plan for håndtering af evt. vanskelig luftvej
- Det anbefales, at der på enhver kejsersnitstue, findes særligt udstyr til håndtering af den overvægtige patient, såsom lejringsudstyr, intubationsudstyr (kortskaftet laryngoskop, videolaryngoskop o.l.) og evt. UL til IVadgang
- Det anbefales, at udstyr til håndtering af vanskelig luftvej er på operationsstuen • Det anbefales, at 2 store IV-adgange lægges
- Det anbefales, at patienten lejres på skråkile før intubation
- Det anbefales at præoxygenere patienten til ETO2>0,9
- Der kan induceres med: o Propofol IV 2,5-3 mg/kg o Thiopental IV 5 mg/kg
- Der kan muskelrelakseres med:
- Suxamethon IV 1,0-1,5 mg/kg TBW
- Rocuronium IV 1 mg/kg IBW. Sugammadex IV (16 mg/kg) haves klar ved behov for hurtig revertering af rocuronium
BAGGRUND FOR REKOMMANDATIONER
GENERELT
Generel anæstesi til kejsersnit forbeholdes kejsersnit, hvor tidsfaktoren er af afgørende betydning, og hvor neuroaksial blokade ikke kan nås, svigter eller er kontraindiceret. Risici er vanskelig luftvej, awareness og aspiration, mens hurtighed og anslagssikkerhed ses ved generel anæstesi (132).
Med hensyn til den nyfødtes tilstand er der ringe forskel mellem de forskellige anæstesiteknikker. Sammenlignet med neuroaksial anæstesi forårsager generel anæstesi en kortvarig påvirkning af barnets bevidsthed: Apgar score efter 1 min. er lavere og tiden til stabil respiration er længere, men påvirkningen er reversibel og varer under 5 min. (130,133).
ASPIRATIONSPROFYLAKSE
DASAIMs anbefalinger ”Anæstesi til den akutte voksne patient” anvendes (www.dasaim.dk) (134).
Normalt anbefales at anvende RSI ved generel anæstesi til gravide, fordi gravide har høj risiko for aspiration af ventrikelindhold til lungerne i forbindelse med generel anæstesi, og RSI vil reducere denne risiko (3,35,135).
LEJRING
Patienten lejres i venstredrejet rygleje med hoved og overkrop lejret, så der opnås bedst mulige intubationsforhold (136). For lejring i øvrigt, jf. afsnit 6. Hypotension: profylakse og behandling ved neuroaksial anæstesi.
PRÆOXYGENERING
Pga. de fysiologiske ændringer, der gradvist indtræder under graviditeten, bliver gravide hurtigere hypoxiske, hyperkapniske og acidotiske ved apnø. Derfor skal gravide altid præoxygeneres (137–139).
Effektiv præoxygenering kan klinisk ses ved ETO2 > 0,9 (140). Præoxygenering af den gravide opnås ved indånding af 100% ilt i tætsluttende maske i 3 min. eller 8 dybe vejrtrækninger (141).
Tilføjes CPAP, fugtet nasal ilt eller THRIVE (Transnasal Humidified Rapid-Insufflation Ventilatory Exchange) til præoxygenering, forlænges tiden fra apnø til desaturation hos patienten (142,143). De nævnte metoder er kun undersøgte og vurderet på ikke-gravide patienter og derfor ikke anbefalet som standard.
INDUKTION
HYPNOTIKA
Propofol anvendes i stigende grad som induktionsmiddel til generel anæstesi. Den største ulempe ved propofol er vanskeligheden ved at vedligeholde en tilstrækkelig anæstesidybde efter induktion uden, at der opstår neonatale bivirkninger (144,145). Awareness er hyppigere med propofol, når doser < 2,4 mg/kg anvendes (144). Hvis man øger dosis til 2,8 mg/kg kan det påvirke barnet (145).
Thiopentaldosis til kejsersnit er højere end for andre indgreb. Thiopental 4-5 mg/kg til kejsersnit medfører awareness hos op mod 50% (146,147). Thiopental > 8 mg/kg giver anledning til signifikant neonatal depression (148,149). Derfor anbefales 5-7 mg/kg, hvor risikoen for awareness hos moderen og signifikant neonatal depression er mindst.
S-ketamin er dobbelt så potent, påvirker kognitive funktioner mindre og medfører hurtigere genvindelse af psykomotoriske færdigheder sammenlignet med racemisk ketamin (150–152). S-ketamin 1 mg/kg er acceptabel ved kejsersnit, giver dog let øget blodtryk og hjertefrekvens, hvilke på den anden side kan være en fordel hos patienter med hypotension.
OPIOID
Alle opioider passerer hurtigt placenta og kan medføre respirationsdepression hos den nyfødte. Derfor bør man normalt afvente med opioider, til efter barnet er født og afnavlet (153). I situationer hvor hæmodynamisk instabilitet i forbindelse med intubation kan udgøre en fare for moderen, kan opioid være indiceret. Bolus remifentanil har, pga. den ultrakorte virkning, været anvendt med gode resultater hos højrisiko obstetriske patienter (f.eks. ved HELLP-syndrom, hjertesygdomme og intrakranielle tumorer) (154). Remifentanil er at foretrække pga. den ultrakorte virkning og dermed nedsatte risiko for neonatal respirationsdepression (155). Alfentanil har også været anvendt som bolus til obstetriske højrisikopatienter for at opnå hæmodynamisk stabilitet under induktion ved kejsersnit (156,157). Trods den korte virkningsvarighed kan anvendelse af alfentanil og remifentanil, før barnet er født, medføre respiratorisk påvirkning af barnet og give behov for kortvarig respiratorisk støtte (153,156–158).
MUSKELRELAKSANS
Suxamethon passerer, pga. den lave lipidopløselighed, placenta i så ringe grad, at det kun ved doser > 300 mg kan påvises i navleveneblod (159). Rocuronium passerer placenta i en ukendt mængde og er fundet at give lavere Apgar score efter 1 min. sammenlignet med suxamethon (160). Rocuronium kan erstatte suxamethon, når sugammadex haves i beredskab. Højdosis rocuronium (0,9 – 1,2 mg/kg) giver paralyse med en hastighed sammenlignelig med suxamethon 1 mg/kg, men med en længere virkningsvarighed (159–163).
INTUBATION
Gravide har ødematøse luftveje og høj risiko for blødning i luftvejene, specielt epistaxis (164–167). Intubation bør foretages med bedst muligt og velkendt udstyr (f.eks. videolaryngoskop) (168).
VANSKELIG LUFTVEJSALGORITME VED KEJSERSNIT
Incidensen af vanskelig intubation hos obstetriske patienter var uændret i perioden 1970 til 2014. Et review fandt, at mislykket trakeal intubation forekom i 1:443 kejsersnit i generel anæstesi. Maternal mortalitet var 2,3 per 100.000 generelle anæstesier ved kejsersnit. Kvinderne døde hyppigst af hypoxi, aspiration og uerkendt esofageal intubation (169). Der ses stadig enkelte maternelle dødsfald på grund af mislykket intubation, og hypoxi er den hyppigste årsag hertil (170).
Vanskelig luftvej ved kejsersnit skyldes ikke alene anatomi og fysiologi, men også at de fleste kejsersnit foretages i neuroaksial anæstesi, at det oftest er akutte indgreb under tidspres og uden mulighed for at vurdere luftvejen og planlægge intubationen. Derfor bør man altid vurdere luftvej og intubationsforhold samt optimere intubationsforholdene og formulere en plan for håndtering af evt. vanskelig luftvej, før man indleder generel anæstesi hos en gravid. DAS guidelines for håndtering af obstetrisk luftvej anvendes (140): www.das.uk.com. Derudover anbefales, at udstyr til vanskelig intubation er umiddelbart tilgængelig på operationsstuen. Det anbefales, at man hurtigt erkender, at intubation er umulig og max. forsøger 2 gange, før algoritmen påbegyndes (140). Det primære mål i håndteringen af mislykket intubation er at sikre den maternelle oxygenering. Dette har højere prioritet end f.eks. risikoen for aspiration; hypoxi dræber hurtigt, mens aspiration kun er en risiko.
VEDLIGEHOLDELSE
ILTKONCENTRATION
Den optimale iltkoncentration hos gravide under generel anæstesi er ikke klart. Når iltkoncentrationen øges hos gravide under generel anæstesi til elektivt kejsersnit, øges den føtale oxygenering (171). Hos nyfødte, hvor moderen havde fået 100% ilt under kejsersnittet, var behovet for iltbehandling og overtryksventilation mindre end hos nyfødte, hvor moderen havde fået 50% ilt (172). Derfor bør højere iltkoncentrationer anvendes, når der er tegn på føtal asfyksi.
INHALATIONSANÆSTESI
Sevofluran har en farmakologisk profil, som medfører flere fordele. Sevofluran har lav blod:gas opløselighed og er ikke luftvejsirriterende. Derfor har sevofluran hurtigt anslag og er velegnet til inhalationsindledning. Kejsersnit er et indgreb, som normalt starter umiddelbart efter intubation, hvorfor man ikke har tid til equilibrering. Derfor er det nødvendigt at anvende koncentrationseffekten, dvs. en høj koncentration af sevofluran, ofte 6-8%, kombineret med højt flow for at opnå tilstrækkelig end-tidal niveau hurtigst muligt (173,174).
Sevofluran 0,5 MAC kombineret med kvælstofforilte (N2O) har tidligere været anbefalet til kejsersnit i generel anæstesi for at minimere neonatal sedation og uterin atoni. Dog er brug af høj MAC ikke nødvendigvis associeret med øget neonatal sedation (175). Flere steder i Danmark er kvælstofforilte (N2O) afskaffet, og derfor bør koncentrationen af sevofluran øges til 1-1,5 MAC.
Alle inhalationsanæstetika relakserer uterusmuskulaturen og i tilfælde af svær uterin atoni, bør man derfor skifte til TIVA (176,177).
TIVA
TIVA anbefales ikke som førstevalg til kejsersnit. Propofol, remifentanil og S-ketamin passerer placenta hurtigt (178– 182). Propofol kan reducere uterin tonus i in vitro, men propofolkoncentrationen, som kræves for signifikant at reducere tonus, er meget højere end de klinisk relevante (183). S-ketamin i kliniske doser kan fremkalde uteruskontraktioner i den tidlige graviditet, men har ingen effekt sidst i graviditeten (184).
VENTRIKELSONDE
Flere undersøgelser viser, at op mod 50% af aspiration til lungerne af ventrikelindhold sker ved ekstubation og postoperativt (185–187). Tømning af ventriklen under generel anæstesi er relativt enkelt og atraumatisk, og bør overvejes ved mistanke om fyldt ventrikel.
ADIPØSE KEJSERSNITSPATIENTER
Et review af anæstesirelaterede dødsfald i Michigan 1985-2003 fandt, at 6 ud af 8 kvinder, der døde i relation til anæstesi under fødsel, var svært overvægtige (188). I Storbrittanien har man i de sidste 3 rapporter dækkende 2003- 2013 fra “The Confidential Enquiry into Maternal Deaths” fundet, at 49-52% af kvinder, der døde under fødslen, var overvægtige eller svært overvægtige, og i 6 ud af 17 dødsfald relateret til anæstesi var BMI > 30 kg/m2 (189).
Overvægtige gravide har en øget risiko for vanskelig eller fejlagtig intubation (190). I en 6 års gennemgang af fejlintubationer hos gravide i en region i Storbrittanien fandtes 36 tilfælde, hos disse var gennemsnits-BMI 33 kg/m2 (191). Maskeventilation besværliggøres også ved stigende overvægt (192).
En amerikansk dataanalyse fandt, at kejsersnitfrekvensen ved intenderet vaginal fødsel for normalvægtige nullipara var 11,1% mod 42,8% ved BMI > 40 kg/m2 (193). Vigtigheden af en tidligt anlagt, velfungerende fødeepidural kan derfor ikke understreges kraftigt nok (193). Der anbefales at afholde præanæstesiologisk samtale med gravide med prægravid BMI ≥ 40 kg/m2 (193).
For adipøse gravide er ramped position (skråkile med løftet overkrop) bedre til at få overblik end sniffing position (136,194,195). Lejring med 25 graders elevation af overkroppen hos nonobstetriske patienter med ekstrem svær overvægt (BMI > 40 kg/m2 ) under 3 min. præoxygenering resulterer i en længere tid (201sek.) til desaturation under apnø sammenlignet med planleje (69 sek.) (196).
Svær overvægt (BMI > 30 kg/m2 ) ændrer distributionen af og responset på anæstesimidler. Således vil doser beregnet på basis af aktuelle kropsvægt (TBW) give for store doser og dermed for mange bivirkninger og komplikationer (197). Undersøgelser viser, at der ved induktion med propofol eller thiopental anbefales doser efter lean body weight (kropsvægten uden fedt) (38,198) eller IBW plus nogle fraktioner af forskel mellem TBW og IBW (199). Da man erfaringsmæssigt underdoserer, kan det være nødvendigt at supplere, hvis denne dosis ikke er tilstrækkeligt.
For suxamethon gælder, at svært overvægtige har øget aktivitet af plasmakolinesterase, men da graviditet i sig selv medfører lettere nedsat aktivitet af plasmakolinesterase, er doseringen af suxamethon den samme for overvægtige som for normalvægtige: 1,0-1,5 mg/kg TBW (38,198,199). Non-depolariserende neuromuskulær blokade (TOF 1-2) med rocuronium kan reverteres med sugammadex 2 mg/kg IBW + 40% (200).
FASTE OG ASPIRATIONSPROFYLAKSE
KE og OR
REKOMMANDATIONER
FASTE
- Fastereglerne er som oftest kun mulige at opfylde før elektivt kejsersnit
FASTE EFTER INDTAGELSE AF FAST FØDE
- Den gravide må spise indtil 6 timer før anæstesien
FASTE EFTER INDTAGELSE AF VÆSKE
- Den gravide må drikke klar væske indtil 2 timer før anæstesien
- Vand, juice (uden frugtkød), kaffe/te (uden mælk, men gerne med sukker), saftevand eller sportsdrik kan alle anbefales
- Ved længerevarende faste som følge af udsat operation bør kvinden tilbydes yderligere væske, gerne i form af en kulhydratrig, isotonisk sportsdrik, senest 2 timer før anæstesien
ASPIRATIONSPROFYLAKSE
ELEKTIVT KEJSERSNIT
- På operationslejet ved generel anæstesi anbefales: Natriumcitrat 0,3 M, 30 ml peroralt
AKUT KEJSERSNIT GRAD 1
- Neuroaksial anæstesi: Ingen profylakse
- Generel anæstesi: Natriumcitrat 0,3 M, 30 ml peroralt – bør indtages
AKUT KEJSERSNIT GRAD 2
- Neuroaksial anæstesi: Ingen profylakse
- Generel anæstesi: Natriumcitrat 0,3 M, 30 ml peroralt – bør indtages
AKUT KEJSERSNIT GRAD 3
- Neuroaksial anæstesi: Ranitidin 50 mg kan evt. gives langsomt IV senest 30 min. før anæstesi
- Generel anæstesi: Natriumcitrat 0,3 M, 30 ml peroralt – bør indtages
FASTE OG ASPIRATIONSPROFYLAKSE POST PARTUM
- Ved kirurgiske indgreb post partum behandles kvinden som gravid ved terminen indtil 24 timer post partum
- Efter 24 timer post partum betragtes kvinden risikomæssigt som værende ikke-gravid, medmindre smerter, blødning og opioidbehandling indicerer, at patienten behandles som akut
- Efter generel anæstesi skal man overveje tømning af evt. fyldt ventrikel med orogastrisk sonde
BAGGRUND FOR REKOMMANDATIONER
GRAVIDITETSBETINGEDE RISICI FOR ASPIRATION
Efter 20. gestationsuge er der en øget anæstesirisiko på grund af følgende graviditetsbetingede forhold:
Intubation er vanskeligere hos gravide, og risikoen for vanskelig intubation og fejlintubation hos gravide er markant højere end hos ikke-gravide (jf. afsnit 9. Generel anæstesi) (201–203). Både aspiration og hypoxi nævnes som dødsårsager.
Gastro-esofageal refluks er almindeligt forekommende hos gravide som følge af et lavere pH i ventrikelindholdet, øget intragastrisk tryk og en, formentlig progesteron-induceret, relaksation af den af nedre esofageale sphincter (204–208).
Ventrikeltømningen forsinkes straks, efter fødslen går i gang, af smerter, men også af opioid. Ventrikeltømningen er normaliseret 24 timer post partum, men vil stadig være påvirket af smerter og/eller indgift af opioid (209–211). Administration af både epidural eller intrathekal opioid under fødslen vil hæmme ventrikeltømningen. Dog forårsager infusion af epidural fentanyl doser < 100 mikrog ikke en yderligere forsinkelse af ventrikeltømningen (212,213).
H2-antagonist reducerer risikoen for pH < 2,5 i ventrikelindholdet sammenlignet med placebo. Der foreligger ingen evidens for, at profylakse med H2-antagonist forbygger maternel død pga. aspiration ved elektivt kejsersnit i neuroaksial eller generel anæstesi hos en fastende patient (214). Af samme grund justerede DASAIMs Obstetriske Anæstesiudvalg i 2016 på anbefalingen vedrørende aspirationsprofylakse til elektiv kejsersnit i regional anæstesi, og anbefalingen af ranitidin/PPI blev ændret fra “bør” til “kan” anvendes (www.dasaim.dk).
VENTRIKELTØMNING OG FASTE
Hos voksne og raske patienter til elektive operationer tillades og tilrådes oral indtagelse af klar væske op til 2 timer før induktion af anæstesien, da dette ikke øger volumen eller aciditet af ventrikelsekretet (215).
Graviditet i sig selv forlænger ikke ventrikeltømningen. Dette er påvist i en række undersøgelser omfattende paracetamolabsorption, ultralyd og tomografi (216–218).
Et Cochrane review fra 2013 fandt ingen evidens for hverken fordele eller ulemper ved føde eller væskeindtagelse hos fødende (med lav komplikationsrisiko). Der foreligger ingen studier på fødende med høj komplikationsrisiko (219).
Der er ikke påvist negative effekter af de metaboliske ændringer efter faste på fødselsforløbet eller på det nyfødte barn (220,221).
FARMAKOLOGISK ASPIRATIONSPROFYLAKSE
Aspirationsprofylakse anbefales alene på et teoretisk grundlag, da det pga. sjælden forekomst ikke er muligt at påvise en effekt på morbiditet eller mortalitet.
Mekanismerne for aspirationsprofylakse er at reducere risikoen ved at nedsætte ventrikelindholdets volumen og øge pH (222). Muligheder for farmakologisk profylakse er antacida i form af natriumcitrat, H2-receptor antagonist, PPI og prokinetisk dopaminreceptor agonist (metoclopramid).
Natriumcitrat 0,3 M, f.eks. 30 ml peroralt, er alkalisk, neutraliserer mavesyren og øger ventrikelindholdets pH i løbet af få min., og virkningsvarighed er ca. 1 time.
H2-antagonisten ranitidin, f.eks. 50 mg IV, hæmmer sekretionen af syre i ventriklen og nedsætter derved ventrikelindholdet og øger pH. Den virker i løbet af ca. 30 min., og plasmahalveringstid er 2-3 timer.
PPI, f.eks. omeprazol 20 mg peroralt eller pantoprazol 40 mg IV, hæmmer også ventriklens syresekretion og har en plasmahalveringstid på 1-2 timer.
Metoclopramid 10 mg IV virker ved at øge gastrisk motilitet og ventrikeltømning og nedsætter dermed ventrikelindholdet. Derudover har det en antiemetisk effekt. Det virker i løbet af 5-15 min., og plasmahalveringstid er 4- 6 timer.
Kombinationen af 2 præparater lader til at være mere effektiv end ét præparat alene (www.promedicin.dk) (12). Der anbefales derfor brug af 2 præparater som aspirationsprofylakse for at øge pH og nedsætte ventrikelindholdet (3). Et Cochrane review fra 2014 konkluderede, at når kun ét præparat blev brugt var natriumcitrat mere effektiv til at øge pH > 2,5 end H2-antagonist, som var mere effektiv end PPI (207).
ESA anbefaler H2-antagonist aftenen før og morgenen inden planlagt kejsersnit og natriumcitrat ved generel anæstesi. Man bør overveje metoclopramid 10 mg IV (223).
En belgisk retningslinje anbefaler, at alle patienter til kejsersnit som minimum får antacida, f.eks. natriumcitrat (153).
UTERIN ATONIPROFYLAKSE
DJ og KL
REKOMMANDATIONER
- Det anbefales at administrere farmakologisk atoniprofylakse umiddelbart efter barnets fødsel for at reducere blødning
- Oxytocin (Syntocinon®) anbefales som førstevalgspræparat og kan administreres enten IV eller IM
- Der anbefales, at IV oxytocin givet som bolus max. er 5 IE
- Det anbefales, at administrationshastigheden af IV oxytocin ikke overstiger 1 IE/min
- Afhængigt af komorbiditet og risikofaktorer for PPH anbefales det at individualisere regimet for administration af IV oxytocin (opstartsdosering: 0-5 IE, vedligeholdelsesdosering: 0-10 IE/time, varighed af vedligeholdelsesdosering: 0-5 timer)
- Ved forsat atoni, trods administration af oxytocin, foreslås det at supplere med et uterotonikum, som ikke virker via oxytocinreceptorer
BAGGRUND FOR REKOMMANDATIONER
OXYTOCIN/SYNTOCIN©
Der er evidens for, at profylaktisk administration af oxytocin umiddelbart efter barnets fødsel reducerer risikoen for PPH > 500 ml efter vaginal forløsning (224,225).
Der anvendes mange forskellige regimer for atoniprofylakse (226,227).
RCOG/NICE mfl. anbefaler oxytocin som atoniprofylakse og understreger, at det skal gives langsomt IV med max 1 IE/min., med en max. profylaksedosis på 5 IE (228–231).
Profylaktisk oxytocin kan gives IV eller IM, hvilket er fundet lige effektive og med samme bivirkninger. Hvis det gives IM anbefales, at dosis ikke overskrider 10 IE (232).
Kvinder i fødsel, der stimuleres med infusion oxytocin, er estimeret til at behøve mere end dobbelt så stor dosis til efterfølgende atoniprofylakse. Flere forskellige regimer, som tager højde for evt. eksponering op til kejsersnittet, har været foreslået (233,234).
Kvinder til elektivt kejsersnit til termin er ikke stimuleret naturligt med oxytocin før kejsersnittet og kan derfor nøjes med lavere doser 0,5-3 IE oxytocin langsomt IV (235–237).
Kvinder, som er stimuleret med oxytocin før kejsersnittet, behøver højere bolusdosis (3-5 IE) og muligvis efterfølgende infusion af oxytocin (3-5 IE/time). Infusion med oxytocin er rationel pga. den korte halveringstid (2-4 min.), hvis atonien fortsætter (238).
Kvinder til kejsersnit viste betydelig øgning i cardiac output efter IV oxytocin (239). Forsøg på at modvirke blodtryksfald og takykardi ved bolus phenylephrin (50 mikrog) efter 3 IE oxytocin har ikke været muligt (240).
BOLUS OG/ELLER INFUSION AF OXYTOCIN
I et observationelt studie på elektive kejsersnitpatienter i spinal anæstesi fandt forfatterne, at der ikke var forskel på blødningen mellem patienter, der fik oxytocin 3 IE og oxytocin 5 IE, dog var der signifikant mindre opkastning i gruppen, som fik 3 IE (235). Ca. halvdelen i begge grupper havde behov for yderligere uterotonika (235). Tilsvarende er beskrevet, at IV oxytocin 5 IE givet over 5-10 sek. giver signifikant mere kvalme sammenlignet med 2 IE givet over 5-10 sek.; desuden ses en trend mod højere frekvens af opkast ved oxytocin 5 IE sammenlignet med 2 IE, men ikke signifikant (236).
Oxytocin har ED90 på 0,35 IE i et studie på 40 kvinder til elektivt kejsersnit uden risikofaktorer for atoni (241). Et andet studie fandt, at kvinder som havde været eksponeret for oxytocin op til kejsersnittet havde ED90 på 3,0 IE oxytocin (242).
DSOG anbefaler, at oxytocin gives før placenta fjernes (232). Nyere studie har vist, at bolus oxytocin muligvis med fordel kan gives allerede inden incision af uterus (243).
RCOG anbefaler oxytocin 5 IE langsomt IV til kvinder, som føder ved kejsersnit (228). Ved sammenligning af oxytocin 5 IE langsomt IV med 20 IE IM i uterus fandt man større blodtryksfald efter IM administration, men samme tonus af uterus (244). Et andet studie fandt længere tid til maksimalt kontraheret uterus (subjektiv scoret ved obstetriker) ved lavdosis oxytocin IM i uterus (0,07 IE/kg) sammenlignet med oxytocin IV af samme dosis, begge givet over 30 sek., men ingen forskel i blodtab eller bivirkninger (n=40) (245).
Der ses større blodtryksfald og øget hjertefrekvens ved oxytocin 5 IE givet over 5 sek. sammenlignet med 5 min. (230).
METHYLERGOMETRIN/METHERGIN®
Kan bruges som ’second-line’ i behandling af atoni. Effekt efter IM administration kommer efter 2-5 min. IV methylergometrin bør administreres langsomt. Anbefalet dosis er 0,2 mg IM/IV. Methylergometrin medfører vasokonstriktion og er derfor kontraindiceret til patienter med præeklampsi og hypertension (246).
CARBOPROST/PROSTINFENEM®
Kan bruges som ’second-line’, evt. sammen med methylergometrin. 80% af patienterne har effekt af 0,25 mg og 95% af patienterne af 0,5 mg. Anbefalet dosis er 0,25 mg IM, kan gentages efter 15 min., max. 8 gange i alt. Carboprost er kontraindiceret ved astma (232).
CARBETOCIN/PABAL®
Carbetocin virker på oxytocinreceptorerne og har længere halveringstid end oxytocin, ca. 40 min. Carbetocin administreres som bolus.
Et retrospektivt cohortestudie fandt ingen forskel mellem oxytocin og carbetocin i andel af PPH > 1000 ml (247). Ligeledes fandt et Cochrane review ingen forskel i PPH (både > 500 ml og >1000 ml) mellem oxytocin og carbetocin (248). Flere studier har ikke fundet forskel i intraoperativ blødning mellem carbetocin og oxytocin (249–251).
Carbetocin findes i ampuller med 100 mikrog, hvilket er for meget til elektiv kejsersnit og for lidt til akut kejsersnit. Carbetocin har ED90 på 14,8 mikrog hos gravide til termin, der ikke er i fødsel, og 121 mikrog hos kvinder i fødsel. Nyligt er kommet et studie, hvor carbetocin har effekt og bivirkninger sammenlignelige med oxytocin; desuden behøves det i studiet anvendte lægemiddel ikke at opbevares på køl, hvilken kan være en stor fordel i lande med begrænset kølemuligheder (252).
POSTOPERATIV SMERTEBEHANDLING EFTER KEJSERSNIT
GS og KL
REKOMMANDATIONER
MULTIMODAL SMERTEBEHANDLING
- 1. postoperative døgn anbefales: Fast opioid (eller neuroaksial morfin) + NSAID + paracetamol + p.n. opioid IV eller peroralt
- 2-3. postoperative døgn anbefales: Fast NSAID + paracetamol + p.n. opioid peroralt
OPIOIDBEHANDLING
INTRATHEKAL OG EPIDURAL MORFIN
- Morfin i dosis 50 mikrog intrathekalt eller 2 mg epiduralt anbefales, men trods den lave dosis kan der ses bivirkninger som kvalme/opkast/hudkløe
INTRAVENØS PATIENT KONTROLLERET ANALGESI
- IV PCA kan anvendes ved manglende mulighed for intrathekal eller epidural analgesi eller ved manglende mulighed for peroralt indtag
- Peroral opioid anbefales fremfor IV (inkl. PCA), hvis kvinden har fået neuroaksial opioid
KONTINUERLIG EPIDURAL INFUSION
- Kan bruges til patienter med særligt behov for effektiv smertebehandling. Anbefales som postoperativ smertebehandling til kvinder med kroniske smerter eller kvinder i behandling med buprenorphin eller metadon
NON-OPIOID SMERTEBEHANDLING PARACETAMOL OG NSAID
- Anbefales i fast dosering de første døgn
- Non-selektiv COX-hæmmer anbefales frem for selektiv COX-2 hæmmer
- Hvis patienten har svær hypertension, svær præeklampsi, trombocytopeni (<100 x 109 /l), koagulopati, pågående blødning, uterus atoni, hjerteinsufficiens (NYHA II-IV) og/eller svær nyre- eller leverinsufficiens er NSAID kontraindiceret
TRANSVERSUS ABDOMINIS PLANE BLOK, TRANSMUSKULÆR QUADRATUM LUMBORUM BLOK OG QUADRATUM LUMBORUM BLOK
- Hvis patienten tåler opioider dårligt eller ikke har fået neuroaksial blokade med opioid, kan TAP, TQL eller QL forsøges
- Kan også anvendes som rescue-blok ved stærke smerter efter kejsersnit
SÅRKATETER
- Fordelen ved sårkateter er begrænset og anbefales derfor ikke
ØVRIG MEDICINSK BEHANDLING
- Hos kroniske smertepatienter eller ved intraktable smerter kan gabapentin overvejes
- Profylaktisk ondansetron 4 mg IV anbefales efter barnet er forløst til kvinder i højrisiko for PONV. Kan også bruges til behandling af kløe efter neuroaksial opioid
- Naloxon 0,04 mg IV anbefales som andet valg til kløe efter neuroaksial opioid
BAGGRUND FOR REKOMMANDATIONER
GENERELT
Kejsersnit resulterer almindeligvis i moderate til svære postoperative smerter i 24-48 timer. Effektiv postoperativ analgesi er vigtig, fordi kvinder, der får lavet kejsersnit, angiver som deres højeste prioritet at undgå smerter intra- og postoperativt. Effektiv smertebehandling efter kejsersnit forbedrer kvindens evne til at fungere og passe den nyfødte (253). Optimal multimodal postoperativ analgetika og forebyggelse af PONV hos kvinder til elektivt kejsersnit anbefales (254).
Der findes meget stor spredning i behovet for postoperativ smertebehandling efter kejsersnit i en ellers meget homogen gruppe. Dette kan delvis kan skyldes genforskelle (255–257).
INTRATHEKAL, EPIDURAL OG INTRAVENØS ANALGESI
MORFIN INTRATHEKALT
Indgift af intrathekal morfin beskrives i et nyligt review som ‘the golden standard’, som giver postoperativ analgesi i op til 36 timer og betyder, at fast postoperativ opioid er unødvendig og kan forbeholdes gennembrudssmerter (253). Varigheden af intrathekal morfin angives at være 14-36 timer (258).
En nylig metaanalyse viste, at højere doser (100-250 mikrog) intrathekal morfin forlænger tid til første smertestillende medicin efter operation med gennemsnitligt 4,5 timer sammenlignet med lav intrathekal morfindosis (50-100 mikrog). Dog er der mindre postoperativ kløe og PONV efter lav morfindosis intrathekal i forhold til højdosis. Der var ikke signifikant forskel i smertescoring efter 12 timer eller morfinforbrug efter 24 timer mellem grupperne med høj og lav intrathekal morfindosis (259).
Hudkløe efter intrathekal morfin er fundet med en nærmest lineær sammenhæng i forhold til dosis. Øvrige bivirkninger, f.eks. urinretention og kvalme/opkast, er dog ikke sikkert relateret til intrathekal morfin (260). Et ældre studie har fundet reduceret indlæggelsestid ved tilsætning af morfin til spinal til kejsersnit (261).
Berger et al. randomiserede kvinder (n=144) til at få 50, 100 eller 150 mikrog morfin i spinal anæstesien (sammen med bupivacain tung 12 mg og fentanyl 15 mikrog) (n=144) og fandt ingen forskel, bortset fra mindre hudkløe efter 6 og 12 timer i 50 mikrog gruppen. Det bemærkes, at der var meget stor spredning i behovet for IV morfin (PCA-pumpe) for både 0-6, 6-12, 12-18 og 18-24 timer for både 50 og 150 mikrog grupperne. Patienterne fik postoperativ NSAID, men ikke paracetamol (19).
MORFIN EPIDURALT
Epiduralt morfin har effekt og bivirkningsprofil som intrathekal morfin. Rekommanderet epiduralt morfin dosis ved kejsersnit er 2-4 mg (253,258,262).
Epiduralt morfin forlænger tiden til første anmodning om yderligere smertestillende medicin med nærmest lineær dosiseffekt og forbedrer kvaliteten af analgesi efter kejsersnit, men dette er begrænset til de første ca. 30 timer. Højere doser morfin epiduralt (4-6 mg) øger signifikant bivirkninger som kløe, kvalme og respiratorisk depression, også i sammenligning med IV opioider. En enkelt bolus epidural morfin giver bedre analgesi end IV opioid, men kun de første 24 timer, og det øger forekomsten af kløe (263).
Ulempen ved at anvende epiduralinfusion som postoperativ smertelindring er, at det hæmmer kvindernes mobilisering og dermed øger risikoen for tromboembolier. Det kan dog opvejes hos specielle patientkategorier, f.eks. ekstremt overvægtige eller patienter med komplekse/kroniske smerter (f.eks. opioidafhængige og kroniske smertepatienter) (258).
INTRAVENØS PATIENT KONTROLLERET ANALGESI
Hvis det ikke er muligt at administrere intrathekal eller epidural opioid eller i tilfælde af generel anæstesi, kan opioid PCA anvendes til postoperativ smertebehandling.
Forslag til PCA-regime fra www.uptodate.com:
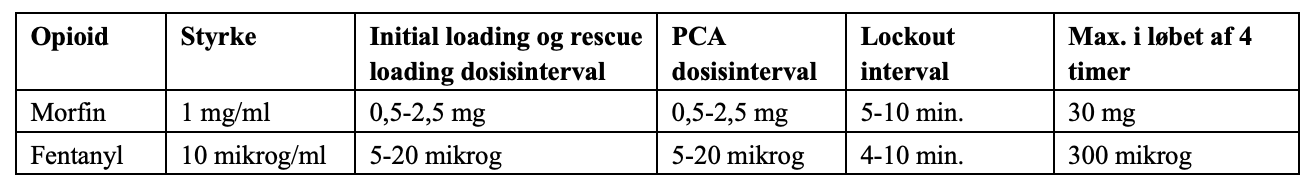
PCA kan være indiceret hos kvinder, som er kroniske smertepatienter, men her kan epidural med fordel også anvendes (253).
Postoperativ opioid IV er uhensigtsmæssigt, med mindre patienten har meget kraftige smerter, behov for gentagne opioiddoseringer eller ikke kan indtage peroral opioid, og da er PCA uden basal infusion bedst (264–266).
FASCIE-BLOK, SÅRINFILTRATION OG SÅRKATETER
TRANSVERSUS ABDOMINIS PLANE BLOK, TRANSMUSKULÆR QUADRATUM LUMBORUM BLOK OG QUADRATUM LUMBORUM BLOK
Effekten af TAP-blok er angivet til 0-12 timer (267). Patienter, som får lagt TAP-blok har reduceret morfinforbrug, effekten er størst hos patienter, som ikke har fået intrathekalt morfin (268). En højere dosis lokalanalgetika i TAPblokket reducerer ikke 24-timers opioidforbruget eller PONV (269). Toxisk niveau af lokalanalgetika og kramper efter TAP-blok hos obstetriske patienter har været beskrevet (270–272).
QL-blok, et fascieblok, hvor blokaden anlægges mellem QL og m. transversus abdominis, sammen med spinal anæstesi (bupivacain tung 15 mg og fentanyl 20 mikrog) og postoperativ paracetamol og NSAID reducerer opioidforbruget og smertescoren postoperativt (273,274).
Ved sammenligning af QL-blok anlagt med ropivacain eller NaCl fandtes signifikant forskel efter 12 timer i kumulativ PCA ketoganforbrug, men ikke efter 36 eller 48 timer. Der blev ikke brugt intrathekal morfin, men et multimodalt regime med paracetamol og NSAID. Bortset fra et lavere forbrug inden for de første 6-8 timer, ser medianforbruget ud til at være helt parallelt fra 8-45 time postoperativt (275).
To mindre studier sammenligner TAP-blok med QL-blok/sårinfiltration hos kejsersnitpatienter. QL-blok gav mindre postoperativt opioidforbrug end TAP-blok (276), men der var ikke forskel på postoperativt fentanylforbrug mellem TAP-blok og sårinfiltration (277). En del af effekten kan muligvis stamme fra systemisk effekt af lokalanalgetika (277).
Rutine TAP-, QL- og TQL-blok er ikke indiceret, særligt ikke hvis man har fået intrathekal morfin, men blokkene kan bruges som rescue (278,279).
SÅRINFILTRATION OG SÅRKATETER
Ved infiltration af cikatrice med lokalanalgetika er fundet reduktion i 24 timers forbrug af morfinækvivalenter, dog ikke hvis der var givet intrathekal morfin, men ingen klinisk relevant effekt på smertescore 24 timer postoperativt. Der er ikke fundet reduktion af PONV eller hudkløe. Der er ikke fundet fordele ved infusion via sårkateter sammenlignet med sårinfiltration (280,281).
Ved sammenligning af TAP-blok med sårkateter i et multimodalt smerteregime (spinal med bupivacain/sufentanil, paracetamol og NSAID) fandtes ingen signifikant forskel (282).
Et ældre dansk review finder ingen effekt af infiltration af cikatricen (283).
Hvis sårkateter placeres, anbefales det placeret lige under fascien (284).
PARACETAMOL OG NSAID
Paracetamol nedsætter opioidbehovet med ca. 20%. Fast dosering af paracetamol og kun opioid ved behov er anbefalet (258,285).
NSAID nedsætter opioidforbruget med 30-50% hos kejsersnitpatienter (286–289). COX-2 har begrænset virkning ift. almindelig NSAID efter kejsersnit (290). IV NSAID er ikke anbefalet som rutine pga. højere pris og mangel på evidens (258).
NICE anbefaler NSAID, forudsat der ikke er kontraindikationer. Ved udskrivelse anbefales for milde smerter paracetamol og for moderate smerter et kombinationspræparat med paracetamol og kodein samt tillæg af ibuprofen (229).
Up-to-date anbefaler fast paracetamol og NSAID de første 24 timer postoperativt, mens opioid (IV, PCA og oralt) er forbeholdt kvinder, som har fået lavet kejsersnit i generel anæstesi, eller hvor neuroaksial opioider er kontraindiceret.
Prospect under ESRA anbefaler oral NSAID og paracetamol efter kejsersnit (www.esraeurope.org/prospect/).
ORAL OPIOID
Postoperativ opioid kan med fordel doseres oralt frem for IV (253).
ANDRE ADJUTIVA
Clonidin kan tilsættes spinal anæstesi hos kvinder som er i højrisiko for svære postoperative smerter. Dosis er intrathekalt 30 mikrog og epiduralt 60-75 mikrog. Bivirkninger er hypotension og sedation (253).
Intrathekal dexmedetomidin er fundet at have samme effekt som intrathekal morfin, dog med mindre hudkløe og mindre shivering (291).
ACOG anbefaler ikke gabapentin som standard behandling, men angiver, at det kan overvejes som del af multimodal regime hos kvinder med kroniske smerter eller kvinder, som ikke får smertelindring på vanlig standard behandling (266).
PONV PROFYLAKSE OG BEHANDLING
Ondansetron, dopamine receptor antagonist og sedativa er fundet at have nogen effekt på PONV, mens steroid og akupressur har været undersøgt uden overbevisende fund. Kombination af flere forskellige præparater kunne ikke vises at være bedre (292).
ACOG angiver, at en enkelt intraoperativ dosis af dexamethason forbedrer smertebehandlingen og reducerer PONV det første postoperative døgn (266).
Hvis der anvendes intrathekal morfin kan der med fordel anvendes lave doseringer < 50 mikrog, højere doser øger risiko for bivirkninger, herunder PONV (19).
Oxytocin dosis > 5 IE IV eller hurtig administration er forbundet med øget risiko for bivirkninger, både alvorlige kardiovaskulære og PONV (jf. afsnit 11. Uterin atoniprofylakse)
Profylaktisk ondansetron reducerer muligvis incidensen af hypotension og PONV (81,100). Manipulation af uterus kan give kvalme trods sufficient neuroaksial anæstesi. Mindre dosis af opioid (f.eks. 25-50 mikrog fentanyl) kan ofte afhjælpe kvalme. Patienter med PONV i anamnesen kan muligvis have fordel af forebyggende antiemetisk behandling (ondansetron, scopolamin, dexamethason eller metoclopramid) (12).
BEHANDLING AF OPIOIDINDUCERET KLØE
Ondansetron, der er en 5-HT3 serotonin antagonist, er vist at kunne behandle kløe efter kejsersnit i spinal anæstesi, hvor der er givet intrathekal morfin (293). Dette kunne ikke genfindes i et studie fra 2014, hverken som profylakse eller som behandling (294).
Der er ikke vist effekt af akupunktur mod hudkløe induceret af intrathekal morfin (295).
Kombination af palonosetron (5-HT3 serotonin antagonist) med dexamethason er ikke bedre end dexamethason alene hos kejsersnitpatienter mht. hudkløe og PONV (296).
Forbyggende behandling med ondansetron og nalbuphine (syntetisk opioid af partiel agonist-/antagonisttype) er bedre end placebo til at undgå intrathekal morfininduceret hudkløe (297).
Naloxon 0,04 mg IV anbefales ved opioidinduceret kløe (298).
KRONISKE SMERTER
Kronisk smerte er hyppigere efter kejsersnit end efter vaginal forløsning (299). I et nyere prospektivt studie var incidensen af kroniske smerter efter kejsersnit 1-18%, faldende over tid (300). Et andet studie fandt, at 9% af kejsersnitpatienter angiver smerter 2 mdr. efter kejsersnittet (301). Høj smerteintensitet i det umiddelbare postoperative forløb har været mistænkt for at øge risikoen for udvikling af persisterende smerter (302,303), omend dette ikke er genfundet i andre nyere studier (304,305).
Der findes ikke entydige data på, om kroniske smerter er hyppigere efter kejsersnit i generel anæstesi end efter kejsersnit i neuroaksial anæstesi (305,306), men noget tyder på, at neuroaksial anæstesi kan afbøde risikoen for persisterende postoperative smerter i kejsersnitarret (307).
Hos kvinder i højrisiko for svære postoperative smerter kan overvejes patientkontrolleret epidural analgesi (med lokalanalgetika og opioid), sårkateter, TAP-kateter, S-ketamin (IV 10-15 mg) og/eller dexamethason (IV 4-8 mg) efter barnet er født og afnavlet.
REFERENCER
- Knight M, Nair M, Tuffnell D, Shakespeare J, Kenyon S, Kurinczuk J. Saving Lives, Improving Mothers’ Care (2013-2015). 2017.
- DASAIMs anæstesiudvalg. Rekommandation for anæstesi 2017. www.dasaim.dk. 2017.
- American Society of Anesthesiologists. Practice Guidelines for Obstetric Anesthesia: An Updated Report by the American Society of Anesthesiologists Task Force on Obstetric Anesthesia and the Society for Obstetric Anesthesia and Perinatology. Anesthesiology. 2016;124(2):270–300.
- Arevalo-Rodriguez, I; Muñoz, L; GodoyCasasbuenas, N; Ciapponi, A; Arevalo, JJ; Boogaard, S; Roqué i Figuls M. Needle gauge and tip designs for preventing post-dural puncture headache (PDPH). Cochrane Database Syst Rev. 2017;(4).
- Lee, SI; Sandhu SD, B; Mhaskar R. Impact of spinal needle type on postdural puncture headache among women undergoing Cesarean section surgery under spinal anesthesia: A meta-analysis. Evid Based Med. 2018;11(3):136–44.
- Saifuddin A, Burnett SJD, White J. The variation of position of the conus medullaris in an adult population. A magnetic resonance imaging study. Spine (Phila Pa 1976). 1998;23(13):1452–6.
- Broadbent CR, Maxwell WB, Ferrie R, Wilson DJ, Gawne-Cain M, Russell R. Ability of anaesthetists to identify a marked lumbar interspace. Anaesthesia. 2000 Nov;55(11):1122–6.
- Chakraverty R, Pynsent P, Isaacs K. Which spinal levels are identified by palpation of the iliac crests and the posterior superior iliac spines? J Anat. 2007;210(2):232–6.
- Margarido CB, Mikhael R, Arzola C, Balki M, Carvalho JCA. The intercristal line determined by palpation is not a reliable anatomical landmark for neuraxial anesthesia. Can J Anesth Can d’anesthésie. 2011;58(3):262–6.
- Halpern SH, Banerjee A, Stocche R, Glanc P. The use of ultrasound for lumbar spinous process identification: A pilot study. Can J Anesth Can d’anesthésie. 2010 Sep;57(9):817– 22.
- Srinivasan K, Deighan M, Crowly L, McKeating K. Spinal anaesthesia for caesarean section: an ultrasound comparison of two different landmark techniques. IntJ Obs. 2014;23(3):206–12.
- Nixon, Heather; Leffert L. Anesthesia for cesarean delivery [Internet]. www.uptodate.com. Available from: www.uptodate.com/contents/anesthesia-forcesarean-delivery
- Sng BL, Siddiqui FJ, Leong WL, Assam PN, Chan ESY, Tan KH SA. Hyperbaric Versus Isobaric Bupivacaine for Spinal Anesthesia. Cochrane Database Syst Rev. 2016;(9).
- Sia, ATH; Tan, KH; Sng, B; Lim, Y; Chan, ESY; Siddiqui F. Hyperbaric Versus Plain Bupivacaine for Spinal Anesthesia for Cesarean Delivery. Anesth Analg. 2015;120(1):132–40.
- Malhotra R, Johnstone C, Halpern S, Hunter J, Banerjee A. Duration of motor block with intrathecal ropivacaine versus bupivacaine for caesarean section: a meta-analysis. Int J Obstet Anesth. 2016;27(July 2015):9–16.
- Arzola C, Wieczorek PM. Efficacy of low-dose bupivacaine in spinal anaesthesia for Caesarean delivery: systematic review and meta-analysis. Br J Anaesth. 2011 Sep;107(3):308–18.
- Qiu M, Lin F, Fu S, Zhang H, Li H, Zhang L, et al. Combination of Low-Dose Bupivacaine and Opioids Provides Satisfactory Analgesia with Less Intraoperative Hypotension for Spinal Anesthesia in Cesarean Section. CNS Neurosci Ther. 2012;18:426–32.
- Royal College of Obstetricians and Gynaecologists. Caesarean Section. 2011;1– 276.
- Berger JS, Gonzalez A, Hopkins A, Alshaeri T, Jeon D, Wang S, et al. Dose–response of intrathecal morphine when administered with intravenous ketorolac for post-cesarean analgesia: a two-center, prospective, randomized, blinded trial. Int J Obstet Anesth. 2016;28(2016):3–11.
- Hu J, Zhang C, Yan J, Wang R, Wang Y, Xu M. Sufentanil and bupivacaine combination versus bupivacaine alone for spinal anesthesia during cesarean delivery: A meta-analysis of randomized trials. PLoS One. 2016;11(3):1–15.
- Uppal V, Retter S, Casey M, Sancheti S, Matheson K, McKeen DM. Efficacy of Intrathecal Fentanyl for Cesarean Delivery: A Systematic Review and Meta-analysis of Randomized Controlled Trials With Trial Sequential Analysis. Anesth Analg. 2019;[Epub ahead of print].
- Norris MC. Patient variables and the subarachnoid spread of hyperbaric bupivacaine in the term parturient. Anesthesiology. 1990;72(3):478–82.
- Norris MC. Height, weight, and the spread of subarachnoid hyperbaric bupivacaine in the term parturient. Anesth Analg. 1988;67(6):555–8.
- She, Y.-J.; Zheng, X.; Zhao, B.-S.; Zeng, M.- T.; Tan, Y.-H.; Song X-R. Body height and the spread of spinal anaesthesia for caesarean section: a prospective controlled trial. Acta Anaesthesiol Scand. 2017;61(7):824–31.
- Bauer ME, Kountanis JA, Tsen LC, Greenfield ML, Mhyre JM. Risk factors for failed conversion of labor epidural analgesia to cesarean delivery anesthesia: a systematic review and meta-analysis of observational trials. IntJ Obs. 2012 Oct;21(4):294–309.
- Hillyard SG, Bate TE, Corcoran TB, Paech MJ, O’Sullivan G. Extending epidural analgesia for emergency Caesarean section: a meta-analysis. BrJ Anaesth. 2011 Nov;107(5):668–78.
- Sviggum HP, Yacoubian S, Liu X, Tsen LC. The effect of bupivacaine with fentanyl temperature on initiation and maintenance of labor epidural analgesia: A randomized controlled study. Int J Obstet Anesth. 2015;24(1):15–21.
- Clark V, Mcgrady E, Sugden C, Dickson J, Mcleod G. Speed of onset of sensory block for elective extradural caesarean section: Choice of agent and temperature of injectate. Br J Anaesth. 1994;72(2):221–3.
- Han, SS; Lee, SC; Ro, YJ; Min, SW; Huh J. Warming the epidural injectate improves first sacral segment block: A randomised doubleblind study. Anaesth Intensive Care. 2010;38(4):690–4.
- Goring-Morris J, Russell IF. A randomised comparison of 0.5% bupivacaine with a lidocaine/epinephrine/fentanyl mixture for epidural top-up for emergency caesarean section after “low dose” epidural for labour. IntJ Obs. 2006 Apr;15(2):109–14.
- Malhotra S, Yentis SM. Extending low-dose epidural analgesia in labour for emergency caesarean section – A comparison of levobupivacaine with or without fentanyl. Anaesthesia. 2007;62(7):667–71.
- Pöpping DM, Elia N, Wenk M, Tramèr MR. Combination of a reduced dose of an intrathecal local anesthetic with a small dose of an opioid: A meta-analysis of randomized trials. Pain. 2013;154(8):1383–90.
- Shapiro A, Fredman B, Olsfanger D, Jedeikin R. Anaesthesia for caesarean delivery: Lowdose epidural bupivacaine plus fentanyl. Int J Obstet Anesth. 1998;7(1):23–6.
- Ng, KW; Parsons, J; Cyna, AM; Middleton P. Spinal versus epidural anaesthesia for caesarean section ( Review ). Cochrane Database Syst Rev. 2004;(2).
- Chestnut DH. Chestnut’s obstetric anesthesia, principles and practice. Fifth edit. Elsevier/Saunders; 2014.
- Zink W, Graf BM. The toxicity of local anesthetics: the place of ropivacaine and levobupivacaine. CurrOpinAnaesthesiol. 2008 Oct;21(5):645–50.
- Klimek M, Rossaint R, van de Velde M, Heesen M. Combined spinal-epidural vs. spinal anaesthesia for caesarean section: metaanalysis and trial-sequential analysis. Anaesthesia. 2018;73(7):875–88.
- Lamon, AM; Habib A. Managing anesthesia for cesarean section in obese patients: current perspectives. Local Reg Anesth. 2016 Aug;Volume 9:45–57.
- Hoyle J, Yentis SM. Assessing the height of block for caesarean section over the past three decades: trends from the literature. Anaesthesia. 2015 Apr 1;70(4):421–8.
- Blondon M, Casini A, Hoppe K, Boehlen F, Righini F, Smith N. Risks of Venous Thromboembolism After Cesarean Sections: A Meta-Analysis. Chest. 2016;150(3):572–96.
- Rodgers A, Walker N, Schug S, McKee A, Kehlet H, van Zundert A, et al. Reduction of postoperative mortality and morbidity with epidural or spinal anaesthesia: results from overview of randomised trials. BMJ. 2000 Dec 16;321(7275):1493.
- Guay J, Choi P, Suresh S, Albert N, Kopp S, Pace NL. Neuraxial blockade for the prevention of postoperative mortality and major morbidity: An overview of Cochrane systematic reviews. Vol. 2014, Cochrane Database of Systematic Reviews. 2014.
- Dansk Selskab for Trombose og Hæmostase. Perioperativ regulering af antitrombotisk behandling. www.dsth.dk.
- Dansk Selskab for Trombose og Hæmostase. Tromboembolisk sygdom under graviditet og post partum – risikovurdering, profylakse og behandling. www.dsth.dk.
- Breivik H, Bang U, Jalonen J, Vigfusson G, Alahuhta S, Lagerkranser M, et al. Nordic guidelines for neuraxial blocks in disturbed haemostasis from the Scandinavian Society of Anaesthesiology and Intensive Care Medicine. Acta Anaesthesiol Scand. 2010 Jan;54(1):16– 41.
- Nielsen LH, Sundtoft I, Vestgaard MJ, Persson L, Storgaard L, Salvig JD, et al. Hypertension og præeklampsi. www.dsog.dk. 2018;
- Killeen T, Kamat A, Walsh D, Parker A, Aliashkevich A. Severe adhesive arachnoiditis resulting in progressive paraplegia following obstetric spinal anaesthesia: a case report and review. Anaesthesia. 2012 Dec;67(12):1386– 94.
- Iqbal IM, Morris R, Hersch M. Adhesive Arachnoiditis following Inadvertent Epidural Injection of 2% Chlorhexidine in 70% Alcohol—Partial Recovery over the Ensuing Eight Years. Anaesth Intensive Care. 2018 Nov 9;46(6):572–4.
- Campbell JP, Plaat F, Checketts MR, Bogod D, Tighe S, Moriarty A, et al. Safety guideline: skin antisepsis for central neuraxial blockade. Anaesthesia. 2014;69(11):1279–86.
- American Society of Anesthesiologists. Practice Advisory for the Prevention, Diagnosis, and Management of Infectious Complications Associated with Neuraxial Techniques: An Updated Report by the American Society of Anesthesiologists Task Force on Infectious Complications Associated with Neuraxi. Anesthesiology. 2017;126(4):585–601.
- Inglis A, Daniel M, McGrady E. Maternal position during induction of spinal anaesthesia for caesarean section. A comparison of right lateral and sitting positions. Anaesthesia. 1995 Apr;50(4):363–5.
- Law ACS, Lam KK, Irwin MG. The effect of right versus left lateral decubitus positions on induction of spinal anesthesia for cesarean delivery. Anesth Analg. 2003 Dec;97(6):1795– 9.
- Kapur D, Grimsehl K. A comparison of cerebrospinal fluid pressure and block height after spinal anaesthesia in the right and left lateral position in pregnant women undergoing Caesarean section. Eur J Anaesthesiol. 2001;18(10):668–72.
- Elfil H, Crowley L, Segurado R, Spring A. A randomised controlled trial of the effect of a head-elevation pillow on intrathecal local anaesthetic spread in caesarean section. Int J Obstet Anesth. 2015;24(4):303–7.
- Chatmongkolchart, S; Prathep S. Supplemental oxygen for caesarean section during regional anaesthesia. Cochrane Database Syst Rev. 2016;(3).
- Bryanton J. Predictors of women’s perceptions of the childbirth experience. J Obs Gynecol Neonatal Nurs. 2008;37:24–34.
- Lie, B; Juul J. Effect of epidural vs. general anesthesia on breastfeeding. Acta Obs Gynecol Scand. 1988;67(3):207–9.
- Kutlucan L, Seker İS, Demiraran Y, Ersoy Ö, Karagöz İ, Sezen G, et al. Effects of different anesthesia protocols on lactation in the postpartum period. J Turkish Ger Gynecol Assoc. 2014;
- Hirose M, Hara Y, Hosokawa T, Tanaka Y. The effect of postoperative analgesia with continuous epidural bupivacaine after cesarean section on the amount of breast feeding and infant weight gain. Anesth Analg. 1996;82:1166–9.
- Klohr S, Roth R, Hofmann T, Rossaint R, Heesen M. Definitions of hypotension after spinal anaesthesia for caesarean section: literature search and application to parturients. Acta Anaesthesiol Scand. 2010 Sep;54(8):909– 21.
- Kinsella SM, Carvalho B, Dyer RA, Fernando R, Mcdonnell N, Mercier FJ, et al. International consensus statement on the management of hypotension with vasopressors during caesarean section under spinal anaesthesia. Anaesthesia. 2018;73(1):71–92.
- Habib AS. A review of the impact of phenylephrine administration on maternal hemodynamics and maternal and neonatal outcomes in women undergoing cesarean delivery under spinal anesthesia. AnesthAnalg. 2012 Feb;114(2):377–90.
- Robson SC, Boys RJ, Rodeck C, Morgan B. Maternal and fetal haemodynamic effects of spinal and extradural anaesthesia for elective caesarean section. BrJAnaesth. 1992 Jan;68(1):54–9.
- Lato K, Bekes I, Widschwendter P, Friedl TWP, Janni W, Reister F, et al. Hypotension due to spinal anesthesia influences fetal circulation in primary caesarean sections. Arch Gynecol Obstet. 2018;297(3):667–74.
- Chooi C, Cox JJ, Lumb RS, Middleton P, Chemali M, Emmett RS, et al. Techniques for preventing hypotension during spinal anaesthesia for caesarean section. Cochrane Database Syst Rev. 2017 Aug 4;(8).
- Clark RB, Thompson DS, Thompson CH. Prevention of spinal hypotension associated with cesarean section. Vol. 32, Obstetrical and Gynecological Survey. 1977.
- Jacob J, Williams A, Afzal L, Verghese M. Crystalloid preload versus crystalloid coload for parturients undergoing cesarean section under spinal anesthesia. J Obstet Anaesth Crit Care. 2012;
- Mercier FJ. Fluid loading for cesarean delivery under spinal anesthesia: have we studied all the options? AnesthAnalg. 2011 Oct;113(4):677– 80.
- Davies P, French GWG. A randomised trial comparing 5 mL/kg and 10 mL/kg of pentastarch as a volume preload before spinal anaesthesia for elective caesarean section. Int J Obstet Anesth. 2006;15(4):279–83.
- National Institute for Health and Care Excellence. Caesarean Section Clinical Guideline. 2011.
- Marx G, Schindler AW, Mosch C, Albers J, Bauer M, Gnass I, et al. Intravascular volume therapy in adults Guidelines from the Association of the Scientific Medical Societies in Germany.
- Heesen M, Klöhr S, Rossaint R, Straube S. Prophylactic phenylephrine for caesarean section under spinal anaesthesia: Systematic review and meta-analysis. Anaesthesia. 2014;69(2):143–65.
- Kee WDN. The use of vasopressors during spinal anaesthesia for caesarean section. Current Opinion in Anaesthesiology. 2017.
- Lin FQ, Qiu MT, Ding XX, Fu SK, Li Q. Ephedrine Versus Phenylephrine for the Management of Hypotension During Spinal Anesthesia for Cesarean Section: An Updated Meta-Analysis. CNS Neurosci Ther. 2012;18(7):591–7.
- Dyer RAA, Emmanuel A, Adams SCC, Lombard CJJ, Arcache MJJ, Vorster A, et al. A randomised comparison of bolus phenylephrine and ephedrine for the management of spinal hypotension in patients with severe preeclampsia and fetal compromise. Int J Obstet Anesth. 2018;33:23–31.
- Jain K, Makkar JK, Subramani Vp S, Gander S, Kumar P. A randomized trial comparing prophylactic phenylephrine and ephedrine infusion during spinal anesthesia for emergency cesarean delivery in cases of acute fetal compromise. J Clin Anesth. 2016;34:208– 15.
- Mohta M, Aggarwal M, Sethi AK, Harisinghani P, Guleria K. Randomized double-blind comparison of ephedrine and phenylephrine for management of post-spinal hypotension in potential fetal compromise. Int J Obstet Anesth. 2016;27(2016):32–40.
- Heesen M, Rijs K, Hilber N, Ngan Kee WD, Rossaint R, van der Marel C, et al. Ephedrine versus phenylephrine as a vasopressor for spinal anaesthesia-induced hypotension in parturients undergoing high-risk caesarean section: meta-analysis, meta-regression and trial sequential analysis. Int J Obstet Anesth. 2019;37:16–28.
- Patel SD, Habib AS, Phillips S, Carvalho B, Sultan P. The effect of glycopyrrolate on the incidence of hypotension and vasopressor requirement during spinal anesthesia for cesarean delivery: A meta-analysis. Anesth Analg. 2018;126(2):552–8.
- Mirakhur RK, Jones CJ, Dundee JW. Effects of intravenous administration of glycopyrrolate and atropine in anaesthetised patients. Anaesthesia. 1981 Mar;36(3):277–81.
- Gao L, Zheng G, Han J, Wang Y, Zheng J. Effects of prophylactic ondansetron on spinal anesthesia-induced hypotension: a metaanalysis. Int J Obstet Anesth. 2015;24:335–43.
- Sahoo T, SenDasgupta C, Goswami A, Hazra A. Reduction in spinal-induced hypotension with ondansetron in parturients undergoing caesarean section: A double-blind randomised, placebo-controlled study. Int J Obstet Anesth. 2012;21(1):24–8.
- Heesen M, Klimek M, Hoeks SE, Rossaint R. Prevention of Spinal Anesthesia-Induced Hypotension During Cesarean Delivery by 5- Hydroxytryptamine-3 Receptor Antagonists. Anesth Analg. 2016;123(4):977–88.
- Aya AG, Vialles N, Tanoubi I, Mangin R, Ferrer JM, Robert C, et al. Spinal anesthesiainduced hypotension: a risk comparison between patients with severe preeclampsia and healthy women undergoing preterm cesarean delivery. AnesthAnalg. 2005 Sep;101(3):869- 75,table.
- Clark VA, Sharwood-Smith GH, Stewart A V. Ephedrine requirements are reduced during spinal anaesthesia for caesarean section in preeclampsia. IntJObstetAnesth. 2005 Jan;14(1):9–13.
- Hofmeyr R, Matjila M, Dyer R. Preeclampsia in 2017: Obstetric and Anaesthesia Management. Best Pract Res Clin Anaesthesiol. 2017;31(1):125–38.
- Aya AGM, Mangin R, Vialles N, Ferrer JM, Robert C, Ripart J, et al. Patients with severe preeclampsia experience less hypotension during spinal anesthesia for elective cesarean delivery than healthy parturients: A prospective cohort comparison. Anesth Analg. 2003;97(3):867–72.
- Crowley LJ, Buggy DJ. Shivering and Neuraxial Anesthesia. Reg Anesth Pain Med. 2008;33(3):241–52.
- Sultan P, Habib AS, Cho Y, Carvalho B. The Effect of patient warming during Caesarean delivery on maternal and neonatal outcomes : a meta-analysis. Br J Anaesth. 2015;115(4):500– 10.
- Chebbout R, Newton RS, Walters M, Wrench IJ, Woolnough M. Does the addition of active body warming to in-line intravenous fluid warming prevent maternal hypothermia during elective caesarean section? A randomised controlled trial. Int J Obstet Anesth. 2017 May 1;31:37–44.
- De Figueiredo Locks G. Incidence of Shivering after Cesarean Section under Spinal Anesthesia with or without Intrathecal Sufentanil: A Randomized Study. Rev Bras Anestesiol. 2012 Sep;62(5):676–84.
- Sadegh A, Tazeh-kand NF, Eslami B. Intrathecal fentanyl for prevention of shivering in spinal anesthesia in cesarean section. 2012;26(2):85–9.
- Kranke P, Eberhart LH, Trame MR, Roewer N. Single-Dose Parenteral Pharmacological Interventions for the Prevention of Postoperative Shivering: A Quantitative Systematic Review of Randomized Controlled Trials. 2004;718–27.
- Liu, WHD; Luxton M. The effect of prophylactic fentanyl on shivering in elective Caesarean section under epidural analgesia. Anaesthesia. 1991;46:344–8.
- Subedi A, Biswas BK, Tripathi M, Bhattarai BK, Pokharel K. Analgesic effects of intrathecal tramadol in patients undergoing caesarean section : a randomised , double-blind study. Int J Obstet Anesth. 2013;22(4):316–21.
- Khan ZH, Zanjani AP, Makarem J, Samadi S. Antishivering effects of two different doses of intrathecal meperidine in caesarean section: A prospective randomised blinded study. Eur J Anaesthesiol. 2011 Mar;28(3):202–6.
- Farzi F, Mirmansouri A, Nabi BN, Roushan ZA, Tehran G, Sani MN, et al. Comparing the Effect of Adding Fentanyl , Sufentanil , and Placebo with Intrathecal Bupivacaine on Duration of Analgesia and Complications of Spinal Anesthesia in Patients Undergoing Cesarean Section. 2017;7(5).
- Kelsaka E, Baris S, Karakaya D, Sarihasan B. Comparison of ondansetron and meperidine for prevention of shivering in patients undergoing spinal anesthesia. Reg Anesth Pain Med. 2006 Jan;31(1):40–5.
- Tie H-T, Su G-Z, He K, Liang S-R, Yuan HW, Mou J-H. Efficacy and safety of ondansetron in preventing postanesthesia shivering: a meta-analysis of randomized controlled trials. 2014.
- Efficacy of ondansetron for spinal anesthesia during cesarean section: a meta-analysis of randomized trials. J Int Med Res. 2018 Feb;46(2):654–62.
- Browning RM, Fellingham WH, O’Loughlin EJ, Brown NA, Paech MJ. Prophylactic ondansetron does not prevent shivering or decrease shivering severity during cesarean delivery under combined spinal epidural anesthesia: A randomized trial. Reg Anesth Pain Med. 2013 Jan;38(1):39–43.
- Casey WF, Ffarcst MB, Frcp CES, Katz JM, Loughlm KO, Ffarc MB. Intravenous meperidine for control of shivering during Caesarean section under epidural anaesthesia. 1988;128–33.
- Capogna G, Celleno D. I.V. Clonidine for postextradural shivering in parturients: A preliminary study. Br J Anaesth. 1993 Aug;71(2):294–5.
- Ravn A, Lyckhage LF, Jensen R. Postdural punkturhovedpine. Ugeskr Laeger. 2018;180:2–5.
- Arevalo-Rodriguez, I; Ciapponi, A; Roqué i Figuls, M; Munoz, L; Bonfill Cosp X. Cochrane Database of Systematic Reviews Posture and fluids for preventing post-dural puncture headache (Review). 2016;
- Russell R, Laxton C, Lucas DN, Niewiarowski J, Scrutton M, Stocks G. Treatment of obstetric post-dural puncture headache. Part 1: conservative and pharmacological management. Int J Obstet Anesth. 2019;
- Bezov D, Lipton RB, Ashina S. Post-dural puncture headache: Part I – Diagnosis, epidemiology, etiology, and pathophysiology. Headache. 2010;50:1144–52.
- Headache Classification Committee of the International Headache Society (IHS) The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 2018;38(1):1–211.
- Choi P, Galinski S, Takeuchi L, Tamayo C, Jadad AR, Lucas S. Post Dural Puncture Headache (PDPH) – Metaanalysis. Can J Anesth. 2003;50(5):460–9.
- Bezov D, Ashina S, Lipton R. Post-dural puncture headache: Part II – Prevention, management, and prognosis. Headache. 2010;50(9):1482–98.
- Antibas, PL; do Nascimento Junior, P; Braz, LG; Vitor Pereira Doles, J; Modolo, NSP; El Dib R. Air versus saline in the loss of resistance technique for identification of the epidural space. Cochrane Database Syst Rev. 2014;2014(7):CD008938.
- Chin KJ, Karmakar MK, Peng P. Ultrasonography of the adult thoracic and lumbar spine for central neuraxial blockade. Anesthesiology. 2011 Jun;114(6):1459–85.
- Perlas A, Chaparro LE, Chin KJ. Lumbar neuraxial ultrasound for spinal and epidural anesthesia: A systematic review and metaanalysis. Reg Anesth Pain Med. 2016 Jan;41(2):251–60.
- Agerson AN, Scavone BM. Prophylactic epidural blood patch after unintentional dural puncture for the prevention of postdural puncture headache in parturients. AnesthAnalg. 2012 Jul;115(1):133–6.
- Heesen M, Klohr S, Rossaint R, Walters M, Straube S, Van V de, et al. Insertion of an intrathecal catheter following accidental dural puncture: a meta-analysis. IntJObstetAnesth. 2013 Jan;22(1):26–30.
- Jagannathan D, Arriaga A, Elterman K, Kodali B, Robinson J, Tsen L, et al. Effect of neuraxial technique after inadvertent dural puncture on obstetric outcomes and anesthetic complications. Int J Obstet Anesth. 2016;25:23–9.
- Al-metwalli RR. Epidural morphine injections for prevention of post dural puncture headache. Anaesthesia. 2008 Aug;63(8):847–50.
- Hakim SM. Cosyntropin for prophylaxis against postdural puncture headache after accidental dural puncture. Anesthesiology. 2010 Aug;113(2):413–20.
- Gaiser RR. Postdural puncture headache: a headache for the patient and a headache for the anesthesiologist. CurrOpinAnaesthesiol. 2013 Jun;26(3):296–303.
- Halker RB, Demaerschalk BM, Wellik KE, Wingerchuk DM, Rubin DI, Crum BA, et al. Caffeine for the prevention and treatment of postdural puncture headache: debunking the myth. Neurologist. 2007 Sep;13(5):323–7.
- Sandesc D, Lupei MI, Sirbu C, Plavat C, Bedreag O, Vernic C. Conventional treatment or epidural blood patch for the treatment of different etiologies of post dural puncture headache. Acta Anaesthesiol Belg. 2005;56(3):265–9.
- Seebacher J, Ribeiro V, LeGuillou JL, Lacomblez L, Henry M, Thorman F, et al. Epidural blood patch in the treatment of post dural puncture headache: a double blind study. Headache. 1989 Nov;29(10):630–2.
- van KF, Oedit R, Bakker SLM, Dippel DWJ, van Kooten F, Oedit R, et al. Epidural blood patch in post dural puncture headache: a randomised, observer-blind, controlled clinical trial. JNeurolNeurosurgPsychiatry. 2008 May;79(5):553–8.
- Kokki M, Sjövall S, Keinänen M, Kokki H, Sjovall S, Keinanen M, et al. The influence of timing on the effectiveness of epidural blood patches in parturients. IntJObstetAnesth. 2013 Nov;22(4):303–9.
- Paech MJ, Doherty DA, Christmas T, Wong CA, Epidural Blood Patch Trial Group EBPT. The volume of blood for epidural blood patch in obstetrics: a randomized, blinded clinical trial. AnesthAnalg. 2011 Jul;113(1):126–33.
- . Beards SC, Jackson A, Griffiths AG, Horsman EL. Magnetic resonance imaging of extradural blood patches: appearances from 30 min to 18 h. BrJAnaesth. 1993 Aug;71(2):182–8.
- Vakharia SB, Thomas PS, Rosenbaum AE, Wasenko JJ, Fellows DG. Magnetic resonance imaging of cerebrospinal fluid leak and tamponade effect of blood patch in postdural puncture headache. AnesthAnalg. 1997 Mar;84(3):585–90.
- Russell R, Laxton C, Lucas DN, Niewiarowski J, Scrutton M, Stocks G. Treatment of obstetric post-dural puncture headache. Part 2: epidural blood patch. Int J Obstet Anesth. 2019;
- Martin R, Jourdain S, Clairoux M, Tetrault JP, Tétrault J. Duration of decubitus position after epidural blood patch. CanJAnaesth. 1994 Jan;41(1):23–5.
- Afolabi BB, Lesi AFE, N. A. Merah. Regional versus general anaesthesia for caesarean section ( Review ). Cochrane Review. 2010.
- Diaz JJH, Weed JJT. Correlation of Adverse Neurological Outcomes with Increasing Volumes and Delayed Administration of Autologous Epidural Blood Patches for Postdural Puncture Headaches. Pain Pract. 2005;5(3):216–22.
- Kim WH, Hur M, Park SK, Yoo S, Lim T, Yoon HK, et al. Comparison between general, spinal, epidural, and combined spinal-epidural anesthesia for cesarean delivery: a network meta-analysis. Int J Obstet Anesth. 2019 Feb 1;37:5–15.
- Ginosar Y, Russell IF, Halpern SH. Is regional anesthesia safer than general anesthesia for cesarean section? In: Halpern SH, Douglas MJ, editors. Evidence-based Obstetric Anesthesia. Blackwell Publishing Ltd; 2005. p. 121–7.
- Jensen, AG; Callesen, T; Hagemo, JS; Lund, V; Hreinsson, K; Nordmark J. Anaestesi til den akutte voksne patient. Acta Anaesthesiol Scand. 2010;8:922–50.
- Mendelson CL. The Aspiration of Stomach Contents into the Lungs During Obstetric Anesthesia. Am J Obstet Gynecol. 2016 Dec 29;52(2):191–205.
- Lee SWY. Haemodynamic effects from aortocaval compression at different angels of lateral til in non-labouring term pregnant women. BrJAnaesth. 2012;109(6):950–6.
- Alaily AB, Carrol KB. Pulmonary ventilation in pregnancy. BrJObstetGynaecol. 1978 Jul;85(7):518–24.
- Hagerdal M, Morgan CW, Sumner AE, Gutsche BB. Minute ventilation and oxygen consumption during labor with epidural analgesia. Anesthesiology. 1983 Nov;59(5):425–7.
- Russell IF, Chambers WA. Closing volume in normal pregnancy. BrJAnaesth. 1981 Oct;53(10):1043–7.
- Mushambi, MC; Kinsella, SM; Popat, M; Swales, H; Ramaswamy, KK; Winton, AL; Quinn A. Obstetric Anaesthetists’ Association and Difficult Airway Society guidelines for the management of difficult and failed tracheal intubation in obstetrics. Anaesthesia. 2015 Nov 9;70(11):1286–306.
- McClelland SH, Bogod DG, Hardman JG. Preoxygenation in pregnancy: An investigation using physiological modelling. Anaesthesia. 2008 Mar;63(3):259–63.
- Baraka AS, Taha SK, Siddik-Sayyid SM, Kanazi GE, El-Khatib MF, Dagher CM, et al. Supplementation of pre-oxygenation in morbidly obese patients using nasopharyngeal oxygen insufflation. Anaesthesia. 2007 Aug;62(8):769–73.
- Mir F, Patel A, Iqbal R, Cecconi M, Nouraei SAR. A randomised controlled trial comparing transnasal humidified rapid insufflation ventilatory exchange (THRIVE) preoxygenation with facemask pre-oxygenation in patients undergoing rapid sequence induction of anaesthesia. Anaesthesia. 2017 Apr 1;72(4):439–43.
- Capogna G, Celleno D, Sebastiani M, Muratori F, Costantino P, Cipriani G, et al. Propofol and thiopentone for caesarean section revisited: maternal effects and neonatal outcome. IntJObstetAnesth. 1991;1(1):19–23.
- Celleno D, Capogna G, Tomassetti M, Costantino P, Di Feo G, Nisini R. Neurobehavioural effects of propofol on the neonate following elective caesarean section. BrJAnaesth. 1989 Jun;62(6):649–54.
- Gaitini L, Vaida S, Collins G, Somri M, Sabo E. Awareness detection during caesarean section under general anaesthesia using EEG spectrum analysis. CanJAnaesth. 1995 May;42(5 Pt 1):377–81.
- Schwender D, Madler C, Klasing S, Poppel E, Peter K. Mid-latency auditory evoked potentials and wakefulness during caesarean section. EurJAnaesthesiol. 1995 Mar;12(2):171–9.
- Finster M, Mark LC, Morishima HO, Moya F, Perel JM, James LS, et al. Plasma thiopental concentrations in the newborn following delivery under thiopental–nitrous oxide anesthesia. AmJObstetGynecol. 1966 Jul 1;95(5):621–9.
- Kosaka Y, Takahashi T, Mark LC. Intravenous thiobarbiturate anesthesia for cesarean section. Anesthesiology. 1969 Dec;31(6):489–506.
- White PF, Ham J, Way WL, Trevor AJ. Pharmacology of ketamine isomers in surgical patients. Anesthesiology. 1980 Mar;52(3):231– 9.
- Pfenninger EG, Durieux ME, Himmelseher S. Cognitive impairment after small-dose ketamine isomers in comparison to equianalgesic racemic ketamine in human volunteers. Anesthesiology. 2002 Feb;96(2):357–66.
- White PF, Schuttler J, Shafer A, Stanski DR, Horai Y, Trevor AJ. Comparative pharmacology of the ketamine isomers. Studies in volunteers. BrJAnaesth. 1985 Feb;57(2):197–203.
- Devroe S, Van De Velde M, Rex S. General anesthesia for caesarean section. Curr Opin Anaesthesiol. 2015;28(3):240–6.
- Park BY, Jeong CW, Jang EA, Kim SJ, Jeong ST, Shin MH, et al. Dose-related attenuation of cardiovascular responses to tracheal intubation by intravenous remifentanil bolus in severe pre-eclamptic patients undergoing Caesarean delivery. Br J Anaesth. 2011;
- Kan RE, Hughes SC, Rosen MA, Kessin C, Preston PG, Lobo EP. Intravenous remifentanil: placental transfer, maternal and neonatal effects. Anesthesiology. 1998 Jun;88(6):1467–74.
- Gin T, Ngan-Kee WD, Siu YK, Stuart JC, Tan PE, Lam KK. Alfentanil given immediately before the induction of anesthesia for elective cesarean delivery. AnesthAnalg. 2000 May;90(5):1167–72.
- Gepts E, Heytens L, Camu F. Pharmacokinetics and placental transfer of intravenous and epidural alfentanil in parturient women. AnesthAnalg. 1986 Nov;65(11):1155– 60.
- Cooper J, Jauniaux E, Gulbis B, Quick D, Bromley L. Placental transfer of fentanyl in early human pregnancy and its detection in fetal brain. BrJAnaesth. 1999 Jun;82(6):929– 31.
- Kvisselgaard N, Moya F. Investigation of placental thresholds to succinylcholine. Anesthesiology. 1961 Jan;22:7–10.
- Kosinova M, Stourac P, Adamus M, Seidlova D, Pavlik T, Janku P, et al. Rocuronium versus suxamethonium for rapid sequence induction of general anaesthesia for caesarean section: influence on neonatal outcomes. Int J Obstet Anesth. 2017;32:4–10.
- Magorian T, Flannery KB, Miller RD. Comparison of rocuronium, succinylcholine, and vecuronium for rapid-sequence induction of anesthesia in adult patients. Anesthesiology. 1993 Nov;79(5):913–8.
- Lee C, Jahr JS, Candiotti KA, Warriner B, Zornow MH, Naguib M. Reversal of profound neuromuscular block by sugammadex administered three minutes after rocuronium: a comparison with spontaneous recovery from succinylcholine. Anesthesiology. 2009 May;110(5):1020–5.
- Baraka A, Haroun S, Bassili M, Abu-Haider G. Response of the newborn to succinlycholine injection in homozygotic atypical mothers. Anesthesiology. 1975 Jul;43(1):115–6.
- Leontic EA. Respiratory disease in pregnancy. MedClinNorth Am. 1977 Jan;61(1):111–28.
- Boutonnet M, Faitot V, Katz A, Salomon L, Keita H. Mallampati class changes during pregnancy, labour, and after delivery: can these be predicted? BrJ Anaesth. 2010 Jan;104(1):67–70.
- Izci B, Vennelle M, Liston WA, Dundas KC, Calder AA, Douglas NJ. Sleep-disordered breathing and upper airway size in pregnancy and post-partum. EurRespirJ. 2006 Feb;27(2):321–7.
- Kodali BS, Chandrasekhar S, Bulich LN, Topulos GP, Datta S. Airway changes during labor and delivery. Anesthesiology. 2008 Mar;108(3):357–62.
- Zaouter C, Calderon J, Hemmerling TM. Videolaryngoscopy as a new standard of care. Br J Anaesth. 2015;114(2):181–3.
- Kinsella, SM; Winton, AL; Mushambi, MC; Ramaswamy, K; Swales, H; Quinn, AC; Popat M. Failed tracheal intubation during obstetric general anaesthesia: a literature review. Int J Obstet Anesth. 2015 Nov 3;24(4):356–74.
- Preston R. Management of the obstetric airway — time for a paradigm shift (or two)? Int J Obstet Anesth. 2015;24(4):293–6.
- Ngan-Kee WD, Khaw KS, Ma KC, Wong AS, Lee BB. Randomized, double-blind comparison of different inspired oxygen fractions during general anaesthesia for Caesarean section. BrJAnaesth. 2002 Oct;89(4):556–61.
- Piggott SE, Bogod DG, Rosen M, Rees GA, Harmer M. Isoflurane with either 100% oxygen or 50% nitrous oxide in oxygen for caesarean section. BrJAnaesth. 1990 Sep;65(3):325–9.
- Bogod D, Plaat F. Be wary of awareness – Lessons from NAP5 for obstetric anaesthetists. Int J Obstet Anesth. 2015;24(1):1–4.
- Chaggar RS, Campbell JP. The future of general anaesthesia in obstetrics. BJA Educ. 2017 Mar 1;17(3):79–83.
- Lyons G, Macdonald R. Awareness during Caesarean section. Anaesthesia. 1991;46(1):62–4.
- Turner RJ, Lambrost M, Holmes C, Katz SG, Downs CS, Collins DW, et al. The effects of sevoflurane on isolated gravid human myometrium. AnaesthIntensive Care. 2002 Oct;30(5):591–6.
- Munson ES, Embro WJ. Enflurane, isoflurane, and halothane and isolated human uterine muscle. Anesthesiology. 1977 Jan;46(1):11–4.
- Ellingson A, Haram K, Sagen N, Solheim E. Transplacental passage of ketamine after intravenous administration. Acta AnaesthesiolScand. 1977;21(1):41–4.
- Hall JE, Ng WS, Smith S. Blood loss during first trimester termination of pregnancy: comparison of two anaesthetic techniques. BrJAnaesth. 1997 Feb;78(2):172–4.
- Sanchez-Alcaraz A, Quintana MB, Laguarda M. Placental transfer and neonatal effects of propofol in caesarean section. JClinPharmTher. 1998 Feb;23(1):19–23.
- Van De Velde M, Teunkens A, Kuypers M, Dewinter T, Vandermeersch E. General anaesthesia with target controlled infusion of propofol for planned caesarean section: maternal and neonatal effects of a remifentanilbased technique. Int J Obstet Anesth. 2004 Jul;13(3):153–8.
- Baraka A, Louis F, Dalleh R. Maternal awareness and neonatal outcome after ketamine induction of anaesthesia for Caesarean section. CanJAnaesth. 1990 Sep;37(6):641–4.
- Shin YK, Kim YD, Collea J V. The effect of propofol on isolated human pregnant uterine muscle. Anesthesiology. 1998 Jul;89(1):105–9.
- Oats JN, Vasey DP, Waldron BA. Effects of ketamine on the pregnant uterus. BrJAnaesth. 1979 Dec;51(12):1163–6.
- Report on confidential enquiries into maternal deaths in England and Wales 1982-84. HMSO. 1989;
- Tiret L, Desmonts JM, Hatton F, Vourc’h G. Complications associated with anaesthesia–a prospective survey in France. Can Anaesth Soc J. 1986 May;33:336–44.
- Rhodes A, Hughes KR, Cohen DG. An argument for orogastric tubes during caesarean section. Int J Obs Anesth. 1996;5:156–9.
- Mhyre, JM; Riesner, MN; Polley, LS; Naughton N. A series of anesthesia-related maternal deaths in Michigan, 1985-2003. Anesthesiology. 2007;106(6):1096–104.
- Cantwell, R; Clutton-Brock, T; Cooper, G; Dawson, A; Drife, J; Garrod D. Saving Mothers’ Lives: Reviewing maternal deaths to make motherhood safer: 2006-2008. The Eighth Report of the Confidential Enquiries into Maternal Deaths in the United Kingdom. BJOG. 2011;118(March):1–203.
- Hood, DD; Dewan D. Anesthetic and obstetric outcome in morbidly obese parturients. Anesthesiology. 1993;79:1210–8.
- Barnardo PD, Jenkins JG. Failed tracheal intubation in obstetrics: a 6-year review in a UK region. Anaesthesia. 2000 Jul;55(7):690–4.
- Kheterpal S, Han R, Tremper KK, Shanks A, Tait AR, O’Reilly M, et al. Incidence and predictors of difficult and impossible mask ventilation. Anesthesiology. 2006;105(5):885– 91.
- Kominiarek MA, Vanveldhuisen P, Hibbard J, Landy H, Haberman S, Learman L, et al. The maternal body mass index: a strong association with delivery route. AmJ Obs. 2010 Sep;203(3):264–7.
- Hignett R, Fernando R, McGlennan A, McDonald S, Stewart A, Columb M, et al. A randomized crossover study to determine the effect of a 30° head-up versus a supine position on the functional residual capacity of term parturients. Anesth Analg. 2011;
- Collins JS, Lemmens HJM, Brodsky JB, Brock-Utne JG, Levitan RM. Laryngoscopy and morbid obesity: A comparison of the “sniff” and “ramped” positions. Obes Surg. 2004;
- Dixon, BJ; Dixon, JB; Carden, JR; Burn, AJ; Schachter, LM; Playfair, JM; Laurie, CP; O’Brien P. Preoxygenation Is More Effective in the 25° Head-Up Position Than in the Supine Position in Severely Obese Patients. Anesthesiology. 2005;102:1110–5.
- Bouillon, T; Shafer S. Does Size Matter? Anesthesiology. 1998;89(3):557–60.
- Soens MA, Birnbach DJ, Ranasinghe JS, van ZA. Obstetric anesthesia for the obese and morbidly obese patient: an ounce of prevention is worth more than a pound of treatment. Acta Anaesthesiol Scand. 2008 Jan;52(1):6–19.
- Loubert C, Fernando R. Cesarean delivery in the obese parturient: Anesthetic considerations. Vol. 7, Women’s Health. 2011. p. 163–79.
- Van LP, Dillemans B, Bogaert T, Mulier JP, De KM, Haspeslagh M. Ideal versus corrected body weight for dosage of sugammadex in morbidly obese patients. Anaesthesia. 2011 Aug;66(8):721–5.
- Davis JM, Weeks S, Crone LA, Pavlin E, Davies JM, Weeks S, et al. Difficult intubation in the parturient. CanJAnaesth. 1989 Nov;36(6):668–74.
- Mushambi MC, Jaladi S. Airway management and training in obstetric anaesthesia. Curr Opin Anaesthesiol. 2016;29(3):261–7.
- Rajagopalan S, Suresh M, Clark SL, Serratos B, Chandrasekhar S. Airway management for cesarean delivery performed under general anesthesia. Int J Obstet Anesth. 2017;29(January 2006):64–9.
- Hart DM. Heartburn in pregnancy. J Int Med Res. 1978;6:1–5.
- Hey VM, Cowley DJ, Ganguli PC, Skinner LD, Ostick DG, Sharp DS. Gastro– oesophageal reflux in late pregnancy. Anaesthesia. 1977 Apr;32(4):372–7
- Van Thiel DH, Gavaler JS, Joshi SN, Sara RK, Stremple J. Heartburn of pregnancy. Gastroenterology. 1977 Apr;72(4 Pt 1):666–8.
- Van Thiel DH, Gavaler JS, Stremple J. Lower esophageal sphincter pressure in women using sequential oral contraceptives. Gastroenterology. 1976 Aug;71(2):232–4.
- Attia RR, Ebeid AM, Fischer JE, Goudsouzian NG. Maternal fetal and placental gastrin concentrations. Anaesthesia. 1982 Jan;37(1):18–21.
- Nimmo WS, Wilson J, Prescott LF. Narcotic analgesics and delayed gastric emptying during labour. Lancet. 1975 Apr 19;1(7912):890–3.
- Whitehead EM, Smith M, Dean Y, O’Sullivan G. An evaluation of gastric emptying times in pregnancy and the puerperium. Anaesthesia. 1993 Jan;48(1):53–7.
- Wilson J. Gastric emptying in labour: some recent findings and their clinical significance. JIntMedRes. 1978;6 Suppl 1(1):54–62.
- Porter JS, Bonello E, Reynolds F. The influence of epidural administration of fentanyl infusion on gastric emptying in labour. Anaesthesia. 1997 Dec;52(12):1151–6.
- Zimmermann DL, Breen TW, Fick G. Adding fentanyl 0.0002% to epidural bupivacaine 0.125% does not delay gastric emptying in laboring parturients. AnesthAnalg. 1996 Mar;82(3):612–6.
- Paranjothy S, Griffiths JD, Broughton HK, Gyte GM, Brown HC, Thomas J. Interventions at caesarean section for reducing the risk of aspiration pneumonitis. CochraneDatabaseSystRev. 2014;2:CD004943.
- Soreide E, Strømskag K, Steen PA, Stromskag KE, Steen PA. Statistical aspects in studies of preoperative fluid intake and gastric content. Acta AnaesthesiolScand. 1995 Aug;39(6):738– 43.
- Carp H, Jayaram A, Stoll M. Ultrasound examination of the stomach contents of parturients. AnesthAnalg. 1992 May;74(5):683–7.
- Macfie AG, Magides AD, Richmond MN, Reilly CS, Magides, A D, MN R, et al. Gastric emptying in pregnancy. BrJAnaesth. 1991 Jul;67(1):54–7.
- Sandhar BK, Elliott RH, Windram I, Rowbotham DJ. Peripartum changes in gastric emptying. Anaesthesia. 1992 Mar;47(3):196–8.
- Singata M, Tranmer J, Gyte G. Restricting oral fluid and food intake during labour. Cochrane database Syst Rev. 2013;(1):1–58.
- Kubli M, Scrutton MJ, Seed PT, O’Sullivan G. An evaluation of isotonic “sport drinks” during labor. Anesth Analg. 2002 Feb;94(2):404–8.
- Scrutton MJ, Metcalfe GA, Lowy C, Seed PT, O’Sullivan G, Metcalfe, GA, et al. Eating in labour. A randomised controlled trial assessing the risks and benefits. Anaesthesia. 1999 Apr;54(4):329–34.
- Gyte GM RY. Routine prophylactic drugs in normal labour for reducing gastric aspiration and its effects. Cochrane Database Syst Rev. 2006;19(3).
- Smith, I; Kranke, P Murat I, Smith A, O’Sullivan G, Søreide E, Spies C in’t VB. Perioperative fasting in adults and children: guidelines from the European Society of Anaesthesiology. Eur J Anaesthesiol. 2011;28(8):556–69.
- Westhoff G, Cotter AM, Tolosa JE. Prophylactic oxytocin for the third stage of labour to prevent postpartum haemorrhage. CochraneDatabaseSystRev. 2013;10.
- Prendiville W, Elbourne D, Chalmers I. The effects of routine oxytocic administration in the management of the third stage of labour: an overview of the evidence from controlled trials. BrJObstetGynaecol. 1988 Jan;95(1):3–16.
- Thorneloe B, Carvalho JCA, Downey K, Balki M. Uterotonic drug usage in Canada: a snapshot of the practice in obstetric units of university-affiliated hospitals. Int J Obstet Anesth. 2019 Feb;37:45–51.
- Heesen M, Carvalho B, Carvalho JCA, Duvekot JJ, Dyer RA, Lucas DN, et al. International consensus statement on the use of uterotonic agents during caesarean section. Anaesthesia. 2019 Oct 25;74(10):1305–19.
- Mavrides, E; Allard, S; Chandraharan, E; Collins, P; Green, L; Hunt, BJ; Riris, S; Thomson A on behalf of the RC of O and G. Prevention and management of postpartum haemorrhage. BJOG. 2016 Apr 1;124:e106–49.
- Soltanifar S, Russell R. The National Institute for Health and Clinical Excellence (NICE) guidelines for caesarean section, 2011 update: Implications for the anaesthetist. Vol. 21, International Journal of Obstetric Anesthesia. 2012. p. 264–72.
- Thomas JSS, Koh SHH, Cooper GMM. Haemodynamic effects of oxytocin given as i.v. bolus or infusion on women undergoing Caesarean section. BrJAnaesth. 2007 Jan;98(1):116–9.
- Bhattacharya S, Ghosh S, Ray D, Mallik S, Laha A. Oxytocin administration during cesarean delivery: Randomized controlled trial to compare intravenous bolus with intravenous infusion regimen. JAnaesthesiol ClinPharmacol. 2013 Jan;29(1):32–5.
- Aabakke, A; Andresdottir, G; Bjørn, AMB; Bødker, B; Clausen, TD; Gade, AW; Glavind, J; Hedegaard, M; Jensen, AN; Klemmensen, ÅK; Krebs, L; Lousen, T; Petersen, JF; Rønneberg, E; Schroll, J; Skajaa, GØ; Thisted, D; Wielandt H. Sectio (kejsersnit) til terminenoperationsteknik og praktisk håndtering. 2016.
- Foley A, Gunter A, Nunes KJ, Shahul S, Scavone BM. Patients Undergoing Cesarean Delivery After Exposure to Oxytocin During Labor Require Higher Postpartum Oxytocin Doses. Anesth Analg. 2018 Mar;126(3):920–4.
- Tsen LC, Balki M. Oxytocin protocols during cesarean delivery: time to acknowledge the risk/benefit ratio? Int J Obstet Anesth. 2010 Jul;19(3):243–5.
- Terblanche N, Otahal P, Messmer A, Wright P, Patel S, Nathan K, et al. An observational cohort study of 3 units versus 5 units slow intravenous bolus oxytocin in women undergoing elective caesarean delivery. J Physiol Pharmacol. 2017 Aug;68(4):547–53.
- Sartain JB, Barry JJ, Howat PW, McCormack DI, Bryant M. Intravenous oxytocin bolus of 2 units is superior to 5 units during elective Caesarean section. BrJAnaesth. 2008 Dec;101(6):822–6.
- Butwick AJ, Coleman L, Cohen SE, Riley ET, Carvalho B. Minimum effective bolus dose of oxytocin during elective Caesarean delivery. BrJ Anaesth. 2010 Mar;104(3):338–43.
- El-Sayed YY, Duffield A, McKenzie C, Butwick AJ, Ramachandran B, Carvalho B, et al. Effect of a High-Rate Versus a Low-Rate Oxytocin Infusion for Maintaining Uterine Contractility During Elective Cesarean Delivery. Anesth Analg. 2016;
- Dyer RA, Piercy JL, Reed AR, Lombard CJ, Schoeman LK, James MF. Hemodynamic changes associated with spinal anesthesia for cesarean delivery in severe preeclampsia. Anesthesiology. 2008 May;108(5):802–11.
- Rumboll CK, Dyer RA, Lombard CJ. The use of phenylephrine to obtund oxytocin-induced hypotension and tachycardia during caesarean section. Int J Obstet Anesth. 2015 Nov;24(4):297–302.
- Carvalho JC, Balki M, Kingdom J, Windrim R. Oxytocin requirements at elective cesarean delivery: a dose-finding study. ObstetGynecol. 2004 Nov;104(5 Pt 1):1005–10.
- Balki M, Ronayne M, Davies S, Fallah S, Kingdom J, Windrim R, et al. Minimum oxytocin dose requirement after cesarean delivery for labor arrest. ObstetGynecol. 2006 Jan;107(1):45–50.
- Abdelaleem AA, Abbas AM, Thabet AL, Badran E, El-Nashar IH. The effect of initiating intravenous oxytocin infusion before uterine incision on the blood loss during elective cesarean section: a randomized clinical trial. J Matern Neonatal Med. 2018 May 9;1–6.
- Dennehy KC, Rosaeg OP, Cicutti NJ, Krepski B, Sylvain JP. Oxytocin injection after caesarean delivery: intravenous or intramyometrial? CanJAnaesth. 1998 Jul;45(7):635–9.
- Akinaga C, Uchizaki S, Kurita T, Taniguchi M, Makino H, Suzuki A, et al. Randomized double-blind comparison of the effects of intramyometrial and intravenous oxytocin during elective cesarean section. J Obstet Gynaecol Res. 2016 Apr 1;42(4):404–9.
- Vallera C, Choi LO, Cha CM, Hong RW. Uterotonic Medications. Anesthesiol Clin. 2017 Jun;35(2):207–19.
- Wohling J, Edge N, Pena-Leal D, Wang R, Mol BW, Dekker G. Clinical and financial evaluation of carbetocin as postpartum haemorrhage prophylaxis at caesarean section: A retrospective cohort study. Aust N Z J Obstet Gynaecol. 2018 Nov 9;
- Su LL, Chong YS, Samuel M. Carbetocin for preventing postpartum haemorrhage. CochraneDatabaseSystRev. 2012;4:CD005457.
- Sotillo L, De la Calle M, Magdaleno F, Bartha JL. Efficacy of carbetocin for preventing postpartum bleeding after cesarean section in twin pregnancy. J Matern Neonatal Med. 2018 Jul 22;1–5.
- Mannaerts D, Van der Veeken L, Coppejans H, Jacquemyn Y. Adverse Effects of Carbetocin versus Oxytocin in the Prevention of Postpartum Haemorrhage after Caesarean Section: A Randomized Controlled Trial. J Pregnancy. 2018;2018:1374150.
- Chen YT, Chen SF, Hsieh TT an., Lo LM, Hung TH. A comparison of the efficacy of carbetocin and oxytocin on hemorrhage-related changes in women with cesarean deliveries for different indications. Taiwan J Obstet Gynecol. 2018;57(5):677–82.
- Widmer M, Piaggio G, Nguyen TMH, Osoti A, Owa OO, Misra S, et al. Heat-Stable Carbetocin versus Oxytocin to Prevent Hemorrhage after Vaginal Birth. N Engl J Med. 2018 Aug 23;379(8):743–52.
- Sutton CD, Carvalho B. Optimal Pain Management After Cesarean Delivery. Anesthesiology Clinics. 2017.
- Huang J, Cao C, Nelson G, Wilson RD. Review of Enhanced Recovery after Surgery Principles Used for Scheduled CD: Perioperative Process Evaluation. J Obstet Gynaecol Can. 2018 Nov 12;
- Palmer C, Emerson S. Dose-response Relationship of intratecal morphine for CS analgesia. Vol. 90, Anesthesiology. 1999. p. 437–44.
- Sia AT, Lim Y, Lim ECP, Goh RWC, Law HY, Landau R, et al. A118G single nucleotide polymorphism of human mu-opioid receptor gene influences pain perception and patientcontrolled intravenous morphine consumption after intrathecal morphine for postcesarean analgesia. Anesthesiology. 2008 Sep;109(3):520–6.
- Landau R, Kern C, Columb MO, Smiley RM, Blouin J-L. Genetic variability of the μ-opioid receptor influences intrathecal fentanyl analgesia requirements in laboring women☆. Pain. 2008 Sep 30;139(1):5–14.
- Carvalho B, Butwick AJ. Postcesarean delivery analgesia. Best Pract Res Clin Anaesthesiol. 2017;31(1):69–79.
- Sultan P, Halpern SH, Pushpanathan E, Patel S, Carvalho B. The Effect of Intrathecal Morphine Dose on Outcomes After Elective Cesarean Delivery. Anesth Analg. 2016 Jul;123(1):154–64.
- Kerai S, Saxena KN, Taneja B. Post-caesarean analgesia: What is new? Indian J Anaesth. 2017 Mar;61(3):200–14.
- Stenkamp SJ, Easterling TR, Chadwick HS. Effect of epidural and intrathecal morphine on the length of hospital stay after cesarean section. Anesth Analg. 1989 Jan;68(1):66–9.
- Fuller JG, McMorland GH, Douglas MJ, Palmer L. Epidural morphine for analgesia after Caesarean section: a report of 4880 patients. Can J Anaesth. 1990 Sep;37(6):636– 40.
- Bonnet M-P, Mignon A, Mazoit J-X, Ozier Y, Marret E. Analgesic efficacy and adverse effects of epidural morphine compared to parenteral opioids after elective caesarean section: A systematic review. Eur J Pain. 2010;14:894.e1-894.e9.
- George JA, Lin EE, Hanna MN, Murphy JD, Kumar K, Ko PS, et al. The effect of intravenous opioid patient-controlled analgesia with and without background infusion on respiratory depression: a meta-analysis. J Opioid Manag. 6(1):47–54.
- Hudcova J, McNicol ED, Quah CS, Lau J, Carr DB. Patient controlled opioid analgesia versus conventional opioid analgesia for postoperative pain. In: Hudcova J, editor. Cochrane Database of Systematic Reviews. Chichester, UK: John Wiley & Sons, Ltd; 2006. p. CD003348.
- The American College of Obstetricians and Gynecologists. ACOG Committee Opinion Postpartum Pain Management. Obstet Gynecol. 2018;132(1):e35–43.
- Abdallah FW, Laffey JG, Halpern SH, Brull R. Duration of analgesic effectiveness after the posterior and lateral transversus abdominis plane block techniques for transverse lower abdominal incisions: a meta-analysis. BrJAnaesth. 2013 Nov;111(5):721–35.
- Champaneria R, Shah L, Wilson MJ, Daniels JP. Clinical effectiveness of transversus abdominis plane (TAP) blocks for pain relief after caesarean section: a meta-analysis. Int J Obstet Anesth. 2016;28(2016):45–60.
- Ng SC, Habib AS, Sodha S, Carvalho B, Sultan P. High-dose versus low-dose local anaesthetic for transversus abdominis plane block postCaesarean delivery analgesia: a meta-analysis. Br J Anaesth. 2018 Feb;120(2):252–63.
- Trabelsi B, Charfi R, Bennasr L, Marzouk S Ben, Eljebari H, Jebabli N, et al. Pharmacokinetics of bupivacaine after bilateral ultrasound-guided transversus abdominis plane block following cesarean delivery under spinal anesthesia. Int J Obstet Anesth. 2017 Nov;32:17–20.
- Weiss E, Jolly C, Dumoulin J-L, Meftah R Ben, Blanié P, Laloë P-A, et al. Convulsions in 2 Patients After Bilateral Ultrasound-Guided Transversus Abdominis Plane Blocks for Cesarean Analgesia. Reg Anesth Pain Med. 2014;39(3):248–51.
- Chandon M, Bonnet A, Burg Y, Barnichon C, DesMesnards-Smaja V, Sitbon B, et al. Ultrasound-guided Transversus Abdominis plane block versus continuous wound infusion for post-caesarean analgesia: a randomized trial. Gemzell-Danielsson K, editor. PLoS One. 2014 Aug 5;9(8):e103971.
- Blanco R, Ansari T, Girgis E. Quadratus lumborum block for postoperative pain after caesarean section. Eur J Anaesthesiol. 2015 Nov;32(11):812–8.
- Mieszkowski MM, Mayzner-Zawadzka E, Tuyakov B, Mieszkowska M, Żukowski M, Waśniewski T, et al. Evaluation of the effectiveness of the Quadratus Lumborum Block type I using ropivacaine in postoperative analgesia after a cesarean section — a controlled clinical study. Ginekol Pol. 2018 Feb 28;89(2):89–96.
- Krohg A, Ullensvang K, Rosseland LA, Langesæter E, Sauter AR. The Analgesic Effect of Ultrasound-Guided Quadratus Lumborum Block After Cesarean Delivery: A Randomized Clinical Trial. Anesth Analg. 2018 Feb;126(2):559–65.
- Blanco R, Ansari T, Riad W, Shetty N. Quadratus Lumborum Block Versus Transversus Abdominis Plane Block for Postoperative Pain After Cesarean Delivery: A Randomized Controlled Trial. Reg Anesth Pain Med. 2016;41(6):757–62.
- Tawfik MM, Mohamed YM, Elbadrawi RE, Abdelkhalek M, Mogahed MM, Ezz HM. Transversus abdominis plane block versus wound infiltration for analgesia after cesarean delivery: A randomized controlled trial. Anesth Analg. 2017;124(4):1291–7.
- Mishriky BM, George RB, Habib AS. Transversus abdominis plane block for analgesia after Cesarean delivery: A systematic review and meta-analysis. Canadian Journal of Anesthesia. 2012.
- Abdallah FW, Halpern SH, Margarido CB. Transversus abdominis plane block for postoperative analgesia after Caesarean delivery performed under spinal anaesthesia? A systematic review and meta-analysis. BrJ Anaesth. 2012 Nov;109(5):679–87.
- Adesope O, Ituk U, Habib AS. Local anaesthetic wound infiltration for postcaesarean section analgesia. Eur J Anaesthesiol. 2016 Oct;33(10):731–42.
- Bamigboye AA, Hofmeyr GJ. Local anaesthetic wound infiltration and abdominal nerves block during caesarean section for postoperative pain relief. In: Bamigboye AA, editor. Cochrane Database of Systematic Reviews. Chichester, UK: John Wiley & Sons, Ltd; 2009.
- Klasen F, Bourgoin A, Antonini F, Dazeas E, Bretelle F, Martin C, et al. Postoperative analgesia after caesarean section with transversus abdominis plane block or continuous infiltration wound catheter: A randomized clinical trial. TAP vs. infiltration after caesarean section. Anaesth Crit Care Pain Med. 2016 Dec;35(6):401–6.
- Møiniche S, Mikkelsen S, Wetterslev J, Dahl JB. A qualitative systematic review of incisional local anaesthesia for postoperative pain relief after abdominal operations. Br J Anaesth. 1998 Sep;81(3):377–83.
- Rackelboom T, Le Strat S, Silvera S, Schmitz T, Bassot A, Goffinet F, et al. Improving continuous wound infusion effectiveness for postoperative analgesia after cesarean delivery: a randomized controlled trial. Obstet Gynecol. 2010 Oct;116(4):893–900.
- Valentine AR, Carvalho B, Lazo TA, Riley ET. Scheduled acetaminophen with as-needed opioids compared to as-needed acetaminophen plus opioids for post-cesarean pain management. Int J Obstet Anesth. 2015 Aug;24(3):210–6.
- Elia N, Lysakowski C, Tramèr MR. Does multimodal analgesia with acetaminophen, nonsteroidal antiinflammatory drugs, or selective cyclooxygenase-2 inhibitors and patient-controlled analgesia morphine offer advantages over morphine alone? Metaanalyses of randomized trials. Anesthesiology. 2005 Dec;103(6):1296–304.
- Pavy TJ, Paech MJ, Evans SF. The effect of intravenous ketorolac on opioid requirement and pain after cesarean delivery. Anesth Analg. 2001 Apr;92(4):1010–4.
- Ambrose FP. A retrospective study of the effect of postoperative indomethacin rectal suppositories on the need for narcotic analgesia in patients who had a cesarean delivery while they were under regional anesthesia. Am J Obstet Gynecol. 2001 Jun;184(7):1544–7; discussion 1547-8.
- Zeng AM, Nami NF, Wu CL, Murphy JD. The Analgesic Efficacy of Nonsteroidal Antiinflammatory Agents (NSAIDs) in Patients Undergoing Cesarean Deliveries: A MetaAnalysis. Reg Anesth Pain Med. 2016;41(6):763–72.
- Paech MJ, Mcdonnell NJ, Sinha A, Baber C, Nathan EA. A Randomised Controlled Trial of Parecoxib, Celecoxib and Paracetamol as Adjuncts to Patient-Controlled Epidural Analgesia after Caesarean Delivery. Anaesth Intensive Care. 2014 Jan 14;42(1):15–22.
- Qi X, Chen D, Li G, Huang X, Li Y, Wang X, et al. Comparison of Intrathecal Dexmedetomidine with Morphine as Adjuvants in Cesarean Sections. Biol Pharm Bull. 2016 Sep 1;39(9):1455–60.
- Griffiths, JD; Gyte, GML; Paranjothy, S; Brown, HC; Broughton, HK; Thomas J. Interventions for preventing nausea and vomiting in women undergoing regional anaesthesia for caesarean section. Cochrane Database Syst Rev. 2012;(9).
- Charuluxananan S, Somboonviboon W, Kyokong O, Nimcharoendee K. Ondansetron for treatment of intrathecal morphine-induced pruritus after cesarean delivery. Reg Anesth Pain Med. 2000 Sep;25(5):535–9.
- Kung AT, Yang X, Li Y, Vasudevan A, Pratt S, Hess P. Prevention versus treatment of intrathecal morphine-induced pruritus with ondansetron. Int J Obstet Anesth. 2014 Aug 1;23(3):222–6.
- Mazda Y, Kikuchi T, Yoshimatsu A, Kato A, Nagashima S, Terui K. Acupuncture for reducing pruritus induced by intrathecal morphine at elective cesarean delivery: a placebo-controlled, randomized, double-blind trial. Int J Obstet Anesth. 2018 Nov;36:66–76.
- Swaro S, Karan D, Banerjee A. Comparison of Palonosetron, Dexamethasone, and Palonosetron Plus Dexamethasone as Prophylactic Antiemetic and Antipruritic Drug in Patients Receiving Intrathecal Morphine for Lower Segment Cesarean Section. Anesth essays Res. 2018;12(2):322–7.
- Moustafa AM, Baaror A, Abdelazim I. Comparative study between nalbuphine and ondansetron in prevention of intrathecal morphine-induced pruritus in women undergoing cesarean section. Anesth Essays Res. 2016;10(2):238.
- Siddik-Sayyid SM, Yazbeck-Karam VG, Zahreddine BW, Adham AM, Dagher CM, Saasouh WA, et al. Ondansetron is as effective as diphenhydramine for treatment of morphineinduced pruritus after cesarean delivery. Acta Anaesthesiol Scand. 2010 Jul;54(6):764–9.
- Kainu JP, Halmesmaki E, Korttila KT, Sarvela PJ. Persistent pain after cesarean delivery and vaginal delivery: A prospective cohort study. Anesth Analg. 2016;123(6):1535–45.
- Wang LZ, Wei CN, Xiao F, Chang XY, Zhang YF. Incidence and risk factors for chronic pain after elective caesarean delivery under spinal anaesthesia in a Chinese cohort: a prospective study. Int J Obstet Anesth. 2018 May;34:21–7.
- Booth JL, Sharpe EE, Houle TT, Harris L, Curry RS, Aschenbrenner CA, et al. Patterns of recovery from pain after cesarean delivery. Pain. 2018 Oct;159(10):2088–96.
- Yimer H, Woldie H. Incidence and Associated Factors of Chronic Pain After Caesarean Section: A Systematic Review. J Obstet Gynaecol Canada. 2018 Oct 24;
- Eisenach JC, Pan PH, Lavand’homme PM, Landau R, Houle TT. Severity of acute pain after childbirth, but not the type of delivery predicts persistent pain and post partum depression. Pain. 2008;140:87–94.
- Moriyama K, Ohashi Y, Motoyasu A. Intrathecal administration of morphine decreases persistent pain after cesarean section: a prospective observational study. PLoS One. 2016;11:e0155114.
- Liu TT, Raju A, Boesel T, Cyna AM, Tan SGMM. Chronic pain after caesarean delivery: An Australian cohort. Anaesth Intensive Care. 2013;41(4):496–500.
- Jin J, Peng L, Chen Q, Zhang D, Ren L, Qin P, et al. Prevalence and risk factors for chronic pain following cesarean section: a prospective study. BMC Anesthesiol. 2016;16(1):99.
- Levene JL, Weinstein EJ, Cohen MS, Andreae DA, Chao JY, Johnson M, et al. Local anesthetics and regional anesthesia versus conventional analgesia for preventing persistent postoperative pain in adults and children: A Cochrane systematic review and meta-analysis update. J Clin Anesth. 2019 Aug;55:116–27.
