En klinisk vejledning
Arbejdsgruppe under DASAIM, i samarbejde med DSOG og Dansk Kirurgisk Selskab
Introduktion
Formål og målgruppe
At give anbefalinger til anæsetsiologer der bedøver gravide kvinder til non-obstetrisk kirurgi. Der er anvendt Oxford gradering af evidens.
Arbejdsgruppens medlemmer
Neel Walløe, Overlæge, Bedøvelse og Intensiv, Sydvestjysk Sygehus, Esbjerg
Renee Bøgeskov, Afd. læge, Afdeling for Bedøvelse, Operation og Intensiv Behandling, Herlev Hospital Mette Legaard Andersson, Overlæge, Anæstesiologisk-Intensiv Afdeling, Odense Universitetshospital Patricia Duch, Overlæge, Anæstesiologisk Afd., Nordsjællands Hospital, Hillerød
Jeanett Strandbygaard, Afd. læge, Afd. for Graviditet, Fødsel og Barsel, JMC, Rigshospitalet Kim Lindelof (Tovholder), Afd. læge, Afd. for Bedøvelse og Operation, JMC, Rigshospitalet Seda Koyuncu, reservelæge, Anæstesiologisk Afd., Nordsjællands Hospital, Hillerød
Gitte Hedermann Christensen, reservelæge, Afd. for Graviditet, Fødsel og Barsel, JMC, Rigshospitalet Mona Aarenstrup Karlsen, Afd.læge, Afd. for Graviditet, Fødsel og Barsel, JMC, Rigshospitalet
Tak til Lotte Marie Vestergaard, Overlæge, Bedøvelse, Operation og Intensiv, Sjællands Universitetshospital, Køge og Deepti Jain, Overlæge, Bedøvelse og operation, AUH, Skejby for gennemlæsning og kommentarer
Forfatterne har ingen interessekonflikter
Forkortelser
ACoG American College of Obstetricians and Gynecologists
BIS Bispectral index
CO Cardiac output
CO2 Kuldioxid
CTG Cardiotokografi
DAS Difficult Airway Society
DL Direkte laryngoscopi
ETCO2 End-tidal CO2
FDA Food and Drug Administration
FHR Foster hjertefrekvens
FRC Funktionel residualkapacitet
GA Gestationsalder
GFR Glomerulære filtrationsrate
IAP Intraabdominalt tryk
IQ Intelligenskvotient
KIM-KIT Kan Ikke Maskeventilere – Kan Ikke Intubere
LMA Larynxmaske
MAC Minimale alveolære koncentration
MV Minutvolumen
NAP4 4th National Audit Project
NAP5 5th National Audit Project
NIBT Non-invasivt blodtryk
N2O Lattergas
OAA Obstetric Anaesthetists’ Association
PaO2 Partialtryk af O2 i arterieblod
pCO2 Partialtrykket af CO2 i blod
PEEP Positive End-Expiratory Pressure
RSI Rapid Sequence Induction
SOAP Society for Obstetric Anesthesia and Perinatology
ST-forandringer ST-forandringer i EKG
SVR Systemisk Vaskulær modstand
TBW Totalt vand i kroppen
TOF Train Of Four
TSH Thyoideastimulerende hormon
TV Tidalvolumen
UKOSS United Kingdom Obstetric Surveillance System
VL Videolaryngoskopi
WHO World Health Organization
Indledning
Baggrunden for rådgivning af gravide, som kræver anæstesi i forbindelse med non-obstetrisk kirurgi, kommer fra observationelle studier, dyrestudier, ekspert udtalelser og ekstrapolerede data fra sectio og andre obstetriske procedurer. Der savnes humane studier på gravide kvinder. Der foreligger derfor meget sparsom evidens på området.
Det er ikke muligt at adskille, om et eventuelt dårligere outcome hos mor og/eller foster skyldes kirurgi, anæstesi, den tilgrundliggende sygdom eller kombinationen.
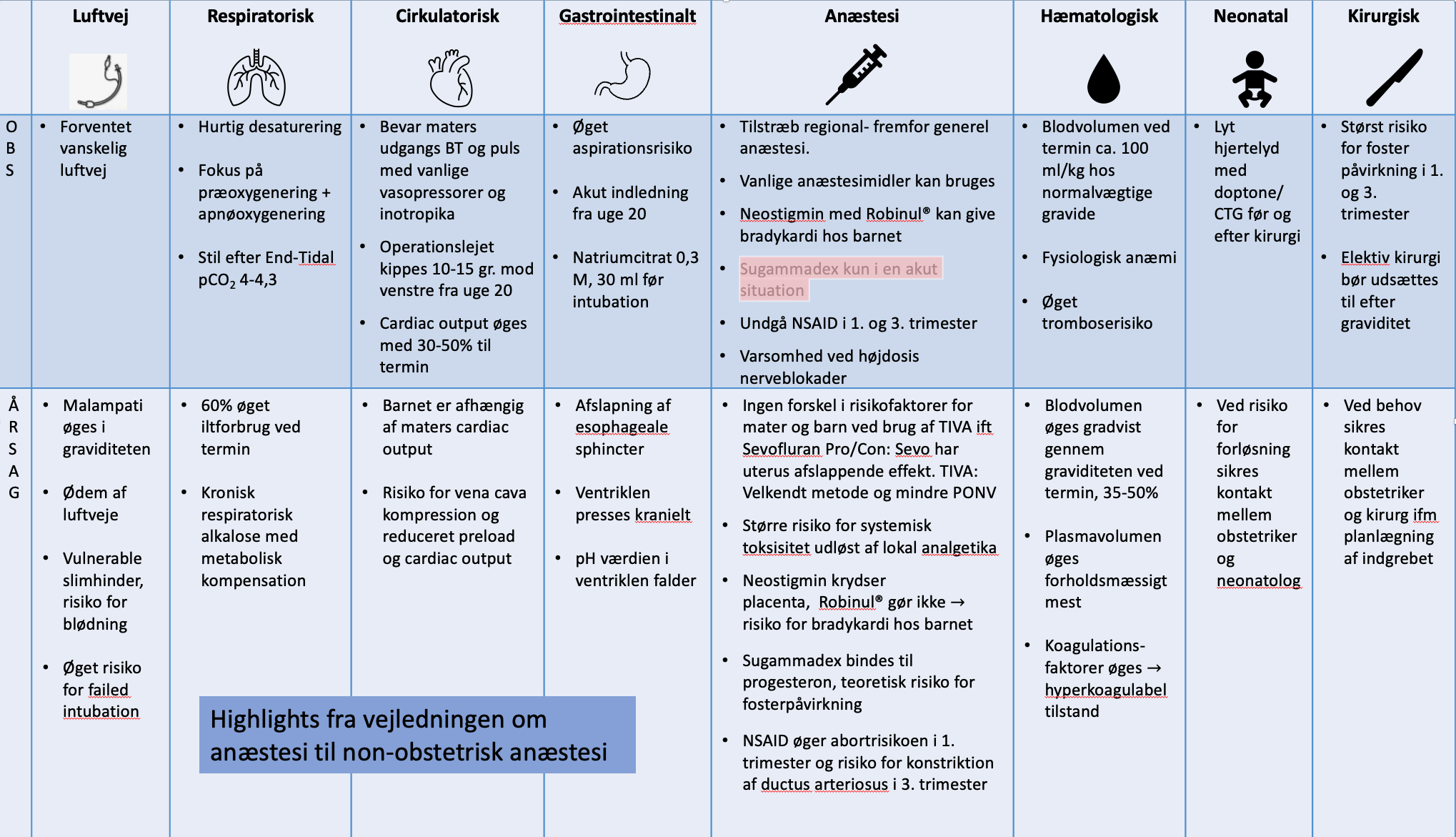
1. Fysiologi
Skrevet af Neel Walløe
Gennemgang af anatomiske og fysiologiske forandringer hos den gravide kvinde.
Kardiovaskulære forandringer
Cardiac output (CO) stiger op mod 50% i løbet af graviditeten. Dette er som konsekvens af øget hjertefrekvens, 10-15 slag/minut, og øget slagvolumen (30%). Årsagen til den øgede hjertefrekvens og slagvolumen er et respons på en lavere systemisk vaskulær modstand (SVR) for at opretholde den perifere perfusion. Slagvolumen øges på baggrund af venstresidig ventrikulær hypertrofi og dilatation, mens kontraktiliteten er uændret. I et elektrokardiogram (EKG) kan der ses venstresidig aksedeviation samt mindre ST-forandringer. Til termin vil 10% af CO gå til placenta (1).
Vena cava syndrom
Når uterus vokser, kan den komprimere vena cava, når den gravide ligger i fladt rygleje. Kompression af vena cava nedsætter det venøse tilbageløb/preload, hvilket reducerer CO med op til 20%. Den gravide vil kompensere med at øge den sympatiske tonus med takykardi og vasokonstriktion. Desuden vil der omfordeles blod fra andre organer, f.eks. uterus, hvilket kan medføre føtal stress. Vena cava syndrom er klinisk relevant fra omkring uge 20 (1).
Hæmatologiske forandringer
Blodvolumen øges gennem graviditeten og er ved termin forøget 35-50%. Der sker både en øgning af plasmavolumen og af erytrocytterne. Da plasmavolumen forholdsmæssigt øges mest, vil det resultere i fortyndingsanæmi. Den nedsatte viskositet hjælper med blodgennemstrømningen i placenta, og det forøgede volumen vil kompensere det forventede blodtab ved fødslen.
Graviditet medfører en hyperkoagulabel tilstand med øgning af samtlige koagulationsfaktorer. Trombocyttallet vil ofte falde lidt pga. øget forbrug, dette på trods af en øget produktion. Graviditet medfører øget risiko for tromboembolier (2).
Respiratoriske forandringer
Ved termin er der et øget iltbehov på op til 60%. Det øgede iltbehov bliver tilgodeset af øget CO og respiratorisk minut volumen (MV). MV øges, da både respirationsfrekvens stiger og tidalvolumen (TV) øges op mod 45% til termin. Årsagen til at MV øges, skyldes et øget progesteronniveau, der agerer som respiratorisk stimulans. Den forøgede MV medfører en mild respiratorisk alkalose, hvor øgningen i pH begrænses af øget udskillelse af bikarbonat via nyrerne. En øgning i maternel PaCO2 vil begrænse CO2- diffusionen fra fosteret til det maternelle blod, hvilket således vil medføre føtal acidose (3,4).
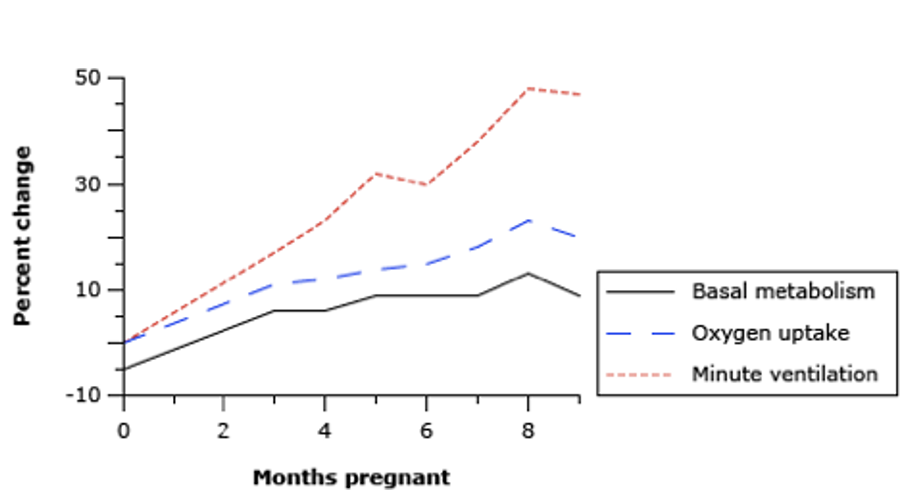
Figuren illustrerer det stigende iltforbrug i løbet af graviditeten (5).
Den funktionelle residualkapacitet (FRC) nedsættes hos den gravide i takt med, at uterus vokser, hvorved diafragma displaceres opad. Dette bliver særligt udtalt i fladt rygleje. FRC er den vigtigste oxygenreserve hos den apnøiske patient (3,4). Graviditet kan derudover medføre øget fedtvæv omkring halsen, forstørrelse af mammae og øget kapillær permeabilitet medførende ødem af øvre luftveje (6,7).
Gastrointestinale forandringer
Gennem hormonpåvirkning fra progesteron samt anatomisk displacering af ventriklen op i thorax, reduceres tonus i den nedre esophageale sphincter, hvilket øger risikoer for aspiration. Samtidig bliver pH lavere i ventriklen. Ventrikeltøming og ventrikelsekretion påvirkes ikke af graviditet, derimod er motiliteten reduceret i gastrointestinalkanalen og i galdevejene (8).
Renale forandringer
Den glomerulære filtrationsrate (GFR) stiger med 40% gennem graviditeten, og ligeledes stiger blodgennemstrømningen i nyrerne. Dette medfører en reduktion af serum kreatinin og carbamid. Elektrolytterne er ligeledes påvirkede; øget blodgennemstrømning medfører øget tab af natrium, mens et øget aldosteronniveau øger natriumreabsorbtionen. Nettoeffekten bliver væskeretention og øgning af totalt vand i kroppen (TBW) på op til 6 liter. Nyrerne øger udskillelsen af bikarbonat for at kompensere for den respiratoriske alkalose (9,10).
Endokrinologiske forandringer
Thyroidea: TSH reduceres i starten af graviditeten, men normaliseres i tredje trimester. Forøget østrogen medfører øget thyroideabindende globulin, men frit T3 og T4 forbliver normale, således at graviditet medfører euthyroid tilstand.
Insulin: Gennem graviditeten ændres glukosemetabolismen via hormoner fra placenta, således at der opstår en relativ insulinresistens, specielt i skeletmuskelvæv. Dette medfører en forøget kompensatorisk insulinsekretion på op til 3-4 gange normal sekretion, hvorved der opnås normal glukosetolerans.
Sammenfattende er det normale svangerskab karakteriseret ved hyperinsulinæmi med risiko for hypoglykæmi ved længerevarende faste, men ellers let faste-hypoglykæmi med fasteglukose 0,5-1 mmol lavere end ikke-gravide og postprandial hyperglykæmi, der varer længere end for ikke-gravide (11).
Placenta
Uteroplacental blodgennemstrømning
Uterin blodgennemstrømning øges fra 50-100 ml/min før graviditeten til 700-900 ml/min ved termin. Umbilical blodgennemstrømning er relativt konstant gennem graviditeten, ca. 110-120 ml/min/kg fostervægt. Dyrestudier har vist, at den uteroplacentale cirkulation er et dilateret, lavresistent system, hvor perfusion hovedsageligt er trykafhængigt. Dette, sammenholdt med at den uteroplacentale cirkulation har begrænset autoregulation, gør, at placentaperfusionen er afhængig af maternelt blodtryk og CO. Nedsat perfusionstryk i uterus fra f.eks. maternel hypotension, fald i CO, blodtab, dehydrering, neuroaksial eller generel anæstesi, kan således kompromittere den uteroplacentale perfusion og medføre føtal asfyksi. Øget venøst tryk i uterus fra f.eks. vena cava syndrom eller langvarig eksponering af uteruskontraktioner, kan nedsætte perfusionen i uterus. Hyperventilation under smerter kan medføre ekstrem maternel hypocapni (PaCO2 < 2,6) og dermed reducere den uterine blodgennemstrømning på grund af arteriel kontraktion, og igen resultere i føtal hypoxi og acidose (1,12–14).
Udveksling af farmaka og blodgasser
Transport over placenta foregår gennem passiv diffusion, faciliteret diffusion og transportmedierede mekanismer. Udvekslingen af oxygen sker primært ved passiv diffusion og afhænger af flere faktorer, bl.a. partialtrykket og hæmoglobinkoncentrationer. Føtal PaO2 er normalt 5,3 kPa og aldrig mere en 8,0 kPa trods maternel ilttilskud på 100%. CO2 passerer nemt placenta ved diffusion og begrænses primært af blodgennemstrømningen (14).
Farmaka med molekylvægt større end 1000 Dalton passerer placenta i meget begrænset omfang. Molekyler mindre end 600 Dalton kan passere, hvorimod det er svært at udtale sig om molekyler mellem 600-1000 Dalton. Den maternelle blodkoncentration af farmaka er typisk den primære faktor for, hvor meget der vil passere over placenta. Andre faktorer, der har betydning for passagen, er høj lipidopløselighed, nedsat ionisering, lav maternel proteinbinding og høj blodgennemstrømningen i placenta, der alle øger passagen. F.eks. er non-depolariserende farmaka ioniseret med høj molekylærvægt og ringe lipidopløselighed, og passerer derfor stort set ikke placenta. Succinylcholine har lav molekylærvægt, men er højt ioniseret, og passerer ikke placenta i klinisk relevante doser. Da føtalt blod er mere acidotisk end det maternelle blod, vil svage basiske farmaka såsom lokalanæstetika og opioider passerer placenta som ikke-ioniserede farmaka, hvorefter de bliver ioniserede i fosteret med deraf følgende risiko for ophobning (14).
Resume af evidens Evidensgrad
|
Kardiovaskulært: Cardiac output øges med 30-50%; HF stiger med 10-15 slag pr. minut; SVR nedsættes; Ved termin går 10% af CO til placenta; Det venøse tilbageløb reduceres på grund af uterus kompression ved rygleje fra 20. graviditetsuge. |
4 |
| Hæmatologisk:
Blodvolumen øges med ca. 35-50% ved termin. Kvinden bliver tiltagende hyperkoagulabel under graviditeten. |
4 |
| Respiratorisk: |
4 |
| Respirationsfrekvensen og tidalvolumen stiger under gravidteten => fald i pCO2 => let alkalotisk tilstand i kvindens blod.
Øget pCO2 medfører føtal acidose. FRC nedsættes, iltbehovet øges op til 60% => risiko for hurtig desaturation. |
|
| Gastrointestinalt:
Øget pH i ventriklen. Nedsat tonus i den nedre esophagale sphincter. |
3 |
| Renalt:
Øget blodgennemstrømning, deraf øget GFR op til 40% og nedsat kreatinin. Øget renal udskillelse af bikarbonat. |
3b |
| Endokrinologisk:
Som hovedregel medfører graviditet euthyroid tilstand. Øget insulin produktion og insulinresistens kan medføre risiko for hypoglykæmi ved langvarig faste. |
3b |
| Uteroplacental blodgennemstrømning
Uteroplacental blodgennemstrømning er afhængig af maternelt blodtryk og cardiac output. |
2 |
| Udveksling over placenta:
Faktorer der begunstiger farmaka passage over placenta er høj lipidopløselighed, lav molekylvægt, ringe ionisering, lav protein-binding, høj koncentration i maternelt blod og blodgennemstrømningen i placenta. |
2 |
2. Risici ved anæstesi for den gravide kvinde og fostret
Skrevet af Renee Bøgeskov
Maternel risiko
Anæstesirelaterede maternelle dødsfald forekommer ekstremt sjældent i industrialiserede lande. Det kan være svært at fastslå årsagssammenhæng (15). Ændret fysiologi og kompensatoriske mekanismer hos unge gravide kan kamuflere tidlige tegn på septisk eller hypovolæmisk shock, og dermed gøre den kliniske vurdering sværere end hos ikke-gravide. Der foreligger modstridende data for, hvorvidt non-obstetrisk kirurgi medfører højere mortalitet og morbiditet hos gravide kvinder (16–19).
Et retrospektivt kohortestudie fra 2015 med 2700 gravide fandt ingen forskel i morbiditet og 30-dages mortalitet efter non-obstetrisk kirurgi sammenlignet med ikke-gravide kvinder (19). Et amerikansk studie med 2500 gravide kvinder fandt ligeledes ingen forskel i morbiditet og 30-dages mortalitet efter cholecystektomi (17). Derimod fandt et taiwansk studie med 5000 kvinder 4 gange øget risiko for maternel mortalitet under indlæggelse, 2,5 gange større risiko for indlæggelse på intensivafdeling og øget risiko for postoperativ sepsis, pneumoni og urinvejsinfektion (16).
Udsættelse af akut kirurgi er associeret med dårligere outcome hos gravide, især ved infektiøse kirurgiske problemstillinger. Et studie med 7100 gravide med appendicitis fandt, at konservativ behandling var associeret med øget risiko for septisk shock, venøse tromboembolier og peritonitis sammenlignet med kirurgisk appendektomi (20). Et lignende studie med gravide kvinder med cholecystitis viste, at kirurgisk behandling medførte færre maternelle og føtale komplikationer sammenlignet med medicinsk konservativ behandling (17).
Både FDA og ACoG tilråder, at nødvendig kirurgi ikke udsættes på grund af graviditeten (21,22).
Neuropsykologisk udvikling
Dyrestudier har påvist histologiske ændringer i hjerneceller samt påvirket psykomotorisk udvikling efter eksponering for anæstesimidler. Humane studier har ikke givet entydige resultater, men peger dog i retning af, at en enkelt kortvarig eksponering ikke har negativ indvirkning på den psykomotoriske udvikling, mens gentagen eksponering er associeret med beskeden øget forekomst af udviklings- og adfærdsvanskeligheder (23–25).
Teratogenicitet
Der foreligger ikke evidens for teratogen effekt af anæstesimidler administreret i normale anæstetiske doser ej hellere i 1. trimester (21,26). Et systematisk review med 12.452 patienter viste ingen øget forekomst af misdannelser sammenlignet med baggrundsbefolkningen (27). Større retrospektive studier har hellere ikke påvist nogen association mellem medfødte misdannelser og børn født af mødre, som er eksponeret for anæstetika under graviditeten (28–31).
Risiko for abort og fosterdød
Et systematisk review med 12.000 gravide kvinder fandt ingen højere forekomst af aborter i 1. trimester efter non-obstetrisk kirurgi sammenlignet med baseline i den gravide population (4). Et registerstudie fra English National Health Service påviste en let øget forekomst af spontan abort sammenlignet med kvinder, som ikke fik foretaget kirurgi under graviditeten (32,33). Et dansk registerstudie fandt derimod 3 gange øget risiko for spontan abort hos kvinder, som undergik abdominalkirurgi under graviditeten (34). Enkelte andre studier rapporterer også en højere risiko for abort ved kirurgi i 1. trimester (32). Det er ikke afklaret, hvorvidt disse højere abortforekomster skyldes anæstesi, kirurgi og/eller den underliggende sygdom.
Obstetriske outcomes efter kirurgi og anæstesi i graviditeten
Overall risiko for negative obstetriske events relateret til non-obstetrisk kirurgi under graviditeten ser ud til at være lav, om end der ikke findes definitive konklusioner (26). Et stort engelsk retrospektivt kohortestudie
(35) med 47.000 non-obstetriske indgreb fandt følgende ved non-obstetrisk kirurgi vs. gravide, som ikke blev udsat for kirurgi:
| Graviditet uden kir. | Graviditet med kir. | Antal outcome pr 100
operationer |
|
| Foetus Mortuus | 33.363 (0,6%) | 411 (0,9%) | 0,7 |
| Præterm fødsel | 452.877 (7,5%) | 4.916 (11,1%) | 3,2 |
| Lav fødselsvægt
(<2500g) |
338.800 (5,6%) | 3.831 (8,6%) | 2,6 |
| Sectio | 1.461.707 (23,9%) | 12.836 (28,8%) | 4 |
| Maternel død | 223 (0,003%) | 12 (0,025%) | 0,01 |
Et andet retrospektivt case-control studie fra 2016 (36) inkluderede 36.512 fødsler, hvoraf 171 var eksponeret for anæstesi og kirurgi under graviditeten. Disse blev matchet med 684 kontroller. Studiet viste, at kvinder eksponeret for kirurgi og anæstesi under graviditeten havde større risiko for præterm fødsel (<37 uger) og lavere fødselsvægt end kontrolgruppen.
ACoG anbefaler at elektiv kirurgi, om muligt, udsættes til efter forløsning (21). Foreligger der indikation for elektiv kirurgi i graviditeten, bør dette, såfremt muligt, gennemføres i 2. trimester, hvor risikoen for præterm fødsel antages og være mindst (37).
Resume af evidens Evidensgrad
| Anæstesirelaterede maternelle dødsfald forekommer meget sjældent. |
2 |
| Der foreligger modstridende data for, hvorvidt non-obstetrisk kirurgi medfører højere
mortalitet og morbiditet hos gravide kvinder sammenlignet med ikke-gravide. |
3 |
| Enkeltstående og/eller kortvarig anæstesi/kirurgi formodes at være uden større øget risiko for fosteranomalier. Der er beskrevet (lidt) højere incidens af abortering, men litteraturen er modstridig.
Det kan ikke udelukkes at gentagen og/eller langvarig eksponering for anæstesi og kirurgi under graviditeten, kan medføre neuropsykologiske udviklingsforstyrrelser hos fosteret. |
3 |
| Der er en lav overall risiko for negative obstetriske events ved non-obstetrisk kirurgi og
anæstesi under graviditeten. |
3 |
Kliniske rekommandationer Styrke
| Ikke nødvendig kirurgi bør udsættes til efter fødslen.
Det tilrådes, at nødvendig kirurgi ikke udsættes under graviditeten. |
C |
| Det anbefales at minimere fosterets eksponering for medicin, herunder anæstesimidler. |
C |
| Hvis muligt fortrækkes elektiv kirurgi udført i 2. trimester. |
D |
3. Faste og aspirationsprofylakse
Skrevet af Mette Legaard Andersson
Dette afsnit vil afdække evidensen omkring anbefalet faste og anbefalet aspirationsprofylakse hos gravide, som skal have udført non-obstetrisk kirurgi.
Gastrointestinale påvirkninger og ændringer under graviditeten
Der henvises til afsnittet ‘Gastrointestinale forandringer’ i kap. 1. Fysiologi.
Faste
Ventrikeltømning og ventrikelsekretion påvirkes ikke af graviditet, hvorfor standard fasteregler for voksne anvendes til gravide, som skal opereres (38,39).
Aspirationsprofylakse
Gravide har øget risiko for aspiration under intubation og ekstubation pga. øget intraabdominalt tryk og relaksation af den nedre esophageale sphincter (40–42). Ydermere opfylder obstetriske patienter ofte øvrige risikofaktorer for aspiration, så som akut operation, vanskelig intubation, overfladisk anæstesi og refluks (43). Et Cochrane review undersøgte præoperative interventioner for at reducere aspirationsrisikoen ved generel anæstesi til sectio (44). Forfatterne fandt, at evidensen på området var af lav kvalitet. Resultaterne tydede dog på, at kombinationen af opløselige antacida (f.eks. natriumcitrat) og H2-receptor antagonist (f.eks. ranitidin) var bedst til at forebygge lav pH-værdi i ventriklen. Ved brug af ét præparat til at reducere risikoen for pH under 2,5 i ventriklen, var opløselige antacida bedre end H2- receptor-antagonist, som igen var bedre end proton-pumpe-hæmmere (PPI). Desværre undersøgte ingen af de inkluderede studier kritiske og betydende kliniske outcomes (45).
H2-receptor antagonist er i skrivende stund ikke registreret i Danmark, hvorfor disse selvsagt ikke er tilgængelige.
Resume af evidens Evidensgrad
| Ventrikeltømning og ventrikelsekretion påvirkes ikke af graviditet. | 3b |
| Tonus i nedre esophageale sphincter er reduceret under graviditet. | 3b |
| Opløselige antacida (natriumcitrat) er bedre end H2-receptorantagonister til at reducere
risikoen for ventrikel pH under 2,5, men effekt på aspirationsrisiko er ikke undersøgt. |
1c |
Kliniske rekommandationer Styrke
| Standard fasteregler for voksne anvendes for gravide. | B |
| Natriumcitrat 0,3 M, 30 ml peroralt, umiddelbart præoperativt for at øge
ventrikelindholdets pH værdi kan overvejes. |
B |
| Såfremt der er tid til yderligere aspirationsprofylakse, kan PPI, f.eks. esomeprazol 40 mg IV
ca. 1 time før anæstesiindledning overvejes. |
E |
4. Lejring
Skrevet af Neel Walløe og Patricia Duch
Dette afsnit vil afdække evidensen omkring anbefalet lejring under anæstesi af den gravide.
Aortocaval Hypotension Syndrome/ vena cava syndrom
Et studie med MR-skanning af gravide vs. ikke-gravide kvinder uden anæstesi, hvor kvinderne var lejret i hhv. fladt rygleje, 15 gr. og 30 gr. venstre sideleje, har vist, at aorta ikke ændrede diameter, men at vena cava inferior var større i diameter i 15. gr. ve. sideleje, og størst i 30. gr. venstre sideleje (46). Ved MR- skanning uden anæstesi er det hos raske gravide fundet, at den spinale venøse plexus bidrager til det venøse returløb via vena cava inferior (47). Kompression af vena cava inferior sker primært pga. størrelsen af uterus, men er også afhængig af, hvor mobil uterus er samt kvindens og fosterets position (48).
I litteraturen findes ikke et præcist tidspunkt for, hvornår risikoen for vena cava syndrom indtræder, og oftest regnes fra uge 20, men ned til uge 18 er beskrevet.
Ramped position
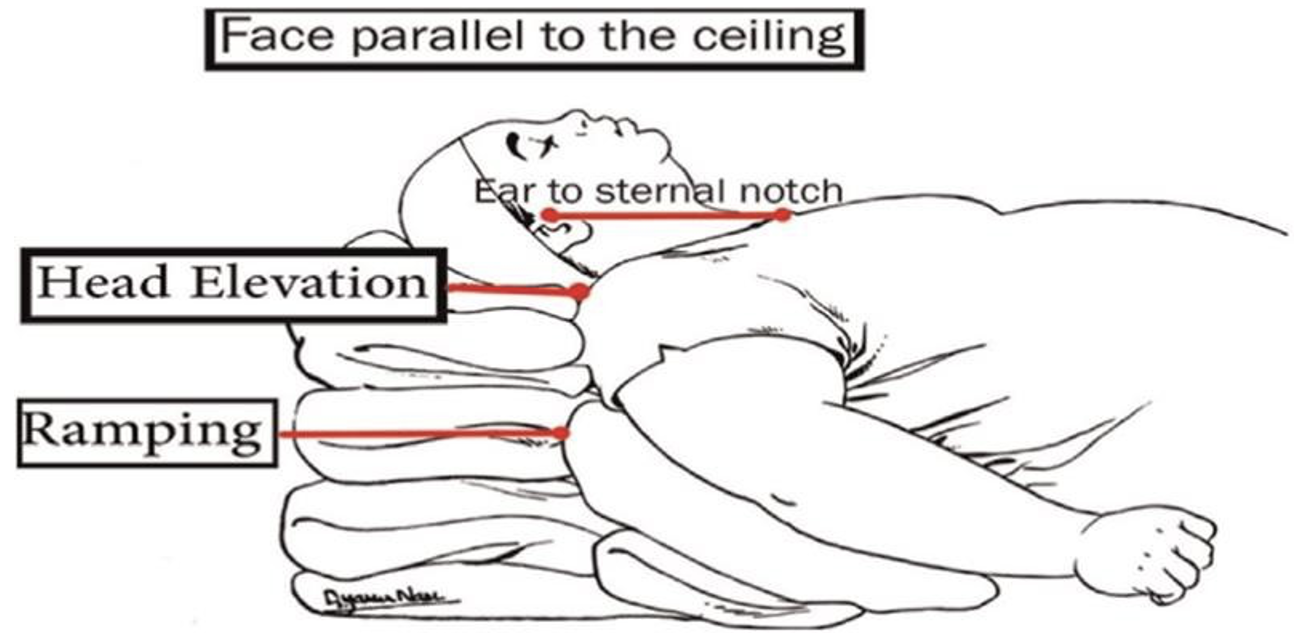
Ved ’ramped position’ lejres patienten med eleveret overkrop på en skråkile, således at en horisontal linje kan trækkes fra den eksterne øregang til brystbenet. Ramped position kan ligeledes forbedre ventilationen hos gravide til termin ved at nedsætte presset på diafragma fra uterus og giver mere plads til lungerne og dermed øge den FRC (6).
Et studie med raske gravide målte CO med transthorakal ekkokardiografi i 3 positioner (venstre sideleje vs. venstredrejet rygleje på skråkile med samtidig ramped position vs. ramped position). De fandt, at ramped position alene hos ikke-fødende raske gravide uden anæstesi ikke giver ændringer i CO og er komfortabelt (49).
Resume af evidens Evidensgrad
| Vena cava syndrom ses fra graviditetsuge 18-20, når den gravide er i fladt rygleje. |
2b |
| 15 gr. venstredrejet rygleje kan være svært at opnå uden måleudstyr. 15 gr. venstredrejet
rygleje kan give kirurgiske udfordringer og ubehag for den gravide. |
2c |
| Ramped position kan muligvis give mere plads til lungerne og bedre FRC. |
2b |
| Intraabdominal tryk er signifikant forhøjet i fladt rygleje vs. venstredrejet rygleje. |
2b |
Kliniske rekommandationer Styrke
| Minimum 10-15 gr. venstredrejet rygleje anbefales fra og med 20. graviditets uge. Forhindrer eller besværliggør venstredrejet rygleje kirurgien, kan anden lejring overvejes f.eks. højre sideleje eller fladt rygleje med pressorstoffer for at opretholde det uteroplacentale blood flow. |
C |
5. Monitorering
Skrevet af Kim Lindelof og Jeanett Strandbygaard
Generelt
Standard peroperativ monitorering som til ikke-gravide anbefales, jf. DASAIM’s vejledning “Rekommandationer for anæstesi”
- Non-invasivt blodtryk (NIBT), 3-punkts EKG, saturationsmåler
- Ved overtryksventilation: Kapnografi
- Ved anvendelse af neuromuskulær blokade: TOF-nervestimulator
- temperatur og timediureser ved længerevarende/større indgreb
- Mere avanceret monitorering som invasiv blodtryks monitorering anbefales kun, hvis der forventes betydende hæmodynamisk instabilitet (42,50).
- Postoperativ monitorering er i princippet det samme som hos ikke-gravide, men med øget fokus på at forebygge og behandle hypotension, hypoventilation og desaturation (42).
- Peroperativ fosterovervågning ved operation med udtalt hæmodynamisk instabilitet hos kvinden kan overvejes hvis gestationsalder er mere end 25 uger (21).
Blodtryk
Se venligst kap. 7 ’Maternelt blodtryk og placentaperfusion’
Kapnografi
Ved overtryksventilation anbefales måling af endtidal CO2. Efter uge 20 bør tilstræbes endtidal CO2 4,0-4,3 (42), se venligst kap. 6. Luftvej hos gravide.
Laparoskopi med peritoneal insufflering af CO2 kan medføre hyperkapni og ekstra opmærksomhed på endtidal CO2 anbefales (51). Under graviditet øges ventilationen mod termin og pCO2 er derfor fysiologisk lavere mod termin. Det bør tilstræbes at endtidal CO2 holdes i normalområde svt. gestationsalder og alarmgrænser bør justeres. Det intraabdominale tryk bør holdes så lavt så muligt med udgangspunkt på f.eks. 10-15 mmHg, akkurat som hos ikke-gravide (52).
Temperatur
Monitorering af temperatur anbefales ved længerevarende procedurer (f.eks. > 1 time), hvor der kan være behov for aktiv opvarmning.
Søvndybde
Ved sedation bør kvinden observeres tæt for at undgå dyb sedation med risiko for aspiration. Særligt fra 20. gestationsuge kan kvinden ikke anses for at være fastende.
Minimale alveolære koncentration (MAC) er reduceret for gravide. Bispectral index (BIS) kan muligvis være en hjælp, og herved kan overdosering og medfølgende hypotension forsøges undgået (38), men der har ikke kunnet findes studier, der understøtter dette.
Timediurese
Ved større/længerevarende operationer kan timediureser med fordel monitoreres (53).
Øvrig monitorering
ACoG anbefaler FHR ved CTG før og efter kirurgi samt monitorering af kontraktioner/veer ved levedygtigt foster (>22. gestationsuge) (21).
Hæmoglobin og blodgasser kan med fordel monitoreres lidt oftere end hos ikke-gravide operationspatienter (54).
Resume af evidens Evidensgrad
| Avanceret monitorering som invasivt blodtryk anbefales kun ved betydende hæmodynamisk instabilitet |
3 |
Kliniske rekommandationer Styrke
| Standard per- og postoperativ monitorering som til ikke-gravide anbefales, jf. DASAIM’s vejledning |
B |
| Der er behov for at være mere pro-aktiv i behandling (f.eks. af hypotension, hypoxi mm) end hos ikke-gravide |
B |
|
Fosterhjerteaktion i form af CTG eller doptone før og efter anæstesi anbefales |
B |
6. Luftvej hos gravide
Skrevet af Kim Lindelof og Renee Bøgeskov
Den gravide luftvej generelt
Se venligst Kap. 1 ’Fysiologi’
Maternel komorbiditet, især adipositas, er forbundet med øget frekvens af vanskelig luftvejshåndtering (55–57).
Ifølge ’The UK Confidential Enquiries into Maternal Deaths over the past 40 years’ er der sket en dramatisk reduktion i anæstesirelaterede maternelle dødsfald igennem de sidste 10 år, men den hyppigste årsag til disse dødsfald er relateret til luftvejshåndtering (58), hvilket også fremgår af øvrige studier og opgørelser (59–61). Data fra USA viser højere risiko for død ved generel anæstesi end neuroaxial anæstesi hos gravide (62), formentlig fordi man ved sidstnævnte undgår maternelle luftvejskomplikationer.
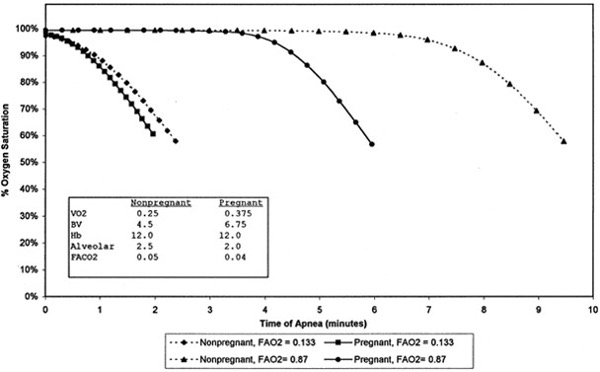
Figuren viser fald i oxygensaturation efter indledning af anæstesi for gravide og ikke-gravide som har/ikke har været præoxygeneret (63).
Præoperativ luftvejsvurdering
Anæstesiologisk prætilsyn bør udføres, før den gravide patient bedøves. Maternel og føtal præoperativ tilstand afklares, og potentielle luftvejsproblemer afdækkes. Gennemgang af journal for tidligere luftvejshåndtering og intubation skal tolkes med forsigtighed, da luftvejsforholdene ændres under graviditet (se kapitel 1).
En potentielt vanskelig luftvej hos gravide kan forsøges identificeret ved en standardiseret kombination af tests (61), men hovedparten af vanskelige intubationer forekommer alligevel uforudset. Et review af mislykkede obstetriske intubationer over en 45-års periode har vist, at 2/3 af tilfældene var uventede (64). Antallet af patienter med mallampati score 4 øges med 34% mellem gestationsuge 12 og 38 og er signifikant korreleret med vægtøgning (65). Et stort dansk kohortestudie af over 90.000 gravide fandt, at BMI >35 kg/m2 var en signifikant risikofaktor for vanskelig intubation (66). Forekomsten af vanskelig intubation er associeret med høj Mallampati score og ses 11 gange hyppigere ved score 4 vs. score 1 under graviditet og postpartum (67).
Præoxygenering
Reduceret FRC og øget metabolisme medfører hurtigere desaturation hos gravide, hvorfor adækvat præoxygenering er yderst vigtigt, og apnøoxygenering kan overvejes (42). Føtal oxygenering øges, når den maternelle PaO2 øges, og der er ikke fundet skadelige effekter på fosteret som følge af høj maternel PaO2 (68).
Præoxygenering foregår mest effektivt med 100% ilt og flow >10 liter på tætsluttende maske i 3 minutter. I meget tidskritiske situationer kan præoxygenering gennemføres ved 8 dybe inspirationer over 1 minut.
Denne teknik bør dog begrænses til de mest akutte tilfælde (69). Præoxygenering med 20-30 grader eleveret hovedgærde øger FRC, hvilket kan forlænge tiden til desaturation, især hos adipøse patienter (70,71).
Præoxygenering og apnøoxygenering med highflow nasal ilt (Transnasal humidified rapid-insufflation ventilatory exchange (THRIVE)) er vist at kunne udsætte desaturation hos ikke-obstetriske patienter (72).
Apnøoxygenering med 10-15 liter flow på standard næsekateter under laryngoskopi kan måske også forlænge tiden til desaturation, men er ikke undersøgt hos gravide. Til gravide hvor der foreligger risiko for vanskelig luftvejshåndtering, foreslår Uptodate at anvende apnøoxygenering med 10 liter flow på næsekateter under præoxygenering og indtil luftvejen er sikret (38).
Neuromuskulær blokade og revertering heraf
Suxamethonium er traditionelt anvendt til neuromuskulær blokade ved RSI til obstetriske patienter (73). Idealdosis er fortsat omdiskuteret, men generelt anbefales 1-1,5 mg/kg (74,75). Et studie med 240 patienter til sectio i generel anæstesi viste, at rocuronium sammenlignet med suxamethonium gav bedre laryngoskopiforhold og lavere forekomst af postoperativ myalgi (76). I et Cochrane review fra 2015 vedr. ikke-gravide fandtes bedre intubationsforhold ved suxamethonium 1mg/kg vs. rocuronium 0,6-0,7 mg/kg, men ingen forskel når rocuronium blev doseret til 1,2 mg/kg (38). Propofol og thiopental er ligeværdige til induktion mhp. optimale intubationsforhold, når der anvendes suxamethonium (77).
I en KIM-KIT situation kan den neuromuskulære blokade ved rocuronium hurtigt reverteres med sugammadex. Der mangler dog evidens omkring anvendelsen af sugammadex til obstetriske patienter.
Ventilation
Ved mekanisk ventilation af gravide under anæstesi bør hypoxi, acidose og hyperventilation undgås, da disse faktorer giver fosteret acidose. Maternel arteriel ilttension og uteroplacental perfusion er afgørende for den føtale oxygenering. Der er ikke rapporteret tilfælde af føtal retinopati som følge af høj iltfraktion efter non-obstetrisk kirurgi på gravide, og Uptodate anbefaler FiO2 >50% under anæstesi (42).
CO2 krydser placenta, og maternel hyperkapni kan medføre føtal acidose og myokardiedepression. Føtal acidose ses også ved hyperventilation med respiratorisk alkalose grundet påvirket perfusion i uterus og dermed påvirket føtal oxygenering (38). Derfor bør den maternelle pCO2 holdes indenfor normalområdet for gravide svarende til terminen. Gravide har normalt PaCO2 4,0-4,3 kPa (30-32 mmHg), men mod termin falder den yderligere og ETCO2 på 3,3-4,0 kPa bør tilstræbes i 3. trimester; arteriel blodgas anbefales ved længerevarende procedurer (78). Normal værdi af PaCO2 hos ikke-gravide kvinder er 4,3-6,0.
Der er sparsom evidens for hvorvidt lungerekruttering forebygger atelektaser, om end dette anbefales af nogle forfattere (79). Lungerekruttering må forsøges under hensyntagen til placentaperfusion (maternelt blodtryk). Herudover anbefales et positive end expiratory pressure (PEEP) på 5-8 cm H2O som hos ikke- gravide (80,81).
Luftvejshåndtering
Larynxmaske
Der er generel enighed om, at gravide kvinder bør intuberes ved generel anæstesi efter gestationsuge 18- 20 primært af hensyn til øget aspirationsrisiko (38). Anvendelsen af larynxmaske (LMA) til gravide er dog undersøgt uden dokumenteret øget aspirationsrisiko (82,83). Men da disse studier er gennemført under kontrollerede forhold og på normalvægtige kvinder uden refluks, skal resultaterne tolkes med forsigtighed. Der vurderes på nuværende tidspunkt ikke at være nok evidens for, at LMA sikkert kan erstatte intubation hos gravide patienter (84)
Anvendelsen af 2. generations LMA (fx ProSeal) som rescue device efter mislykket intubation af obstetriske patienter er kasuistisk beskrevet (85–87). Et britisk studie fandt, at 39 ud af 57 patienter med mislykket intubation kunne håndteres med en klassisk LMA (88). Succesraten for fiberintubation igennem LMA er oplyst tæt på 100% (89). Fasttrach intubationslarynxmaske er designet til blind tracheal intubation, men kan også kombineres med fiberskopisk intubation og er beskrevet med succesfuld anvendelse efter mislykket intubation til akut sectio (90,91).
Intubation
Mislykket intubation forekommer hyppigere i den obstetriske population end hos ikke-gravide (38,92). Et prospektivt studie fra ’the United Kingdom Obstetric Surveillance System’ (UKOSS) rapporterede i perioden 2008-2010 en forekomst af mislykket intubation på 1:224 for obstetriske patienter med gestationsalder > 20 uger (88). Et systematisk review fra 2015 fandt en forekomst af mislykket intubation på 1:433 ved sectio, og 1:390 for general anæstesi til obstetriske patienter. Incidensen af maternel død ved mislykket intubation var 2.9:100.000 (svt. 1 maternelt dødsfald per 90 mislykkede intubationer) (65).
Gravide har, foruden øget aspirationsrisiko, også en række anatomiske og fysiologiske risikofaktorer for vanskelig intubation (se kap. 1) (93). Når den obstetriske patient bedøves, bør algoritmer og udstyr til håndtering af uventet vanskelig luftvej derfor være umiddelbart tilgængelig og kendt af personalet. Der bør foruden plan for intubation også foreligge plan for opvågning og ekstubation.
De anatomiske luftvejsforhold hos gravide medfører behov for en mindre diameter endotrachealtube (ETT) end hos ikke-gravid især ved mistænkt luftvejsødem, anamnestisk vanskelig luftvej eller svært overblik under første laryngoskopi (94).
Med henblik på at reducere aspirationsrisikoen, er rapid sequence induktion (RSI) golden standard for gravide fra 20. gestationsuge (95). RSI gennemføres normalt uden maskeventilation, men såfremt der forventes vanskelig intubation eller desaturation indtræffer før laryngoskopi, anbefaler Uptodate, at man maskeventilerer med lave inspiratoriske tryk (<20 cm H2O) (96).
Nasal intubation frarådes pga. øget risikoen for slimhindeblødning (97).
Direkte laryngoskopi vs videolaryngoskopi
Der foreligger sparsom evidens for den obstetriske population, men ekstrapolering af studier på ikke- gravide patienter, og især adipøse patienter, indikerer, at videolaryngoskopi (VL) kan være et bedre alternativ end direkte laryngoskopi (DL). Vejledning fra 2015 af Obstetric Anaesthetists’ Association (OAA) og Difficult Airway Society (DAS) anbefaler, at et videolaryngoskop skal være umiddelbart tilgængelig ved al obstetrisk generel anæstesi (98). Uptodate anbefaler brugen af VL til første intubationsforsøg på alle gravide patienter (42). Såfremt DL anvendes, kan der til obstetriske patienter anvendes et laryngoskop med kort håndtag, da dette faciliterer intubationen hos patienter med stor barm og/eller adipositas (38).
Et Cochrane review af VL vs. DL fra 2016 med 7000 patienter fandt, at VL gav signifikant færre mislykkede intubationer på (ikke gravide) patienter med forventet og simuleret vanskelig luftvej, men ingen forskel på patienter med uventet vanskelig luftvej (99). Et andet studie fandt, at VL gav signifikant bedre overblik sammenlignet med DL, men længere apnøinterval (100). Et tredje studie har vist, at luftvejstrauma kan reduceres ved anvendelsen af VL sammenlignet med DL (101).
Opvågning og ekstubation
Opvågning og ekstubation udgør en kritisk fase i forhold til luftvejskomplikationer, og gravide patienter bør først ekstuberes i vågen tilstand, når der er sikret intakte luftvejsreflekser (38).
Flere studier dokumenteret risiko for alvorlige komplikationer relateret til ekstubation. Risiko for død og hjerneskade er større i forbindelse med opvågnings-/ekstubationsfasen end induktionsfasen (102–104).
NAP4 udført af the Royal College of Anaesthetists fandt, at 1/3 af luftvejsrelaterede komplikationer forekom under opvågningsfasen (105).
DAS har beskrevet en 4-trins guide til ekstubation, hvor alle obstetriske patienter tilhører højrisikogruppen (106).
Kendt vanskelig luftvej
Samme faktorer er associeret med svær intubation hos gravide som hos ikke-gravide. Vanskelig maskeventilation hos gravide ses især ved højt BMI, stort halsomfang, høj Mallampati score og nedsat thyromental afstand.
I nogle tilfælde kan vågen intubation, og dermed etablering af en sikker luftvej før anæstesiinduktion, være det sikreste alternativ for patienter med forventet vanskelig luftvej, især hvis der også forventes vanskelig maskeventilation (107).
Vågen intubation kan udføres relativt hurtigt, med høj successrate og med minimalt ubehag for patienten (108). Det er væsentligt at undgå oversedation med risiko for apnø og hypoxi. Ved anvendelsen af lokalbedøvende til overfladeanalgesi, skal man huske, at gravide pga. øget vaskularisering i slimhinder og en generel øget følsomhed for lokal analgetika, er i øget risiko for at udvikle systemisk toksisitet (38).
I tilfælde hvor man i forvejen forventer svært vanskelig luftvejshåndtering, bør vågen trakeostomi overvejes (109).
Håndtering af den uventede vanskelige luftvej
Algoritmer og udstyr til håndtering af uventet vanskelig luftvej bør være umiddelbart tilgængeligt og kendt af personalet. Ligeledes bør der foreligge en plan for opvågning og ekstubation.
OAA og DAS har udviklet en guideline med algoritmer for håndtering af vanskelig luftvej hos den obstetriske patient til sectio, som også er relevant for gravide, som anæsteseres til non-obstetrisk kirurgi (98).
Algoritmen støtter beslutningsprocessen i forhold til, hvorvidt patienten skal vækkes, eller man kan acceptere en risk-benefit og fortsætte med usikker luftvej og LMA/maskeventilation i en situation med mislykket intubation.
Guidelinen består af 3 algoritmer:
- Sikker obstetrisk generel anæstesi med planlægning og forberedelse
- Håndtering af mislykket intubation
- Håndtering af KIM-KIT på obstetrisk patient
Guideline kan findes på: https://www.oaa-anaes.ac.uk/OAA_DAS_Obstetric_Airway_Guidelines (98).
Såfremt ventilation kan gennemføres ved maskeventilation eller LMA efter mislykket intubation, bør det kirurgiske hold sammen træffe beslutning om, hvorvidt indgrebet skal fortsætte eller ej (38). Ultimativt er det anæstesiologens beslutning, om der kan forløses.
| Resume af evidens | Evidensgrad |
| Gravide har højere risiko for vanskelig maskeventilation og vanskelig intubation end ikke-gravide. |
2b |
| Gravide desaturerer hurtigere end ikke-gravide. |
1 |
| Effekten af apnøoxygenering med highflow/nasal iltkateter er uafklaret hos gravide patienter. |
2b |
| Normalværdi for endtidal CO2 ændres under graviditet. |
1 |
| Lokal- og regionalanæstesi bør overvejes, så luftvejshåndering kan undgås. |
2b |
| Komplikationer relateret til luftvej forekommer hyppigt i opvågningsfasen. |
3 |
| Kliniske rekommandationer | Styrke |
| Udstyr til håndtering af vanskelig luftvej anbefales at være umiddelbart tilgængelig ved
induktion. |
D |
|
Luftvejsvurdering forud for luftvejshåndtering anbefales. |
D |
| Præoxygenering med tætsluttende maske anbefales forud for anæstesi. |
D |
| Highflow nasal ilt anbefales ikke som præoxygenering. |
D |
| Ved behov for overtryksventilation anbefales intubation til gravide fra og med
gestationsuge 20 pga. risiko for aspiration. |
D |
| Suxamethonium og rocuronium kan anvendes. Neostigmin kan anvendes til revertering.
Sugammadex kan anvendes til akut revertering og på indikation, f.eks. til kvinder med neuromuskulær sygdom. |
D |
| Aspiration er også en risiko i forbindelse med opvågning. Det anbefales først at ekstubere, når patienten selv kan beskytte sine luftveje. |
D |
| Hvis intubation må opgives anbefales anlæggelse af 2. generations LMA. |
D |
| PEEP initialt 5-8. |
D |
| Det anbefales at endtidal CO2 holdes i normalområdet svt. gestationsalderen. |
D |
7. Maternelt blodtryk og placentaperfusion
Skrevet af Mette Legaard Andersson og Neel Walløe
Dette afsnit vil afdække evidensen omkring anbefalet peroperativt maternelt blodtryk, anbefalet vasopressor- og/eller inopressorbehandling samt optimalt hæmoglobinniveau hos gravide, som skal have udført non-obstetrisk kirurgi.
Generelt
De hyppigste årsager til hypotension hos gravide, som gennemgår non-obstetrisk kirurgi, er for dyb generel anæstesi, sympatikusblokade ved neuroaksial anæstesi, aortocaval kompression, blødning og hypovolæmi (1,12,13).
Generel anæstesi
Anæstesimidler, både intravenøse- og inhalationsanæstetika, anvendt til generel anæstesi i vanlige kliniske doser udøver minimal direkte påvirkning af den uterine blod perfusion. Uterin blod perfusion kan dog påvirkes indirekte af generel anæstesi, hvis induktionen, intubationen og/eller vedligeholdelsen af anæstesien medfører ændringer i maternelt blodtryk og/eller CO. Således kan negativ inotrop og kronotrop effekt samt vasodilatation af det maternelle kredsløb i forbindelse med generel anæstesi indirekte reducere uterin perfusion, og uteroplacental hypoperfusion kan opstå (13,38)
Neuroaksial anæstesi
Spinal- og epiduralanæstesi kan medføre maternel hypotension pga. sympatikusblokade med reduktion i systemisk vaskulær modstand, som medfører vasodilatation. Dermed kan den uteroplacentale blodgennemstrømning falde (13,38,110,111).
Maternelt blodtryk under anæstesi
Lejring i 10-15 gr. venstredrejet rygleje medvirker til at undgå vena cava kompression og hæmodynamisk påvirkning, som kan ses ved fladt rygleje (13,38,110,111), jf. kap. 4.’ Lejring’.
Blodtryksmål og brug af vasopressorer er primært undersøgt for sectiopatienter, og disse data ekstrapoleres i litteraturen til obstetriske patienter, som skal have udført non-obstetrisk kirurgi. Således anbefales opretholdelse af patientens udgangsblodtryk og opstart af intravenøs væske- og vasopressorbehandling, hvis blodtrykket falder mere end 10-20% af udgangsblodtrykket (38,94,110,112). Phenylephrin og efedrin er sammenlignet i et systematisk review (n = 292) for sectiopatienter i neuroaksial anæstesi (113) Der er ikke forskel mellem stofferne i forhold til at opretholde uterin blodgennemstrømning, når de anvendes til at opretholde maternelt baseline middelblodtryk (38,94,110,112,113).
Noradrenalin er undersøgt til sectiopatienter og kan ikke ekstrapoleres til gravide, som skal have udført non-obstetrisk kirurgi. Der er ingen specifikke guidelines til vasopressorbehandling af gravide, men der er data, der favoriserer noradrenalin som førstevalg til gravide med sepsis. Bekymringen er, at noradrenalin kan forårsage arteriel kontraktion af karrene i placenta med negative føtale konsekvenser til følge, men der mangler data herpå. Til patienter med sepsis eller længerevarende kirurgi kan noradrenalin indtil videre anvendes ud fra samme kriterier som til ikke-gravide (114–117).
Maternel tilstræbt hæmoglobinværdi
Den fysiologiske øgning i blodvolumen og fortyndingsanæmien, som opstår gradvist gennem graviditeten, gør, at gravides hæmoglobinreserver ved blødning er reduceret (13). WHO definerer anæmi hos gravide som hæmoglobin < 6,8 mmol/l i 1. og 3. trimester og hæmoglobin < 6,5 mmol/l i 2. trimester. Kronisk anæmi med hæmoglobin < 5,6 mmol/l øger risikoen 2-3 gange for intrauterin væksthæmning og fosterdød (118).
Blodtransfusion er ikke uden risici, bl.a. kan volumenoverload og hæmolytisk reaktion opstå hos både den gravide og fosteret. Blodtransfusion til gravide bør derfor reserveres til akut eller kontinuerlig blødning eller ved risiko for større blødning ved f.eks. kirurgi. Der kan ligeledes transfunderes ved meget lavt hæmoglobinniveau, hvor der er svære symptomer på anæmi eller insufficient fysiologisk kompensation ved eksempelvis hjertesygdomme, hvor anæmien udgør en risiko for mor og/eller foster. Klinisk stabile, raske gravide med hæmoglobinniveau på > 4,3 mmol/l kan normalt behandles med jern per os eller iv (118,119). Der er således ikke fundet evidens, som angiver andre transfusionsgrænser for obstetriske patienter sammenlignet med non-obstetriske patienter.
Resume af evidens Evidensgrad
| De hyppigste årsager til hypotension hos gravide, som gennemgår non-obstetrisk kirurgi,
antages at være for dyb generel anæstesi, sympatikusblokade ved neuroaksial anæstesi, aortocaval kompression, blødning og hypovolæmi. |
4 |
| Lejring i 15 gr. venstre rygleje ved GA > uge 18-20 medvirker sandsynligvis til at undgå aorta-caval kompression og maternel hæmodynamisk påvirkning. |
2b |
| Intravenøs væske og vasopressorbehandling anvendes til at opretholde maternel blodtryk perioperativt. |
4 |
| Der er ikke forskel på phenylephrin og efedrin i forhold til at opretholder uteroplacental blodgennemstrømning og maternel blodtryk. |
1a |
|
Gravides reserver ved betydelig blødning antages at være let reduceret pga. fysiologisk anæmi hos obstetriske patienter. |
4 |
| Transfusionsgrænserne er ens for gravide og ikke-gravide patienter. |
4 |
Kliniske rekommandationer Styrke
| For at undgå aorto-caval kompression fra gestationsuge 20 bør obstetriske patienter ikke
lejres i fladt rygleje. 10-15 gr. venstredrejet rygleje er at foretrække. |
B |
| Maternel udgangsblodtryk bør sandsynligvis opretholdes for at opretholde uteroplacental
blodgennemstrømning. |
B |
| Behandling med intravenøse væsker og phenylephrin og/eller efedrin bør opstartes, hvis
maternel blodtryk falder 10-20% af udgangsblodtrykket. |
B |
| Hos gravide bør generelle transfusionsgrænser følges. |
D |
8. Anæstesimidler til non-obstetrisk kirurgi
Skrevet af Kim Lindelof, Patricia Duch, Seda Koyuncu, Jeanett Strandbygaard
Generelt
Effekten af anæstesimidler på fosteret er umulig at skelne fra effekten af den tilgrundliggende lidelse som har givet anledning til at kvinden kræver en operation (120).
Unødig eksponering af fostre for anæstetika bør undgås ud fra et forsigtighedsprincip. Der er dog enighed om, at man altid bør tilbyde nødvendig operation/diagnostik, og diagnostik og behandling ikke må forsinkes grundet graviditet (21). Det er aldrig vist at, anæstesimidler har teratogen effekt i klinisk anvendte doser (21,121). Varigheden af operation/anæstesi er muligvis en vigtig faktor, når det kommer til alvorlige komplikationer. Et retrospektivt studie fandt, at risikoen for alvorlige komplikationer stiger med 2% for hvert minut anæstesitiden forlænges (122).
Hvis tidspunktet for operation kan påvirkes, anbefaler bl.a. ACoG at den udføres i 2. trimester, som mest optimale tidspunkt (21,110).
Generel anæstesi af neonatale (født og opereret efter 26 ugers gestationsalder, men før 60. postkonceptionelle uge) har ikke vist påvirkning af cerebrale funktioner, når der sammenlignes med operation i regional anæstesi, hverken i 2- eller i 5-års alderen (24,123). I et retrospektivt studie var der flere for tidligt fødte hos gravide, som var blevet opereret (22%) end hos kontrolgruppen (17%) p=0,02 (124). Denne gruppe anbefaler at regional anæstesi overvejes frem for GA, men finder ikke evidens for et bedre outcome. 81% blev i deres studie opereret i generel anæstesi mod 19% i regional anæstesi (+/- sedation) (124). Forfattergruppen på området hos UpToDate angiver, at til indgreb hvor generel anæstesi og regional anæstesi er ligeværdige, foretrækkes regional (38).
Anæstesimiddel og dosering
Det har ikke været muligt at finde god evidens om sevofluran eller propofol foretrækkes til gravide til non- obstetrisk kirurgi (12,38). I en nyere oversigtsartikel angives, at regional, neuroaxial eller generel anæstesi kan anvendes i alle trimestre (97).
Gravide er generelt mere følsomme for anæstesimidler, og dosis kan reduceres (110) i nogen grad, med opmærksomhed på risiko for awareness, idet NAP5 viste øget risiko for awareness under anæstesi hos gravide (125,126).
Uptodate nævner, at TOF og BIS kan bruges for at undgå overdosering af anæstesimidler med samtidig dyb nok anæstesidybde til at reducere risikoen for awareness (38).
Medicin
Sevofluran
I dyreforsøg er der på ustressede dyr vist minimal føtal effekt, når inhalationsanæstetika anvendes i moderate doser. Inhalationsanæstesi med MAC >2 gennem længere tid kan give føtal hypoxi, fald i fosterets CO og føtal acidose (12).
Inhalationsanæstesi er vist at hæmme uterine kontraktioner og øge blodperfusionen (i normal anæstesidosering), hvilket kan være en fordel (127). Men hvis doseringen øges, så der indtræder maternel hypotension, og placentaperfusionen vil kompromitteres. Man skal derfor være opmærksom på, at følsomheden for inhalationsanæstetika hos gravide er øget (128,129). Reduktion med op til 30% i MAC foreslås derfor (127).
Lattergas
Lattergas (N2O) er i dyreforsøg vist at påvirke fosterudviklingen, når gravide gnavere eksponeres, men ekstrapoleringen til mennesker har været anfægtet. Chestnut’s taler for anvendelsen af N2O sammen med inhalationsanæstetrika efter gestationsuge 6 for at undgå hypotension pga. overdosering. Dog ikke ved længerevarende operationer (12). Andre fraråder brugen af N2O hos gravide (94,128,129).
Propofol
Uptodate angiver, at propofol er det fortrukne induktionsmiddel hos raske gravide (38). Om induktionsdosis for propofol er den samme for gravide som for ikke-gravide er omdiskuteret. I et studie kunne propofoldosis reduceres med ca. 8% hos gravide (130) mens et andet studie fandt, at samme dosis var nødvendig (131).
Thiopental
Der er ikke fundet forskel mellem thiopental og propofol ved induktion af anæstesi til sectio (126). NAP5 angiver overdosering af thiopental som mulig medvirkende årsag til maternel mortalitet hos kritisk syge gravide og angiver, at overdosering er en risiko, hvis det er et præparat, som personalet sjældent anvender (125).
Ketamin
Ketamin (i doser på maximalt 2 mg/kg) kan anvendes, men højere doser bør undgås (12,120).
Opioid
Opioid i vanlige doseringer er ikke vist at give fosterskader (126) jf. Kapitel 9. Postoperativ smertebehandling og forebyggelse af og behandling af PONV.
Muskelrelaksantia
Anvendes muskelrelaksantia bør der observeres med TOF (127). Ved anvendelse af suxamethon kan fasciculationer være mindre udtalte, men den muskelafslappende effekt er uændret (38).
Revertering af muskelrelaksantia
Neostigmin-glycopyrrolat anvendes rutinemæssigt til revertering af non-depolariserende neuromuskulær blokade i forbindelse med anæstesi. Neostigmin krydser placenta, men det gør glycopyrrolat (Robinul®) ikke, hvormed der kan ses bradykardi hos fosteret. De muscarinerge effekter af neostigmin kan reduceres ved samtidig administration af atropin, som krydser placenta og dermed også har effekt på barnet. Derfor er anvendelsen af neostigmin/atropin muligvis bedre end neostigmin/robinul (132). Et studie anbefaler, at der først gives atropin og derefter neostigmin (127). Indgiften af atropin anbefales langsom, da det teoretisk kan øge uterustonus og resultere i præterm fødsel (12). Den kliniske betydning er ukendt.
Sugammadex bindes til progesteron, og har i farmakologiske simulationsstudier reduceret progesteronniveauet (39). Dyrestudier med sugammadex har vist inkonklusive resultater i forhold til teratogenicitet og risiko for abort, og der findes ikke humane studier (19). The Society of Obstetric Anesthesia and Perinatology anbefaler på grund af den manglende evidens, at man undgår rutinemæssig anvendelse af sugammadex til gravide, især tidligt i graviditeten, men fastholder at sugammadex kan anvendes i akutte tilfælde (KIM-KIT) eller efter individuel vurdering (133).
Vasopressor
Efedrin og metaoxedrin og noradrenalin kan anvendes til gravide ved behov (12) venligst kap. 7. Placentaperfusion har ikke autoregulation og er afhængigt af maternelt blodtryk.
Lokalanæstetika
Nogle forfattere anbefaler at anvende regional eller neuroaxial nerveblokade, enten som eneste anæstesi eller som supplement til generel anæstesi (12,126). Risiko for større intravasalindgift ved anvendelse af UL ved nerveblokade er lav. Dog er dosis ved fascieblokader som TQL og TAP stor og systemisk effekt og effekt på fosteret må overvejes. Plasma albumin lav hos gravide og medfører reduceret plasmabinding af lokalanæstetika og dermed større risiko for systemisk toksicitet (12,38) og kramper efter 150 mg levobupivacain er beskrevet ultralydsanlagt TAP til sectio (134). Amid-typen af lokalanæstetika (som lidokain, bupivacain og ropivacain) er svage baser og fosterets acidose kan resultere i akkumulering i fosteret og give føtale bivirkninger (135,136). Desuden kan de ændrede anatomiske strukturer hos gravide kan vanskeliggøre anlæggelse af TAP (137). Lokalanæstesi er mere effektiv hos gravide og lidt lavere dosis kan benyttes (110).
Bier blokade (intravenøs indgift af lokalanæstetika i ekstremitet med tourniquet) frarådes pga. risiko for systemisk toksicitet, og da alternativer findes (132).
Øvrige
Midazolam kan anvendes (21).
| Resume af evidens | Evidensgrad |
| Anæstesimidler er ikke vist at have føtal teratogen effekt i klinisk anvendte doser. |
3 |
| Varigheden af operation/anæstesi korreleret med risiko for alvorlige komplikationer hos kvinden og/eller foster. |
4 |
| Gravide kvinder er mere følsomme for anæstesimidler. |
3 |
| Dosis af lokalanæstetika ved fascie blokader er høj. Risiko for komplikationer er forhøjede. |
3 |
| Inhalationsanæstetika kan hæmme uterine kontraktioner. |
3 |
Kliniske rekommandationer Styrke
| Varighed af operation/anæstesi anbefales at være kortest mulig. |
D |
| Såvel propofol som sevofluran kan anvendes til generel anæstesi. |
D |
| Fascie blokader (TAP/TQL) kan anvendes med forsigtighed. Forventede fordele skal
opvejes mod potentielle risici. |
D |
|
Bier-blok frarådes. |
C |
|
Sugammadex bør kun anvendes ved behov for akut revertering og på skærpet indikation – f.eks til kvinder med neuromuskulær sygdom. |
D |
9. Postoperativ smertebehandling og forbyggelse af og behandling af PONV
Skrevet af Gitte Hedermann Christensen og Mona Aarenstrup Karlsen
Generelt: kortvarigt brug, bør om muligt undgås osv. Nedenstående skema er på ingen måde fuldstændigt ift. bivirkninger og kontraindikationer, men mere et overblik over hyppigst anvendte medikamentgrupper.
Postoperativ smertebehandling
| Medikament | Dosis og brug | Særlige maternelle
forbehold |
Særlige føtale/neonatale forbehold | Referencer |
| Paracetamol | Kan bruges i vanlig dosis ved behov. Kan bruges i hele
graviditeten. |
Janusinfo | ||
| NSAID | Alternativer bør være første valg.
Bør ikke anvendes i første og tredje trimester
Kan anvendes i nogle dage i GA 12+0 – 32+6 i normal dosering |
1. trimester: mistænkt for let øget risiko for abort, læbeganespalt e og nyreagenesi hos foster.
3. trimester: Risiko for konstriktion af ductus arteriosus Ved GA < uge 32+0 kan NSAID anvendes i op til 48 timer uden væsentlige føtale bivirkninger. Længere behandlingstid kræver overvågning af fosteret og skal konfereres |
DSOG guideline: ”Indometacin og graviditet”
https://janusmed.se/fosterpaverkan?nplId s=19851206000039 |
| med obstetriker. | ||||
| Opioider | Kan bruges i vanlig dosis ved behov. Kan bruges i hele
graviditeten. |
|||
| Ketogan | Som opioider. Kan formentlig bruges i vanlig dosis ved behov. | Almindelig e bivirkninge r er bl.a. bradykardi og hypotensio n | Bivirkning ifa. hypotension og bradykardi kunne teoretisk have konsekvenser for fostret, men dette er
ikke velundersøgt. |
https://pro.medicin.dk/Medicin/Praeparat er/662 https://janusmed.se/fosterpaverkan?nslIds
=IDE4POCBU9EJDVERT1 |
| Catapressan | Bør om muligt undgås. | Hos ikke- gravide er registreret bivirkninge r i form af hypo- tension. | Dyrestudier viser stagnerende fostervækst. Bivirkning ifa. hypotension kunne teoretisk have konsekvenser for fostret, men dette er ikke
velundersøgt. |
https://pro.medicin.dk/Laegemiddelgrupp er/Grupper/318427 https://janusmed.se/fosterpaverkan?nslIds
=IDE4POGTUB63EVERT1 |
| Benzo- diazepin | Kortvarig lavdosisbehan dling er næppe af betydning, fx som beroligende præ eller postoperativt.
Benzodiazepin er indebærer muligvis en let forøget risiko for misdannelser i . |
https://pro.medicin.dk/Laegemiddelgrupp er/Grupper/239010 https://janusmed.se/fosterpaverkan?nslIds
=IDE4POCAU9E2EVERT1 |
|
Ved brug i 3. trimester kan nogle børn enten udvise “Floppy Child Syndrom” (tremor, irritabilitet, sutteprobleme r) eller have abstinenssymp tomer. Enkeltdosering er af diazepam op til 30 mg kort før fødslen har ikke vist negativ effekt vurderet ved Apgar score. |
||||
| Postoperativ e fascie blokader, fx TQL/TAP) | Frarådes, da serumkoncen trationen risikerer at blive høj og lokalanæstes tica kan opkoncentrer
es i foster |
Se kap 8 |
Postoperativ kvalmestillende
Man må tilstræbe lavest mulige dosis i kortest mulig tid.
| Medikament | Dosis | Maternelle
forbehold |
Føtale/neonatale
forbehold |
Referencer |
| Ondansetron | Kan | Risikoen for | DSOG guideline: ”Hyperemesis | |
| bruges i | hjertemisdannelse | gravidarum” | ||
| vanlig | r er ikke verificeret | https://pro.medicin.dk/Medicin/Praepa | ||
| dosis i få | og risikoen for | rater/8582 | ||
| dage ved | læbeganespalte i | https://janusmed.se/fosterpaverkan?ns | ||
| behov, | absolutte tal er | lIds=IDE4POGTUB69IVERT1 | ||
| bør dog | meget lav og kun |
| ikke være
1. valg. |
fundet ved længere behandlings varighed | https://www.ema.europa.eu/en/docum ents/prac-recommendation/prac- recommendations-signals-adopted-8- 11-july-2019-prac-meeting_en.pdf | ||
| Metoclopra | Kan | Ekstrapyramid | Velundersøgt ift. | DSOG guideline: ”Hyperemesis |
| mid | bruges i | ale | fostermisdannelse | gravidarum” |
| vanlig | bivirkninger | r, hvilket ikke giver | https://janusmed.se/fosterpaverkan?np | |
| dosis ved | mistanke om øget | lIds=20151013000045 | ||
| behov. | risiko. | |||
| Forsigtighed | ||||
| tilrådes ved | ||||
| anvendelse i 3. | ||||
| trimester grundet | ||||
| risiko for | ||||
| abstinenssympto | ||||
| mer. | ||||
| Antihistamin | Kan | Ved behov for | DSOG guideline: ”Hyperemesis | |
| bruges i | forløsning ses | gravidarum” | ||
| vanlig | risiko for sedation | |||
| dosis ved | af barnet efter | |||
| behov. | brug af sløvende | |||
| Kan | antihistaminer, | |||
| bruges i | halveringstid mm. | |||
| hele | må undersøges for | |||
| graviditet | det specifikt | |||
| en, dog | anvendte | |||
| forsigtigh | præparat. | |||
| ed ved | ||||
| sløvende | ||||
| antihista | ||||
| miner | ||||
| pga. | ||||
| fosterpåv | ||||
| irkning. | ||||
| Dexamethas | Kan | Leukocytose | Præparatafhængig | https://janusmed.se/fosterpaverkan?np |
| on | bruges i | Hyperglykæmi | t om steroid | lIds=20131010000279 |
| vanlig | /nedsat | krydser blod- | ||
| dosis ved | glukosetolera | placenta barrieren | ||
| behov. | nce | |||
| Kan | ||||
| bruges i | ||||
| hele | ||||
| graviditet | ||||
| en. | ||||
| Droperidol | Utilstræk | https://janusmed.se/fosterpaverkan?ns | ||
| (DHB) | keligt | lIds=IDE4POCFU9HJLVERT1 | ||
| data, bør | https://pro.medicin.dk/Medicin/Praepa | |||
| ikke være | rater/4785 |
| første
valg |
10. Referencer
- Foley MR. Maternal adaptations to pregnancy: Cardiovascular and hemodynamic changes [Internet]. uptodate.com. 2021. p. 1–25. Available from: https://www.uptodate.com.acs.hcn.com.au/contents/maternal-adaptations-to-pregnancy- cardiovascular-and-hemodynamic-changes?search=pregnancy changes&topicRef=429&source=related_link#H4128796442
- Maternal adaptations to pregnancy: Hematologic changes – UpToDate [Internet]. [cited 2021 Apr 29]. Available from: https://uptodate.com/contents/maternal-adaptations-to-pregnancy- hematologic-changes?csi=a7a9fc7b-2c84-40cb-88b1-160aaf083d98&source=contentShare
- Hegewald MJ, Crapo RO. Respiratory Physiology in Pregnancy. Clinics in Chest Medicine [Internet]. 2011;32(1):1–13. Available from: http://dx.doi.org/10.1016/j.ccm.2010.11.001
- Maternal adaptations to pregnancy: Dyspnea and other physiologic respiratory changes – UpToDate [Internet]. [cited 2021 Apr 29]. Available from: https://uptodate.com/contents/maternal- adaptations-to-pregnancy-dyspnea-and-other-physiologic-respiratory-changes?csi=75c171ed-4284- 43ad-84c1-a5d9451f6abe&source=contentShare
- PROWSE CM, GAENSLER EA. RESPIRATORY AND ACID-BASE CHANGES DURING PREGNANCY. Anesthesiology [Internet]. 1965 [cited 2021 Dec 12];26:381–92. Available from: https://pubmed.ncbi.nlm.nih.gov/14313450/
- Hegewald MJ, Crapo RO. Respiratory Physiology in Pregnancy. Clinics in Chest Medicine. 2011;32(1):1–13.
- Maternal adaptations to pregnancy: Dyspnea and other physiologic respiratory changes – UpToDate [Internet]. [cited 2021 Apr 29]. Available from: https://uptodate.com/contents/maternal- adaptations-to-pregnancy-dyspnea-and-other-physiologic-respiratory-changes?csi=75c171ed-4284- 43ad-84c1-a5d9451f6abe&source=contentShare
- Bianco A. Maternal adaptations to pregnancy: Gastrointestinal tract – UpToDate [Internet]. 2021 [cited 2021 Apr 29]. Available from: https://www.uptodate.com/contents/maternal-adaptations-to-pregnancy-gastrointestinal- tract?csi=d2e15463-2977-477e-922c-3b680691699a&source=contentShare
- Cheung KL, Lafayette RA. Renal Physiology of 2013;
- Maternal adaptations to pregnancy: Renal and urinary tract physiology – UpToDate [Internet]. [cited 2021 Apr 29]. Available from: https://uptodate.com/contents/maternal-adaptations-to- pregnancy-renal-and-urinary-tract-physiology?csi=16b4feb8-987f-423c-aed5- b4b512a54cef&source=contentShare
- Meo SA, Hassain A. Metabolic Physiology in Pregnancy. J Pak Med Assoc. 2016 Sep 1;66(9 Suppl 1):S8–10.
- Bauchat JR, van de Velde M. Nonobstetric Surgery during Pregnancy. In: Chestnut’s Obstetric Anesthesia [Internet]. Sixth Edit. Elsevier Inc.; 2019. p. 368–91. Available from: https://doi.org/10.1016/B978-0-323-56688-9.00017-X
- Ngan Kee WD. Uteroplacental Blood Flow. In: Chestnut’s Obstetric Anesthesia [Internet]. Sixth Edit. Elsevier ; 2019. p. 38–55. Available from: https://doi.org/10.1016/B978-0-323-56688-9.00003-X
- Gropper M, Eriksson LI, Fleisher LA, Wiener-Kronish JP, Cohen NH, Leslie K. Miller’s Anesthesia. 9th 2019.
- Moaddab A, Dildy GA, Brown HL, Bateni ZH, Belfort MA, Sangi-Haghpeykar H, et al. Health Care Disparity and State-Specific Pregnancy-Related Mortality in the United States, 2005–2014. Obstetrics & Gynecology [Internet]. 2016 Oct 1 [cited 2021 Apr 20];128(4):869–75. Available from: https://journals.lww.com/00006250-201610000-00025
- Huang SY, Lo PH, Liu WM, Cherng YG, Yeh CC, Chen TL, et al. Outcomes After Nonobstetric Surgery in Pregnant Patients: A Nationwide Study. Mayo Clinic Proceedings [Internet]. 2016 Sep 1 [cited 2021 Apr 20];91(9):1166–72. Available from: http://www.mayoclinicproceedings.org/article/S0025619616303603/fulltext
- Kuy SR, Roman SA, Desai R, Sosa JA. Outcomes following cholecystectomy in pregnant and nonpregnant women. Surgery [Internet]. 2009 Aug 1 [cited 2021 Apr 20];146(2):358–66. Available from: http://www.surgjournal.com/article/S0039606009002530/fulltext
- Silvestri MT, Pettker CM, Brousseau EC, Dick MA, Ciarleglio MM, Erekson EA. Morbidity of Appendectomy and Cholecystectomy in Pregnant and Nonpregnant Women. Obstetrics & Gynecology [Internet]. 2011 Dec [cited 2021 Apr 20];118(6):1261–70. Available from: https://journals.lww.com/00006250-201112000-00009
- Moore HB, Juarez-Colunga E, Bronsert M, Hammermeister KE, Henderson WG, Moore EE, et al. Effect of pregnancy on adverse outcomes after general surgery. JAMA Surgery. 2015 Jul 1;150(7):637–43.
- Abbasi N, Patenaude V, Abenhaim H. Management and outcomes of acute appendicitis in pregnancy-population-based study of over 7000 cases. BJOG: An International Journal of Obstetrics & Gynaecology [Internet]. 2014 Nov 1 [cited 2021 Apr 20];121(12):1509–14. Available from: http://doi.wiley.com/10.1111/1471-0528.12736
- ACOG Committee Opinion No. 775: Nonobstetric Surgery During Pregnancy. Obstetrics & Gynecology [Internet]. 2019 Apr 1 [cited 2021 Apr 20];133(4):e285–6. Available from: https://journals.lww.com/00006250-201904000-00060
- FDA Warnings Regarding Use of General Anesthetics and Sedation Drugs in Young Children and Pregnant Women | ACOG [Internet]. [cited 2021 Apr 20]. Available from: https://acog.org/clinical/clinical-guidance/practice-advisory/articles/2016/12/fda-warnings- general-anesthetics-sedation-drugs-young-children-pregnant-women
- Warner DO, Zaccariello MJ, Katusic SK, Schroeder DR, Hanson AC, Schulte PJ, et al. Neuropsychological and behavioral outcomes after exposure of young children to procedures requiring general anesthesia: The mayo anesthesia safety in kids (MASK) study. Anesthesiology [Internet]. 2018 Jul 1 [cited 2021 Apr 20];129(1):89–105. Available from: http://links.lww.
- McCann ME, Berde C, Soriano S, Marmor J, Bellinger D, de Graaff JC, et al. Neurodevelopmental outcome at 5 years of age after general anaesthesia or awake-regional anaesthesia in infancy (GAS): an international, multicentre, randomised, controlled equivalence trial. The Lancet [Internet]. 2019 Feb 16 [cited 2021 Apr 20];393(10172):664–77. Available from: www.thelancet.com
- Sun LS, Li G, Miller TLK, Salorio C, Byrne MW, Bellinger DC, et al. Association between a single general anesthesia exposure before age 36 months and neurocognitive outcomes in later childhood. JAMA – Journal of the American Medical 2016 Jun 7;315(21):2312–20.
- Cohen-Kerem R, Railton C, Oren D, Lishner M, Koren G. Pregnancy outcome following non-obstetric surgical intervention. American Journal of Surgery [Internet]. 2005 Sep 1 [cited 2021 Apr 20];190(3):467–73. Available from: http://www.americanjournalofsurgery.com/article/S0002961005005015/fulltext
- Fisher SC, Siag K, Howley MM, van Zutphen AR, Reefhuis J, Browne ML. Maternal surgery and anesthesia during pregnancy and risk of birth defects in the National Birth Defects Prevention Study, 1997–2011. Birth Defects 2020 Jan 15;112(2):162–74.
- Mazze RI, Källén B. Reproductive outcome after anesthesia and operation during pregnancy: A Registry study of 5405 cases. American Journal of Obstetrics and Gynecology [Internet]. 1989 Nov 1 [cited 2021 Apr 20];161(5):1178–85. Available from: http://www.ajog.org/article/0002937889906595/fulltext
- Czeizel AE, Pataki T, Rockenbauer M. Reproductive outcome after exposure to surgery under anesthesia during pregnancy. Archives of Gynecology and Obstetrics [Internet]. 1998 Aug [cited 2021 Apr 20];261(4):193–9. Available from: https://link.springer.com/article/10.1007/s004040050221
- Visser BC, Glasgow RE, Mulvihill KK, Mulvihill SJ. Safety and Timing of Nonobstetric Abdominal Surgery in Pregnancy. Digestive Surgery [Internet]. 2001 [cited 2021 Apr 20];18(5):409–17. Available from: https://karger.com/Article/FullText/50183
- Duncan PG, Pope WDB, Cohen MM, Greer N. Fetal risk of anesthesia and surgery during pregnancy. Anesthesiology [Internet]. 1986 Jun 1 [cited 2021 Apr 20];64(6):790–4. Available from: http://pubs.asahq.org/anesthesiology/article-pdf/64/6/790/311873/0000542-198606000- pdf
- Balinskaite V, Bottle A, Sodhi V, Rivers A, Bennett PR, Brett SJ, et al. The Risk of Adverse Pregnancy Outcomes Following Nonobstetric Surgery during Pregnancy. Annals of Surgery [Internet]. 2017 Aug 1 [cited 2021 May 19];266(2):260–6. Available from: https://pubmed.ncbi.nlm.nih.gov/27617856/
- Aylin P, Bennett P, Bottle A, Brett S, Sodhi V, Rivers A, et al. Estimating the risk of adverse birth outcomes in pregnant women undergoing non-obstetric surgery using routinely collected NHS data: an observational study. Health Services and Delivery Research [Internet]. 2016 Oct [cited 2021 Apr 20];4(29):1–76. Available from: https://ncbi.nlm.nih.gov/books/NBK390252/
- Rasmussen AS, Christiansen CF, Ulrichsen SP, Uldbjerg N, Nørgaard M. Non‐obstetric abdominal surgery during pregnancy and birth outcomes: A Danish registry‐based cohort study. Acta Obstetricia et Gynecologica Scandinavica [Internet]. 2020 Apr 1 [cited 2021 Apr 20];99(4):469–76. Available from: https://onlinelibrary.wiley.com/doi/abs/10.1111/aogs.13775
- Balinskaite V, Bottle A, Sodhi V, Rivers A, Bennett PR, Brett SJ, et al. The Risk of Adverse Pregnancy Outcomes Following Nonobstetric Surgery during Pregnancy. Annals of Surgery. 2017 Aug 1;266(2):260–6.
- Devroe S, Bleeser T, Van de Velde M, Verbrugge L, De Buck F, Deprest J, et al. Anesthesia for non- obstetric surgery during pregnancy in a tertiary referral center: a 16-year retrospective, matched case-control, cohort International Journal of Obstetric Anesthesia. 2019 Aug 1;39:74–81.
- Fatum M, Rojansky N. Laparoscopic surgery during pregnancy [Internet]. Vol. 56, Obstetrical and Gynecological Survey. Obstet Gynecol Surv; 2001 [cited 2021 Apr 20]. p. 50–9. Available from: https://pubmed.ncbi.nlm.nih.gov/11140864/
- Sviggum H. Anesthesia for nonobstetric surgery during pregnancy [Internet]. uptodate.com. 2021 [cited 2021 Apr 3]. p. 1–31. Available from: https://www.uptodate.com/contents/anesthesia- for-nonobstetric-surgery-during-pregnancy?search=non obstetric surgery during pregnancy&source=search_result&selectedTitle=2~150&usage_type=default&display_rank=2
- Farber Aspiration: Risk, Prophylaxis, and Treatment. In: Chestnut’s Obstetric Anesthesia. Sixth Edit. Elsevier Inc.; 2019. p. 671–91.
- Bianco A. Maternal adaptations to pregnancy: Gastrointestinal tract – UpToDate [Internet]. 2021 [cited 2021 Apr 29]. Available from: https://www.uptodate.com/contents/maternal-adaptations-to-pregnancy-gastrointestinal- tract?csi=d2e15463-2977-477e-922c-3b680691699a&source=contentShare
- Bauchat JR, Van De Velde Nonobstetric Surgery during Pregnancy. In: Chestnut’s Obstetric Anesthesia. Sixth Edit. Elsevier Inc.; 2019. p. 368–91.
- Sviggum H. Anesthesia for nonobstetric surgery during pregnancy [Internet]. uptodate.com. 2021 [cited 2021 Apr 3]. p. 1–31. Available from: https://www.uptodate.com/contents/anesthesia- for-nonobstetric-surgery-during-pregnancy?search=non obstetric surgery during pregnancy&source=search_result&selectedTitle=2~150&usage_type=default&display_rank=2
- Farber Aspiration: Risk, Prophylaxis, and Treatment. In: Chestnut’s Obstetric Anesthesia. Sixth Edit. Elsevier Inc.; 2019. p. 671–91.
- Paranjothy S, Griffiths JD, Broughton HK, Gyte GML, Brown HC, Thomas J. Interventions at caesarean section for reducing the risk of aspiration pneumonitis. Cochrane Database of Systematic Reviews. 2014;2014(2).
- Paranjothy S, Griffiths JD, Broughton HK, Gyte GML, Brown HC, Thomas J. Interventions at caesarean section for reducing the risk of aspiration pneumonitis. Cochrane Database of Systematic Reviews. 2014;2014(2).
- Fujita N, Higuchi H, Sakuma S, Takagi S, Latif MAHM, Ozaki M. Effect of Right-Lateral Versus Left- Lateral Tilt Position on Compression of the Inferior Vena Cava in Pregnant Women Determined by Magnetic Resonance Imaging. In: Anesthesia and Analgesia. Lippincott Williams and Wilkins; 2019. 1217–22.
- Hughes EJ, Price AN, McCabe L, Hiscocks S, Waite L, Green E, et al. The effect of maternal position on venous return for pregnant women during NMR in Biomedicine. 2021 Apr;34(4).
- Kinsella SM; Supine hypotensive syndrome. Obstet Gynecol. 1994;May(83):774–88.
- Dennis AT, Buckley A, Mahendrayogam T, Castro JM, Leeton L. Echocardiographic determination of resting haemodynamics and optimal positioning in term pregnant women. Anaesthesia. 2018 Nov;73(11):1345–52.
- Ravindra GL, Madamangalam AS, Seetharamaiah S. Anaesthesia for non-obstetric surgery in obstetric Indian Journal of Anaesthesia. 2018;62(9):710–6.
- Cho S, Chung RK, Jin SH. Factors affecting maternal and fetal outcomes of non-obstetric surgery and anesthesia during pregnancy: A retrospective review of data at a single tertiary university hospital. Journal of Korean Medical 2020 Apr 1;35(16).
- Pearl JP, Price RR, Tonkin AE, Richardson WS, Stefanidis D. SAGES guidelines for the use of laparoscopy during Surg Endosc [Internet]. 2017 Oct 1 [cited 2022 Mar 5];31(10):3767–
- Available from: https://pubmed.ncbi.nlm.nih.gov/28643072/
- Okeagu CN, Anandi P, Gennuso S, Hyatali F, Stark CW, Prabhakar A, et al. Clinical management of the pregnant patient undergoing non-obstetric surgery: Review of guidelines. Vol. 34, Best Practice and Research: Clinical Bailliere Tindall Ltd; 2020. p. 269–81.
- Vasco Ramirez M, Valencia G CM. Anesthesia for Nonobstetric Surgery in Pregnancy. Clinical Obstetrics and 2020 Jun 1;63(2):351–63.
- Saravanakumar K, Rao SG, Cooper GM. Obesity and obstetric anaesthesia. Anaesthesia. 2006 Jan;61(1):36–48.
- Juvin P, Lavaut E, Dupont H, Lefevre P, Demetriou M, Dumoulin JL, et al. Difficult Tracheal Intubation Is More Common in Obese Than in Lean Patients. Anesthesia & Analgesia. 2003 Aug 1;97(2):595–
- Lundstrøm LH, Møller AM, Rosenstock C, Astrup G, Wetterslev J. High body mass index is a weak predictor for difficult and failed tracheal intubation: A cohort study of 91,332 consecutive patients scheduled for direct laryngoscopy registered in the danish anesthesia database. Anesthesiology. 2009 Feb 1;110(2):266–74.
- Saving Mothers’ Lives: Reviewing maternal deaths to make motherhood safer: 2006-2008. BJOG: An International Journal of Obstetrics & 2011 Mar;118:1–203.
- Mushambi MC, Kinsella SM, Popat M, Swales H, Ramaswamy KK, Winton AL, et Obstetric Anaesthetists’ Association and Difficult Airway Society guidelines for the management of difficult and failed tracheal intubation in obstetrics. Vol. 70, Anaesthesia. Blackwell Publishing Ltd; 2015. p. 1286–306.
- Mitchell V, Dravid R, Patel A, Swampillai C, Higgs A. Difficult Airway Society Guidelines for the management of tracheal Anaesthesia. 2012 Mar 1;67(3):318–40.
- Apfelbaum JL, Hagberg CA, Caplan RA, Connis RT, Nickinovich DG, Benumof JL, et al. Practice guidelines for management of the difficult airway: An updated report by the American Society of Anesthesiologists Task Force on Management of the Difficult Airway. Vol. 118, Anesthesiology. American Society of Anesthesiologists; p. 251–70.
- Hawkins JL, Chang J, Palmer SK, Gibbs CP, Callaghan WM. Anesthesia-Related Maternal Mortality in the United States: 1979–2002. Obstetrics & Gynecology [Internet]. 2011 Jan [cited 2021 Mar 8];117(1):69–74. Available from: https://journals.lww.com/00006250-201101000-00011
- Pulmonary Physiology and Airway Management | GLOWM [Internet]. [cited 2022 Mar 18]. Available from: https://glowm.com/section-view/item/169#.YjRr-BDMK3I
- Kinsella SM, Winton AL, Mushambi MC, Ramaswamy K, Swales H, Quinn AC, et al. Failed tracheal intubation during obstetric general anaesthesia: a literature review. International Journal of Obstetric 2015;24:356–74.
- Kinsella SM, Winton AL, Mushambi MC, Ramaswamy K, Swales H, Quinn AC, et al. Failed tracheal intubation during obstetric general anaesthesia: a literature review. International Journal of Obstetric Anesthesia [Internet]. 2015 [cited 2021 Mar 9];24:356–74. Available from: http://dx.doi.org/10.1016/j.ijoa.2015.06.008
- Lundstrøm LH, Møller AM, Rosenstock C, Astrup G, Wetterslev J. High body mass index is a weak predictor for difficult and failed tracheal intubation: A cohort study of 91,332 consecutive patients scheduled for direct laryngoscopy registered in the danish anesthesia database. Anesthesiology [Internet]. 2009 Feb 1 [cited 2021 Mar 9];110(2):266–74. Available from: http://pubs.asahq.org/anesthesiology/article-pdf/110/2/266/491003/0000542-200902000- pdf
- Rocke DA, Murray WB, Rout CC, Gouws E. Relative risk analysis of factors associated with difficult intubation in obstetric Anesthesiology. 1992 Jul 1;77(1):67–73.
- Mcclaine RJ, Uemura K, de La Fuente SG, Manson RJ, Booth J v, White WD, et al. General anesthesia improves fetal cerebral oxygenation without evidence of subsequent neuronal injury. Journal of Cerebral Blood Flow & Metabolism [Internet]. 2005 [cited 2021 Mar 8];25:1060–9. Available from: jcbfm.com
- Russell EC, Wrench I, Feast M, Mohammed F. Pre-oxygenation in pregnancy: The effect of fresh gas flow rates within a circle breathing Anaesthesia. 2008 Aug;63(8):833–6.
- Dixon BJ, Dixon JB, Carden JR. Preoxygenation Is More Effective in the 25° Head-up Position Than in the Supine Position in Severely Obese Patients A Randomized Controlled Study [Internet]. Vol. 102, 2005 [cited 2021 Mar 10]. Available from: www.anesthesiology.org.
- Hignett R, Fernando R, McGlennan A, McDonald S, Stewart A, Columb M, et al. A Randomized Crossover Study to Determine the Effect of a 30° Head-Up Versus a Supine Position on the Functional Residual Capacity of Term Parturients. Anesthesia & Analgesia [Internet]. 2011 Nov [cited 2021 Apr 3];113(5):1098–102. Available from: http://journals.lww.com/00000539-201111000- 00026
- Mir F, Patel A, Iqbal R, Cecconi M, Nouraei SAR. A randomised controlled trial comparing transnasal humidified rapid insufflation ventilatory exchange (THRIVE) pre-oxygenation with facemask pre- oxygenation in patients undergoing rapid sequence induction of anaesthesia. Anaesthesia. 2017 Apr 1;72(4):439–43.
- Blitt CD, Petty WC, Alberternst EE, Wright BJ. Correlation of plasma cholinesterase activity and duration of action of succinylcholine during pregnancy. Anesthesia and Analgesia [Internet]. 1977 [cited 2021 Mar 15];56(1):78–83. Available from: https://pubmed.ncbi.nlm.nih.gov/556913/
- Donati F. The Right Dose of Succinylcholine [Internet]. Vol. 99, Anesthesiology. American Society of Anesthesiologists; 2003 [cited 2021 Mar 15]. p. 1037–8. Available from: http://pubs.asahq.org/anesthesiology/article-pdf/99/5/1037/337797/0000542-200311000- pdf
- Naguib M, Samarkandi A, Riad W, Alharby SW. Optimal Dose of Succinylcholine Revisited. Anesthesiology [Internet]. 2003 Nov 1 [cited 2021 Mar 15];99(5):1045–9. Available from: http://pubs.asahq.org/anesthesiology/article-pdf/99/5/1045/338390/0000542-200311000-pdf
- Stourac P, Adamus M, Seidlova D, Pavlik T, Janku P, Krikava I, et al. Low-Dose or High-Dose Rocuronium Reversed with Neostigmine or Sugammadex for Cesarean Delivery Anesthesia. Anesthesia & Analgesia [Internet]. 2016 May 1 [cited 2021 Mar 15];122(5):1536–45. Available from: http://journals.lww.com/00000539-201605000-00043
- Tran DTT, Newton EK, Mount VAH, Lee JS, Wells GA, Perry JJ. Rocuronium versus succinylcholine for rapid sequence induction intubation. Vol. 2015, Cochrane Database of Systematic Reviews. John Wiley and Sons Ltd;
- Episode 160: Non-OB Surgery in Pregnancy With Dave Berman – ACCRAC Podcast [Internet]. [cited 2021 Dec 10]. Available from: http://accrac.com/episode-160-non-ob-surgery-in-pregnancy-with- dave-berman/
- Auron M, Duran Castillo MY, Garcia OFD. Perioperative management of pregnant women undergoing nonobstetric surgery. Vol. 88, Cleveland Clinic journal of medicine. NLM (Medline); p. 27–34.
- Lapinsky S. The Continuous Textbook of Women’s Glob. lib. women’s med. 2021.
- Ernesto DT, Tania ML, Manuel GGA, Jorge LF, Orlando PNR, Jorge CMD, et al. Considerations for Mechanical Ventilation in the Critically III Obstetric Patient. Critical Care Obstetrics and Gynecology [Internet]. 2020 [cited 2021 Aug 11];6(4). Available from: https://obstetrics.imedpub.com/
- Halaseh BK, Sukkar ZF, Haj Hassan L, Sia ATH, Bushnaq WA, Adarbeh H. The use of ProSeal laryngeal mask airway in caesarean section – Experience in 3000 cases. Anaesthesia and Intensive Care [Internet]. 2010 Nov 16 [cited 2021 Mar 15];38(6):1023–8. Available from: http://journals.sagepub.com/doi/10.1177/0310057X1003800610
- Yao WY, Li SY, Sng BL, Lim Y, Sia ATH. The LMA SupremeTM in 700 parturients undergoing Cesarean delivery: An observational study. Canadian Journal of Anesthesia [Internet]. 2012 Jul 4 [cited 2021 Mar 15];59(7):648–54. Available from: https://link.springer.com/article/10.1007/s12630-012-9718-4
- White LD, Thang C, Hodsdon A, Melhuish TM, Barron FA, Godsall MG, et al. Comparison of Supraglottic Airway Devices With Endotracheal Intubation in Low-Risk Patients for Cesarean Delivery: Systematic Review and Meta-analysis. Anesthesia & Analgesia [Internet]. 2020 Oct 8 [cited 2021 Apr 3];131(4):1092–101. Available from: https://journals.lww.com/10.1213/ANE.0000000000004618
- Halaseh BK, Sukkar ZF, Haj Hassan L, Sia ATH, Bushnaq WA, Adarbeh H. The use of ProSeal laryngeal mask airway in caesarean section – Experience in 3000 cases. Anaesthesia and Intensive Care [Internet]. 2010 Nov 16 [cited 2021 Mar 15];38(6):1023–8. Available from: http://journals.sagepub.com/doi/10.1177/0310057X1003800610
- Keller C, Brimacombe J, Lirk P, P??hringer F. Failed Obstetric Tracheal Intubation and Postoperative Respiratory Support with the ProSeal??? Laryngeal Mask Airway. Anesthesia & Analgesia [Internet]. 2004 May [cited 2021 Mar 15];98(5):1467–70. Available from: http://journals.lww.com/00000539- 200405000-00049
- Sharma B, Sahai C, Sood J, Kumra VP. The ProSeal laryngeal mask airway in two failed obstetric tracheal intubation scenarios [Internet]. Vol. 15, International Journal of Obstetric Anesthesia. Elsevier; 2006 [cited 2021 Mar 15]. p. 338–9. Available from: http://www.obstetanesthesia.com/article/S0959289X06000951/fulltext
- Quinn AC, Milne D, Columb M, Gorton H, Knight M. Failed tracheal intubation in obstetric anaesthesia: 2 yr national case–control study in the UK. British Journal of Anaesthesia. 2012;110:74–80.
- Benumof JL. Laryngeal mask airway and the ASA difficult airway algorithm [Internet]. Vol. 84, American Society of Anesthesiologists; 1996 [cited 2021 Mar 15]. p. 686–99. Available from: http://pubs.asahq.org/anesthesiology/article-pdf/84/3/686/376434/0000542- 199603000-00024.pdf
- Joo HS, Rose DK. The Intubating Laryngeal Mask Airway With and Without Fiberoptic Guidance. Anesthesia & Analgesia [Internet]. 1999 Mar [cited 2021 Mar 15];88(3):662–6. Available from: http://journals.lww.com/00000539-199903000-00036
- Minville V, N???Guyen L, Coustet B, Fourcade O, Samii K. Difficult Airway in Obstetric Using Ilma- Fastrach?? Anesthesia & Analgesia [Internet]. 2004 Dec [cited 2021 Mar 15];99(6):1873. Available from: http://journals.lww.com/00000539-200412000-00063
- SAMSOON GLT, YOUNG JRB. Difficult tracheal intubation: a retrospective study. Anaesthesia. 1987;42(5):487–90.
- Russell R, Popat The Difficult Airway : Risk , Assessment , Prophylaxis , and Management [Internet]. Sixth Edit. Vol. 000, Chestnut’s Obstetric Anesthesia: Principles and Practice. Elsevier Inc.; 2016. 684–712 p. Available from: http://dx.doi.org/10.1016/B978-1-4557-4866-2.00030-4
- Ravindra GL, Madamangalam AS, Seetharamaiah S. Anaesthesia for non-obstetric surgery in obstetric patients. Indian Journal of Anaesthesia [Internet]. 2018 [cited 2021 Jan 19];62(9):710–6. Available from: https://ncbi.nlm.nih.gov/pmc/articles/PMC6144550/
- El-Orbany M, Woehlck H, Salem MR. Head and Neck Position for Direct Laryngoscopy. Anesthesia & Analgesia [Internet]. 2011 Jul [cited 2021 Mar 10];113(1):103–9. Available from: http://journals.lww.com/00000539-201107000-00019
- Sviggum H. Anesthesia for nonobstetric surgery during pregnancy [Internet]. uptodate.com. 2021 [cited 2021 Apr 3]. p. 1–31. Available from: https://www.uptodate.com/contents/anesthesia- for-nonobstetric-surgery-during-pregnancy?search=non obstetric surgery during pregnancy&source=search_result&selectedTitle=2~150&usage_type=default&display_rank=2
- Haggerty E, Daly J. Anaesthesia and non-obstetric surgery in pregnancy. BJA Education [Internet]. 2021 Feb 1 [cited 2021 May 19];21(2):42–3. Available from: https://pubmed.ncbi.nlm.nih.gov/33889428/
- Mushambi MC, Kinsella SM, Popat M, Swales H, Ramaswamy KK, Winton AL, et Obstetric Anaesthetists’ Association and Difficult Airway Society guidelines for the management of difficult and failed tracheal intubation in obstetrics. Vol. 70, Anaesthesia. Blackwell Publishing Ltd; 2015. p. 1286–306.
- Lewis SR, Butler AR, Parker J, Cook TM, Smith AF. Videolaryngoscopy versus direct laryngoscopy for adult patients requiring tracheal intubation [Internet]. Vol. 2016, Cochrane Database of Systematic John Wiley and Sons Ltd; 2016 [cited 2021 Mar 15]. Available from: https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD011136.pub2/full
- Med Sci TJ, Arici S, Karaman S, Doğru S, Karaman T, Tapar H, et al. Turkish Journal of Medical Sciences The McGrath Series 5 video laryngoscope versus the Macintosh laryngoscope: a randomized trial in obstetric patients. [cited 2021 Mar 15]; Available from: http://journals.tubitak.gov.tr/medical/
- Scott-Brown S, Russell R. Video laryngoscopes and the obstetric airway [Internet]. Vol. 24, International Journal of Obstetric Anesthesia. Churchill Livingstone; 2015 [cited 2021 Mar 15]. p. 137–46. Available from: http://www.obstetanesthesia.com/article/S0959289X15000229/fulltext
- Mhyre JM. A Series of Anesthesia-related Maternal Deaths in Michigan, 1985-2003 [Internet]. Vol. 106, Anesthesiology. 2007 [cited 2021 Apr 20]. Available from: http://www.cdc.gov/reproductivehealth/MCHEpi/
- Auroy Y, Benhamou D, Péquignot F, Bovet M, Jougla E, Lienhart A. Mortality related to anaesthesia in France: analysis of deaths related to airway complications. Anaesthesia [Internet]. 2009 Apr 1 [cited 2021 Mar 15];64(4):366–70. Available from: http://doi.wiley.com/10.1111/j.1365- 2008.05792.x
- Peterson GN, Domino KB, Caplan RA, Posner KL, Lee LA, Cheney FW. Management of the Difficult Airway A Closed Claims Analysis [Internet]. Vol. 103, Anesthesiology. 2005 [cited 2021 Mar 15]. Available from: http://data.bls.gov/cgi-bin/cpicalc.pl.
- NAP4: Major Complications of Airway Management in the United Kingdom – The National Institute of Academic Anaesthesia [Internet]. [cited 2021 Mar 17]. Available from: https://nationalauditprojects.org.uk/NAP4_home?newsid=463#pt
- Mitchell V, Dravid R, Patel A, Swampillai C, Higgs A. Difficult Airway Society Guidelines for the management of tracheal extubation. Anaesthesia [Internet]. 2012 Mar 1 [cited 2021 Mar 8];67(3):318–40. Available from: http://doi.wiley.com/10.1111/j.1365-2044.2012.07075.x
- Popat M, Russell R. Awake fibreoptic intubation following previous failed intubation [5] [Internet]. 10, International Journal of Obstetric Anesthesia. Churchill Livingstone; 2001 [cited 2021 Mar 15]. p. 332–3. Available from: https://pubmed.ncbi.nlm.nih.gov/15321600/
- Harwood TN. Fiberoptic Endoscopy and the Difficult Airway, 2nd edition . Anesthesiology [Internet]. 1998 Feb 1 [cited 2021 Mar 15];88(2):555–6. Available from: http://pubs.asahq.org/anesthesiology/article-pdf/88/2/555/384669/0000542-199802000- 00050.pdf
- Benumof JL. Management of the difficult adult airway: With special emphasis on awake tracheal Vol. 75, Anesthesiology. 1991. p. 1087–110.
- Okeagu CN, Anandi P, Gennuso S, Hyatali F, Stark CW, Prabhakar A, et al. Clinical management of the pregnant patient undergoing non-obstetric surgery: Review of guidelines. Best Practice and Research: Clinical Anaesthesiology [Internet]. 2020;34(2):269–81. Available from: https://doi.org/10.1016/j.bpa.2020.04.004
- Ngan Kee WD, Khaw KS. Vasopressors in obstetrics: What should we be using? Current Opinion in 2006;19(3):238–43.
- Reitman E, Flood P. Anaesthetic considerations for non-obstetric surgery during pregnancy. British Journal of Anaesthesia. 2011;107(SUPPL. 1):72–8.
- Lee A, Ngan Kee WD, Gin T. A quantitative, systematic review of randomized controlled trials of ephedrine versus phenylephrine for the management of hypotension during spinal anesthesia for cesarean Anesthesia and Analgesia. 2002;94(4):920–6.
- Bridwell RE, Carius BM, Long B, Oliver JJ, Schmitz G. Sepsis in Pregnancy: Recognition and Western Journal of Emergency Medicine [Internet]. 2019 [cited 2021 Sep 30];20(5):822. Available from: /pmc/articles/PMC6754194/
- Morgan J, Roberts S. Maternal Sepsis. Obstetrics and Gynecology Clinics of North America. 2013 Mar 1;40(1):69–87.
- Neligan PJ, Laffey JG. Clinical review: Special populations – critical illness and pregnancy. Critical Care [Internet]. 2011 Aug 12 [cited 2021 Sep 30];15(4):227. Available from: /pmc/articles/PMC3387584/
- D VN, DC D. The action of vasopressors on isolated uterine arteries. Am J Obstet Gynecol [Internet]. 1974 Apr 15 [cited 2021 Sep 30];118(8):1099–103. Available from: https://pubmed.ncbi.nlm.nih.gov/4817644/
- Astrid International Society of Blood Transfusion. 8. Obstetric anaemia. www.isbtweb.org.
- Norfolk (Editor) D. Joint United Kingdom (UK) Blood Transfusion and Tissue Transplantation Services Professional Advisory Committee. Transfusion Handbook. 9.3: Red cell transfusion in pregnancy. transfusionguidelines.org.
- McPherson C, Inder T. Perinatal and neonatal use of sedation and analgesia [Internet]. Vol. 22, Seminars in Fetal and Neonatal Medicine. W.B. Saunders Ltd; 2017 [cited 2021 May 19]. p. 314–20. Available from: https://pubmed.ncbi.nlm.nih.gov/28734732/
- Vujic J, Marsoner K, Lipp-Pump AH, Klaritsch P, Mischinger HJ, Kornprat P. Non-obstetric surgery during pregnancy – An eleven-year retrospective analysis. BMC Pregnancy and Childbirth [Internet]. 2019 Oct 25 [cited 2021 Jan 19];19(1):382. Available from: https://bmcpregnancychildbirth.biomedcentral.com/articles/10.1186/s12884-019-2554-6
- Cho S, Chung RK, Jin SH. Factors affecting maternal and fetal outcomes of non-obstetric surgery and anesthesia during pregnancy: A retrospective review of data at a single tertiary university Journal of Korean Medical Science [Internet]. 2020 Apr 1 [cited 2021 May 19];35(16). Available from: https://pubmed.ncbi.nlm.nih.gov/32329258/
- Davidson AJ, Disma N, de Graaff JC, Withington DE, Dorris L, Bell G, et al. Neurodevelopmental outcome at 2 years of age after general anaesthesia and awake-regional anaesthesia in infancy (GAS): An international multicentre, randomised controlled trial. The Lancet [Internet]. 2016 Jan 16 [cited 2021 May 19];387(10015):239–50. Available from: https://pubmed.ncbi.nlm.nih.gov/26507180/
- Devroe S, Bleeser T, van de Velde M, Verbrugge L, de Buck F, Deprest J, et al. Anesthesia for non- obstetric surgery during pregnancy in a tertiary referral center: a 16-year retrospective, matched case-control, cohort study. International Journal of Obstetric Anesthesia [Internet]. 2019 Aug 1 [cited 2021 Apr 8];39:74–81. Available from: http://www.obstetanesthesia.com/article/S0959289X18303765/fulltext
- NAP5: Accidental Awareness During General Anaesthesia in the UK and Ireland – The National Institute of Academic Anaesthesia [Internet]. [cited 2022 Mar 18]. Available from: https://nationalauditprojects.org.uk/NAP5home
- Bonnet MP. Sedation and anaesthesia for non-obstetric surgery. Anaesthesia Critical Care and Pain 2016;35:S35–41.
- Vasco Ramirez M, Valencia G CM. Anesthesia for Nonobstetric Surgery in Pregnancy. Clinical Obstetrics and Gynecology [Internet]. 2020 Jun 1 [cited 2021 May 19];63(2):351–63. Available from: https://pubmed.ncbi.nlm.nih.gov/32205791/
- van de Velde M, de Buck F. Anesthesia for non-obstetric surgery in the pregnant patient [Internet]. 73, Minerva Anestesiologica. Minerva Anestesiol; 2007 [cited 2021 May 19]. p. 235–40. Available from: https://pubmed.ncbi.nlm.nih.gov/17473818/
- Kuczkowski KM. The safety of anaesthetics in pregnant women. Expert Opinion on Drug Safety. 2006;5(2):251–64.
- Mongardon N, Servin F, Perrin M, Bedairia E, Retout S, Yazbeck C, et al. Predicted propofol effect- site concentration for induction and emergence of anesthesia during early pregnancy. Anesthesia and Analgesia [Internet]. 2009 [cited 2021 May 19];109(1):90–5. Available from: https://pubmed.ncbi.nlm.nih.gov/19439683/
- Higuchi H, Adachi Y, Arimura S, Kanno M, Satoh T. Early pregnancy does not reduce the C50 of propofol for loss of consciousness. Anesthesia and Analgesia [Internet]. 2001 [cited 2021 May 19];93(6):1565–9. Available from: https://pubmed.ncbi.nlm.nih.gov/11726445/
- Nejdlova M, Frca TJ, Irving FC. Anaesthesia for non-obstetric procedures during pregnancy. [cited 2021 Apr 3]; Available from: https://academic.oup.com/bjaed/article/12/4/203/275380
- Society for Obstetric Anesthesia and Perinatology Statement on Sugammadex during pregnancy and lactation Ad Hoc task force. 2019.
- Chandon M, Bonnet A, Burg Y, Barnichon C, DesMesnards-Smaja V, Sitbon B, et al. Ultrasound- guided Transversus Abdominis plane block versus continuous wound infusion for post-caesarean analgesia: a randomized trial. PLoS One [Internet]. 2014 Aug 5 [cited 2022 Aug 6];9(8). Available from: https://pubmed.ncbi.nlm.nih.gov/25093663/
- Nau H. Clinical pharmacokinetics in pregnancy and perinatology. I. Placental transfer and fetal side effects of local anaesthetic agents. Dev Pharmacol Ther [Internet]. 1985 [cited 2022 Aug 6];8(3):149–81. Available from: https://pubmed.ncbi.nlm.nih.gov/3891263/
- Johnson RF, Herman NL, Johnson HV, Arney TL, Paschall RL, Downing JW. Effects of fetal pH on local anesthetic transfer across the human placenta. Anesthesiology [Internet]. 1996 [cited 2022 Aug 6];85(3):608–15. Available from: https://pubmed.ncbi.nlm.nih.gov/8853092/
- Kiefer N, Krahe S, Gembruch U, Weber S. Ultrasound anatomy of the transversus abdominis plane region in pregnant women before and after cesarean
