Vejledning i forebyggelse og behandling af postoperativ kvalme og opkastning
Dansk Selskab for Anæstesi og Intensiv Medicin
Anæstesiudvalget 2021
Forfattere
Sven Felsby
Jens Engbæk
Jan Mick Jensen
Henrik Andersen
Henriette Trøjborg
Christian Sigvald Langfrits
Jens Aage Kølsen Petersen (formand)
Indledning
Kvalme og opkastning efter anæstesi og operation (postoperative nausea and vomiting, PONV) forekommer hyppigt. Op til 30 % af patienterne kaster op, og 50% oplever svimmelhed. Op til 80% af højrisikopatienter kan opleve PONV.
Ud over øget ubehag for patienten kan PONV medføre operationskomplikationer, forlænget ophold i opvågningen og hospitalsindlæggelse, og dermed øgede omkostninger.
Anæstesiudvalget under Dansk Selskab for Anæstesi og Intensiv Medicin (DASAIM) nedsatte derfor i september 2015 en arbejdsgruppe med det formål at besvare følgende spørgsmål: Hvad er den bedste farmakologiske forebyggelse og behandling af postoperativ kvalme og opkastning?
Arbejdsgruppen har haft repræsentanter fra Region Nord, Region Midt, Region Syd og Region Hovedstaden. Den aktuelle vejledning er et resultat af konsensus i gruppen efter en systematisk gennemgang og diskussion af litteraturen frem til marts 2016. Det har ikke været gruppens intention at tage stilling til evidensstyrken af de enkelte studier. Vejledningen har sigte som klinisk beslutningsstøtte for farmakologisk forebyggelse og behandling af postoperativ kvalme og opkastning og bør tilpasses lokale forhold og indgreb.
Vi gennemførte en systematisk litteratursøgning i PubMed og Cochrane-biblioteket, samt manuelt i referencelister fra relevant international og national litteratur og vejledninger og udvalgte både primær og sekundær litteratur samt systematiske reviews.
Jens Aage Kølsen Petersen
Oktober 2016
Revision af vejledningen 2021
I august 2020 kom den 4. internationale konsensus guideline om håndteringen af postoperativ kvalme og opkastning (122). Den har givet anledning til ændring i vejledningen af den farmakologiske profylakse, således at der nu anbefales multimodal profylakse til patienter som kun har én eller to risikofaktorer. Revisionen af vejledningen har ikke givet anledning yderligere ændringer, det er således de samme risikofaktorer, præparater og dosering. Der er heller ikke nogen ændring i vejledningen til behandlingen af etableret PONV eller PDNV (postoperativ kvalme og opkastning efter udskrivelse) eller forebyggelse og behandling af PONV hos børn.
Jan Mick Jensen
April 2021
Resumé
Risikofaktorer
Farmakologisk forebyggelse af postoperativ kvalme og opkastning bør baseres på en individuel risikovurdering. Den bedste dokumentation af uafhængige risikofaktorer kommer fra et systematisk review af 22 prospektive studier omfattende 95.000 patienter.1 Her fandtes flere uafhængige faktorer med varierende betydning for PONV (se afsnittet om risikofaktorer). De patientrelaterede risikofaktorer med undtagelse af alder men med forventet postoperativt opioidbehov indgår i Apfelscore.

Tabel 1. Risikofaktorer i Apfel score
Risikofaktorerne i Apfelscore bør indgå i en simpel præoperativ basisvurdering af alle patienter. Desuden bør den kliniske situation, herunder yderligere risikofaktorer (tabel 2), patientens præferencer, bivirkninger og evt. allergi indgå i den endelige vurdering af behovet for kvalmeprofylakse.

Tabel 2. Yderligere risikofaktorer
Forebyggelse af PONV
Strategien til reduktion af PONV skal baseres på en kombination af reduktion af anæstesiologiske risikofaktorer, hvis muligt, samt farmakologisk profylakse.
Reduktion af anæstesirelaterede risikofaktorer
Total intravenøs anæstesi (TIVA) eller regional anæstesi mindsker risikoen i forhold til inhalationsanæstesi. Smertebehandlingen bør planlægges med brug af så lidt postoperativt opioid som muligt.
Farmakologisk profylakse
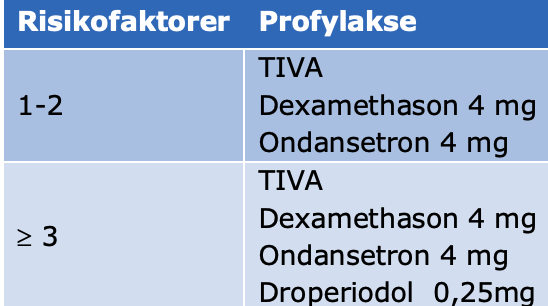
Tabel 3. Farmakologisk profylakse af postoperativ kvalme og opkastning
Den nye anbefaling er multimodal profylakse til patienter som kun har én eller to risikofaktorer. Multimodal profylakse defineres som mindst 2 præparater. Hvis patienten har flere end 2 risikofaktorer, anbefales profylakse med 3-4 præparater. Ændringen i anbefalingen skyldes problemer med inadækvat profylakse med den gamle anbefaling og en øget mængde sikkerhedsdata på præparaterne, som giver basis for mere udbredt brug (122). I bilag nr. 1 kan den samlede anbefaling til profylakse fra Gan et al. ses.
Farmakologisk behandling af etableret PONV
Behandling af etableret PONV bør foregå med en stofgruppe, patienten ikke tidligere har fået i det aktuelle forløb. Man kan godt gentage den profylaktiske behandling med samme stof, blot først 4-6 timer efter at det er givet første gang.
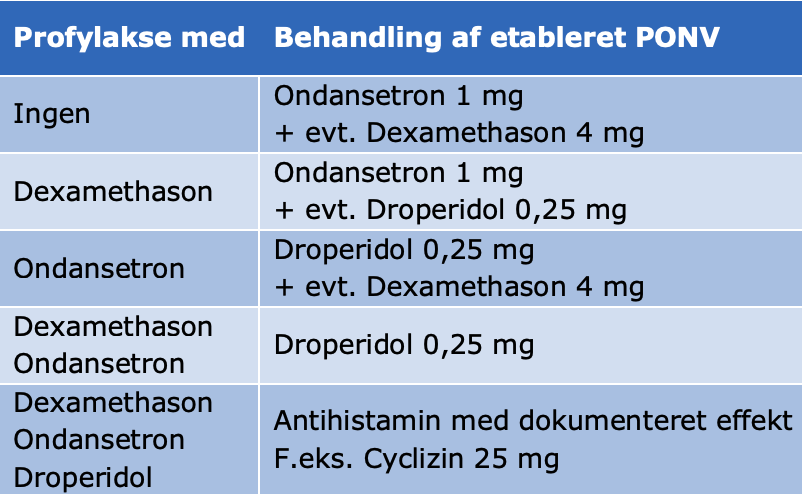
Tabel 4. Farmakologisk behandling af etableret postoperativ kvalme og opkastning
Risikofaktorer
I det til dato største systematiske review omfattende 95.000 patienter fandtes flere uafhængige faktorer af betydning for PONV (Tabel 5).1

Tabel 5. Uafhængige risikofaktorer for PONV med odds ratio (Apfel et al 2012.)
Alder
Lav alder øger risikoen og høj alder beskytter mod PONV. Det er imidlertid ikke klart, hvor gammel patienten skal være, før der er tale om en reel risikoreduktion. Konsensus i gruppen blev, at alder under 50 år kan betragtes som en risikofaktor, eftersom patienter over 50 år har betydeligt nedsat PONV risiko (OR < 0,52). Samtidig bliver 50 års aldersgrænsen brugt til Post-Discharge Nausea and Vomiting (PDNV) scoren, og det var derfor rationelt at indføre denne grænse.
Anæstesivarigheden
Denne risikofaktor var meget omdiskuteret i gruppen. Den eksisterende litteratur omhandler primært inhalationsanæstesi, hvorfor resultaterne ikke kan ekstrapoleres til TIVA.
Desuden er varigheden af indgrebet stærkt korreleret til postoperativt opioidforbrug, der er en veletableret risikofaktor for PONV.2, 3
Arbejdsgruppen valgte med denne baggrund ikke at inkludere anæstesivarighed som risikofaktor.
Kirurgirelaterede faktorer
Selvom Apfel fandt statistisk signifikans for at tre typer indgreb var uafhængige risikofaktorer for PONV er resultatet emne for diskussion. Heterogeniteten mellem studierne er høj og Apfel beskriver også selv resultaterne som usikre.
Arbejdsgruppen valgte med denne baggrund ikke at inkludere arten af det kirurgiske indgreb som risikofaktor.
Reduktion af baselinerisiko for PONV
En essentiel del af den profylaktiske behandling af PONV er baselinereduktion. Formålet at fjerne eller reducere patienternes uafhængige risikofaktorer. Anæstesirelaterede risikofaktorer kan reduceres, men ikke fjernes.
TIVA vs. inhalationsanæstesi
Den første større metaanalyse fra 1997 med 84 studier og 6069 patienter viste en klar fordel ved TIVA frem for inhalationsanæstesi mht. PONV med NNT 4,9.4
Gupta et al. fandt ved en metaanalyse, af inhalationsanæstesi (sevofluran, desfluran og isofluran) vs. TIVA med propofol, en incidens for PON 25,8 vs. 14,1 (NNH 8,6), POV 14,1 vs. 5,2 (NNH 11,2), behov for antiemetika 16,6 vs. 5,1 (NNH 12,5) samt PDNV 15,6 vs. 5,9 (NNH 10,3).
Det skal dog pointeres at der ved sammenligning af propofol og sevofluran var mindre risiko for PON og POV med NNH på hhv. 11 og 15 og behov for antiemetika med NNH 11. Der var ikke signifikant forskel på PDNV ved sevofluran vs. Propofol.5
I et review af dagkirurgiske patienter fra 2014 viste Kumar et al. lavere incidens af PONV ved TIVA med propofol vs. inhalationsanæstesi (sevofluran, desfluran, N2O) med 13.8% vs. 29.2%, RR 0.50 (95% CI 0.35–0.71, p < 0.001).
Hvis undersøgelserne med N2O blev ekskluderet var der ikke signifikant forskel på de to grupper. Der fandtes ikke forskel på PDNV ved sammenligningen. Generelt fandt man høj heterogenitet ved studierne med I2=76.6
Andre nyere randomiserede undersøgelser viser generelt mindre PONV ved brug af TIVA frem for inhalationsanæstesi.6–8
Regional anæstesi
En metaanalyse fra 2005 viser ikke nogen forskel på PONV mellem central nerveblokade og generel anæstesi. Der ses dog en markant mindre risiko for PONV for perifer nerveblokade vs generel anæstesi med OR 0,17.9 Tong et al beskriver dog effekt på PONV ved central nerveblokade uden opioid vs. general anæstesi og henviser til ovenstående artikel.10 Der forligger ikke nyere studier på området.
Behov for postoperative opioider og mængden heraf
Behov for og brug af postoperative opioider har betydning for risikoen for PONV. Herudover ses en tendens til uændret PONV så længe der er behov for opioid.2, 3 NSAID og paracetamol reducerer det postoperative opioidbehov og nedsætter incidensen af PONV.
NSAID
En metaanalyse af randomiserede forsøg viser reduktion af PONV på 30% ved administration af NSAID, korreleret til et mindre forbrug af morfin. Morfinindtag er korreleret til PONV.11
NSAID nedsætter morfinforbruget (MD 210.18; 95% CrI 211.65, 28.72), og PONV (odds ratio 0.70; 95% CrI 0.53, 0.88) ved patientkontrolleret analgesi.12 –
I et Cochrane review opnåede 79% af patienterne ≥ 50% reduktion af VAS score efter NSAID 400 mg + paracetamol 1000 mg i forhold til placebo, NNT 1,5. Der var her dog ikke fokus på PONV eller reduktion af opioider.13
Paracetamol
I.v. paracetamol administreret profylaktisk før kirurgi reducerer kvalme med OR 0,54 (0,4- 0,74) eller før ankomst til opvågningen, OR 0,67 (0,55-0,83), men ikke administreret efter udbrud af smerter.
Når paracetamol blev givet profylaktisk var reduktionen af kvalme korreleret til reduktionen af smerter.14
Herudover kan gabapentin og a2-agonister reducere opioidforbruget postoperativt, se afsnit med alternative præparater.
Væsketerapi
Supplerende behandling med i.v. krystalloid nedsætter risikoen for PONV.15 Studierne er dog primært baseret på inhalationsanæstesi, de er inhomogene og incidensen for PONV er meget høj i en del af studierne (68-90%). Ingen af studierne sammenlignede effekten af væsketerapi mod antiemetika, men de to studier hvor TIVA blev anvendt som vedligehold kunne ikke påvise lavere incidens af PONV i opvågningsafsnittet. Der blev overvejende brugt Ringer laktat i studierne. Studierne med NaCl kunne vise signifikant effekt på PON, muligvis pga. hyperchloræmisk acidose og den deraf følgende risiko for kvalme og opkastning.16 I flere af studierne fastede patienterne fastende fra dagen før og i enkelte af studierne fik kontrolgruppen ingen peroperativ væske.
Den danske rekommandation for faste og tørste tillader patenterne at indtage væske indtil 2 timer inden OP og de har derfor mindre væskedeficit.
Vi anbefaler at man følger DASAIMS rekommandationer for tørste og faste og kan ikke anbefale yderligere væsketerapi som PONV-profylakse.
Glukokortikoider
Litteratursøgning
Der blev anvendt følgende søgestreng i Pubmed: ((“Dexamethasone”[Mesh]) AND “Postoperative Nausea and Vomiting”[Mesh]) AND “Meta-Analysis” [Publication Type] og fundet 22 hits. Studier og metaanalyser baseret på organspecifik kirurgi er udeladt fra resultatet. Der fandtes tre generelle metaanalyser..17–19
Virkningsmåde
Årsagen til steroiders antiemetiske effekt er ikke fuldstændigt klarlagt, men menes at kunne tilskrives 1) den antiinflammatoriske effekt, 2) En direkte central påvirkning af nucleus tractus solitarius og/eller 3) ved at hæmme serotonin- og NK1/2-syntesen.20
Dexamethason
Effekt
Effekten af dexamethason ses ved doser > 25 µg/kg med ringe effekt af øget dosis > 100 µg/kg.21 Ved monoterapi ligger effekten på linje med setroner og dopaminantagonister. Metaanalyse.17: 8-10 mg hos voksne eller 1-1.5 mg/kg hos børn sammenlignet med placebo: Voksne NNT=7.1 (4.5-18), børn NNT 3.8 (2.9 – 5) for POV. For voksne var PON NNT 4.3 (2.3- 26).
Metaanalyse18: Sammenlignet med placebo: RR=0.49 (0.15-0.42); NNT=3.4 (2.5-5.3). Doser var ikke specificeret.
Metaanalyse19: 4-5 mg sammenlignet med placebo: RR=0.31 (0.23-0.41); NNT=3.7 (3.0-4.7). 8-10-mg sammenlignet med placebo: RR=0.26 (0.20–0.32); NNT=3.8 (3.0–4.3).
Bivirkninger
Perioperativ hyperglykæmi forværres under steroidadministration, både hos diabetikere og raske.22 Steroider medfører kognitivt deficit efter gentagen administration, men det er ikke beskrevet ved enkeltadministration. Steroidpsykose og stemningsændringer er beskrevet efter enkeltdoser, men der foreligger ikke kvantitative data. Incidensen må forventes at være lav, men en anamnese med delirium, konfusion eller svær depression kan udgøre en relativ kontraindikation.23 Et studie, der viste øget post-tonsillektomiblødning har ikke kunnet verificeres, men heller ikke afkræftes, da studierne ikke er tilrettelagt med dette endpoint for øje.24 Intravenøs administration af steroidfosfatsalte ledsages ofte af intens anogenital kløe, der svinder i løbet af få minutter.25 Kvinder rammes hyppigere.26
Administrationsmåde
Dexamethason gives normalt intravenøst. Oral administration af dexamethason resulterer i bioavailability på 80%.27
Substitution med andre steroider
Tilgængelige data viser en ækvivalent antiemetisk effekt af methylprednisolon.28 Dexamethason udviser den længste halveringstid blandt tilgængelige steroider til humant brug, hvilket må anses som ønskeligt i behandlingen af PONV. Ydermere besidder dexamethason ringe mineralokortikoid effekt.
5-HT3-receptorantagonister
Litteratursøgning
Tre søgestrenge blev anvendt i Pubmed:
- “Ondansetron”[Mesh] AND “Postoperative Nausea and Vomiting”[Mesh] gav 387 referencer, der blev gennemgået med fokus på systematiske reviews og metaanalyser af undersøgelser omfattende universel anæstesi hvor flere operationstyper indgik. Enkelte relevante RCT studier blev inkluderet. Undersøgelser af børn blev ekskluderet. Der blev udvalgt 9 undersøgelser.
- (“Ondansetron”[Mesh] AND “adverse effects”[Subheading]) AND “Arrhythmias, Cardiac”[Mesh] gav 38 referencer, der blev gennemgået med fokus på systematiske reviews og metaanalyser. Heraf blev 2 udvalgt.
- (“Granisetron”[Mesh]) AND “Postoperative Nausea and Vomiting”[Mesh] gav 89 referencer, der blev gennemgået med fokus på systematiske reviews og metaanalyser. Der blev udvalgt 9 undersøgelser og 1 editorial.
Virkningsmåde
Kemotriggerzonen i area postrema i bunden af 4. ventrikel i og i tractus solitarius indeholder 5-HT3 serotoninreceptorer der har betydning for transmission af impulser til brækcentret.29 5- HT3 receptorantagonister er mest effektive mod kemoterapi-induceret kvalme og opkastning men er også virksomme som profylakse mod og behandling af manifest PONV. Antagonisterne omfatter primært ondansetron, granisetron og palonosetron. Alle tre er registreret til anvendelse ved kemoterapi – ondansetron og granisetron tillige i forbindelse med operation. Ondansetron er det mest undersøgte antiemetikum ifm. PONV. Der er betydelig evidens for anvendelse af ondansetron som led i PONV profylakse, både som enkeltstof og som led i flerstofbehandling.30, 31 I modsætning hertil er der begrænset evidens for anvendelsen af ondansetron ved behandling af manifest PONV med eller uden forudgående profylakse. Granisetron og palonosetron adskiller sig både farmakokinetisk og mht. receptoraffinitet fra ondansetron.32, 33
Ondansetron
Dosis ved profylakse
Voksne: Både 4 og 8 mg er anbefalet som enkeltstof profylakse.30, 34 Ondansetron 4 mg i.v. profylaktisk som enkeltstof hæmmer opkastning mere end kvalme, NNT hhv. 6 og 7.30 Denne dosis reducerer PONV risikoen med 25%, svarende til effekten af 4 mg dexamethason eller 1,25 mg droperidol.31 Ondansetron 4 mg i.v. er indiceret til profylakse ved moderat eller høj risiko for PONV.35 Virkningen efter i.v. indgift indtræder i løbet af få minutter, og profylaktisk præoperativ tabletbehandling er derfor ikke indiceret. Øgning af den profylaktiske dosis til 8 mg har ikke bedre effekt end placebo.36 Ondansetron administreres typisk ved afslutning af operation men der er ikke evidens for, at effekten påvirkes af, om administrationen sker før, under eller efter operation.34 Gentagelse af den profylaktiske dosis ved postoperativ kvalme har ikke bedre effekt end placebo37 hvilket bekræfter at der bør skiftes til anden stofgruppe ved behandling af etableret PONV. Ved p.o. administration øges dosis til 8 mg. Eliminationshalveringstiden er ca. 3 timer og den initiale dosis kan gentages efter ca. 6 timer.
Dosis ved etableret PONV
Uden forudgående profylakse er der ikke påvist klinisk relevant dosis-respons for henholdsvis 1, 4 og 8 mg hvor NNT er 4.1 – 4.8. Den mindste effektive dosis på 1mg anbefales derfor og her er effekten også større ved opkast end ved kvalme.38, 39 Der er ringe evidens for effekt af ondansetron til manifest PONV, hvis der er givet profylakse. Det anbefales her at anvende antiemetika med virkning på andre receptorer i CNS end omfattet af profylaksen.
Bivirkninger
Anvendelse af ondansetron er sikkert. NNH ved en enkeltdosis ondansetron er 36 for hovedpine og 31 for påvirkede leverenzymer.30, 40 Anvendelse af HT3-receptorantagonister indebærer risiko for forlænget QTc og Torsades de Pointes arytmi. Risikoen er størst ved iv indgift.40, 41 Den kliniske betydning er usikker, men denne egenskab ved HT3-receptorantagonister bør huskes, når ondansetron gives sammen med andre lægemidler med samme egenskab. Ved kemoterapi-induceret kvalme og opkastning er højest anbefalede enkeltdosis ondansetron derfor 16 mg.40, 41
Granisetron
Granisetron anvendes ikke rutinemæssigt i forbindelse med PONV. Profylaktisk granisetron har effekt svarende til ondansetron. Doser fra 0,1 mg til 3 mg er undersøgt.42–45 Den relative risikoreduktion er i nogle studier fundet større med høje doser, mens andre ikke har kunnet påvise dosis-effekt sammenhæng.42, 46 Denne forskel kan tilskrives forskel i baselinerisiko.47 De seneste undersøgelser anvender 3 mg mens den rekommanderede dosis i DLI er 2 mg p.o. eller 1 mg i.v. præoperativt. Granisetrons hyppigste bivirkninger er som ondansetron hovedpine og obstipation, og også her er der risiko for forlænget QTc og Torsades de Pointes arytmi.40, 48, 49 Ved behandling af etableret PONV på trods af profylakse med ondansetron ses ingen effekt ved at skifte til anden 5-HT3-receptorantagonist.50
Palonosetron
Palonosetron adskiller sig fra ondansetron og granisetron ved en betydeligt længere halveringstid på 40 timer og en større receptoraffinitet.33 Palonosetron kan have potentiale som profylakse mod Post Discharge Nausea and Vomiting (PDNV). Den høje pris udelukker aktuelt anvendelse i forbindelse med PONV og PDNV.
Dopaminantagonister
Litteratursøgning
Der blev anvendt følgende søgestreng i Pubmed: “Postoperative Nausea and Vomiting”[Mesh] AND (“Dopamine D2 Receptor Antagonists”[Mesh] OR “Dopamine Antagonists”[Mesh] OR “Dopamine Antagonists”[Pharmacological Action] OR Dopamine Antagonist OR Dopamine D2 Receptor Antagonists OR “Chlorpromazine”[Mesh] OR “Domperidone”[Mesh] OR “Droperidol”[Mesh] OR “Fluphenazine”[Mesh] OR “Haloperidol”[Mesh] OR “Metoclopramide”[Mesh] OR “Perphenazine”[Mesh] OR “Prochlorperazine”[Mesh]) med følgende filtre: “Meta-analysis” og “Systematic Reviews” og fundet 27 hits.
Virkningsmåde
Dopaminreceptor-agonister er emetogene. D2-antagonister modvirker kvalme og opkastning. Kemotriggerzonen indeholder mange D2-receptorer. Præparater omtalt i dette kapitel er alle D2-receptorantagonister.
Baggrund for valg af det anbefalede stof
Droperidol er undersøgt i det største antal studier, som alle viser positiv effekt, fulgt af metoclopramid hvor studierne viser mere blandet effekt. Der findes kun få studier med haloperidol og perphenazin, men haloperidol er effektivt i modsætning til perphenazin.
Droperidol
Anbefalingen bygger på studier som viser effekt indenfor de første 6 timer postoperativt.
Profylakse
Metaanalyserne kan ikke demonstrere en dosis-respons sammenhæng,17, 51, 52 så den mindste effektive dosis anbefales for at reducere risikoen for bivirkninger.53
Droperidol er effektivt mod kvalme i en dosis på 0,25-2,5 mg iv. – mindste effektive dosis er 0,25 mg (ingen dosis-respons sammenhæng).51, 53
Droperidol er effektivt mod opkastning i en dosis på 0,25-2,5 mg iv. – mindste effektive dosis er 0,25 mg (svag dosis-respons sammenhæng).51, 53
Behandling
Der findes ingen metaanalyser hvor droperidol gives til behandling af etableret PONV.
Bivirkninger
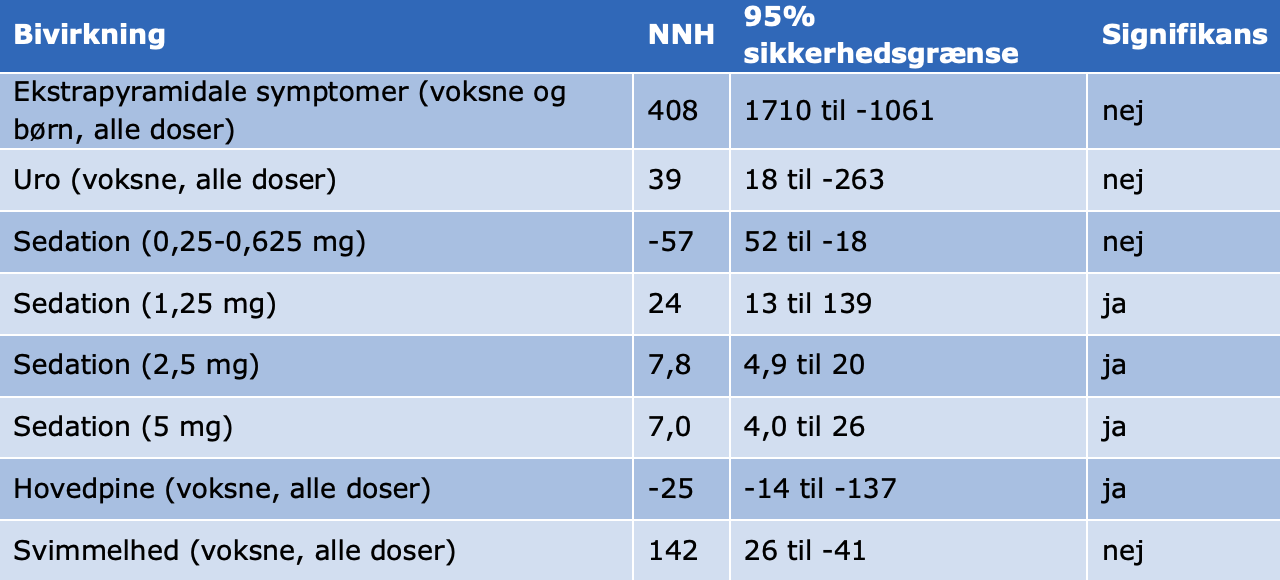
Henzi et al. har lavet en metaanalyse af studier hvor der gives droperidol som profylakse mod PONV.53 Bivirkningerne ses som NNH. Der er dosis-respons sammenhæng for sedation og sløvhed, men ikke for øvrige bivirkninger. Droperidol beskytter imod hovedpine, dvs. det giver mindre hovedpine end placebo.
Haloperidol
Profylakse
Haloperidol er effektivt som profylakse mod PONV i en dosis mellem 4-5 mg; er mere effektiv mod kvalme end opkastning.54
Behandling
Haloperidol er effektivt som behandling af etableret opkastning postoperativt i en dosis på mellem 1-2 mg.54 Der findes ingen undersøgelser om effektivitet mod etableret kvalme.54
Metoclopramid
Profylakse
Metoclopramid er effektivt som profylakse mod PONV i en dosis på 10 mg i.v.24, 55–57 I en direkte sammenligning er ondansetron mere effektivt end metoclopramid.58
Behandling
Der er ikke udarbejdet metaanalyser vdr. behandling af etableret PONV.
Perphenazin
Profylakse
Perphenazin er effektivt som profylakse mod PONV i en dosis på 5 mg og 0,11 mg/kg.34, 59
Behandling
Der findes ingen metaanalyser vdr. perphenazin til behandling af etableret PONV.
Gennemgang af metaanalyser
Droperidol
Henzi et al. 53:Metaanalyse af studier hvor der gives droperidol som profylakse mod PONV. Ingen dosis-respons effekt for profylaksen af kvalme fra 0-6 timer postoperativt (NNT næsten uændret for alle doser). Der er en svag dosis-respons effekt for profylaksen af opkastning fra 0-6 timer postoperativt. Svag dosis-respons effekt for profylaksen af kvalme fra 0-24 timer postoperativt. Ingen dosis-respons effekt for profylaksen af opkastning fra 0-24 timer postoperativt.
Schaub et al. 51:Metaanalyse af studier hvor der gives droperidol som profylakse mod PONV. Der kan ikke påvises dosis-respons for doser mellem 0,25 og 1,0 mg for profylakse af kvalme og opkastning for højrisikopatienter. Eberhart et al. 52:Metaanalyse af studier hvor der gives droperidol som profylakse mod PONV. Der kan ikke vises dosis-respons for doser mellem 0,5-300 ug/kg. Carlisle et al. 34:Metaanalyse (Cochrane review) af alle studier hvor der gives et farmakon som profylakse mod PONV. Droperidol findes signifikant mere effektiv end placebo. Domino et al. 60: Metaanalyse af studier hvor der gives droperidol, metoclopramid eller ondansetron som profylakse mod PONV. Droperidol findes signifikant mere effektivt end metoclopramid men lige så effektivt som ondansetron.
Haloperidol
Büttner et al. 54:Metaanalyse af studier hvor haloperidol benyttes som profylakse og til behandling af etableret PONV. Droperidol findes signifikant mere effektivt som profylakse end placebo.
Metoclopramid
Carlisle et al. 34:Metaanalyse (Cochrane review) af alle studier hvor der gives et farmaka som profylakse mod PONV. Metoclopramid findes signifikant mere effektivt end placebo. Wu et al. 58:Metaanalyse af studier hvor metoclopramid eller ondansetron benyttes som profylakse mod PONV ved laparoskopisk cholecystektomi. Der er ingen placebogruppe. Ondansetron findes signifikant mere effektivt end metoclopramid. De Oliveira et al. 55:Metaanalyse af studier hvor der gives 10 mg metoclopramid systemisk som profylakse mod PONV. I denne metaanalyse er studier af Yoshitaka Fujii ekskluderet. Studierne fra Fujii var alle negative. Metoclopramid findes signifikant mere effektivt end placebo. Mshriky et al. 56:Metaanalyse af studier hvor der gives 10 mg metoclopramid systemisk som profylakse mod PONV ved ceasarean sectio. Studier af Yoshitaka Fujii er inkluderet. Metoclopramid findes signifikant mere effektivt end placebo. Henzi et al. 57:Metaanalyse af studier hvor der gives metoclopramid som profylakse mod PONV. Der præsenteres resultater for flere forskellige doser og administrationsformer. Metoclopramid 10 mg i.v. findes signifikant mere effektivt ift. placebo for profylakse mod opkastning og PONV, men ikke mod kvalme.
Perphenazin
Carlisle et al. 34:Metaanalyse (Cochrane review) af alle studier hvor der gives et farmakon som profylakse mod PONV. Perhenazin findes signifikant mere effektivt end placebo som profylakse mod opkastning men ikke mod kvalme eller PONV. Schnabel et al. 59: Systematisk review af studier hvor perphenazin benyttes som profylakse mod PONV. Perhenazin findes signifikant mere effektivt end placebo som profylakse.
Antihistaminer
Litteratursøgning
Der blev anvendt følgende søgestreng i Pubmed: “Postoperative Nausea and Vomiting”[Mesh] AND (“Histamine H1 Antagonists”[Mesh] OR “Histamine Antagonists”[Mesh] OR “Histamine H1 Antagonists” [Pharmacological Action] OR Histamine Antagonists OR Histamine H1 Antagonists OR “Dimenhydrinate”[Mesh] OR “Diphenhydramine”[Mesh] OR “Clemastine”[Mesh] OR “Cyclizine”[Mesh] OR “Meclizine”[Mesh] OR “Hydroxyzine”[Mesh] OR “Promethazine”[Mesh]) Søgningen gav 84 hits, hvoraf 30 relevante artikler blev fundet, heriblandt en metaanalyse (1). Der blev ikke fundet yderligere metaanalyser eller systematiske reviews.
Virkningsmåde
H1-receptorer medierer både perifere effekter som f.eks. kontraktion af glat muskelvæv, dilatation og øget permeabilitet af kapillærer, og centrale effekter, bl.a. induktion af kvalme og opkastning primært via nucleus tractus solitarius (NTS). Antihistaminer med antiemetisk effekt er H1-antagonister. Nogle virkninger skyldes også blokade af 5-HT, a1 -adrenerge og muscarinerge acetylcholinreceptorer (mAChR). Den vigtigste antiemetiske virkning af H1-antagonister tilskrives blokering af mAChR i de vestibulære baner og H1-receptorer i NTS. Hyppige bivirkninger er sedation, mundtørhed og forstoppelse, sjældnere konfusion, sløret syn og urinretention.61
Antihistaminer som profylakse
Dimenhydrinat har effekt som profylakse sammenlignet med placebo i en metaanalyse fra 2002,62 i en dosis på 1-2 mg/kg. Effekten er moderat, NNT 5-8. Et RCT fra 200463 finder ligeværdig effekt af dosis 25 mg med droperidol 0,625 mg. To RCT64, 65 finder at kombinationen dimenhydrinat 31 mg + dexamethason 4 mg reducerer incidensen af PONV signifikant sammenlignet med placebo med OR 0,17.65 Diphenhydramin 1 mg/kg er hos børn vist at reducere PONV i forhold til placebo (56,7% vs. 6,7% p<0,01) i et enkelt RCT66 med 60 børn i alderen 1-6 år, men børnene tilbragte længere tid i opvågningsafsnittet.
Cyclizin 50 mg er i 5 RCT67–71 vist at have effekt som PONV profylakse. I et RCT på børn (12), havde ondansetron bedre effekt som PONV profylakse end cyclizin 20 mg. Meclozin 50 mg er i to mindre RCT fundet at reducere postoperativ kvalme sammenlignet med placebo, det ene af studierne72 har fundet effekten for meclozin alene, mens det i det andet studie73 er undersøgt i kombination med ondansetron. Hydroxyzin er kun undersøgt i et ældre RCT,74 hvor der fandtes reduceret hyppighed af postoperativ kvalme ved hydroxyzin 100 mg i.m. (10%) sammenlignet med droperidol 2,5 mg i.m. (44%) og placebo (56%).
Promethazin som profylakse er undersøgt i 3 RCT75–77 uden effekt. I kombination med hhv. granisetron75 og ondansetron76 finder man dog signifikant bedre effekt end for hvert af stofferne alene sammenlignet med placebo.
Antihistaminer som behandling ved etableret PONV
Promethazin som behandling af etableret PONV er undersøgt i fire studier. Et retrospektivt studie78 undersøger effekten af hhv. ondansetron 4 mg eller promethazin 6,25-25 mg som 1. ”rescue” antiemetikum til patienter med etableret PONV, der har fået ondansetron 4 mg som profylakse. De finder signifikant bedre effekt af promethazin. I et RCT79 hvor patienter trods profylakse med enten ondansetron eller droperidol udvikler PONV, fandt man signifikant bedre effekt af behandling med promethazin 6,25-25 mg sammenlignet med behandling med hhv. ondansetron og droperidol. I et andet RCT80 fandt man ligeværdig effekt af droperidol 0,625 mg, ondansetron 4 mg og promethazin 12,5 mg som behandling af PONV hos patienter, der havde fået droperidol som profylakse og ingen signifikant forskel på bivirkninger. I et studie af promethazin 6,25 mg vs. 12,5 mg var der ingen forskel og 97% af alle patienter havde tilfredsstillende effekt på PONV efter en enkelt dosis promethazin.81 Der sås mere sedation ved den høje dosis end med den lave. I tre af de fundne studier sammenligner man således promethazin med et antiemetikum, der er givet som profylakse, til at behandle etableret PONV trods denne, hvilket bekræfter at der bør skiftes til anden stofgruppe ved behandling af etableret PONV. Samlet set er evidensen for brug af promethazin til behandling af etableret PONV utilstrækkelig.
Dimenhydrinat 25-50 mg er undersøgt som behandling til patienter med PONV trods anden profylakse i en RCT fra 2005 uden at man kan konkludere nogen relevant effekt heraf.79
Der er ikke fundet studier af effekten af hverken dimenhydramin, cyclizin, meclozin eller hydroxyzin ved etableret PONV.
Antikolinergika
Litteratursøgning
Der findes kun få studier af andre antikolinergika end skopolamin. ((“scopolamine”[Mesh]) AND “Postoperative Nausea and Vomiting”[Mesh]) AND “Meta-Analysis”[Publication Type] giver 2 hits.82, 82 (“Cholinergic Antagonists”[Mesh]) AND “Postoperative Nausea and Vomiting”[Mesh] giver 21 hits, heraf ingen meta-analyser.
Virkningsmåde
Antikolinergika er kompetetive hæmmere af acetylkolin på den muskarine receptor. Både det vestibulære system og kemotriggerzonen i loftet af 4. ventrikel er involveret i den antiemetiske effekt. Dette forudsætter penetrans over blod-hjernebarrieren, hvilket forklarer at scopolamin har højere antiemetisk effekt end atropin. Glykopyrron optages stort set ikke i CNS, men nedsætter alligevel kvalme under spinal anæstesi.84 En del antihistaminer har antikolinerg effekt, se afsnit om disse.
Skopolamin
Administrationsmåde
Kommercielt tilgængeligt skopolamin omfatter p.t. kun plaster. Det giver initialt ca. 150 µg, derefter 5 µg/t i de følgende døgn.
Effekt
De to meta-analyser af transdermal skopolamin viser en relativ risiko for PONV på hhv. 0.77 og 0.83.
Bivirkninger
Den antikolinerge effekt forårsager mundtørhed pga. nedsat spytsekretion og synsforstyrrelser pga. akkomodationsparese. Begge bivirkninger ses signifikant hyppigere ved behandling med skopolamin. De tilgængelige studier tillader ikke opgørelse af incidensen af øvrige antikolinerge bivirkninger som konfusion, urinretention og svimmelhed.
Konklusion
Set i lyset af bivirkningsprofilen og den sparsomme evidens er der ikke basis for at anbefale transdermal skopolamin til profylakse eller behandling af PONV.
Postoperativ kvalme og opkast efter udskrivelse (PDNV)
Litteratursøgning
Pubmed søgeordene ’Postdischarge nausea vomiting’ og ’Late postoperative nausea vomiting’ der ikke er Mesh termer. Søgeresultaterne var hhv.74 og 185 referencer, hvorfra der blev udvalgt 11 systematiske reviews og publikationer med fokus på risikofaktorer og risikovurdering.
Incidens
Postoperativ kvalme og opkastning efter udskrivelse (PDNV, Post Discharge Nausea and Vomiting) har først i de senere år fået opmærksomhed i takt med den stigende udbredelse af dagkirurgi og accelererede patientforløb. Data og viden om PONV kan ikke appliceres på PDNV, der fremstår som et særligt problemfelt. Incidensen af PDNV spænder vidt fra 0% – 72%.85–87 I et multicenter kohorte studie af Apfel et al. 88 havde 37% af patienterne PDNV, heraf 13% med kraftig kvalme, 12% med opkastning og 5% med kraftig opkastning.
Risikofaktorer
Risikofaktorerne for PDNV inden for 48 timer postoperativt er stort set identiske med dem der kendes for PONV: kvinder, tidligere PONV, postoperativt opioid, alder < 50 år og postoperativ kvalme.88 Isofluran, men ikke sevofluran eller desfluran, øger risikoen for PDNV sammenlignet med propofol.89 Generel anæstesi øger risikoen i forhold til både lokal bedøvelse og spinal analgesi, ligesom operationsvarighed > 30 min er en risikofaktor.90 Anvendelse af intraoperativ ondansetron, rygerstatus og operationstypen er tilsyneladende ikke disponerende for at udvikle PDNV i de første 2 døgn efter operation.87, 88, 90 Ved udvikling af sen PDNV (3-7 dage) er anvendelse af postoperativ ondansetron og smerter ligesom PONV anamnese og operationsvarighed stærke prædiktorer.91 Blandt patienter med høj risiko for PONV kan den klassiske præoperative Apfel risiko score tilsyneladende ikke relateres til udvikling af sen PDNV.92
Apfel et al88 har udviklet en PDNV risikoscore baseret på fem uafhængige prædiktorer: kvinde, alder < 50 år, PONV anamnese, postoperativt opioid og postoperativ kvalme. Nul, en, to, tre, fire og fem af disse faktorer estimerer en risiko for udvikling af PDNV på henholdsvis 7%, 20%, 28%, 53% 60% og 89%. Samme risikofaktorer er fundet af Brookes et al.87 Opioidbesparende analgesi bør derfor være en del af strategien for at reducere risikoen for PDNV.93 Fravær af PONV indtil udskrivelse giver ingen sikkerhed mod PDNV.85 Hos børn er generel anæstesi, alder > 3 år og operationsvarighed > 30 min korreleret til øget risiko for PDN.90
Profylakse
Såvel enkeltstof- som kombinationsbehandling har effekt. Til kvalmebehandling er NNT dog 12-13 med enkeltstofprofylakse (4 mg ondansetron eller 4-10 mg dexamethason), at enkeltstofbehandling næppe har nogen plads ved behandling af lavrisikopatienter. I modsætning hertil er profylaktisk kombinationsbehandling med ondansetron og dexamethason før udskrivelse effektiv mod PDN (NNT=5) i de første 24 timer efter udskrivelse.86 Samme forhold gør sig gældende for PDV.86 Klassiske antiemetika til profylakse og behandling af manifest PONV har relativ kort halveringstid og kan derfor ikke forventes at række længe efter udskrivelse. Dertil kommer, at andre faktorer i forbindelse med udskrivelse som for tidlig mobilisering, hjemtransport, ophævet lokal analgesi, smerter og opioidbehandling hjemme samt angst og uro kan betyde, at andre strategier skal tages i anvendelse mod PDNV.
Supplerende profylakse efter udskrivelse med ondansetron er således en mulighed. Peroperativ profylakse med ondansetron 4 mg og dexamethason 8 mg suppleret med ondansetron 8 mg peroralt umiddelbart postoperativt plus 1. og 2. postoperative dag sænker incidensen af PDN fra 2. til 5 døgn og øger ’quality of life’ i de 5 første postoperative døgn postoperativt sammenlignet med ondansetron 4 mg intraoperativt.93 Palonosetron reducerer incidensen af PDNV i op til 24 timer sammenlignet med ondansetron men den kliniske betydning af dette er uafklaret som følge af et højt NNT (5.4 – 9.7). Der mangler også dokumentation for palonosetrons effekt ud over 24 timer som PDNV profylakse94 og der vil som tidligere omtalt være betydelige omkostninger forbundet med anvendelse af palonosetron.
Forebyggelse og behandling af postoperativ kvalme og opkastning hos børn
Litteratursøgning
Pubmed søgning på ”pediatric” OR ”children” AND ”PONV” begrænset til review publiceret inden for 10 år på engelsk. Søgningen gav 65 referencer, hvoraf 3 systematiske review blev udvalgt. Herefter blev der foretaget en søgning i Google på ”guideline” AND ”pediatric” AND ”PONV”. Det gav flere hospitalsspecifikke aktuelle vejledninger og en enkelt anbefaling udarbejdet af European Society for Paediatric Anaesthesiology.
Incidens og risikofaktorer
Risikoen for PONV hos børn 3-15 år angives mellem 33% og 82% eller dobbelt så høj som hos voksne.95, 96 Risikofaktorer fremgår af Tabel 1.

Tabel 1. Risikofaktorer for PONV hos børn
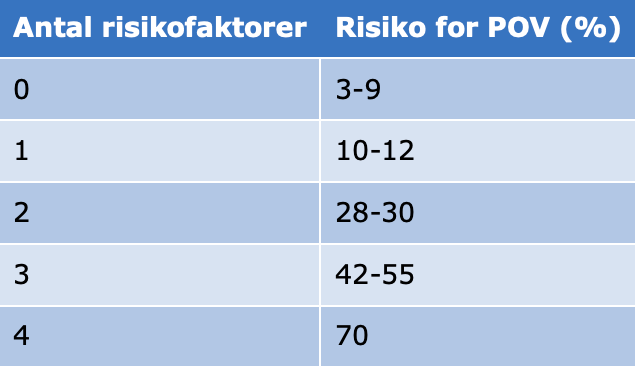
Tabel 2. Risiko for POV95, 96
Forebyggelse og behandling af PONV hos børn
Principperne er som hos voksne, dvs. reduktion af baselinerisiko (Tabel 3) og farmakologisk profylakse og behandling.10, 97, 98 Kombination af stoffer fra forskellige grupper er bedre end monoterapi.10, 97, 98 Ved behandling anvendes stof fra ny gruppe.10, 97, 98

Tabel 3. Antiemetisk strategi under generel anæstesi
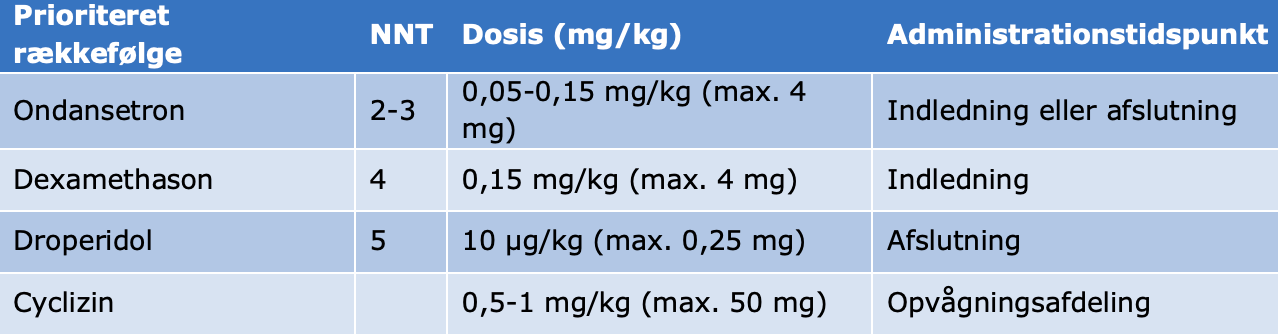
Tabel 4. Dosering til profylakse og behandling af PONV og POV hos børn
Anbefaling
Børn < 3 år har sjældent brug for profylakse. For børn ≥ 3 kan nedenstående anbefales10, 97-99

Tabel 5. Antiemetisk profylakse
Behandling
Anvend stof fra anden stofgruppe (Tabel 4). Cyclizin er ikke anbefalet til børn.99 Det kan forsøges til børn ≥6 år ved svær POV/PONV med utilstrækkelig effekt af ondansetron, dexamethason og droperidol.
Referencer
- Apfel CC, Heidrich FM, Jukar-Rao S, Jalota L, Hornuss C, Whelan RP, Zhang K, Cakmakkaya OS. Evidence-based analysis of risk factors for postoperative nausea and vomiting. Br J Anaesth 2012; 109:742-53.
- Roberts GW, Bekker TB, Carlsen HH, Moffatt CH, Slattery PJ, McClure AF. Postoperative nausea and vomiting are strongly influenced by postoperative opioid use in a dose-related manner. Anesth Analg 2005; 101:1343-8.
- Choi JB, Shim YH, Lee YW, Lee JS, Choi JR, Chang CH. Incidence and risk factors of postoperative nausea and vomiting in patients with fentanyl-based intravenous patientcontrolled analgesia and single antiemetic prophylaxis. Yonsei Med J 2014; 55:1430-5.
- Tramer M, Moore A, McQuay H. Propofol anaesthesia and postoperative nausea and vomiting: quantitative systematic review of randomized controlled studies. Br J Anaesth 1997; 78:247-55.
- Akkurt BC, Temiz M, Inanoglu K, Aslan A, Turhanoglu S, Asfuroglu Z, Canbolant E. Comparison of recovery characteristics, postoperative nausea and vomiting, and gastrointestinal motility with total intravenous anesthesia with propofol versus inhalation anesthesia with desflurane for laparoscopic cholecystectomy: A randomized controlled study. Curr Ther Res Clin Exp 2009; 70:94-103.
- Kumar G, Stendall C, Mistry R, Gurusamy K, Walker D. A comparison of total intravenous anaesthesia using propofol with sevoflurane or desflurane in ambulatory surgery: systematic review and meta-analysis. Anaesthesia 2014; 69:1138-50.
- Visser K, Hassink EA, Bonsel GJ, Moen J, Kalkman CJ. Randomized controlled trial of total intravenous anesthesia with propofol versus inhalation anesthesia with isoflurane-nitrous oxide: postoperative nausea with vomiting and economic analysis. Anesthesiology 2001; 95:616-26.
- Orhon ZN, Devrim S, Celik M, Dogan Y, Yildirim A, Basok EK. Comparison of recovery profiles of propofol and sevoflurane anesthesia with bispectral index monitoring in percutaneous nephrolithotomy. Korean J Anesthesiol 2013; 64:223-8.
- Liu SS, Strodtbeck WM, Richman JM, Wu CL. A comparison of regional versus general anesthesia for ambulatory anesthesia: a meta-analysis of randomized controlled trials. Anesth Analg 2005; 101:1634-42.
- Gan TJ, Diemunsch P, Habib AS, Kovac A, Kranke P, Meyer TA, Watcha M, Chung F, Angus S, Apfel CC, Bergese SD, Candiotti KA, Chan MT, Davis PJ, Hooper VD, Lagoo-Deenadayalan S, Myles P, Nezat G, Philip BK, Tramer MR, Society for Ambulatory Anesthesia. Consensus guidelines for the management of postoperative nausea and vomiting. Anesth Analg 2014; 118:85-113.
- Marret E, Kurdi O, Zufferey P, Bonnet F. Effects of nonsteroidal antiinflammatory drugs on patient-controlled analgesia morphine side effects: meta-analysis of randomized controlled trials. Anesthesiology 2005; 102:1249-60.
- Derry CJ, Derry S, Moore RA. Single dose oral ibuprofen plus paracetamol (acetaminophen) for acute postoperative pain. Cochrane Database Syst Rev 2013; (6):CD010210. doi:CD010210.
- Nir RR, Nahman-Averbuch H, Moont R, Sprecher E, Yarnitsky D. Preoperative preemptive drug administration for acute postoperative pain: A systematic review and metaanalysis. Eur J Pain 2016; 20:1025-43.
- Apfel CC, Turan A, Souza K, Pergolizzi J, Hornuss C. Intravenous acetaminophen reduces postoperative nausea and vomiting: a systematic review and meta-analysis. Pain 2013; 154:677-89.
- Apfel CC, Meyer A, Orhan-Sungur M, Jalota L, Whelan RP, Jukar-Rao S. Supplemental intravenous crystalloids for the prevention of postoperative nausea and vomiting: quantitative review. Br J Anaesth 2012; 108:893-902.
- Handy JM, Soni N. Physiological effects of hyperchloraemia and acidosis. Br J Anaesth 2008; 101:141-50.
- Henzi I, Walder B, Tramer MR. Dexamethasone for the prevention of postoperative nausea and vomiting: a quantitative systematic review. Anesth Analg 2000; 90:186-94.
- Eberhart LH, Morin AM, Georgieff M. Dexamethasone for prophylaxis of postoperative nausea and vomiting. A meta-analysis of randomized controlled studies. Anaesthesist 2000; 49:713-20.
- De Oliveira GS,Jr, Castro-Alves LJ, Ahmad S, Kendall MC, McCarthy RJ. Dexamethasone to prevent postoperative nausea and vomiting: an updated meta-analysis of randomized controlled trials. Anesth Analg 2013; 116:58-74.
- Chu CC, Hsing CH, Shieh JP, Chien CC, Ho CM, Wang JJ. The cellular mechanisms of the antiemetic action of dexamethasone and related glucocorticoids against vomiting. Eur J Pharmacol 2014; 722:48-54.
- Liu K, Hsu CC, Chia YY. The effective dose of dexamethasone for antiemesis after major gynecological surgery. Anesth Analg 1999; 89:1316-8.
- Eberhart LH, Graf J, Morin AM, Stief T, Kalder M, Lattermann R, Schricker T. Randomised controlled trial of the effect of oral premedication with dexamethasone on hyperglycaemic response to abdominal hysterectomy. Eur J Anaesthesiol 2011; 28:195-201.
- Judd LL, Schettler PJ, Brown ES, Wolkowitz OM, Sternberg EM, Bender BG, Bulloch K, Cidlowski JA, de Kloet ER, Fardet L, Joels M, Leung DY, McEwen BS, Roozendaal B, Van Rossum EF, Ahn J, Brown DW, Plitt A, Singh G. Adverse consequences of glucocorticoid medication: psychological, cognitive, and behavioral effects. Am J Psychiatry 2014; 171:1045- 51.
- Bellis JR, Pirmohamed M, Nunn AJ, Loke YK, De S, Golder S, Kirkham JJ. Dexamethasone and haemorrhage risk in paediatric tonsillectomy: a systematic review and meta-analysis. Br J Anaesth 2014; 113:23-42.
- Novak E, Gilbertson TJ, Seckman CE, Stewart RD, DiSanto AR, Stubbs SS. Anorectal pruritus after intravenous hydrocortisone sodium succinate and sodium phosphate. Clin Pharmacol Ther 1976; 20:109-12.
- Perron G, Dolbec P, Germain J, Bechard P. Perineal pruritus after i.v. dexamethasone administration. Can J Anaesth 2003; 50:749-50.
- Duggan DE, Yeh KC, Matalia N, Ditzler CA, McMahon FG. Bioavailability of oral dexamethasone. Clin Pharmacol Ther 1975; 18:205-9.
- Aouad MT, Nasr VG, Yazbeck-Karam VG, Bitar MA, Bou Khalil M, Beyrouthy O, Harfouche D, Terrin N, Siddik-Sayyid S. A comparison between dexamethasone and methylprednisolone for vomiting prophylaxis after tonsillectomy in inpatient children: a randomized trial. Anesth Analg 2012; 115:913-20.
- Watcha MF, White PF. Postoperative nausea and vomiting. Its etiology, treatment, and prevention. Anesthesiology 1992; 77:162-84.
- Tramer MR, Reynolds DJ, Moore RA, McQuay HJ. Efficacy, dose-response, and safety of ondansetron in prevention of postoperative nausea and vomiting: a quantitative systematic review of randomized placebo-controlled trials. Anesthesiology 1997; 87:1277-89.
- Apfel CC, Korttila K, Abdalla M, Kerger H, Turan A, Vedder I, Zernak C, Danner K, Jokela R, Pocock SJ, Trenkler S, Kredel M, Biedler A, Sessler DI, Roewer N, IMPACT Investigators. A factorial trial of six interventions for the prevention of postoperative nausea and vomiting. N Engl J Med 2004; 350:2441-51.
- Hsu ES. A review of granisetron, 5-hydroxytryptamine3 receptor antagonists, and other antiemetics. Am J Ther 2010; 17:476-86.
- Wong EH, Clark R, Leung E, Loury D, Bonhaus DW, Jakeman L, Parnes H, Whiting RL, Eglen RM. The interaction of RS 25259-197, a potent and selective antagonist, with 5-HT3 receptors, in vitro. Br J Pharmacol 1995; 114:851-9.
- Carlisle JB, Stevenson CA. Drugs for preventing postoperative nausea and vomiting. Cochrane Database Syst Rev 2006; (3):CD004125.
- Habib AS, El-Moalem HE, Gan TJ. The efficacy of the 5-HT3 receptor antagonists combined with droperidol for PONV prophylaxis is similar to their combination with dexamethasone. A meta-analysis of randomized controlled trials. Can J Anaesth 2004; 51:311-9.
- Figueredo ED, Canosa LG. Ondansetron in the prophylaxis of postoperative vomiting: a meta-analysis. J Clin Anesth 1998; 10:211-21.
- Scuderi P, Wetchler B, Sung YF, Mingus M, DuPen S, Claybon L, Leslie J, Talke P, Apfelbaum J, Sharifi-Azad S. Treatment of postoperative nausea and vomiting after outpatient surgery with the 5-HT3 antagonist ondansetron. Anesthesiology 1993; 78:15-20.
- Kazemi-Kjellberg F, Henzi I, Tramer MR. Treatment of established postoperative nausea and vomiting: a quantitative systematic review. BMC Anesthesiol 2001; 1:2.
- Kovac AL, O’Connor TA, Pearman MH, Kekoler LJ, Edmondson D, Baughman VL, Angel JJ, Campbell C, Jense HG, Mingus M, Shahvari MB, Creed MR. Efficacy of repeat intravenous dosing of ondansetron in controlling postoperative nausea and vomiting: a randomized, double-blind, placebo-controlled multicenter trial. J Clin Anesth 1999; 11:453-9.
- Brygger L, Herrstedt J, Academy of Geriatric Cancer Research (AgeCare). 5- Hydroxytryptamine3 receptor antagonists and cardiac side effects. Expert Opin Drug Saf 2014; 13:1407-22.
- Freedman SB, Uleryk E, Rumantir M, Finkelstein Y. Ondansetron and the risk of cardiac arrhythmias: a systematic review and postmarketing analysis. Ann Emerg Med 2014; 64:19,25.e6.
- D’Angelo R, Philip B, Gan TJ, Kovac A, Hantler C, Doblar D, Melson T, Minkowitz H, Dalby P, Coop A. A randomized, double-blind, close-ranging, pilot study of intravenous granisetron in the prevention of postoperative nausea and vomiting in patients abdominal hysterectomy. Eur J Anaesthesiol 2005; 22:774-9.
- White PF, Tang J, Hamza MA, Ogunnaike B, Lo M, Wender RH, Naruse R, Sloninsky A, Kariger R, Cunneen S, Khalili T. The use of oral granisetron versus intravenous ondansetron for antiemetic prophylaxis in patients undergoing laparoscopic surgery: the effect on emetic symptoms and quality of recovery. Anesth Analg 2006; 102:1387-93.
- Bhatnagar S, Gupta D, Mishra S, Srikanti M, Singh M, Arora R. Preemptive antiemesis in patients undergoing modified radical mastectomy: oral granisetron versus oral ondansetron in a double-blind, randomized, controlled study. J Clin Anesth 2007; 19:512-6.
- Metaxari M, Papaioannou A, Petrou A, Chatzimichali A, Pharmakalidou E, Askitopoulou H. Antiemetic prophylaxis in thyroid surgery: a randomized, double-blind comparison of three 5-HT3 agents. J Anesth 2011; 25:356-62.
- Kranke P, Apfel CC, Eberhart LH, Georgieff M, Roewer N. The influence of a dominating centre on a quantitative systematic review of granisetron for preventing postoperative nausea and vomiting. Acta Anaesthesiol Scand 2001; 45:659-70.
- Rasmussen LS, Dahl JB. Meta-analysis – a valuable but easily misused tool. Acta Anaesthesiol Scand 2001; 45:657-8.
- Lee WS, Lee KB, Lim S, Chang YG. Comparison of palonosetron, granisetron, and ramosetron for the prevention of postoperative nausea and vomiting after laparoscopic gynecologic surgery: a prospective randomized trial. BMC Anesthesiol 2015; 15:121,015- 0102-0.
- Upward JW, Arnold BD, Link C, Pierce DM, Allen A, Tasker TC. The clinical pharmacology of granisetron (BRL 43694), a novel specific 5-HT3 antagonist. Eur J Cancer 1990; 26 Suppl 1:S12-5.
- Candiotti KA, Nhuch F, Kamat A, Deepika K, Arheart KL, Birnbach DJ, Lubarsky DA. Granisetron versus ondansetron treatment for breakthrough postoperative nausea and vomiting after prophylactic ondansetron failure: a pilot study. Anesth Analg 2007; 104:1370,3, table of contents.
- Schaub I, Lysakowski C, Elia N, Tramer MR. Low-dose droperidol (</=1 mg or </=15 mug kg-1) for the prevention of postoperative nausea and vomiting in adults: quantitative systematic review of randomised controlled trials. Eur J Anaesthesiol 2012; 29:286-94.
- Eberhart LH, Morin AM, Seeling W, Bothner U, Georgieff M. Meta-analysis of controlled randomized studies on droperidol for prevention of postoperative phase vomiting and nausea. Anasthesiol Intensivmed Notfallmed Schmerzther 1999; 34:528-36.
- Henzi I, Sonderegger J, Tramer MR. Efficacy, dose-response, and adverse effects of droperidol for prevention of postoperative nausea and vomiting. Can J Anaesth 2000; 47:537-51.
- Buttner M, Walder B, von Elm E, Tramer MR. Is low-dose haloperidol a useful antiemetic?: A meta-analysis of published and unpublished randomized trials. Anesthesiology 2004; 101:1454-63.
- De Oliveira GS,Jr, Castro-Alves LJ, Chang R, Yaghmour E, McCarthy RJ. Systemic metoclopramide to prevent postoperative nausea and vomiting: a meta-analysis without Fujii’s studies. Br J Anaesth 2012; 109:688-97.
- Mishriky BM, Habib AS. Metoclopramide for nausea and vomiting prophylaxis during and after Caesarean delivery: a systematic review and meta-analysis. Br J Anaesth 2012; 108:374-83.
- Henzi I, Walder B, Tramer MR. Metoclopramide in the prevention of postoperative nausea and vomiting: a quantitative systematic review of randomized, placebo-controlled studies. Br J Anaesth 1999; 83:761-71.
- Wu SJ, Xiong XZ, Cheng TY, Lin YX, Cheng NS. Efficacy of ondansetron vs. metoclopramide in prophylaxis of postoperative nausea and vomiting after laparoscopic 28 cholecystectomy: a systematic review and meta-analysis. Hepatogastroenterology 2012; 59:2064-74.
- Schnabel A, Eberhart LH, Muellenbach R, Morin AM, Roewer N, Kranke P. Efficacy of perphenazine to prevent postoperative nausea and vomiting: a quantitative systematic review. Eur J Anaesthesiol 2010; 27:1044-51.
- Domino KB, Anderson EA, Polissar NL, Posner KL. Comparative efficacy and safety of ondansetron, droperidol, and metoclopramide for preventing postoperative nausea and vomiting: a meta-analysis. Anesth Analg 1999; 88:1370-9.
- Gan TJ. Mechanisms underlying postoperative nausea and vomiting and neurotransmitter receptor antagonist-based pharmacotherapy. CNS Drugs 2007; 21:813-33.
- Kranke P, Morin AM, Roewer N, Eberhart LH. Dimenhydrinate for prophylaxis of postoperative nausea and vomiting: a meta-analysis of randomized controlled trials. Acta Anaesthesiol Scand 2002; 46:238-44.
- Turner KE, Parlow JL, Avery ND, Tod DA, Day AG. Prophylaxis of postoperative nausea and vomiting with oral, long-acting dimenhydrinate in gynecologic outpatient laparoscopy. Anesth Analg 2004; 98:1660,4, table of contents.
- Voigt M, Frohlich CW, Huttel C, Kranke P, Mennen J, Boessneck O, Lenz C, Erbes T, Ernst J, Kerger H. Prophylaxis of intra- and postoperative nausea and vomiting in patients during cesarean section in spinal anesthesia. Med Sci Monit 2013; 19:993-1000.
- Voigt M, Frohlich CW, Waschke KF, Lenz C, Gobel U, Kerger H. Prophylaxis of postoperative nausea and vomiting in elective breast surgery. J Clin Anesth 2011; 23:461-8.
- Nakagawachi A, Yoshino J, Miura D, Izumi K, Jimi N, Sumiyoshi R, Mizuno K. Prophylactic effect of diphenhydramine on postoperative vomiting in children after laparoscopic surgery. Masui 2012; 61:988-92.
- Nortcliffe SA, Shah J, Buggy DJ. Prevention of postoperative nausea and vomiting after spinal morphine for Caesarean section: comparison of cyclizine, dexamethasone and placebo. Br J Anaesth 2003; 90:665-70.
- Johns RA, Hanousek J, Montgomery JE. A comparison of cyclizine and granisetron alone and in combination for the prevention of postoperative nausea and vomiting. Anaesthesia 2006; 61:1053-7.
- Grimsehl K, Whiteside JB, Mackenzie N. Comparison of cyclizine and ondansetron for the prevention of postoperative nausea and vomiting in laparoscopic day-case gynaecological surgery. Anaesthesia 2002; 57:61-5.
- Ahmed AB, Hobbs GJ, Curran JP. Randomized, placebo-controlled trial of combination antiemetic prophylaxis for day-case gynaecological laparoscopic surgery. Br J Anaesth 2000; 85:678-82.
- Cholwill JM, Wright W, Hobbs GJ, Curran J. Comparison of ondansetron and cyclizine for prevention of nausea and vomiting after day-case gynaecological laparoscopy. Br J Anaesth 1999; 83:611-4.
- Bopp EJ, Estrada TJ, Kilday JM, Spradling JC, Daniel C, Pellegrini JE. Biphasic dosing regimen of meclizine for prevention of postoperative nausea and vomiting in a high-risk population. AANA J 2010; 78:55-62.
- Forrester CM, Benfield DA,Jr, Matern CE, Kelly JA, Pellegrini JE. Meclizine in combination with ondansetron for prevention of postoperative nausea and vomiting in a highrisk population. AANA J 2007; 75:27-33.
- McKenzie R, Wadhwa RK, Uy NT, Phitayakorn P, Tantisira B, Sinchioco C, Taylor FH. Antiemetic effectiveness of intramuscular hydroxyzine compared with intramuscular droperidol. Anesth Analg 1981; 60:783-8.
- Gan TJ, Candiotti KA, Klein SM, Rodriguez Y, Nielsen KC, White WD, Habib AS. Double-blind comparison of granisetron, promethazine, or a combination of both for the prevention of postoperative nausea and vomiting in females undergoing outpatient laparoscopies. Can J Anaesth 2009; 56:829-36.
- Khalil S, Philbrook L, Rabb M, Wells L, Aves T, Villanueva G, Amhan M, Chuang AZ, Lemak NA. Ondansetron/promethazine combination or promethazine alone reduces nausea and vomiting after middle ear surgery. J Clin Anesth 1999; 11:596-600.
- Parlow JL, Meikle AT, van Vlymen J, Avery N. Post discharge nausea and vomiting after ambulatory laparoscopy is not reduced by promethazine prophylaxis. Can J Anaesth 1999; 46:719-24.
- Habib AS, Reuveni J, Taguchi A, White WD, Gan TJ. A comparison of ondansetron with promethazine for treating postoperative nausea and vomiting in patients who received prophylaxis with ondansetron: a retrospective database analysis. Anesth Analg 2007; 104:548-51.
- Habib AS, Gan TJ. The effectiveness of rescue antiemetics after failure of prophylaxis with ondansetron or droperidol: a preliminary report. J Clin Anesth 2005; 17:62-5.
- Kreisler NS, Spiekermann BF, Ascari CM, Rhyne HA, Kloth RL, Sullivan LM, Durieux ME. Small-dose droperidol effectively reduces nausea in a general surgical adult patient population. Anesth Analg 2000; 91:1256-61.
- Deitrick CL, Mick DJ, Lauffer V, Prostka E, Nowak D, Ingersoll G. A comparison of two differing doses of promethazine for the treatment of postoperative nausea and vomiting. J Perianesth Nurs 2015; 30:5-13.
- Apfel CC, Zhang K, George E, Shi S, Jalota L, Hornuss C, Fero KE, Heidrich F, Pergolizzi JV, Cakmakkaya OS, Kranke P. Transdermal scopolamine for the prevention of postoperative nausea and vomiting: a systematic review and meta-analysis. Clin Ther 2010; 32:1987-2002.
- Kranke P, Morin AM, Roewer N, Wulf H, Eberhart LH. The efficacy and safety of transdermal scopolamine for the prevention of postoperative nausea and vomiting: a quantitative systematic review. Anesth Analg 2002; 95:133,43, table of contents.
- Ure D, James KS, McNeill M, Booth JV. Glycopyrrolate reduces nausea during spinal anaesthesia for caesarean section without affecting neonatal outcome. Br J Anaesth 1999; 82:277-9.
- Wu CL, Berenholtz SM, Pronovost PJ, Fleisher LA. Systematic review and analysis of postdischarge symptoms after outpatient surgery. Anesthesiology 2002; 96:994-1003.
- Gupta A, Wu CL, Elkassabany N, Krug CE, Parker SD, Fleisher LA. Does the routine prophylactic use of antiemetics affect the incidence of postdischarge nausea and vomiting following ambulatory surgery?: A systematic review of randomized controlled trials. Anesthesiology 2003; 99:488-95.
- Brookes CD, Turvey TA, Phillips C, Kopp V, Anderson JA. Postdischarge Nausea and Vomiting Remains Frequent After Le Fort I Osteotomy Despite Implementation of a Multimodal Antiemetic Protocol Effective in Reducing Postoperative Nausea and Vomiting. J Oral Maxillofac Surg 2015; 73:1259-66.
- Apfel CC, Philip BK, Cakmakkaya OS, Shilling A, Shi YY, Leslie JB, Allard M, Turan A, Windle P, Odom-Forren J, Hooper VD, Radke OC, Ruiz J, Kovac A. Who is at risk for postdischarge nausea and vomiting after ambulatory surgery? Anesthesiology 2012; 117:475- 86.
- Gupta A, Stierer T, Zuckerman R, Sakima N, Parker SD, Fleisher LA. Comparison of recovery profile after ambulatory anesthesia with propofol, isoflurane, sevoflurane and desflurane: a systematic review. Anesth Analg 2004; 98:632,41, table of contents.
- Mattila K, Toivonen J, Janhunen L, Rosenberg PH, Hynynen M. Postdischarge symptoms after ambulatory surgery: first-week incidence, intensity, and risk factors. Anesth Analg 2005; 101:1643-50.
- Odom-Forren J, Jalota L, Moser DK, Lennie TA, Hall LA, Holtman J, Hooper V, Apfel CC. Incidence and predictors of postdischarge nausea and vomiting in a 7-day population. J Clin Anesth 2013; 25:551-9.
- White PF, Sacan O, Nuangchamnong N, Sun T, Eng MR. The relationship between patient risk factors and early versus late postoperative emetic symptoms. Anesth Analg 2008; 107:459-63.
- Pan PH, Lee SC, Harris LC. Antiemetic prophylaxis for postdischarge nausea and vomiting and impact on functional quality of living during recovery in patients with high emetic risks: a prospective, randomized, double-blind comparison of two prophylactic antiemetic regimens. Anesth Analg 2008; 107:429-38.
- Xiong C, Liu G, Ma R, Xue J, Wu A. Efficacy of palonosetron for preventing postoperative nausea and vomiting: a systematic review and meta-analysis. Can J Anaesth 2015; 62:1268-78.
- Kranke P, Eberhart LH, Toker H, Roewer N, Wulf H, Kiefer P. A prospective evaluation of the POVOC score for the prediction of postoperative vomiting in children. Anesth Analg 2007; 105:1592,7, table of contents.
- Eberhart LH, Geldner G, Kranke P, Morin AM, Schauffelen A, Treiber H, Wulf H. The development and validation of a risk score to predict the probability of postoperative vomiting in pediatric patients. Anesth Analg 2004; 99:1630,7, table of contents.
- Hohne C. Postoperative nausea and vomiting in pediatric anesthesia. Curr Opin Anaesthesiol 2014; 27:303-8.
- Kovac AL. Management of postoperative nausea and vomiting in children. Paediatr Drugs 2007; 9:47-69.
- Carr A. Guidelines on the Prevention of Post-operative Vomiting in Children. The Association of Paediatric Anesthetists of Great Britain & Ireland 2009.
- Blaudszun G, Lysakowski C, Elia N, Tramer MR. Effect of perioperative systemic alpha2 agonists on postoperative morphine consumption and pain intensity: systematic review and meta-analysis of randomized controlled trials. Anesthesiology 2012; 116:1312-22.
- Shilpa SN, Shailaja S, Hilda SS. Comparison of Efficacy of Clonidine versus Ondansetron for Prevention of Nausea and Vomiting Post Thyroidectomy: A Double Blind Randomized Controlled Trial. J Clin Diagn Res 2015; 9:UC01-3.
- Yadav G, Pratihary BN, Jain G, Paswan AK, Mishra LD. A prospective, randomized, double blind and placebo-control study comparing the additive effect of oral midazolam and clonidine for postoperative nausea and vomiting prophylaxis in granisetron premedicated patients undergoing laparoscopic cholecystecomy. J Anaesthesiol Clin Pharmacol 2013; 29:61- 5.
- Alizadeh R, Mireskandari SM, Azarshahin M, Darabi ME, Padmehr R, Jafarzadeh A, Aghsaee-Fard Z. Oral clonidine premedication reduces nausea and vomiting in children after appendectomy. Iran J Pediatr 2012; 22:399-403.
- Liang X, Zhou M, Feng JJ, Wu L, Fang SP, Ge XY, Sun HJ, Ren PC, Lv X. Efficacy of dexmedetomidine on postoperative nausea and vomiting: a meta-analysis of randomized controlled trials. Int J Clin Exp Med 2015; 8:8450-71.
- Gurbet A, Basagan-Mogol E, Turker G, Ugun F, Kaya FN, Ozcan B. Intraoperative infusion of dexmedetomidine reduces perioperative analgesic requirements. Can J Anaesth 2006; 53:646-52.
- Shin HW, Yoo HN, Kim DH, Lee H, Shin HJ, Lee HW. Preanesthetic dexmedetomidine 1 microg/kg single infusion is a simple, easy, and economic adjuvant for general anesthesia. Korean J Anesthesiol 2013; 65:114-20.
- Makhdoom NK, Farid MF. Prophylactic antiemetic effects of midazolam, dexamethasone, and its combination after middle ear surgery. Saudi Med J 2009; 30:504-8.
- Yeo J, Jung J, Ryu T, Jeon YH, Kim S, Baek W. Antiemetic efficacy of dexamethasone combined with midazolam after middle ear surgery. Otolaryngol Head Neck Surg 2009; 141:684-8.
- Ahn EJ, Kang H, Choi GJ, Baek CW, Jung YH, Woo YC. The Effectiveness of Midazolam for Preventing Postoperative Nausea and Vomiting: A Systematic Review and MetaAnalysis. Anesth Analg 2016; 122:664-76.
- Hasani A, Maloku H, Sallahu F, Gashi V, Ozgen SU. Preemptive analgesia with midazolam and diclofenac for hernia repair pain. Hernia 2011; 15:267-72.
- Alayed N, Alghanaim N, Tan X, Tulandi T. Preemptive use of gabapentin in abdominal hysterectomy: a systematic review and meta-analysis. Obstet Gynecol 2014; 123:1221-9.
- Achuthan S, Singh I, Varthya SB, Srinivasan A, Chakrabarti A, Hota D. Gabapentin prophylaxis for postoperative nausea and vomiting in abdominal surgeries: a quantitative analysis of evidence from randomized controlled clinical trials. Br J Anaesth 2015; 114:588-97.
- Pandey CK, Priye S, Singh S, Singh U, Singh RB, Singh PK. Preemptive use of gabapentin significantly decreases postoperative pain and rescue analgesic requirements in laparoscopic cholecystectomy. Can J Anaesth 2004; 51:358-63.
- Pandey CK, Priye S, Ambesh SP, Singh S, Singh U, Singh PK. Prophylactic gabapentin for prevention of postoperative nausea and vomiting in patients undergoing laparoscopic cholecystectomy: a randomized, double-blind, placebo-controlled study. J Postgrad Med 2006; 52:97-100.
- Heidari M, Honarmand A, Safavi M, Chitsazi M, Khalighinejad F. Geranisetron versus gabapentin in preventing postoperative nausea and vomiting after middle ear surgery in adults: A double-blinded randomized clinical trial study. Adv Biomed Res 2015; 4:22,9175.150388. eCollection 2015.
- Jahromi HE, Gholami M, Rezaei F. A randomized double-blinded placebo controlled study of four interventions for the prevention of postoperative nausea and vomiting in maxillofacial trauma surgery. J Craniofac Surg 2013; 24:e623-7.
- Misra S, Parthasarathi G, Vilanilam GC. The effect of gabapentin premedication on postoperative nausea, vomiting, and pain in patients on preoperative dexamethasone undergoing craniotomy for intracranial tumors. J Neurosurg Anesthesiol 2013; 25:386-91.
- Chang FL, Ho ST, Sheen MJ. Efficacy of mirtazapine in preventing intrathecal morphine-induced nausea and vomiting after orthopaedic surgery*. Anaesthesia 2010; 65:1206-11.
- Chen CC, Lin CS, Ko YP, Hung YC, Lao HC, Hsu YW. Premedication with mirtazapine reduces preoperative anxiety and postoperative nausea and vomiting. Anesth Analg 2008; 106:109,13, table of contents.
- Celik M, Dostbil A, Aksoy M, Ince I, Ahiskalioglu A, Comez M, Erdem AF. Is infusion of subhypnotic propofol as effective as dexamethasone in prevention of postoperative nausea and vomiting related to laparoscopic cholecystectomy? A randomized controlled trial. Biomed Res Int 2015; 2015:349806.
- Kawano H, Ohshita N, Katome K, Kadota T, Kinoshita M, Matsuoka Y, Tsutsumi YM, Kawahito S, Tanaka K, Oshita S. Effects of a novel method of anesthesia combining propofol and volatile anesthesia on the incidence of postoperative nausea and vomiting in patients undergoing laparoscopic gynecological surgery. Braz J Anesthesiol 2016; 66:12-8.
- Gan TJ, Belani KG, Bergese S, Chung F, Diemunsch P, Habib AS, m.fl. Fourth Consensus Guidelines for the Management of Postoperative Nausea and Vomiting. Anesth Analg. august 2020;131(2):411–48.
Bilag nr. 1

Gan TJ, Belani KG, Bergese S, Chung F, Diemunsch P, Habib AS, m.fl. Fourth Consensus Guidelines for the Management of Postoperative Nausea and Vomiting. Anesth Analg. august 2020;131(2):411–48.
Appendix 1 – Alternative stofgrupper
a2-agonister
Litteratursøgning
Der blev søgt på pubmed med følgende søgestrenge: “Postoperative Nausea and Vomiting”[Mesh] AND “Clonidine”[Mesh] og “Postoperative Nausea and Vomiting”[Mesh] AND “Dexmedetomidine”[Mesh]. Samt ”PONV AND clonidine/Dexmedetomidine” og ”Adrenergic agonist; Alpha2; Postoperative nausea and vomiting” i freetext. 208 Hits blev gennemgået ved abstracts. Heraf blev de nyeste review og metaanalyser samt artikler udgivet efter den seneste metaanalyse valgt ud til i alt 7 artikler.
Virkningsmåde
a2-agonister har farmakologiske effekter i form af sedation, anxiolyse, analgesi og sympatolyse. Deres antinociceptive effekt skyldes primært stimulation af præsynaptiske inhiberende a2-adrenoreceptorer i CNS og medulla spinalis.
Clonidin
Clonidin er primært undersøgt mht. den opioidbesparende effekt. En metaanalyse fra 2011 beskriver dog effekt på PONV indtil 8 timer postoperativt med NNT på 8,9,100 men er baseret på studier med varierende dosering og administrationstidspunkt. Et nyere studie sammenlignede effekten af clonidin 150 µg vs ondansetron 8mg p.o. præoperativt. Der var her bedre effekt af ondansetron på PONV, men bedre analgesi og mindre opioidforbrug i clonidingruppen.101 I en sammenligning mellem granisetron + enten midazolam 15mg, clonidin 150mikrog eller placebo (glucose 5g) ses der bedre effekt af granisetron + clonidin, men stadig væsentlig effekt af af granisetron+midazolam i forhold til placebo.102 Et iransk studie viser god effekt af clonidin på PONV (risiko for PONV 76,7% vs 23,3% ved placebo vs clonidin 4 µg/kg) ved børn der får udført appendektomi.103 Der var ikke forskel i bivirkninger mellem de to grupper.
Konklusion
Studiernes varierende doser og administrationsformer gør det vanskeligt at give en konkret anbefaling af behandling af PONV med clonidin. Clonidin 150 µg p.o. ½-1 time præoperativt kan udgøre en alternativ PONV profylakse med opioidbesparende effekt ved ASA 1-2 patienter, evt. i kombination med andre antiemetika.
Dexmedetomidin
En metaanalyse viser effekt af dexmedetomidin som profylakse til PONV ved bolus fra 0,3-2 µg/kg i.v. (op til 4 µg/kg ved børn) i forhold til placebo. Mest effektiv og hyppigst undersøgt er dosis på 0,5 µg/kg. Der ses ikke bedre effekt end andre antiemetika eller TIVA.104 Der var ikke effekt af dexmedetomidin ved administration epiduralt, intrathekalt eller regionalt. En tidligere metaanalyse viste kun effekt på PONV indtil 8 timer postoperativt.100 Der ses generelt en opioidbesparende effekt både peri- og postoperativt ved brug af dexmedetomidin.100, 105, 106 Primære bivirkninger ved dexmedetomidin er, ligesom ved clonidin, hypotension og bradykardi.
Konklusion
Peroperativ bolus af dexmedetomidin på 0,5 µg/kg i.v. kan benyttes som PONV profylakse med opioidbesparende effekt. Det er en relativt dyr løsning, der ikke frembyder fordele frem for alternativerne.
Midazolam
Litteratursøgning
“Postoperative nausea and vomiting”[MeSH Terms] OR PONV[Text Word] AND midazolam gav 149 hits. Søgningen blev begrænset til review og gav 16 hits. Heraf blev der udvalgt studier på baggrund af dato og relevans. Virkningsmåde Midazolam er et hurtigt elimineret benzodiazepin. Det binder til de centrale benzodiazepinreceptorer og til GABAA-receptorerne, der er lokaliseret til chloridionkanal-komplekset. Benzodiazepiner har ingen selvstændig effekt, men forstærker virkningen af GABA (gammaaminobutyrsyre), som er en hæmmende neurotransmitter.
Baggrund
Midazolam 2 mg i.v. 30 minutter før afslutning af operation har effekt på PONV svarende til 4 mg ondansetron.10 Der er additiv effekt af midazolam 75 µg/kg + dexamethason 10mg i forhold til de enkelte produkter som monoterapi, hvor de er ækvivalente.107, 108 En metaanalyse med 16 studier viser positiv effekt af midazolam på PONV med RR 0.45; 95% CI, 0.36–0.57; I2 = 31%; NNT = 3; n = 7.109 Dosis i studierne varierede fra fast dosis 2-5 mg til vægtafhængig dosis på 35-75 µg/kg. Kun et enkelt studie har undersøgt effekt af midazolam + diclofenac ved TIVA anæstesi. Man fandt her signifikant effekt på PONV og bedre postoperativ analgesi end ved placebo og diclofenac alene.110 Der kunne ikke findes studier om midazolam som rescue antiemetikum. Et studie har vist nedsat ”late onset PONV” ved postoperativ PCA infusion tilsat midazolam.13
Bivirkninger
Der kunne ikke påvises signifikante bivirkninger i forhold til kontrolgrupperne ved metaanalysen, men enkelte studier har vist længere sedationstid i midazolamgruppen.
Konklusion
Midazolam vurderes på de nuværende studier at være et sikkert alternativ til behandling af PONV ved ASA I-II patienter. En dosis på 2-5mg i.v. ved induktion eller 2 mg i.v. 30 minutter før afslutning af anæstesi er det mest undersøgte og forslås derfor.
Gabapentin
Litteratursøgning
En pubmed søgning på “postoperative nausea and vomiting”[MeSH Terms] OR (“postoperative”[All Fields] AND “nausea”[All Fields] AND “vomiting”[All Fields]) OR “postoperative nausea and vomiting”[All Fields] OR “ponv”[All Fields]) AND (“gabapentin”[Supplementary Concept] OR “gabapentin”[All Fields]) AND Review[ptyp] gav 13 hits, hvorfra artiklerne blev valgt ud fra abstracts. Dette blev suppleret med følgende søgning 37 “postoperative nausea and vomiting”[MeSH Terms] AND (“gabapentin”[Supplementary Concept] OR “gabapentin”[All Fields]) hvorfra der blev søgt efter litteratur med publikation efter den inkluderede i seneste metaanalyse. Der var her ingen fund.
Virkningsmåde
Gabapentin binder sig til α2δ-underenheden af de spændingsafhængige calciumkanaler, hvorved bl.a. frisætningen af glutamat, noradrenalin og substans P hæmmes. Den præcise virkning mht. PONV er uklar, men kan muligvis relateres til den analgetiske effekt.
Baggrund
Gabapentin som profylakse mod PONV har i de fleste studier et positivt udfald. En metaanalyse fra 2014 med 14 studier baseret på abdominal hysterektomi, uden regional analgesi, viser for PON en RR 0,76 (CI 0,66-0,88) og for POV en RR 0,67 (CI 0,52-0,87).111 Der er i studierne anvendt 300-1800 mg doser præoperativt og eventuelt postoperativt, men der kunne ikke vises effektforskel på doserne. Metaanalysen viste generelt et bedre outcome for postoperative smerter og mindre opioidforbrug end for PONV. Achutan et al.112 kunne ikke vise den samme effekt ved en metaanalyse på intraabdominale indgreb, der ikke var signifikant forskel på gabapentin ved PONV overfor placebo med RR 0,71 (CI 0,39-1,28). Såfremt studier der benyttede propofol blev ekskluderet fra metaanalysen var der dog signifikant effekt. Analysen viste igen en markant effekt på postoperative smerter og opioidforbrug. Metaanalysen er præget af et enkelt studie af Pandey et al.113 fra 2004, der viser en markant øget risiko for PONV ved præmedicinering med 300 mg Gabapentin. Samme forfatter finder dog i et studie fra 2006 en markant nedsat risiko for PONV ved samme patientgruppe, men her med en dosering af 600 mg gabapentin som præmedicin.114 Heidari et al. har vist ligeværdig effekt på PONV af Gabapentin 300 mg p.o. præoperativt overfor granisetron 3 mg i.v. og bedre effekt overfor placebo ved ØNH kirurgi.115 Jahromi et al viste ligeværdig effekt på PONV af 300mg gabapentin eller 10mg metoclopramid ved maxillofacial traume kirurgi i forhold til dexaven 5mg og placebo.116 Misra et al.117 undersøgte effekten af Gabapentin 600 mg præoperativt som supplement til dexamethason 4 mg ved kraniotomi. Der var signifikant effekt på POV, PONV og mindre brug af rescue antiemetika. Som et af de få studier var der ikke effekt på postoperative smerter og opioidbehov.
Bivirkninger
Enkelte studier viser bivirkninger i form af sløvhed og svimmelhed. Der kunne ikke vises signifikante bivirkninger i metaanalyserne.
Konklusion
Der er moderat effekt af Gabapentin på PONV. Herudover er der i de fleste studier væsentlig effekt på postoperative smerter og behov for opioider. Dosering kan på basis af tilgængelig litteratur ikke anbefales at overskride 600 mg præoperativt. Det er vurderet sikkert at benytte til ASA I-II patienter og med minimale bivirkninger i anbefalede dosis.
Mirtazapin
Litteratursøgning
Pubmed søgning på “postoperative nausea and vomiting”[MeSH Terms] OR (“postoperative”[All Fields] AND “nausea”[All Fields] AND “vomiting”[All Fields]) OR “postoperative nausea and vomiting”[All Fields] OR “ponv”[All Fields]) AND (“mirtazapine”[Supplementary Concept] OR “mirtazapine”[All Fields] gav 6 hits. Litteratur blev valgt på baggrund af abstracts.
Virkningsmåde
Mirtazapin er en α2-receptorantagonist der øger frigørelsen af noradrenalin og dermed øget frigørelse af serotonin. Herudover virker mirtazapin som antagonist på flere serotoninreceptorer og på histamin H1-receptoren.
Baggrund
Mirtazapin er sparsomt undersøgt, men et studie viser effekt på PONV ved spinal anæstesi med bupivacain tilsat opioid.118 Herudover er det vist at have synergistisk effekt med dexamethason 8 mg ved laparoskopisk gynækologi, ligesom det nedsatte præoperativ angst.119
Bivirkninger
Der blev ikke påvist bivirkninger i studierne.
Konklusion
Mirtazapin 30 mg p.o. præoperativt kan forsøges til PONV profylakse, men kan ikke anbefales som førstevalg.
Propofol
Litteratursøgning
Referencer er fundet i Gan et al. ”Consensus guidelines for the management of postoperative nausea and vomiting”.
Baggrund
Ved brug af propofol til indledning eller vedligehold af anæstesi ses der betydelig reduktion i PONV i forhold til inhalationsanæstesi.10 Se afsnit om baseline reduktion. Propofol i subhypnotiske doser under inhalationsanæstesi er dog også vist at have positiv effekt på PONV. Med propofol som bolus 1 mg/kg + infusion 20 µg/kg/min10 og ved infusion 1-2 mg/kg/t20, 121 under inhalationsanæstesi er der vist positiv effekt på PONV svarende til 4 mg ondansetron eller 4 mg dexamethason. Propofol som ”rescue” medicin er undersøgt i dosis på 20 mg. Der er her effekt svarende til ondansetron 1mg, men virkningen aftager hurtigt.8
Konklusion
Propofol tilrådes primært som baselinereduktion i form af TIVA. Såfremt der benyttes inhalationsanæstesi kan en subhypnotisk dosis af propofol eventuelt benyttes.
Appendix 2 – Interessekonflikter
Sven Felsby har deltaget i advisory board ifm. dansk markedsføring af sugammadex.
Appendix 3 – Litteraturgennemgang til revisionen af vejledningen 2020
Reduktion af baselinerisiko for PONV
Der blev anvendt følgende søgestreng i PubMed: “Postoperative Nausea and Vomiting”[Mesh] med følgende filtre: Meta-Analysis, Systematic Reviews, in the last 5 years. Dette giver 122 hits. Summery læses igennem for disse 122 referencer og kun 12 referencer findes relevante for emnet (3–14). Abstract læses igennem for disse referencer og ingen af disse giver anledning til ændring af anbefalingerne.
Glukokortikoider
Der blev anvendt følgende søgestreng i PubMed: (“Glucocorticoids”[Mesh] AND “Postoperative Nausea and Vomiting”[Mesh]) med følgende filtre: Meta-Analysis, Systematic Reviews, in the last 5 years. Dette giver 10 hits (15–24). Abstract læses igennem for disse referencer og ingen af disse giver anledning til ændring af anbefalingerne.
5-HT3-receptorantagonister
Der blev anvendt følgende søgestreng i PubMed: (“Serotonin 5-HT3 Receptor Antagonists”[Mesh]) AND “Postoperative Nausea and Vomiting”[Mesh] med følgende filtre: Meta-Analysis, Systematic Reviews, in the last 5 years. Dette giver 4 hits (25–28). Abstract læses igennem for disse referencer og ingen af disse giver anledning til ændring af anbefalingerne.
Dopaminantagonister
Der blev anvendt følgende søgestreng i PubMed: (“Dopamine Antagonists”[Mesh]) AND “Postoperative Nausea and Vomiting”[Mesh] med følgende filtre: Meta-Analysis, Systematic Reviews, in the last 5 years. Dette giver 0 hits.
Antihistaminer
Der blev anvendt følgende søgestreng i PubMed: “Postoperative Nausea and Vomiting”[Mesh] AND (“Histamine Antagonists”[Mesh] OR “Dimenhydrinate”[Mesh] OR “Clemastine”[Mesh] OR “Cyclizine”[Mesh]) med følgende filtre: Meta-Analysis, Systematic Reviews, in the last 5 years. Dette giver 0 hits.
Antikolinergika
Der blev anvendt følgende søgestreng i PubMed: (“Scopolamine”[Mesh]) AND “Postoperative Nausea and Vomiting”[Mesh] med følgende filtre: Meta-Analysis, Systematic Reviews, in the last 5 years. Dette giver 1 hits (29). Denne giver ikke anledning til ændring af anbefalingerne.
Postoperativ kvalme og opkast efter udskrivelse (PDNV)
Der blev anvendt følgende søgestreng i PubMed: postdischarge nausea OR postdischarge vomiting OR postdischarge nausea vomiting OR late postoperative nausea OR late postoperative vomiting OR late postoperative nausea vomiting med følgende filtre: in the last 5 years. Dette giver 143 hit. Summery læses igennem for disse 143 referencer og kun 6 er relevante for emnet (30–35). Abstract læses igennem for disse referencer og ingen af disse giver anledning til ændring af anbefalingerne.
Forebyggelse og behandling af PONV hos børn
Der blev anvendt følgende søgestreng i PubMed: “Postoperative Nausea and Vomiting”[Mesh] AND (pediatric OR children) med følgende filtre: Meta-Analysis, Systematic Reviews, in the last 5 years. Dette giver 18 hit (36–51). Abstract læses igennem for disse referencer og ingen af disse giver anledning til ændring af anbefalingerne.
Referencer:
- Gan TJ, Belani KG, Bergese S, Chung F, Diemunsch P, Habib AS, m.fl. Fourth Consensus Guidelines for the Management of Postoperative Nausea and Vomiting. Anesth Analg. august 2020;131(2):411–48.
- Gan TJ, Diemunsch P, Habib AS, Kovac A, Kranke P, Meyer TA, m.fl. Consensus guidelines for the management of postoperative nausea and vomiting. Anesth Analg. 2014;118(1):85– 113.
- Jewer JK, Wong MJ, Bird SJ, Habib AS, Parker R, George RB. Supplemental perioperative intravenous crystalloids for postoperative nausea and vomiting. Cochrane database Syst Rev. marts 2019;3(3):CD012212.
- Singh PM, Borle A, Rewari V, Makkar JK, Trikha A, Sinha AC, m.fl. Aprepitant for postoperative nausea and vomiting: a systematic review and meta-analysis. Postgrad Med J. februar 2016;92(1084):87–98.
- Ul Huda A, Jordan RW, Daggett M, Saithna A. Pre-medication with Gabapentin is associated with significant reductions in nausea and vomiting after shoulder arthroscopy: A metaanalysis. Orthop Traumatol Surg Res. december 2019;105(8):1487–93.
- Jewer JK, Wong MJ, Bird SJ, Habib AS, Parker R, George RB. Supplemental peri-operative intravenous crystalloids for postoperative nausea and vomiting: an abridged Cochrane systematic review. Anaesthesia. februar 2020;75(2):254–65.
- Grant MC, Lee H, Page AJ, Hobson D, Wick E, Wu CL. The Effect of Preoperative Gabapentin on Postoperative Nausea and Vomiting: A Meta-Analysis. Anesth Analg. april 2016;122(4):976–85.
- Zorrilla-Vaca A, Marmolejo-Posso D, Stone A, Li J, Grant MC. Perioperative Dextrose Infusion and Postoperative Nausea and Vomiting: A Meta-analysis of Randomized Trials. Anesth Analg. oktober 2019;129(4):943–50.
- Choi GJ, Lee JJ, Seong H-K, Kang H. Pharmacological interventions for preventing postoperative nausea and vomiting in adult patients undergoing ambulatory surgery: Protocol for a systematic review and network meta-analysis. Medicine (Baltimore). juli 2019;98(29):e16605.
- Grant MC, Kim J, Page AJ, Hobson D, Wick E, Wu CL. The Effect of Intravenous Midazolam on Postoperative Nausea and Vomiting: A Meta-Analysis. Anesth Analg. marts 2016;122(3):656–63.
- Grant MC, Betz M, Hulse M, Zorrilla-Vaca A, Hobson D, Wick E, m.fl. The Effect of Preoperative Pregabalin on Postoperative Nausea and Vomiting: A Meta-analysis. Anesth Analg. november 2016;123(5):1100–7.
- Awad K, Ahmed H, Abushouk AI, Al Nahrawi S, Elsherbeny MY, Mustafa SM, m.fl. Dexamethasone combined with other antiemetics versus single antiemetics for prevention of postoperative nausea and vomiting after laparoscopic cholecystectomy: An updated systematic review and meta-analysis. Int J Surg. december 2016;36(Pt A):152–63.
- Jin S, Liang DD, Chen C, Zhang M, Wang J. Dexmedetomidine prevent postoperative nausea and vomiting on patients during general anesthesia: A PRISMAcompliant meta analysis of randomized controlled trials. Medicine (Baltimore). januar 2017;96(1):e5770.
- Kim HJ, Choi SH, Eum D, Kim SH. Is perioperative colloid infusion more effective than crystalloid in preventing postoperative nausea and vomiting?: A systematic review and meta-analysis. Medicine (Baltimore). februar 2019;98(7):e14339.
- Chen P, Li X, Sang L, Huang J. Perioperative intravenous glucocorticoids can decrease postoperative nausea and vomiting and pain in total joint arthroplasty: A metaanalysis and trial sequence analysis. Medicine (Baltimore). marts 2017;96(13):e6382.
- Cui Z, Liu X, Teng Y, Jiang J, Wang J, Xia Y. The efficacy of steroid injection in total knee or hip arthroplasty. Knee Surg Sports Traumatol Arthrosc. august 2015;23(8):2306–14.
- Cheng S-P, Liu T-P, Yang P-S, Lee K-S, Liu C-L. Effect of perioperative dexamethasone on subjective voice quality after thyroidectomy: a meta-analysis and systematic review. Langenbeck’s Arch Surg. december 2015;400(8):929–36.
- Huynh TM, Marret E, Bonnet F. Combination of dexamethasone and local anaesthetic solution in peripheral nerve blocks: A meta-analysis of randomised controlled trials. Eur J Anaesthesiol. november 2015;32(11):751–8.
- Titirungruang C, Seresirikachorn K, Kasemsuwan P, Hirunwiwatkul P. The use of steroids to reduce complications after tonsillectomy: a systematic review and meta-analysis of randomized controlled studies. Eur Arch oto-rhino-laryngology Off J Eur Fed Oto-RhinoLaryngological Soc Affil with Ger Soc Oto-Rhino-Laryngology – Head Neck Surg. februar 2019;276(2):585–604.
- Fan Z-R, Ma J, Ma X-L, Wang Y, Sun L, Wang Y, m.fl. The efficacy of dexamethasone on pain and recovery after total hip arthroplasty: A systematic review and meta-analysis of randomized controlled trials. Medicine (Baltimore). marts 2018;97(13):e0100.
- Fan Z, Ma J, Kuang M, Zhang L, Han B, Yang B, m.fl. The efficacy of dexamethasone reducing postoperative pain and emesis after total knee arthroplasty: A systematic review and meta-analysis. Int J Surg. april 2018;52:149–55.
- Wang F, Shi K, Jiang Y, Yang Z, Chen G, Song K. Intravenous glucocorticoid for pain control after spinal fusion: A meta-analysis of randomized controlled trials. Medicine (Baltimore). maj 2018;97(20):e10507.
- Yue C, Wei R, Liu Y. Perioperative systemic steroid for rapid recovery in total knee and hip arthroplasty: a systematic review and meta-analysis of randomized trials. J Orthop Surg Res. juni 2017;12(1):100.
- Yang Q, Zhang Z, Xin W, Li A. Preoperative intravenous glucocorticoids can decrease acute pain and postoperative nausea and vomiting after total hip arthroplasty: A PRISMA-compliant meta-analysis. Medicine (Baltimore). november 2017;96(47):e8804.
- Singh PM, Borle A, Makkar JK, Trikha A, Fish D, Sinha A. Haloperidol Versus 5- HT(3) Receptor Antagonists for Postoperative Vomiting and QTc Prolongation: A Noninferiority Meta-Analysis and Trial Sequential Analysis of Randomized Controlled Trials. J Clin Pharmacol. februar 2018;58(2):131–43.
- Tricco AC, Soobiah C, Blondal E, Veroniki AA, Khan PA, Vafaei A, m.fl. Comparative efficacy of serotonin (5-HT3) receptor antagonists in patients undergoing surgery: a systematic review and network meta-analysis. BMC Med. juni 2015;13:136.
- Tricco AC, Soobiah C, Blondal E, Veroniki AA, Khan PA, Vafaei A, m.fl. Comparative safety of serotonin (5-HT3) receptor antagonists in patients undergoing surgery: a systematic review and network meta-analysis. BMC Med. juni 2015;13:142.
- Som A, Bhattacharjee S, Maitra S, Arora MK, Baidya DK. Combination of 5-HT3 Antagonist and Dexamethasone Is Superior to 5-HT3 Antagonist Alone for PONV Prophylaxis After Laparoscopic Surgeries: A Meta-analysis. Anesth Analg. december 2016;123(6):1418– 26.
- Kassel L, Nelson M, Shine J, Jones LR, Kassel C. Scopolamine Use in the Perioperative Patient: A Systematic Review. AORN J. september 2018;108(3):287–95.
- Welliver M. POSTDISCHARGE NAUSEA AND VOMITING SHOULD BE A GREATER CONCERN. Gastroenterol Nurs Off J Soc Gastroenterol Nurses Assoc. 2018;41(4):356–60.
- Efune PN, Minhajuddin A, Szmuk P. Incidence and factors contributing to postdischarge nausea and vomiting in pediatric ambulatory surgical cases. Paediatr Anaesth. marts 2018;28(3):257–63.
- Bruderer U, Fisler A, Steurer MP, Steurer M, Dullenkopf A. Post-discharge nausea and vomiting after total intravenous anaesthesia and standardised PONV prophylaxis for ambulatory surgery. Acta Anaesthesiol Scand. august 2017;61(7):758–66.
- Brookes CD, Turvey TA, Phillips C, Kopp V, Anderson JA. Postdischarge Nausea and Vomiting Remains Frequent After Le Fort I Osteotomy Despite Implementation of a Multimodal Antiemetic Protocol Effective in Reducing Postoperative Nausea and Vomiting. J oral Maxillofac Surg Off J Am Assoc Oral Maxillofac Surg. juli 2015;73(7):1259–66.
- Jelting Y, Eberhart L, Kranke P. Predictive risk scores for post-discharge nausea and vomiting: Simple lessons learned for improving clinical practice. Bd. 33, European journal of anaesthesiology. England; 2016. s. 705–7.
- Mcilvoy L, Richmer L, Kramer D, Jackson R, Shaffer L, Lawrence J, m.fl. The Efficacy of Aromatherapy in the Treatment of Postdischarge Nausea in Patients Undergoing Outpatient Abdominal Surgery. J perianesthesia Nurs Off J Am Soc PeriAnesthesia Nurses. oktober 2015;30(5):383–8.
- Hines S, Steels E, Chang A, Gibbons K. Aromatherapy for treatment of postoperative nausea and vomiting. Cochrane database Syst Rev. marts 2018;3(3):CD007598.
- Schaefer MS, Kranke P, Weibel S, Kreysing R, Ochel J, Kienbaum P. Total intravenous anesthesia vs single pharmacological prophylaxis to prevent postoperative vomiting in children: A systematic review and meta-analysis. Paediatr Anaesth. december 2017;27(12):1202–9.
- Chong MA, Szoke DJ, Berbenetz NM, Lin C. Dexamethasone as an Adjuvant for Caudal Blockade in Pediatric Surgical Patients: A Systematic Review and Meta-analysis. Anesth Analg. august 2018;127(2):520–8.
- Cho HK, Park IJ, Jeong YM, Lee YJ, Hwang SH. Can perioperative acupuncture reduce the pain and vomiting experienced after tonsillectomy? A meta-analysis. Laryngoscope. marts 2016;126(3):608–15.
- Michelet D, Hilly J, Skhiri A, Abdat R, Diallo T, Brasher C, m.fl. Opioid-Sparing Effect of Ketamine in Children: A Meta-Analysis and Trial Sequential Analysis of Published Studies. Paediatr Drugs. december 2016;18(6):421–33.
- Guo J, Jin X, Wang H, Yu J, Zhou X, Cheng Y, m.fl. Emergence and Recovery Characteristics of Five Common Anesthetics in Pediatric Anesthesia: a Network Meta-analysis. Mol Neurobiol. august 2017;54(6):4353–64.
- Monahan A, Guay J, Hajduk J, Suresh S. Regional Analgesia Added to General Anesthesia Compared With General Anesthesia Plus Systemic Analgesia for Cardiac Surgery in Children: A Systematic Review and Meta-analysis of Randomized Clinical Trials. Anesth Analg. januar 2019;128(1):130–6.
- Shi F, Xiao Y, Xiong W, Zhou Q, Yang P, Huang X. Effects of Fentanyl on Emergence Agitation in Children under Sevoflurane Anesthesia: Meta-Analysis of Randomized Controlled Trials. PLoS One. 2015;10(8):e0135244.
- Yokoi A, Mihara T, Ka K, Goto T. Comparative efficacy of ramosetron and ondansetron in preventing postoperative nausea and vomiting: An updated systematic review and meta-analysis with trial sequential analysis. PLoS One. 2017;12(10):e0186006.
- Shin HC, Kim JS, Lee SK, Kwon SH, Kim MS, Lee EJ, m.fl. The effect of acupuncture on postoperative nausea and vomiting after pediatric tonsillectomy: A metaanalysis and systematic review. Laryngoscope. august 2016;126(8):1761–7.
- Scheiermann P, Herzog F, Siebenhofer A, Strametz R, Weberschock T. Intravenous versus inhalational anesthesia for pediatric inpatient surgery – A systematic review and meta-analysis. J Clin Anesth. september 2018;49:19–25.
- Nakajima D, Kawakami H, Mihara T, Sato H, Goto T. Effectiveness of intravenous lidocaine in preventing postoperative nausea and vomiting in pediatric patients: A systematic review and meta-analysis. PLoS One. 2020;15(1):e0227904.
- Barrons RW, Woods JA. Low-Dose Naloxone for Prophylaxis of Postoperative Nausea and Vomiting: A Systematic Review and Meta-analysis. Pharmacotherapy. maj 2017;37(5):546–54.
- Cho HK, Yoon HY, Jin HJ, Hwang SH. Efficacy of dexmedetomidine for perioperative morbidities in pediatric tonsillectomy: A metaanalysis. Laryngoscope. maj 2018;128(5):E184–93.
- Amorim MAS, Govêia CS, Magalhães E, Ladeira LCA, Moreira LG, Miranda DB de. Effect of dexmedetomidine in children undergoing general anesthesia with sevoflurane: a meta-analysis. Brazilian J Anesthesiol. 2017;67(2):193–8.
- Zhu C, Zhang S, Gu Z, Tong Y, Wei R. Caudal and intravenous dexamethasone as an adjuvant to pediatric caudal block: A systematic review and meta-analysis. Paediatr Anaesth. marts 2018;28(3):195–203.
